Протеолитические ферменты для чего нужны
ПРОТЕОЛИТИ́ЧЕСКИЕ ФЕРМЕ́НТЫ
Том 27. Москва, 2015, стр. 625
Скопировать библиографическую ссылку:
ПРОТЕОЛИТИ́ЧЕСКИЕ ФЕРМЕ́НТЫ (протеазы), группа ферментов класса гидролаз, катализируют внутри- и внеклеточное расщепление (протеолиз) пептидных связей C(O) ─ NH в белках и пептидах живых организмов. Выделяют две подгруппы П. ф.: экзопептидазы (пептидазы), отщепляют аминокислоты с аминного ( аминопептидазы ) или карбоксильного ( карбоксипептидазы ) конца молекулы белка или пептида; эндопептидазы (протеиназы; этот термин иногда используется также как синоним термина «П. ф.»), гидролизуют преим. внутр. пептидные связи. Большинство изученных П. ф. синтезируются в виде неактивных предшественников – проферментов, или зимогенов. Их активация происходит путём ограниченного протеолиза – избирательного гидролиза определённых пептидных связей, протекающего либо автокаталитически, либо под действием др. протеиназ, и обычно сопровождается отщеплением пептидов. П. ф. разнообразны по физико-химич. свойствам. В зависимости от локализации П. ф. протеолиз происходит при разл. значениях pH. Напр., пепсин и гастриксины желудка – при pH 1,5–2, ферменты лизосом – при pH 4–5, П. ф. сыворотки крови, тонкого кишечника – при нейтральных или слабощелочных значениях. Некоторые П. ф. в качестве кофактора используют ионы металлов (в т. ч. коллагеназа, термолизин). П. ф. имеют разную субстратную специфичность, которая определяется в осн. особенностями боковых групп аминокислот. Так, напр., трипсин гидролизует связи, образованные карбоксильной группой осно́вных аминокислот – лизина и аргинина, а эластаза – аминокислот с небольшими боковыми цепями – аланина и серина. На расщепление пептидных связей влияет также их доступность при наличии пространственной структуры гидролизуемого субстрата. Ферменты с узкой субстратной специфичностью (напр., коллагеназа, калликреин) гидролизуют пептидные связи, образованные строго определёнными аминокислотными остатками, ферменты с широкой субстратной специфичностью (в т. ч. пепсин, папаин) – связи, образованные многими аминокислотами. В плазме крови и др. биологич. жидкостях, а также в разных клетках и тканях присутствуют белковые ингибиторы П. ф., которые могут блокировать активность отд. ферментов или групп ферментов. Благодаря им осуществляется регуляция активности П. ф. в физиологич. условиях, что предохраняет белки от неконтролируемого расщепления.
Рекомендации к назначению ферментных препаратов при синдромах нарушенного пищеварения и всасывания
Пищеварение — это процесс, обеспечивающий пополнение энергетических и пластических ресурсов организма за счет переработки различных пищевых субстратов, поступающих в пищеварительный тракт. В его осуществлении принимают участие прежде всего пищеварительны
Пищеварение — это процесс, обеспечивающий пополнение энергетических и пластических ресурсов организма за счет переработки различных пищевых субстратов, поступающих в пищеварительный тракт. В его осуществлении принимают участие прежде всего пищеварительные железы, в секрете которых содержатся ферменты (табл. 1).
Нарушение процессов пищеварения (мальдигестия) и всасывания (мальабсорбция) являются наиболее распространенными синдромами в практике врача-терапевта и гастроэнтеролога. Их развитие может быть обусловлено недостаточной продукцией пищеварительных ферментов или снижением их активности. Механизмы нарушений процессов пищеварения и всасывания многообразны и определяются в первую очередь заболеваниями, лежащими в их основе (табл. 2).
Клинические проявления синдромов мальдигестии и мальабсорбции зависят также и от механизмов их развития (табл. 3).
При синдромах мальдигестии и мальабсорбции нередко развиваются специфические синдромы, обусловленные дефицитом в организме некоторых витаминов и микроэлементов. Например, дефицит ретинола (витамин А) сопровождается развитием гемералопии (куриная слепота), ксерофтальмии, кератомаляции, гиперкератоза; дефицит никотинамида (витамин РР) — дерматита, диареи, деменции и потери массы тела; дефицит цианкобаламина (витамин В12) — болезненной нейропатии, атаксии, парастезии, нарушением температурной чувствительности, макроцитарной анемии; дефицит аскорбиновой кислоты (витамин С) — кровоизлияниями под надкостницу и в основании волосяных фолликулов; дефицит железа — мышечной слабости, глоссита, колонихий, микроцитарной анемии и др. Основным направлением в лечении больных с синдромами нарушенного пищеварения и всасывания, особенно при невозможности устранения причин их развития, является заместительная терапия ферментами, иногда витаминами и микроэлементами.
В настоящее время в распоряжении врача имеется большое количество ферментных препаратов, отличающихся количеством входящих компонентов, степенью энзимной активности, способами производства и формами выпуска. Все ферменты условно можно разделить на две группы: панкреатин в чистом виде и панкреатин + компоненты желчи + гемицеллюлаза. Панкреатин содержит три фермента: липазу, протеазу и амилазу. Препарат считается эффективным, если в 1 г панкреатина содержится около 40 000 ЕД липазы (единицы Международной фармацевтической федерации). Липаза участвует в гидролизе эмульгированного желчью нейтрального жира, преимущественно в двенадцатиперстной кишке, так как при поступлении липазы в тощую кишку ее активность резко снижается. Протеазы в панкреатине преимущественно состоят из трипсина, под его влиянием белки, в основном животного происхождения, расщепляются на аминокислоты; кроме того, трипсин по принципу обратной связи участвует в регуляции панкреатической секреции. Амилаза расщепляет внеклеточные полисахариды (крахмал, гликоген) и практически не участвует в гидролизе растительной клетчатки. Препараты панкреатина не оказывают влияния на функцию желудка, печени, моторику билиарной системы и кишечника, но снижают секрецию панкреатического сока.
В состав ряда современных ферментных препаратов наряду с панкреатином входят желчные кислоты (желчь) и гемицеллюлаза. Препараты, содержащие желчные кислоты, увеличивают панкреатическую секрецию и холерез, стимулируют моторику кишечника и желчного пузыря. Желчные кислоты увеличивают осмотическое давление кишечного содержимого, а в условиях микробной контаминации кишечника происходит их деконъюгация с последующим развитием осмотической и секреторной диареи. Желчные кислоты вступают в энтерогепатическую циркуляцию и метаболизируются в печени, что увеличивает ее функциональную нагрузку. Деконъюгированные желчные кислоты повреждают слизистую оболочку желудочно-кишечного тракта.
Ферментные препараты, содержащие желчные кислоты, не следует назначать при остром и хроническом панкреатите, при гепатите и циррозе печени, диарее, язвенной болезни и воспалительных заболеваниях кишечника.
Наличие в ферментном препарате гемицеллюлазы обеспечивает расщепление полисахаридов растительного происхождения.
При назначении того или иного ферментного препарата необходимо прежде всего учитывать его состав.
Вторым фактором, определяющим активность лечения, является форма выпуска препарата. Большинство ферментных препаратов выпускаются в виде драже или таблеток диаметром 5 (и более) мм в кишечнорастворимых оболочках, что защищает ферменты от высвобождения в желудке и разрушения соляной кислотой желудочного сока. Из желудка одновременно с пищей могут эвакуироваться в двенадцатиперстную кишку твердые частицы, диаметр которых составляет не более 2 мм. Более крупные частицы, в частности ферментные препараты в таблетках или драже, эвакуируются в межпищеварительный период, когда пищевой химус уже покинул двенадцатиперстную кишку. В результате препараты не смешиваются с пищей и не участвуют в пищеварении. Для обеспечения быстрого и «гомогенного» смешивания с пищевым химусом были созданы высокоактивные полиферментные препараты в виде микротаблеток (панцинтрат) и микросфер (креон), диаметр которых не превышает 2 мм. Препараты заключены в желатиновую капсулу, которая разрушается в желудке, содержимое (микротаблетки и микросферы) смешивается с пищевым химусом и вместе с ним постепенно поступает в двенадцатиперстную кишку. При pH дуоденального содержимого выше 5,5 оболочки микросфер и микротаблеток растворяются и ферменты начинают действовать на большой поверхности, аналогично физиологическим процессам пищеварения.
Третьим фактором, определяющим активность ферментных препаратов, является интрадуоденальный уровень pH и эффективная моторика двенадцатиперстной кишки, обеспечивающая длительный контакт ферментов с пищевым химусом. Если pH дуоденального содержимого снижается до 3,5 и ниже, то происходит необратимая инактивация липазы и трипсина, преципитация желчных кислот, влекущая за собой нарушение эмульгирования и всасывания жиров. Основными причинами падения pH в двенадцатиперстной кишке являются избыточный бактериальный рост в кишке, гиперацидоз, снижение секреции бикарбонатов. Для повышения pH в дуоденуме используют блокаторы H2-рецепторов гистамина (ранитидин, фамотидин), иногда блокаторы протонной помпы (омепразол и др.), антацидные препараты (маалокс, гастал и др.) и обязательно проводят деконтаминацию двенадцатиперстной кишки антибактериальными препаратами (бисептол и др.), а иногда антипаразитарными (метронидазол и др.) средствами.
Дозы препаратов и продолжительность лечения определяют индивидуально, в зависимости от ведущего механизма данного нарушения. Эффективность ферментных препаратов иногда может зависеть от моторных нарушений верхних отделов пищеварительного тракта. Для устранения этих расстройств чаще всего используют прокинетики типа мотилиум (10 мг за 15 минут до еды три-четыре раза в день).
Важнейшим фактором, определяющим успех терапии, является правильный выбор ферментного препарата, его дозы и продолжительности лечения. При выборе препарата учитывается характер заболевания и механизмы, лежащие в основе нарушений пищеварения (табл. 5).
Основной недостаток ферментной терапии в том, что ее активность порой зависит от других патогенетических механизмов. Эффект терапии ферментными препаратами может быть повышен путем устранения синдрома избыточной микробной контаминации двенадцатиперстной и других отделов тонкой кишки путем проведения курсов антимикробной терапии, а при закислении дуоденума — путем восстановления нужного pH с помощью блокаторов H2-рецепторов гистамина и антацидных средств (маалокс и др.).
Перенедоел: как помочь себе при переедании. Страшная правда о ферментах
Как помочь себе при переедании? Что такое ферменты и как они взаимосвязаны с перееданием — поговорим об этом с гастроэнтерологом GMS Clinic Сергеем Вяловым.
Мифы и легенды современности
Переел — прими ферменты. Зачем? Не понятно. Вероятно, они помогут перевариться пище. Только помогать-то надо не перевариванию — с этим здоровый организм в состоянии справится самостоятельно. А вот средства для сокращения желудка действительно могут облегчить страдания. Но! Обо всем по порядку.
Как работает фермент?
Пища находится в желудке, пока желудок ее не пережует. Это занимает 1-3 часа в зависимости от объема порций. Выпили таблетку фермента — он попал в желудок. Фермент разлагается соляной кислотой желудка. Если просто положить его в желудок, он умрет. Поэтому производители упаковывают фермент в кислотоустойчивую оболочку. И действует он только на выходе из желудка. И на это, к слову, я советую обратить внимание!
Принимать фермент стоит только в капсуле.
Но! Вернемся к нашим ферментам. Вот, мы переели. Приняли фермент. Он достиг желудка и лежит там, в оболочке, вместе с едой час или два. И действовать начнет только тогда, когда желудок опорожнится. Чисто физически, подействовать фермент может только когда выйдет из желудка. Какой от него толк в борьбе с чувством тяжести, возникающим от растягивания желудка — не понятно. Не ясно так же, кто вдруг решил построить рекламную компанию ферментов как средства борьбы с перееданием — но цель достигнута. Прибыли колоссальные. Народ повально глотает ферменты после обильного стола. И знаете, некоторым даже помогает. Как ни крути — эффект плацебо, проще говоря, самовнушение — штука действенная.
Может ли постоянный прием ферментов причинить вред организму?
Стопроцентно доказанного исследования о вреде ферментов не было, но, принимая ферменты, мы уменьшаем тем самым нагрузку на поджелудочную железу. Есть ряд исследований, которые говорят, что может уменьшаться собственная секреция на фоне длительного приема ферментов. Если ферментов достаточно, зачем выделять больше? Поджелудочная ленится и привыкает. Но от разового или недельного приема ферментов вреда не будет.
Когда нужны ферменты
Чтобы понять, достаточно ли у человека ферментов или недостаточно, можно сдать анализ кала и получить готовую цифру. Не нужно пить тоннами ферменты, если их количество в организме достаточное. Это не даст никакого эффекта, только деньги, как говорится, будут выброшены на ветер. Даже если на УЗИ выявляют хронический панкреатит, то это еще не означает, что он происходит от недостаточного количества ферментов. В то же время, если ферменты действительно нужны, что подтвердил и назначил врач, то принимать их необходимо постоянно.
Напутственное слово
Протеолитические ферменты
Содержание
Протеолитические ферменты в спортивной медицине (обзор литературы) [ править | править код ]
Протеолитические ферменты на медицинском и фармацевтическом рынке [ править | править код ]
Наиболее часто встречаемые на рынке варианты комбинированных составов с протеазами приведены в таблице 1.
Таблица 1. Основные активные ингредиенты некоторых типовых комбинированных препаратов протеолитических ферментов на фармацевтическом рынке США и Европы [5]
Примечания: *1 μkat – количество фермента, которое превращает более 1 μM субстрата в секунду при стандартных условиях. Это соответствует 60 F.I.P – единиц. Ph. Eur.-ед протеиназы – протеиназные единицы действия по Европейской Фармакопее. Рутозид (рутин, кверцетин-3-О-рутинозид, софорин) — гликозид флавоноида кверцетина.
Как видно из таблицы 1, в большинстве случаев при формировании состава комбинированных протеолитических препаратов используются растительные протеазы цистеина – бромелайн (обязательный компонент) и папаин, а также протеазы серина животного происхождения – трипсин и химотрипсин. Некоторые составы включают панкреатин, амилазу, липазу и/или рутозид. Популярной формой выпуска являются кишечнорастворимые таблетки, покрытые оболочкой, для обеспечения наибольшей концентрации активных веществ в кишечнике (предотвращение распада таблетки в кислой среде желудка). Дозировки ферментов варьируют в диапазоне от 1 до 200 мг/таблетку. Количество протеаз в дозе на прием соответствует ферментной активности, описанной в F.I.P. (F.I.P.-units of the Federation Internationale Pharmaceutique). Одна F.I.P.-единица – количество фермента, которое способно конвертировать более 1 мкмол субстрата за 1 минуту при стандартных условиях.
Происхождение, химическая структура, классификация и свойства протеолитических ферментов [ править | править код ]
Растительные протеазы. [ править | править код ]
Протеазы дынного дерева [ править | править код ]
В соответствии с данными А.М.Пенджиева и А.Абдуллаева [2] «высушенный млечный сок (латекс) дынного дерева содержит ряд протеаз: Папаин – монотиоловая цистеиновая эндопротеаза. По характеру ферментативного действия ее называют «растительным пепсином». Но, в отличие от пепсина, папаин активен не только в кислых, но и в нейтральных и щелочных средах (диапазон рН 3–12, оптимум рН=5), что важно при часто встречающихся у спортсменов нарушениях кислотного состава желудка. Химопапаин – монотиоловая цистеиновая протеиназа. Благодаря субстратной специфичности похожа на папаин, но отличается от него электрофоретической подвижностью, стойкостью и растворимостью. Протеиназа IV – цистеиновая протеиназа, основная протеиназа латекса, составляет около 30 % присутствующего в нем белка. Проявляет высокую степень гомологии с протеиназой III папайи (81 %), химопапаином (70 %) и папаином (67 %). Очень близка к химопапаину по молекулярной массе и заряду молекулы. Карикаин – наиболее щелочная среди цистеиновых протеиназ латекса папайи. Подобно папаину, карикаин сначала продуцируется в форме неактивного зимогена прокарикаина, содержащего ингибиторный прорегион из 106 N-терминальных аминокислот. Активация фермента заключается в отщеплении прорегиона молекулы без ее последующих конформационных изменений. Протеиназа w (эндопептидаза А, пептидаза А) – монотиоловая цистеиновая протеиназа. Это полипептид, содержащий 216 аминокислотных остатков и 3 дисульфидные связи. Для проявления его ферментативной активности важно наличие свободного остатка цистеина в активном центре. Проявляет высокую степень гомологии с папаином (68,5 %). По специфичности ферментативного действия напоминает папаин, поскольку связывается с субстратом в участках локализации дисульфидных связей. Для стабилизации комплекса протеиназ папайи с практическими целями используются специальные полимеры, разработанные еще во времена существования СССР.
Протеазы ананаса [ править | править код ]
Протеазы животного происхождения [ править | править код ]
Фармакокинетика протеолитических ферментов [ править | править код ]
Абсорбция ПФ в желудочно-кишечном тракте и их биологическая активность [ править | править код ]
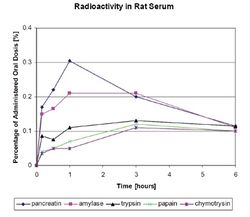
В обзорной работе G.Lorkowski [5] суммированы имеющиеся данные по абсорбции протеолитических ферментов в ЖКТ после их перорального приема, фармакокинетике ПФ и даны возможные объяснения механизмам этих процессов. Ранние исследования абсорбции протеаз у животных были выполнены путем перорального приема ферментных субстратов, меченых радиоактивными изотопами. Другим методом было количественное определение в плазме крови собственной эстеразной активности протеаз в отношении специфических субстратов, например, этилового эфира N-бензолил-L-аргинина (BAEE) как субстрата для трипсина, а этилового эфира N-ацетил-L-тирозина (ATEE) как субстрата для химотрипсина, а уровня гемоглобина – для оценки общей протеолитической активности. Экспериментальные исследования показали, что абсорбция протеолитических ферментов зависит от множества факторов, среди которых наиболее важным является размер молекулы. В серии экспериментальных работ J.Seifert и соавторов [15] [16] было показано, что после перорального приема (рис.1) меченых йодом-123 таких протеолитических ферментов как трипсин, химотрипсин, панкреатин и папаин, наблюдается постепенное нарастание концентрации протеолитических ферментов в крови, дифференцированное по времени и количественным параметрам в зависимости от конкретного протеолитического фермента. Прием панкреатина вызывал наибольший прирост концентрации фермента в сыворотке крови с максимумом в течение часа. В течение последующих 6-и часов происходило плавное снижение его концентрации. Для других протеолитических ферментов (трипсин, химотрипсин и папаин) максимальная концентрация в сыворотке крови достигалась только к 3-ему часу после перорального применения и была существенно ниже (в 3 и более раз) по сравнению с панкреатином. Характерно, что через 6 часов для всех ферментов уровень их концентрации в крови (в процентном соотношении с их введенной дозой на 1 г крови) был примерно одинаковым.
Детальные количественные характеристики изменений показателей ПФ в крови даны в таблице 2.
Таблица 2. Количественный анализ абсорбции ферментов в кишечнике крыс в сыворотку крови и лимфу (из J.Seifert и соавт., 1990).
Общий уровень абсорбции, (%) *
Общий уровень абсорбции (мг)
Низкомолекулярная часть (мг)
Абсорбция бромелаина при интрадуоденальном введении в экспериментах на крысах существенно отличалась от таковой других протеолитических ферментов. Как видно из рис.2, происходит медленное (по сравнению с другими ПФ) нарастание концентрации бромелаина в сыворотке крови и лимфе в течение 4 часов (максимум) и поддержание этих величин до 6-и часов наблюдения. В данной работе уровень абсорбции бромелаина определен в 50% от введенной дозы за 6 часов, при этом 80% составила высокомолекулярная фракция.
Фармакокинетика ПФ у человека [ править | править код ]
Таблица 4. Линейная зависимость максимальных уровней ПФ в плазме крови испытуемых в соответствии с перорально принимаемой суточной дозой ферментных препаратов [20] [21] [22]
Примечания: ДД – дневная доза (г); МКП – максимальная концентрация в плазме (нг/мл).
15 добровольцев получали кишечно-растворимые таблетки, каждая из которых содержала 200 мг бромелайна. Четверо испытуемых служили контролем (плацебо). В течение 1-го дня осуществлялось шесть приемов бромелаина: 3 таблетки в 8.00 утра (время «ноль» для исследования); в 11.00; 14.00; 17.00 и 20.00, а затем 5 таблеток в 23.00. Такой же режим соблюдался на 2-ой день. На 3-ий день осуществлялся только дин прием 3-х таблеток в 8.00. Стандартные приемы пищи производились в: 9.00; 12.00; 15.30 и 18.30. Образцы крови (12 мл) брались каждый раз перед приемом бромелаина. У большинства участников Смакс отмечалась через 48 часов и составляла в среднем 5 нг/мл, Т1/2 в плазме около 6 часов. AUC за период 3-51 часов составила 82,2 нг/час/мл.
В другой работе коллективом авторов из Института клинической фармакологии в Берлине (Германия) [20] [21] [22] (табл.4) выявлена четкая дозозависимость концентрации бромелаина, трипсина и папаина в плазме крови от введенной суточной дозы фермента, что еще раз подчеркивает, что протеолитические ферменты являются фармаконутриентами, т.е. сочетают способность влиять на нутритивные процессы подобно фармакологическим агентам.
Подводя итоги выполненным исследованиям фармакокинетики протеолитических ферментов, G.Lorkowski [5] в своем аналитическом обзоре делает следующее заключение: «Прием протеолитических ферментов обеспечивает усвоение организмом физиологически активных протеинов с высоким молекулярным весом. Фармакокинетические исследования показывают дозозависимое линейное нарастание концентрации протеаз в различных средах организма, варьирующее в достаточно широких индивидуальных пределах, медленную динамику абсорбции в кишечнике, быстрое и 100% связывание в организме с антипротеазными комплексами. Пероральный прием протеолитических ферментов увеличивает протеазную активность сыворотки крови с параллельным возрастанием концентрации в плазме крови соответствующих антипротеаз. Биологическая протеолитическая активность пероральных ПФ определяется взаимодействием с соответствующими рецепторами на поверхности клеток (протеаз-активируемые рецепторы) как в виде свободных протеаз, так и в комплексной форме с антипротеазами. Такой комплекс «протеаза-антипротеаза» вызывает возрастание плазменных концентраций антипротеаз и элиминацию самих комплексов и цитокинов. Эти механизмы реализуются при приеме внутрь протеолитических ферментов в виде кишечнорастворимых таблеток с содержанием растительных и животных протеаз, и обеспечивают стабилизацию и, возможно, улучшение физиологических и иммунологических процессов даже у здоровых лиц. Последнее обстоятельство приобретает особый смысл в спортивной медицине.
Протеолитические ферменты – катализаторы высвобождения аминокислот (АК) из протеинов [ править | править код ]
Сходным образом (рис.5), 150 мг Игнитора в 2 раза усиливает высвобождение лейцина из WPC по сравнению со смесью пепсина и панкреатина, и в 2,5 раза – по сравнению только с эндогенными ферментами. Почти такое же преимущество (рис.6) имел Игнитор и в плане высвобождения ВСАА в целом: в 2 раза активнее смеси пепсина и панкреатина, и в 2,25 раза – эндогенных ПФ.
Замена WPC на изолят (WPI) привела примерно к таким же результатам: 100 мг Игнитора высвобождало в 4 раза больше лейцина, в 3,25 раза больше ВСАА и в 2,25 раза больше глутамина по сравнению с эндогенными ПФ.
Таким образом, смесь протеаз различного происхождения при совместном приеме с whey-протеинами (WPC, WPI) увеличивает и оптимизирует во времени высвобождение из белков ВСАА и глутамина с последующей активацией mTOR, что определяет анаболическую эргогенную активность протеолитических ферментов (ПФ). Эргогенное действие ПФ носит опосредованный характер и проявляется при выборе оптимального соотношения общего количества и качества поступающего белка, собственной активности эндогенных ПФ и количества и протеолитических свойств экзогенных ПФ в составе препаратов и БАДов. Конечным эффектом оптимального приема пищевых добавок протеинов и ПФ в сочетании с силовыми тренировками является увеличение синтеза белка в скелетных мышцах, увеличение размеров мышечных волокон, повышение силы и мощности мышц.
Для повышения эффективности высвобождения ВСАА и глутамина из белка делают комбинированные формы WP и ПФ, в котором уже рассчитаны дозы ферментов, необходимые для оптимального расщепления протеинов (например, Isoject – сочетание изолята WP и Игнитора).
Протеолитические ферменты как фармаконутриенты для предупреждения и лечения EIMD и DOMS [ править | править код ]
В более ранней работе P.C.Miller и соавторов [29] изучено влияние добавок ПФ на DOMS и функцию мышц у бегунов-мужчин (возраст 18-29 лет) в параллельных группах сравнения в холмистой местности (бег под уклон). Комбинированный БАД с протеолитическими и другими ферментами применялся в виде капсул. Каждая капсула содержала 325 мг ферментов поджелудочной железы, 75 мг трипсина, 50 мг папаина, 50 мг бромелаина, 10 мг амилазы, 10 мг липазы, 10 мг лизозима и 2 мг химотрипсина и принималась испытуемыми в течение 4-х дней по 2 капсулы 4 раза в день на пустой желудок за 30 минут до приема пищи в 200 мл воды. В контрольной группе участники получали плацебо в капсулах идентичного вида. Весьма важно, что данный вид бега вызывает достаточно ощутимые микроповреждения мышечных волокон и DOMS. Авторы работы показали, что пероральный прием протеаз редуцирует отсроченные мышечные боли, вызванные физическими нагрузками, что сопровождается ускорением восстановления и улучшением общего настроения и самочувствия у физически активных мужчин. При этом выявлена определенная закономерность: восстановление контрактильной способности мышц происходит быстрее при низкой и средней скоростях бега, чем при высокой скорости. Исследования P.C.Miller и соавторов [29] имеют вполне конкретную прикладную направленность. Лица, впервые начинающие тренировочный процесс без опыта физической подготовки, или пациенты, проходящие курс реабилитации после хирургического вмешательства, особенно при отсутствии консультаций специалиста по ОФП, имеют высокую вероятность развития DOMS. Последняя, в свою очередь, прерывает процесс восстановления или существенно его замедляет. Пищевые добавки ПФ – один из оптимальных способов лечения таких состояний, который снижает боли, ускоряет восстановление мышц. В результате возрастает объем и эффективность тренировочной работы, ускоряется восстановление после травм и операций.
Побочные эффекты перорального приема протеолитических ферментов [ править | править код ]
Грибковые протеазы – новое направление в создании ферментных фармаконутриентов для спортивной медицины [ править | править код ]
Развитие данного направления связано с выделением и изучением группы протеаз грибкового происхождения (Aspergillus niger и Aspergillus oryzae) в виде патентованной формулы Aminogen®. J.Oben и соавторы [33] провели исследование в двух группах здоровых мужчин (n=21, возраст 19-35 лет, ИМТ 20-24, физическая активность в рамках программы бодибилдинга). В течение первых 9 дней участники принимали (на фоне стандартизированной сбалансированной диеты в 2200 ккал/день, 40% углеводов, 25% белка и 35% жиров) 50 г концентрата WP (WPC), затем 50 г WPC с добавлением либо 2,5 г, либо 5 г Аминогена (Aminogen®, Triarco Industries,Wayne, NJ). WPC представлял собой порошок с содержанием 85% протеина, 6% жира, 3% неорганических веществ и 6% лактозы. На каждом этапе исследования (каждые 30-60 минут) брались образцы крови для оценки уровней аминокислот и С-реактивного белка в крови. Результаты показали, что в группах, получавших дополнительно грибковые протеазы, уровень всех аминокислот был через 4 часа после приема пищевых добавок достоверно выше, чем в контроле (увеличение площади под кривой AUC – «время-концентрация»). На фоне ферментов достоверно снижался С-реактивный белок по сравнению с контрольной группой, улучшался азотистый баланс. Авторы сделали заключение, что Аминоген усиливает переваривание белка в ЖКТ и скорость всасывания аминокислот (в 2,2-3,5 раза). Не прослеживалось достоверной связи между дозой ферментов и конечным результатом, что позволяет рассматривать дозу Аминогена 2,5 г как адекватную и достаточную. С практической точки зрения это означает, что грибковые протеазы, с одной стороны, повышают эффективность переваривания белка и всасывание аминокислот в среднем в 2,5 раза (растет уровень аминокислот в плазме крови), а с другой, организм получает возможность потребления дополнительного количества белка, который в обычных условиях не может быть переработан и усвоен собственными эндогенными протеазами (адекватный, т.е. усвояемый, однократный объем белка в обычных условиях – 15 г, на фоне ферментов – 30 г и более). В свою очередь, это приводит к снижению риска белковой перегрузки и вероятности диспептических явлений и желудочно-кишечного дискомфорта. Снижение уровней С-реактивного белка может вносить вклад в торможение процессов воспаления при физических нагрузках, уменьшение негативных последствий чрезмерного мышечного напряжения и ускорение восстановления в постнагрузочный период.
Исследования последних десяти лет позволили сформулировать концепцию полимодальности механизма действия протеолитических ферментов (ПФ) животного, растительного и комбинированного происхождения в спортивной медицине. Условно этот механизм складывается из двух взаимодополняющих частей: усиление и ускорение переваривания белка в ЖКТ и системное антипротеолитическое действие (снижение воспаления, уменьшение EIMD и DOMS. Основные положения этих направлений могут быть сформулированы следующим образом:
Применение ферментов позволяет использовать более приятные по органолептическим свойствам белковые смеси, содержащие нативные высококачественные протеины (например, WP, а не гидролизаты WPH). Такой подход (ферментирование белков «in vivo») является альтернативой промышленной ферментативной обработке белков до поступления в организм. При этом образование и абсорбция ВСАА (в частности, лейцина) в количественном плане идентичен эффективности уже ферментированных белков или добавок ВСАА в составе смесей.
В спорте высших достижений, где в подавляющем большинстве случаев имеет место относительная ферментная недостаточность, обусловленная большим объемом поступления белка (в составе диеты, функциональной пищи или добавок протеинов различного происхождения), задачей ферментных препаратов является адекватное переваривание дополнительных протеинов. Соответственно, расчет потребности в экзогенно вводимых ферментах осуществляется, исходя из имеющегося превышения возрастной нормы потребления белка, антропометрических показателей спортсмена и реальной физической нагрузки в процессе тренировок и соревнований, функционального состояния кислотообразующей и ферментообразующей функции ЖКТ.