Проба с прозерином что это
Диагностика миастении
Диагноз миастении устанавливается на основании жалоб пациента, анамнеза заболевания, осмотра врачом-неврологом, проведении специальных проб, лабораторных и инструментальных исследований.
При выявлении характерных для миастении жалоб и особенностей заболевания, врач проводит функциональную пробу для выявления патологической мышечной утомляемости.
Диагностика с помощью прозериновой пробы
Специфическим тестом для диагностики миастении является проба с ингибиторами АХЭ: неостигминаметилсульфат (код АТХ: N07AA01, Прозерин).
Прозерин – это лекарственный препарат, улучшающий нервно-мышечную передачу. Пациенту предлагается небольшая физическая нагрузка, провоцирующая симптоматику, а затем вводится препарат и оценивается результат. Эффективность прозериновой пробы является важным аспектом в выборе лечения.
Диагноз в обязательном порядке подтверждается с помощью декремент-теста. Данный метод основывается на проведении электромиографии и позволяет установить нарушение нервно-мышечной передачи.
Если диагноз миастении вызывает сомнения, требуется динамическое наблюдение, проведение пробного курса ингибиторов АХЭ (Калимин в сочетании с препаратами калия – только строго избегая холинергических реакций), повторное клиническое и электромиографическое (ЭМГ) обследование.
Диагностика с помощью иммунологических исследований
Дополнительно пациентам с приобретенной формой миастении проводится иммунологические исследования. У подавляющего большинства пациентов можно выявить антитела к ацетилхолиновым рецепторам, отвечающих за нервно-мышечную передачу. У трети больных обнаруживаются антитела к скелетным мышцам, что также позволяет считать диагноз миастении достоверным.
Следует отметить, что у 10-15% пациентов с миастений выявляется тимома (опухоль вилочковой железы). При этом заболеваемость тимомой увеличивается с возрастом, что необходимо учитывать при миастении с поздним началом. Поэтому всем взрослым пациентам с подтвержденным диагнозом необходимо провести компьютерную томографию органов средостения.
Постановка диагноза миастения
Для правильной постановки диагноза миастении, необходимо исключение следующих заболеваний:
Миастению часто сопровождают другие аутоиммунные заболевания такие как: тиреоидит, системная красная волчанка, ревматоидный артрит. При наличии симптомов перечисленных заболеваний врачи Юсуповской больницы проведут необходимую дополнительную диагностику и лечение.
Остались вопросы? Мы вам перезвоним
Мы с радостью проконсультируем вас и ответим на все интересующие вопросы.
Как распознать миастению? Все о диагностике и лечении
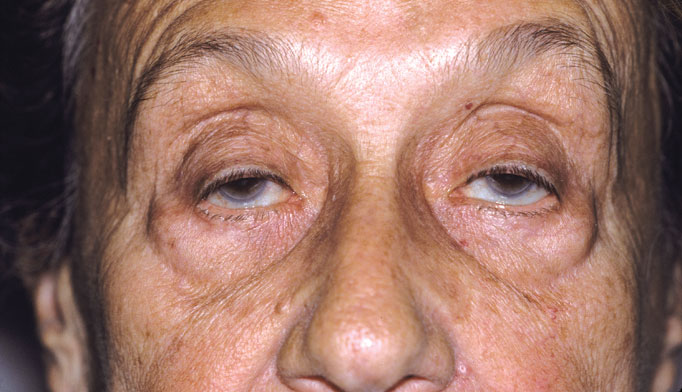
Миастения – это болезнь, которая характеризуется нарушением нервно-мышечной передачи (то есть нарушением процесса сокращения мышцы, возникающим в ответ на импульс, идущий по нервному волокну). Причиной миастении зачастую является аутоиммунный процесс, в результате которого в организме вырабатываются антитела к структурам нервно-мышечного синапса. Согласно статистике, миастения встречается у каждого 5-го из 100 тысяч человек. Это хроническое заболевание с острым или постепенным началом. Основным проявлением является преходящая мышечная слабость, так же может возникать птоз (опущение) верхних век, нарушение глотания, «гнусавость» голоса. В тяжелых случаях и при прогрессировании заболевания может возникнуть слабость дыхательных мышц, вплоть до остановки дыхания.
Опасный недуг быстро прогрессирует, клинические проявления могут утихать и вновь обостряться. Диагностируют патологическую мышечную утомляемость чаще у женщин, чем у мужчин, много реже у детей. Средний возраст пациентов от 15 до 45 лет, таким образом, максимальное количество случаев регистрируется у самой активной части населения.
О причинах
В настоящее время причины развития миастении изучены не до конца. Иногда нельзя однозначно сказать, почему у того или иного пациента возникло заболевание. Принято считать, что весомую роль играют следующие факторы:
При появлении злокачественных новообразований в яичниках, в органах дыхания или в молочных железах говорят о миастеническом синдроме Ламберта-Итона. Мышечная слабость, иногда принимаемая за миастению, возникает при болезни Шарко-Мари, при дерматомиозите (разрушении соединительной ткани), различных формах миопатий, синдроме БАС (боковой амиотрофический склероз) и многих других патологиях.
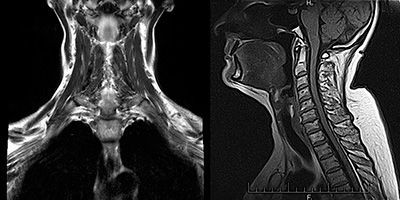
Сложность диагностики состоит в том, что у пациентов с миастенией в начале заболевания может не быть каких-либо четких жалоб и симптоматики. При нейровизуализации (КТ или МРТ) нет значимых отклонений в структурах центральной нервной системы. Только у 30% заболевших тимус увеличивается, либо в нем выявляются новообразования. Мышцы при осмотре так же никак не изменены, патология может выявляться только при микроскопическом исследовании.
Классификация
Врожденная миастения может быть обусловлена генетическими мутациями. Так же плод может получить антитела к рецепторам постсинаптической мембраны от матери, в этом случае речь идет о неонатальной миастении.
Приобретенная миастения может развиться у пациентов любого возраста. Данный диагноз ставят подросткам, молодым людям и пенсионерам. Наиболее часто недуг встречается в активном возрасте, от 20 до 30 лет. Причины могут быть внешними (инфекционные агенты) и внутренними (хронические заболевания, наследственность).
Условно, по распространенности мышечной слабости, миастения подразделяется на следующие виды:
Данное деление относительно, так как при углубленном исследовании чаще всего выявляется поражение всех мышц, но клинические проявления миастении могут возникать только в отдельных группах мышц определенной локализации.
По характеру течения различают:
Симптомы
Клинические проявления миастении зависят от формы заболевания.
Симптомы, характерные для генерализованной формы:
Симптомы, характерные для глазной формы:
Сложность диагностики миастении связана с тем, что вышеперечисленные симптомы могут появляться и пропадать. Наиболее выражено они проявляются, когда человек занимается спортом, длительно читает или работает за компьютером. То есть в те моменты, когда поперечнополосатые мышцы задействованы больше всего. Ведь даже поддержание определенной позы или чтение требуют постоянного напряжения определенных групп мышц.
При отсутствии адекватного лечения существует риск не только инвалидизации, но и смерти. В то время, когда уровень развития медицины не позволял проводить длительную искусственную вентиляцию легких, от миастении умирали 8 из 10 заболевших. При обнаружении тревожных симптомов миастении, необходимо записаться на прием к неврологу. При необходимости специалист направит на обследование и подберет эффективную терапию.
Диагностика
Врач-невролог ставит диагноз миастения на основе жалоб, данных анамнеза, осмотра и исследований. Специалист сравнивает жалобы пациента с симптомами, характерными для этой болезни. Для подтверждения диагноза проводят диагностические исследования.
Электронейромиография при миастении является «золотым стандартом» и обязательным исследованием. Используется специальный режим ЭНМГ – «декремент-тест». При проведении обследования с помощью электрической стимуляции исследуемую мышцу заставляют сокращаться с высокой частотой. В результате при миастении или миастеническом синдроме регистрируется уменьшение интенсивности мышечного сокращения.
Прозериновая проба. Выполняется самостоятельно или после проведения декремент-теста. Прозерин — вещество, улучшающее нервно-мышечную передачу. Подкожно вводится небольшое его количество, через 30 минут после этого пациент вновь осматривается врачом или проводится повторная ЭНМГ. Проба считается положительной, если отмечается клиническое улучшение или позитивная динамика при выполнении декремент-теста.
Лабораторная диагностика. Анализ крови на содержание специфических антител к рецепторам, мышцам. Антитела выявляются далеко не во всех случаях миастении.
Как правило, этих методов в сочетании с консультацией невролога бывает достаточно для установления диагноза.
Во время осмотра врач может провести пробы на повышенную мышечную утомляемость. Сначала на определенную группу мышц дается нагрузка, затем оценивается их состояние. При глазной форме миастении нагружают глазодвигательные мышцы, для этого больного просят в течение 30 секунд смотреть в одну точку. При жалобах на патологическую усталость мышц шеи, пациента укладывают на спину и просят держать голову поднятой в течение 1 минуты. При слабости в ногах, больному нужно сделать несколько приседаний либо походить на носочках. Для определения степени утомляемости мышц кисти и предплечья, человека просят несколько раз интенсивно согнуть и разогнуть кисть.
Проба с прозерином что это
Малкова Н.А., к.м.н.
Новосибирская государственная областная клиническая больница. Областной центр неврологии и нейрохирургии
В настоящее время проблеме миастении уделяется большое внимание специалистами практически всех отраслей медицинской науки. Статьи и обзоры по данному вопросу можно найти в публикациях по неврологии, хирургии, анестезиологии, акушерству и гинекологии, а также в различных теоретических журналах, освещающих аспекты нейрофизиологии, иммунологии, патоморфологии, молекулярной патологии, фармакологии и т.д. Трудности подстерегают врача на всех этапах общения с больными миастенией. Трудно поставить правильный диагноз, провести дифференциальную диагностику с близкими патологическими состояниями, выбрать оптимальную стратегию и тактику лечения, решить проблемы социальной и психологической адаптации больных, вопросы о возможности беременности и родов, а так же множество других проблем, возникающих при общении с данной категорий больных, нуждающихся в наблюдении и общении с врачом на протяжении долгих лет болезни.
Диагноз “миастения”, как правило, ставится с большим опозданием, несмотря на простоту клинических проявлений данного заболевания и общедоступность диагностических тестов, подтверждающих этот диагноз. Причинами являются, вероятно, относительная редкость данной болезни. Под маской миастении протекают многочисленные неврологические феномены, обусловленные поражением самых различных структур периферического нейромоторного аппарата ЦНС, патологией обмена веществ и желез внутренней секреции. Важным фактором является наиболее раннее выявление синдрома патологической мышечной слабости и назначение патогенетической терапии, способствующей нормализации нервномышечной передачи, что дает возможность больным миастенией сохранять работоспособность длительное время.
Миастения – заболевание, характеризующееся нарушением нервно-мышечной передачи и проявляющееся слабостью и патологической утомляемостью скелетных (поперечно-полосатых мышц).
Приобретенная миастения связана с образованием антител против ацетилхолиновых рецепторов постсинаптической мембраны нервно-мышечного синапса. В патогенезе аутоиммунной реакции активную роль, по-видимому, играет вилочковая железа.
Значительно более редкая – врожденная миастения – обусловлена генетически-детерминированным дефектом нервно-мышечных синапсов.
Неонатальная миастения – преходящее состояние, наблюдающееся у младенцев, родившихся от матерей, страдающих миастенией, и обусловленное переходом через плаценту материнских антител к ацетилхолиновым рецепторам.
Подробнее патогенетический механизм заключается в аутоиммунном процессе. Изменения в вилочковой железе (гиперплазия или гиперфункция без увеличения), в которой вырабатываются антитела к белку холинорецепторов к поперечно-полосатым мышцам.
Часто выявляется не просто гиперплазия, а тимома, течение при этом более злокачественное. Аутоантитела вырабатываются в вилочковой железе (или других органах иммунитета), связываются с белком ацетилхолиновых рецепторов, вызывают деградацию и разрушают постепенно мембрану, в следствие чего расширяется синаптическая щель, снижается фактор надежности, следовательно, снижается возможность проведения (частичный или полный блок нейромышечной передачи), так как ацетилхолин поступает, но не связывается или связывается с малым количеством рецепторов.
I. По возрасту возникновения:
1. Неонатальная. Может быть у детей от матерей больных миастенией или транзиторная миастения новорожденных (синдром вялого ребенка).
2. Миастения юношеского возраста.
3. Миастения взрослых.
II. По выявлению антител:
III. Клиническая (Гехт Б.М. 1965)
1. Миастенические эпизоды – преходящие двигательные нарушения с полным регрессом (10-12%).
2. Миастеническое состояние – стационарная непрогрессирующая форма в течение многих лет (13%).
3. Прогрессирующая форма – неуклонное прогрессирование заболевания (50-48%).
4. Злокачественная форма – острое начало и быстрое нарастание нарушения функции мышц (25%).
Формы переходят друг в друга.
По степени гиперплазии:
По степени двигательных расстройств:
По интенсивности восстановления двигательной функции после введения АХЭп (степень компенсации):
Наличие нарушений жизненно-важных функций.
Патологическая утомляемость мышц лабильна – хороший эффект от АХЭп. Быстрое восстановления после отдыха.
Чаще поражаются поперечно-полосатые мышцы:
1. На основании клинических проявлений (миастенический синдром).
2. Электрофизиологическое исследование (ЭНМГ).
1. Прозериновая проба – вводится
Sol.Proserini 0,05% 1-3 мл п/к +
Оценка через 30 минут. Например, уменьшение птоза, восстановления артикуляции при чтении и др.
2. Электрофизиологическое. ЭНМГ – снижение амплитуды потенциала действия min на 10% от нормы. Лучше 12-15% при стимуляционной ЭНМГ.
3. Серологическое определение уровня антител к холиновым рецепторам и поперечно-полосатым мышцам в крови.
4. Рентгеновская компьютерная томография или магнитно-резонансная томография органов средостения. Надежность при выявлении тимомы 95%.
1. При вовлечении в процесс ядер черепно-мозговых нервов (например, опухоль в стволе головного мозга) в клинике есть рефлекторные нарушения, часто страдают проводники.
2. Рассеянный склероз.
3. Синдром Гиенна-Барре
5. Астенические депрессии и неврозы.
6. Соматические болезни.
Убретид, как правило, не применяется в связи с формированием коммулятивного эффекта и развитием холинэргического криза.
Тензилон используется только в диагностических целях.
Прозерин используется для оказания быстрого действия. Поэтому целесообразно применение калимина.
Принцип дозирования – следующая доза принимается за 30 минут до окончания действия предыдущей. При переводе больных на парентеральное введение препаратов, учитывается что 1 таблетка калимина (60 мг) равноценна 1 мл 0,05% раствора прозерина.
В некоторых ситуациях (mensis, инфекции, ремиссия) – чувствительность к АПЭ препаратам повышается. В этом случае доза препаратов уменьшается.
Больных нужно обучать коррегировать дозу индивидуально в зависимости от течения болезни.
Относительные противопоказания к применению АХЭп:
При назначении АХЭп сочетают с препаратами калия, так как последние пролонгируют действие АХЭп. Используется диета богатая калием (печеный картофель, курага, бананы и др.). Используют калийсберегающие препараты (верошпирон 25 мг – 1 таблетка 2 раза в сутки, хлорид калия 3,0 гр в сутки в растворах, порошках, таблетках) с целью предупреждения передозировки АХЭп.
1. Тимэктомия – при тимоме обязательна, эффективность от 70-90%, возможны ремиссии.
Показанием к оперативному лечению являются:
а) злокачественные формы
б) прогрессирующая форма
в) миастеническое состояние в зависимости от степени выраженности дефекта.
При локальных формах подходят избирательно.
Противопоказания к тимэктомии:
До оперативного лечения обязательна предоперационная подготовка:
2. Глюкокортикостероиды (ГКС) показаны при недостаточном эффекте других методов лечения. При этом необходимо длительное применение.
Используют чаще таблетированные формы, такие как преднизолон, дексаметазон или пульс-терапия метилпреднизолоном.
Применяемые чаще схемы – прием ГКС ежедневно или через день. Преднизолон 1 таблетка – 5 мг. Назначают 60-150 мг/сутки утром при выраженном обострении ежедневно через 5-7 дней(до терапевтического эффекта) переходят на схему через день. С больших доз следует уходить быстро.
Длительно применяется поддерживающая доза через день 20-30 мг в сутки, возможно в течение нескольких месяцев или даже лет. При ухудшении состояния доза может быть увеличена. Используется так же ступенчатая схема приема ГКС. В разработанной схеме предлагается увеличение начальной дозы препарата до 25-30 мг в один прием утром. Каждый последующий прием гормонов увеличивается на 25-30 мг до достижения максимальной дозы 100 мг.
Длительный прием глюкокортикостероидов приводит к побочным эффектам, таким как синдром Кушинга, остеопороз, стероидный диабет, артериальная гипертензия, тенденция к нарастанию веса, поверхностный гастрит. Перечисленные побочные явления, развивающиеся у больных в результате длительной терапии преднизолоном или другим ГКС препаратами потребовала разработки и внедрения ряда средств коррекции перечисленных побочных явлений, особенно при наблюдающихся тенденциях к их прогрессированию.
Тенденция к нарастанию веса потребовала систематического использования ограничения калорийности употребляемой пищи, в особенности углеводов. Тенденция к снижению толерантности к углеводам и периодическое повышение сахара в крови, потребовало назначения препаратов, способствующих увеличению толерантности к углеводам, нормализации перекисного окисления липидов и сокращению переносимости к углеводным нагрузкам. Используются препараты липоевой кислоты (тиоксин, тиоктацин и альфа-липоевая кислота по 600 ед/сутки).
С целью профилактики остеопороза используют препараты: Са-Д 3 (Никомед). Альфа-Д 3 и миокальцек.
Для профилактики гастритов используют прерывистые курсы лечения блокаторами гистамина (зонтак по 300 мг 2-3 раза в сутки).
При симпатикотонии (повышение АД, тахикардия, беспокойство вплоть до преднизолонового психоза) необходимо назначение вегетотропных препаратов (анаприлин 20-40 мг 2-3 раза в сутки, грандаксин и др.). Чаще проявляются при пульс-терапии метилпреднизолоном.
3. Если нет эффекта от глюкокортикостероидов, то проводится иммуносупрессивная терапия. Применяются следующие препараты:
Азатиоприн (имуран) назначают с 50 мг в сутки до 100-200 мг в сутки вместе с поддерживающей дозой преднизолона.
При применении иммунодепрессантов могут быть осложнения в виде лейкопении, следовательно необходим контроль общего анализа крови 1 раз в 3 дня, при нарастании лейкопении препарат следует отменить.
Курсовая терапия проводится внутривенно капельно, эффективность 70-90%. Схема – ежедневно до 5-7 дней, затем через день 2-4 недели.
4. Хороший эффект достигается при проведении плазмафереза особенно при обострениях, в период миастенических кризов, при подготовке к операции, неэффективности кортикостероидной терапии. Проводится 3-5 сеансов. Сначала через день, затем 2-3 раза в неделю. Плазмаферез проводят с заменой плазмы или использованием белков-заменителей.
Можно использовать такие методы, как гемосорбция или энтеросорбция (угольные сорбенты СУМС 15-30 мг/кг веса 3 раза в сутки в течение 2-3 недель).
5. Иммуноглобулины G
Вспомогательная терапия включает в себя метаболическую терапию:
Кризы при миастении бывают:
Миастенические кризы развиваются при недостаточном назначении АХЭ препаратов.
Миастенический криз Холинэргический криз
1) Быстрое развитие (часы, минуты) 1) Медленное развитие (сутки и более)
3) Сухость кожи 3) Гипергидроз
4) Повышение АД, тахикардия 4) Снижение АД, брадикардия
5) Задержка при мочеиспускании 5) Учащенное мочеиспускание
6) Парез кишечника 6) Усиление перистальтики, диарея
7) Отсутствие фасцикуляций 7) Наличие фасцикуляций
8) Дыхательные нарушения 8) Дыхательные нарушения
В патогенезе кризов ведущим является развитие нервно-мышечного блока с выраженным прогрессированием патологической мышечной слабости и нарушением функции дыхательных мышц, следовательно лечение кризов должно быть направлено на компенсацию нарушений нервно-мышечной передачи и коррекцию иммунологических расстройств.
1. В качестве первого мероприятия предполагает необходимость адекватного дыхания с помощью принудительной ИВЛ. По показаниям к переводу на ИВЛ – нарушение ритма дыхания, цианоз, возбуждение, потеря сознания, участие вспомогательной мускулатуры, изменение величины зрачков отсутствие реакции на введение АХЭ препаратов.
2. Проведение плазмафереза или плазмасорбции. Проводится курсом на протяжении 1-2 недель с кратностью 2-5 операций.
3. Иммуноглобулины. Человеческий Ig представляет собой иммунореактивный белок. Препараты выделяются из плазмы здоровых людей. Применение высоких доз Ig обладает способностью подавлять иммунные процессы. В настоящее время терапия Ig является как альтернатива плазмафереза, на основании сходств механизмов, лежащих в основе этих методов лечения.
Общепринятым режимом терапии считают короткие 5-дневные курсы в/венного введения препарата в доза 400 мг/кг ежедневно. В среднем клинический эффект отмечается на 4 день терапии и продолжается в течение 50-100 дней. Может так же использоваться опыт при введении минимальных доз октагама и биовена 4-5 мг/кг в/венно капельно №10, суммарная доза 25 гр.
Возможность использования нормального человеческого Ig в дозе 50 мл в/венно капельно на 100-150 мл физиологического раствора. Введения повторяют через день в количестве 3-5 гр на курс лечения.
4. Антихолинэстеразные препараты. Чаще применяют парентеральное введение. Применение АХЭп в количестве диагностической пробы показаны при любой форме криза (наиболее эффективно их введение при миастеническом кризе). Прозерин вводится п/к от 1,5 до 2,5 мл, для уменьшения нежелательных эффектов вводят атропин 0,2-0,5 мл 01% раствора. Результат оценивается как при прозериновой пробе.
5. Глюкокортикостероидные препараты. Наиболее эффективно применение пульс-терапии 1000 мг метилпреднизолона в/в капельно. После которой рекомендуется использовать ежедневный прием преднизолона.
Таким образом, в основе миастениии лежит активный аутоиммунный процесс, повреждающий постсинаптическую мембрану. Заболевание носит как правило прогрессирующий характер. Это требует от врачей ранней диагностики и активной тактики в плане назначения иммунносупрессивной терапии (тимэктомия, кортикостероиды, цитостатики, плазмоферез, иммуноглобулины).


 |