Прайм буст вакцинация что это
Безопасность и эффективность гетерологичной вакцины prime-boost COVID-19 на основе Спутник V: промежуточный анализ исследования фазы 3 в России
Пандемия COVID-19 привела к более чем 98 миллионам подтвержденных случаев заболевания и более чем 2 миллионам смертей (на момент публикации). Существует несколько временно лицензированных вакцин против COVID-19, и глобальные усилия сосредоточены на разработке безопасных и эффективных вакцин для профилактики COVID-19. Согласно проекту ВОЗ «ландшафт вакцин-кандидатов COVID-19», 64 кандидата находятся на клинической оценке (в том числе 13 на этапе 3), а 173-на доклиническом анализе.
Аденовирусные векторные вакцины
Безопасность аденовирусных векторных вакцин широко изучена, и терапевтические препараты на основе аденовирусных векторов используются в клинической практике. Известно, что аденовирусные вектор-доставляемые антигены индуцируют как клеточный, так и гуморальный иммунитет после однократной иммунизации, что позволяет использовать их в качестве средства экстренной профилактики в условиях пандемии. Кроме того, использование двух иммунизаций дает прочный и длительный иммунный ответ.
Эти характеристики делают вакцины на основе рекомбинантного аденовируса с дефицитом репликации (rAd) подходящими кандидатами для профилей целевых продуктов ВОЗ для долгосрочной защиты людей с высоким риском заражения COVID-19 в условиях вспышки, поскольку они стимулируют быстрое наступление защитного иммунитета. Хотя аденовирусные векторы могут индуцировать иммунные реакции против компонентов вектора и ослаблять антиген-индуцированные реакции, гетерологичная вакцинация прайм-бустом с двумя различными векторами позволяет минимизировать этот эффект.
Таким образом, наиболее эффективным подходом для генерирования мощного и длительного иммунного ответа, не зависящего от наличия уже существующего иммунного ответа на вектор, является гетерологичный подход к вакцинации прайм-бустом. Этот подход был использован при разработке вакцины для профилактики COVID-19.
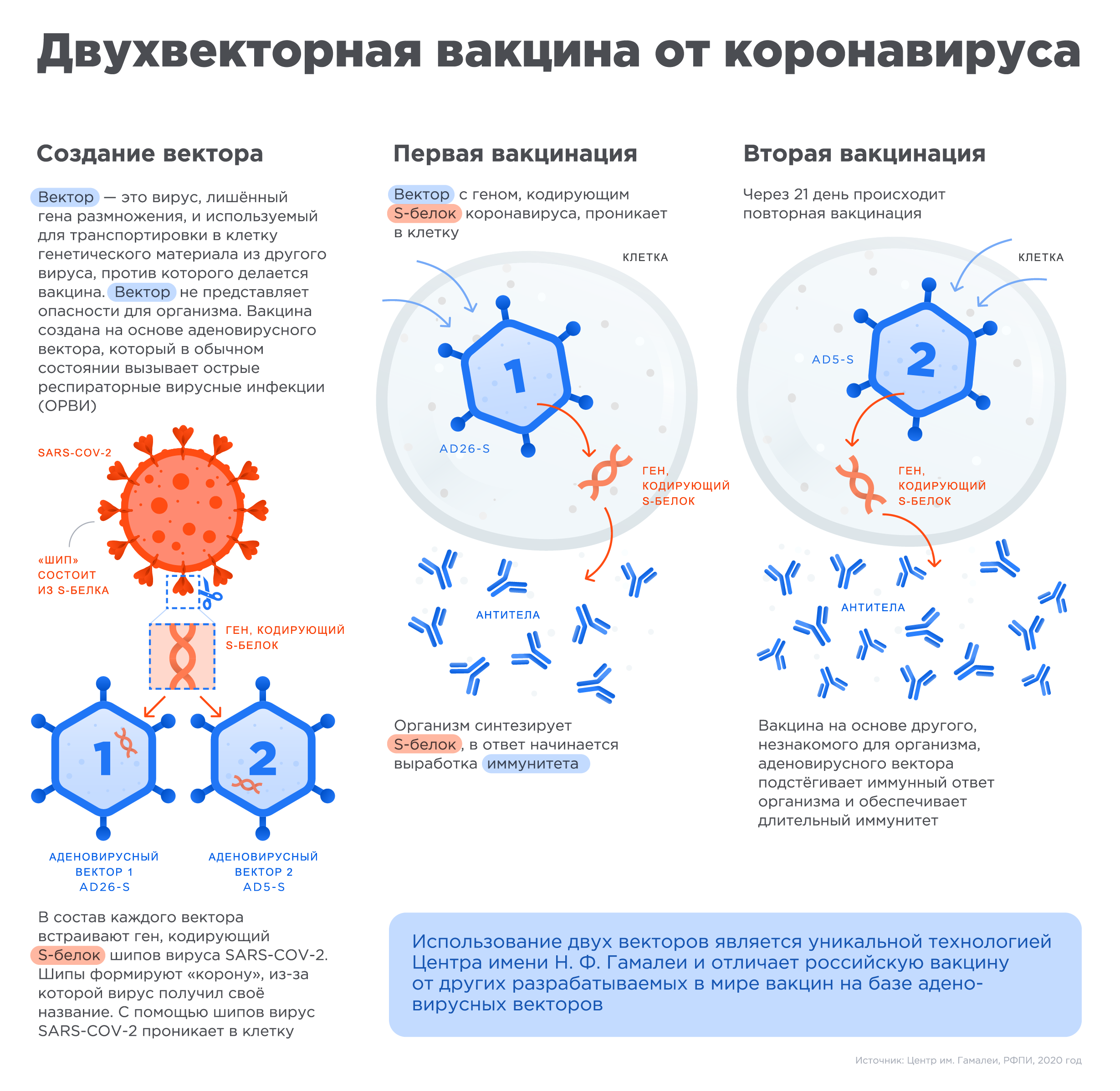
Gam-COVID-Vac—это комбинированная векторная вакцина, основанная на rAd type 26 (rAd26) и rAd type 5 (rAd5)-оба из которых несут ген полноразмерного гликопротеина S SARS-CoV-2 (rAd26-S и rAd5-S). рАд26-С и рАд5-С вводят внутримышечно раздельно с интервалом 21 день. Фаза 1/2 клинических испытаний вакцины была завершена в августе 2020 года.
Результаты показали, что вакцина хорошо переносится и обладает высокой иммуногенностью у здоровых участников. В результате кандидат на вакцину был предварительно одобрен в России в соответствии с национальным законодательством. Такая регистрация позволяет использовать вакцину в группах высокого риска, с усиленным фармаконадзором, при этом проводится постмаркетинговое исследование эффективности. Здесь мы представляем предварительные результаты эффективности и безопасности многоцентрового исследования фазы 3 с использованием Gam-COVID-Vac у взрослых с субанализом взрослых старше 60 лет.
Вакцина prime-boost COVID-19 на основе Спутник V
Гетерологичная рекомбинантная вакцина на основе аденовируса (rAd) Gam-COVID-Vac (Sputnik V) показала хороший профиль безопасности и индуцировала сильные гуморальные и клеточные иммунные реакции у участников клинических испытаний фазы 1/2. Здесь сообщаются предварительные результаты эффективности и безопасности Gam-COVID-Vac из промежуточного анализа исследования фазы 3.
Зарегистрированные участники были разделены на пять возрастных групп (18-30 лет, 31-40 лет, 41-50 лет, 51-60 лет и >60 лет) и распределены в две исследовательские группы с использованием стратифицированной (размер блока 4) интерактивной веб-системы реагирования (IWRS) рандомизации в соотношении 3:1 к группе вакцины или группе плацебо. Участникам исследования были присвоены уникальные рандомизационные номера, которые оставались неизменными на протяжении всего исследования. Статистик сгенерировал последовательность, в соответствии с которой препарат был маркирован. Препарат и плацебо были внешне неразличимы (упаковка, этикетка и содержание). Следователи, участники и весь исследовательский персонал были замаскированы для группового задания.
Процедуры
Все участники, давшие согласие на участие, прошли скрининговый визит для физического обследования, проверки жизненно важных показателей (например, кровяного давления, частоты сердечных сокращений и температуры), а также анализов крови на инфекции (ВИЧ, гепатиты В и С, сифилис) и сбора исходных характеристик иммуногенности. У всех добровольцев были проведены анализы мочи на наркотики и алкоголь, а у женщин-тесты на беременность. ПЦР-анализ мазков SARS-CoV-2 также был проведен при скрининге центральной лабораторией в Москве, чтобы исключить участников с COVID-19. При скрининге информация о наличии сопутствующих заболеваний и группе риска инфицирования SARS-CoV-2 заносилась в бланки историй болезни участников. Высокий риск-это те, чья работа связана с взаимодействием с пациентами с подтвержденным диагнозом COVID-19; средний риск-это те, кто имеет профессиональный контакт с большим количеством людей, таких как врачи общей практики, социальные работники и продавцы; а общий риск-это те, у кого нет дополнительных рисков, связанных с их профессиональной деятельностью. Предполагаемая продолжительность участия индивидуумов в исследовании составляла 180 дней после первой дозы вакцины или плацебо. В ходе исследования было запланировано одно скрининговое посещение и пять выездов на клиническую площадку.
Вакцина состоит из двух векторных компонентов: rAd26-S и rAd5-S. Полная доза вакцины составляла 1011 вирусных частиц на дозу для каждого рекомбинантного аденовируса; 0·5 мл/доза для внутримышечного введения. Плацебо состоит из вакцинного буферного состава, но без рекомбинантных аденовирусов, составленных до равного объема вакцины. Вакцина и плацебо были разработаны, изготовлены и сохранены компанией Gamaleya NRCEM (Москва, Россия) в соответствии с Надлежащей производственной практикой. Вакцину и плацебо использовали в жидком виде (замороженном). Составы вакцины и плацебо описаны в приложении (стр. 1). Вакцину (первая доза rAd26, вторая доза rAd5) или плацебо вводили внутримышечно в дельтовидную мышцу с интервалом между дозами 21 день.
Последующие наблюдательные визиты были запланированы на 28-й день (±2 дня), 42-й день (±2 дня) и 180-й день (±14 дней). Во время наблюдательных визитов у всех участников исследования оценивались жизненные показатели и регистрировались изменения в состоянии и самочувствии участников по сравнению с предыдущим визитом. ПЦР-тест проводился в сочетании с клиническим обследованием в день приема второй дозы (21-й день) для диагностики симптоматических и бессимптомных случаев COVID-19. При наличии клинических признаков респираторной инфекции и положительного ПЦР-теста участник не был вакцинирован второй дозой и был направлен к медицинскому персоналу для лечения COVID-19. Участники без признаков респираторной инфекции были вакцинированы до получения результатов ПЦР. В случае положительного результата ПЦР-теста участники были классифицированы как бессимптомные и не учитывались как случаи COVID-19 в анализе эффективности, согласно протоколу. Во время исследования, кроме скринингового визита и дня приема второй дозы, никаких дополнительных ПЦР-тестов не проводилось, за исключением случаев, когда участники сообщали о симптомах COVID-19.
Спонсор организовал несколько дополнительных наблюдательных визитов дистанционно в качестве телемедицинских консультаций. Внеплановые телемедицинские консультации поощрялись в случае жалоб или вопросов участников о процедурах исследования. Все участники получили контакты исследовательской группы при подписании информированного согласия и были проинструктированы связываться с группой по мере необходимости, но в первую очередь сообщать о любых признаках или симптомах, которые могут свидетельствовать о неблагоприятном событии. Всем участникам также предлагалось установить электронные дневники на свои смартфоны для мониторинга состояния своего здоровья. Информация от тех участников, которые решили не использовать электронные дневники, была собрана сотрудниками сайта с помощью технологии телеконсультации. Данные, собранные в ходе этих телемедицинских консультаций, были внесены исследователями сайта непосредственно в медицинскую карту участника.
Исследование было организовано и контролировалось московским филиалом голландской контрактной исследовательской организации Crocus Medical. Управление данными осуществляется с помощью ДМ 365 MainEDC системы (разработчик-управление данными 365), мощная облачная платформа комплексной включать в себя функции сбора данных, передовые методы рандомизации, полный контроль над лекарственного обеспечения и отпуска, и пациент электронных дневников (электронного захвата данных, приложения, лекарственного обеспечения и электронного пациентов исходы). Система соответствует всем применимым международным нормам, включая Кодекс федеральных правил, Раздел 21 Часть 11, Надлежащую клиническую практику, Надлежащую автоматизированную производственную практику 5, Переносимость и подотчетность Медицинского страхования и Общие Правила защиты данных. Система позволяет собирать и валидировать клинические данные в высоконагруженных клинических испытаниях и поддерживает процессы централизованного мониторинга и риск-ориентированного мониторинга, автоматизированное кодирование с помощью Медицинского словаря для регуляторной деятельности (MedDRA), WHODrug и Логических идентификаторов наблюдений, а также мгновенное сопоставление экспортированных данных со стандартной моделью табуляции данных исследований Консорциума Стандартов обмена клиническими данными.
Забор крови проводился в день вакцинации непосредственно перед введением исследуемого препарата. Забор крови для оценки параметров иммуногенности проводился только в некоторых исследовательских центрах, отобранных на основе логистической цепочки доставки биоматериала в центральную лабораторию, где проводилась первичная обработка крови (сбор сывороток, аликвотирование и замораживание). Забор крови на антиген-специфические IgG в анализе планируется принять от до 9520 участников судебного процесса до окончания судебного разбирательства.
Полученные данные
В период с 7 сентября по 24 ноября 2020 года 21 977 взрослых были разделены в группу вакцинации (n=16 501) или группу плацебо (n=5476). 19 866 получили две дозы вакцины или плацебо и были включены в первичный анализ результатов. С 21 дня после первой дозы вакцины (день введения дозы 2), 16 (0·1%) из 14 964 участников в группе вакцины и 62 (1·3%) из 4902 в группе плацебо было подтверждено наличие COVID-19; эффективность вакцины составила 91·6% (95% ДИ 85·6-95·2). Большинство зарегистрированных нежелательных явлений были 1-й степени (7485 [94·0%] из 7966 общих событий). 45 (0·3%) из 16 427 участников в группе вакцинации и 23 (0·4%) из 5435 участников в группе плацебо имели серьезные побочные эффекты; ни один из них не был признан связанным с вакцинацией, что было подтверждено независимым комитетом по мониторингу данных. В ходе исследования было зарегистрировано четыре смерти (три [
Вывод
Этот промежуточный анализ фазы 3 исследования Gam-COVID-Vac показал 91·6% эффективность против COVID-19 и хорошо переносился в большой когорте.
Первый пошел: читаем инструкцию к российской вакцине от COVID-19
Минздрав РФ зарегистрировал первую российскую вакцину от нового коронавируса, созданную в Центре имени Гамалеи. Регистрация пока «условная», завершены только две фазы испытаний из трех, однако полученных данных, по мнению Минздрава, достаточно, чтобы начать вакцинацию людей из групп риска. Результаты испытаний до сих пор не опубликованы, зато в государственном реестре лекарственных средств появилась инструкция по применению новой вакцины. Редакция N + 1 внимательно ее прочитала — и рассказывает, что можно узнать из нее об эффективности и безопасности препарата.
Вакцина получила название «Спутник-V» (коммерческое название — Гам-КОВИД-Вак) — в честь первого спутника (гадать, что такое V, оставляем читателям). Строго говоря, в «гонке» вакцин российский «Спутник» занимает седьмое место: согласно данным Всемирной организации здравоохранения (последнее обновление — 10 августа), к третьей фазе клинических испытаний уже перешли четыре китайские вакцины, одна американская и одна британская. Третья фаза испытаний российской должна начаться в ближайшие дни, но пока еще впереди. Однако в странах, где созданы остальные вакцины, регистрировать даже для ограниченного применения их пока не стали, за исключением КНР, где военным на год разрешили применять аденовирусную вакцину — видимо, для вакцинации военнослужащих. Россия действительно стала первой страной, которая одобрила вакцину и готова вакцинировать представителей групп риска до завершения третьей фазы испытаний (невзирая на опасения Ассоциации организаторов клинических исследований).
Вместе с регистрацией в открытый доступ были выложены, помимо превосходного промо-ролика и «запрещенной» колонки директора РФПИ Кирилла Дмитриева, и некоторые официальные документы, без которых регистрация препарата, по-видимому, была технически невозможна. Среди них — и инструкция по применению вакцины.
Как работает вакцина?
Она представляет собой два аденовирусных вектора, то есть два обезвреженных аденовируса, которые несут в себе ген поверхностного S-белка SARS-CoV-2. Проникая в клетку, аденовирусы приносят с собой чужеродный ген, и клетки начинают производить коронавирусный белок, на который и реагирует иммунная система. Сами по себе модифицированные аденовирусы в организме не размножаются, то есть работают просто как система доставки (подробнее об этой и других технологиях производства антикоронавирусных вакцин читайте в нашем материале «На острие иглы»).
Вакцинация проходит в два этапа: сначала человек получает внутримышечно дозу одного аденовирусного вектора (серотип 26), через три недели — другого (серотип 5). Оба несут один и тот же коронавирусный S-белок. Такую двухфазную систему называют «прайм-буст»: первый вектор запускает иммунный ответ (prime), а второй его разгоняет и усиливает (boost).
В клинических испытаниях участвовала еще одна вакцина Центра Гамалеи, того же состава, но в лиофилизированной форме (в виде сухого концентрата, из которого необходимо на месте приготовить раствор). Данных о ее регистрации в Государственном реестре лекарственных средств (ГРЛС) пока нет.
Как проходили клинические испытания?
Результаты первых двух фаз клинических испытаний, по словам главы РФПИ Кирилла Дмитриева, появятся в открытом доступе лишь к концу августа. Однако кое-что о них можно прочесть уже в инструкции, в разделе «фармакологическое действие». Там сообщается о 38 взрослых (18-60 лет) добровольцах, которые участвовали в испытании: 9 получили только первую дозу вакцины, еще 9 — только вторую (эти две группы составляли первую фазу испытаний), а еще 20 — обе дозы согласно протоколу прайм-буст (это была вторая фаза). Состояние иммунной системы испытуемых врачи оценивали через 6 недель начала вакцинации.
Контрольную группу дизайн исследования не предусматривал. Силу иммунного ответа у добровольцев сравнивали с их собственными показателями до введения вакцины. Не было предусмотрено и какого бы то ни было ослепления: исследование было открытым, то есть все участники знали о том, кому и какая досталась вакцина.
Насколько вакцина безопасна?
Согласно инструкции по применению, в первые пару дней после вакцинации можно ожидать местные реакции (покраснение, отек, зуд) в области укола и «гриппоподобный симптом», реже — аллергические реакции и нарушение пищеварения, но все они сходят на нет в течение еще нескольких дней.
Участники клинических испытаний с ними столкнулись: в ходе исследования врачи зафиксировали почти 200 «нежелательных явлений», то есть в среднем около пяти побочных эффектов на человека. Впрочем, среди них встречались и совсем незначительные, вроде повышения температуры в месте инъекции, а тяжелых осложнений ни у кого не возникло. К 42-му дню испытаний 144 нежелательных явлений исчезли без последствий, и сохранялись еще несколько десятков явлений, которые авторы инструкции охарактеризовали как «лабораторные отклонения иммунологических показателей, что не имеет клинического значения». В инструкции приводится длинный список этих отклонений, в их числе, например, повышение концентрации лимфоцитов в крови, отклонения, связанные с количеством антител и так далее.
Большинство нежелательных явлений, возникающих в ответ на введение Гам-КОВИД-Вак, авторы инструкции сочли частыми (более чем 1 раз из 100) или очень частыми (более чем 1 раз из 10). Тем не менее, это так для многих других вакцин: например, в списке частых и очень частых побочных эффектов российской вакцины от коклюша АбКДС тоже более десятка пунктов. В испытаниях других вакцин, которые проводил Центр Гамалеи — например, от туберкулеза или лихорадки Эбола (последняя работает на том же аденовирусном «движке», что и вакцина от коронавируса) — доля испытуемых, которые перенесли хотя бы один побочных эффект, доходила до 100 процентов.
Так что в этом смысле вакцина от коронавируса ничем не уникальна. В первых фазах испытаний ее конкурентов — например, аденовирусной вакцины из Великобритании — тоже отмечали похожие побочные эффекты, которые, тем не менее, сочли достаточно безопасными.
Насколько вакцина эффективна?
Инструкция сообщает, что Гам-КОВИД-Вак вызывает образование гуморального и клеточного иммунитета к SARS-CoV-2, иными словами, в организме испытуемых появляются антитела и Т-клетки, «заточенные» на распознавание нового коронавируса. Тем не менее, данные приведены только в отношении антител: их удалось обнаружить у всех участников испытания (в исследованиях британской и китайской аденовирусной вакцин — лишь у половины испытуемых).
Средний титр (концентрация) антител, которые способны распознать S-белок коронавируса, составил 14703, а вируснейтрализующих (то есть тех, что «наводятся» на белок в составе вируса, а не отдельно на S-белок в растворе) — 49,3. Впрочем, пока сложно сказать, много это или мало — эти значения сильно разнятся для успешной «защиты» от разных инфекций, и те количества, которых достаточно, чтобы справиться с одним вирусом, могут оказаться бессильны перед другим. Кроме того, в некоторых исследованиях уже было подмечено, что пожилые люди, переболевшие COVID-19, отличаются повышенными титрами антител. С учетом того, что они часто переносят болезнь тяжелее молодых, «много» в данном случае может означать не защиту, а, наоборот, уязвимость. Так или иначе, в инструкции значится, что «защитный титр антител в данный момент неизвестен».
Кроме того, есть подозрение, что Т-клеточный иммунитет гораздо более эффективен против коронавирусной инфекции, чем антитела. По крайней мере, известно, что тяжелое течение COVID-19 сопровождается нехваткой Т-клеток. Однако о том, хватает ли этих клеток добровольцам, испытавшим на себе вакцину, мы до сих пор ничего не знаем. Инструкция сообщает, что у всех участников испытания обнаружены специфические к SARS-CoV-2 лимфоциты, как Т-киллеры, так и Т-хелперы, а при встрече с вирусным S-белком они активируются — то есть начинают делиться и производить противовирусный белок интерферон гамма. Сколько этих клеток и насколько они активны, однако, неясно.
В ближайшее время (по словам Дмитриева — в ближайшие дни) стартует третья фаза испытаний вакцины. Ожидается также, что осенью экспериментальную дозу получат люди из группы риска. По некоторым сообщениям, в нее войдут врачи, учителя и пожилые люди. Впрочем, насчет последнего возникают сомнения: инструкция предусматривает применение вакцины у людей 18-60 лет. А графе «[применение] с осторожностью» значится внушительный список противопоказаний: болезни почек, печени, сердца, диабет и многие другие частые спутники людей пожилого возраста.
Пресс-служба Минздрава сообщила, что «срок действия» вакцины — около двух лет Здесь Минздрав опирается на слова директора Центра им. Гамалеи Александра Гинцбурга, который так оценил длительность защиты от предыдущей разработки Центра — аденовирусной вакцины от лихорадки Эбола. Тем не менее, авторы инструкции по применению с этим не согласны: в ней значится, что «продолжительность защиты [от COVID-19] неизвестна». И действительно, в научном сообществе до сих пор нет консенсуса по поводу того, сколько длится иммунитет к SARS-CoV-2 — мы рассказывали об этом в материале «Мы его запомним?»
О Спутник V
О Спутник V
«Спутник V» — первая в мире зарегистрированная вакцина на основе хорошо изученной платформы вектора аденовируса человека. Она одобрена в 71 стране с общим населением 4 млрд человек.
Вакцина названа в честь первого советского космического спутника. Запуск «Спутника-1» в 1957 году дал новый импульс космическим исследованиям во всем мире, создав так называемый «момент Спутника» для мирового сообщества.
Эффективность вакцины составляет 97,6% по результатам анализа данных о заболеваемости коронавирусом среди россиян, привитых обоими компонентами препарата в период с 5 декабря 2020 года по 31 марта 2021 года.
Фаза 1 и 2 клинических испытаний вакцины были завершены 1 августа 2020 года. Итоги третьей фазы клинических испытаний в России опубликованы в журнале Lancet 2 февраля 2021 года. Клинические испытания третьей фазы «Спутник V» также успешно проходят в ОАЭ, Индии, Венесуэле и Беларуси.
Вакцина «Спутник V» создана на проверенной и хорошо изученной платформе аденовирусных векторов человека, которые вызывают обычную простуду и с которыми человечество сталкивалось на протяжении тысячелетий.
В вакцине «Спутник V» впервые среди вакцин против коронавируса был применен подход гетерогенного бустирования, в основе которого лежит применение двух разных векторов для двух уколов в процессе вакцинации. Такой подход формирует более стойкий иммунитет по сравнению с вакцинами, которые используют одинаковый механизм доставки для обоих уколов.
Безопасность, эффективность и отсутствие долгосрочных негативных последствий у аденовирусных вакцин доказаны в более чем 250 клинических исследованиях на протяжении двух десятилетий.
«Спутник V» не вызывает сильной аллергии.
Температура хранения на уровне +2+8 градусов Цельсия позволяет хранить вакцину в обычном холодильнике без необходимости инвестиций в дополнительную инфраструктуру холодовой цепи.
Как работают вакцины на основе аденовирусного вектора
«Векторы» являются носителями, которые могут доставить генетический материал из другого вируса в клетку. При этом генетический материал аденовируса, который вызывает инфекцию, удаляется и вставляется материал с кодом белка от другого вируса, в данном случае от шипа коронавируса. Этот новый элемент безопасен для организма, но он помогает иммунной системе реагировать и вырабатывать антитела, которые защищают от инфекции.
Технологическая платформа векторов на основе аденовирусов упрощает и ускоряет создание новых вакцин путем модификации исходного вектора-носителя генетическим материалом из новых появляющихся вирусов, что позволяет получать новые вакцины в сжатые сроки. Такие вакцины вызывают сильный ответ со стороны иммунной системы человека.
Человеческие аденовирусы считаются одними из самых простых для модификации, поэтому они стали очень популярными в качестве векторов.
Преимущества прайм-буст иммунизации

Безопасность и эффективность
После начала пандемии российские исследователи извлекли фрагмент генетического материала нового коронавируса SARS-COV-2, кодирующий информацию о структуре S белка шипа вируса (белок формирующего «корону» вируса и отвечающий за его связывание с клетками человека), и вставили его в уже знакомый им аденовирусный вектор для доставки в человеческую клетку, создав, таким образом, первую в мире вакцину против коронавируса SARS-COV-2.
Чтобы обеспечить длительный иммунитет, российские ученые предложили использовать два разных типа аденовирусных векторов для первой и второй вакцинации, усиливая действие вакцины.
Использование аденовирусов человека в качестве векторов безопасно, так как данные вирусы, вызывающие ОРВИ, не являются новыми и существуют уже тысячи лет.
Эффективность против новых штаммов
Вакцинация препаратом вырабатывает защитные нейтрализующие титры антител против новых штаммов, включая Alpha B.1.1.7 (впервые выявлен в Великобритании), Beta B.1.351 (впервые выявлен в ЮАР), Gamma P.1 (впервые выявлен в Бразилии), Delta B.1.617.2 и B.1.617.3 (впервые выявлены в Индии) и выявленных в Москве вариантов B.1.1.141 и B.1.1.317 с мутациями в рецептор-связывающем домене (RBD).Методология исследования основана на оценке вируснейтрализующей активности (ВНА) с применением живого вируса, что позволяет получить наиболее достоверные данные и является «золотым» стандартом. В ходе исследования сравнивалась ВНА сыворотки крови людей после вакцинации препаратом «Спутник V» на образцах штаммов, имеющих международное распространение, с ВНА против исходного штамма B.1.1.1. Сыворотка крови была собрана у лиц, иммунизированных обоими компонентами «Спутника V».
Полученные данные демонстрируют, что «Спутник V» сохраняет защитные свойства против новых штаммов. Снижение уровня вируснейтрализующей активности у препарата «Спутник V» к ряду штаммов оказалось значительно меньшим по сравнению с данными, опубликованными производителями других вакцин, которые ранее подтвердили эффективность своих препаратов против новых мутаций коронавирусной инфекции.