Полипептиды и нуклеиновые кислоты для чего нужны человеку
Какие инъекции делать: пептиды или нуклеотиды?
Современная косметология предлагает все больше и больше средств, призванных улучшить состояние кожи. Среди таких средств стоит выделить пептидные и нуклеотидные инъекции. В нашей статье мы расскажем вам, что это за препараты, в пользу каких веществ лучше сделать выбор и какого эффекта от них ожидать.
Что такое пептиды?
Это небольшие цепочки белков, обладающие лечебными свойствами. Отметим, что пептиды довольно глубоко проникают в дерму, что является преимуществом в их использовании.
По действию на структуры кожи разберем 7 групп пептидов, которые используются в косметологических препаратах:
При этом лучше всего, если в одном препарате присутствует комбинация пептидов или их групп. Среди наиболее распространенных пептидов стоит выделить 23, 24, 34, 72 и 51 (все – олигопептиды). У каждого из них своя «зона ответственности»:
Показания к применению
Пептидные инъекции показаны в следующих случаях:
Инъекции пептидов обычно применяют в техниках мезотерапии или биоревитализации. Показания для инъекционных процедур с пептидами есть в любом возрасте, только вот комбинацию этих пептидов – препарат, подбирает компетентный врач.
Эффект от пептидных инъекций:
Нуклеотиды
Нуклеотиды – мономеры – «кирпичики», из которых строятся полимеры – «стены», такие важные для человека, как ДНК и РНК (они же – полинуклеотиды), присутствующие внутри клеток любых живых организмов и отвечающих за наследственную информацию.
Всего выделяют 4 нуклеотида:
Процедура по введению в кожу препаратов с нуклеотидами, называется биорепарация – это ремонт поломок ДНК и РНК с помощью запчастей – нуклеотидов. Содержащиеся в препаратах нуклеотиды восстанавливают имеющиеся повреждения, замещая сломанные нуклеотиды в составе белковый спиралей.
Насколько безопасны такие препараты, если их действие, так или иначе, связано с генами? Беспокоиться не стоит. Обычно в составе таких препаратов содержится всего 50-20 000 пар нуклеотидов, а для побочного эффекта в виде формирования нового гена этого точно не хватит. Все, на что хватает содержащихся в препарате «генных» молекул, это исключительно восстановление поврежденных «родных» нуклеотидов в организме. Это значит, что никакой генетической трансформации с человеком не произойдет.
В качестве сырья для таких препаратов обычно выступают молоки рыб семейства лососевых. Дело в том, что ДНК рыбьих молок близки ДНК человеческих лейкоцитов, а это значит, что действие на человеческий организм будет эффективным и безопасным, без побочных эффектов и аллергических реакций.
Препараты с нуклеотидами показаны при следующих ситуациях:
Инъекции каких веществ лучше выбрать?
Все относительно просто. Пептиды направлены, в основном, на стимуляцию деления клеток дермы, вследствие чего происходит омоложение кожи. Пептид отдает команду и организует процесс синтеза белка в нужном количестве, как результат происходит омоложение тканей.
Эффект от нуклеотидов куда более сложный. Они выявляют поломку в молекулах белка, производят реставрацию, в результате чего, мы получаем здоровую матрицу для дальнейшей репродукции таких же здоровых молекул ДНК и РНК. Это профилактика старения с активацией собственных функций всех структур кожи – регенерации.
Нуклеотиды оказывают ещё и иммуномодулирующее воздействие, поддержание гомеостаза (саморегуляции) системы кожи человека, защиту от вредного воздействия УФ-лучей. Все это позволяет эффективно обеспечить антивозрастной эффект, который будет удерживаться в течение как можно более долгого срока.
Окончательный вывод – лучше профилактировать, чем потом лечить, лучше реконструировать матрицу сначала, а потом стимулировать синтез клеток. Эпигенетическое воздействие на кожу грамотно начинать с введения нуклеотидов, а далее подключать пептиды.
Синтетические нуклеиновые кислоты в лечении психоневрологических заболеваний
Концепция использования нуклеиновых кислот в качестве лекарств сложилась в 70-х годах прошлого века ондовременно с разработкой методов синтеза ДНК и РНК-олигонуклеотидов. Синтетические нуклеиновые кислоты обладают способностью специфически связываться с последовательностью РНК-мессенджера (мРНК) и контролировать экспрессию любого гена. Поскольку эти олигонуклеотиды были комплементарны мРНК смысловой цепи, они стали известны как ASO.
Синтетические олигонуклеотиды химически модифицируют в целях улучшения биораспределения, фармакокинетики и эффективности своего эффекта внутри клеток. Как правило, ASO имеют фосфоротиоатные связи между нуклеотидами. Эти связи повышают устойчивость к расщеплению нуклеазой и увеличивают биодоступность за счет улучшения связывания с сывороточными белками. Чтобы увеличить сродство связывания с РНК-мишенями, большинство ASO модифицированы в 2 ‘положении рибозы. Блокированная нуклеиновая кислота и аналогичные нуклеотиды нуклеиновой кислоты с мостиковыми связями содержат связи между положениями 2 ‘и 4’ рибозы, которые служат для «блокировки» кольца в конформации, которая идеально подходит для связывания. Лучшая аффинность связывания может быть преобразована в более эффективное распознавание последовательностей-мишеней внутри клеток.
В некоторых случаях разрушение РНК и ингибирование экспрессии генов являются желаемыми результатами. В этих случаях используются «гамперы» ASO. Гапмеры представляют собой синтетические ASO, которые содержат фланкирующие области, содержащие 2′-нуклеотидные модификации и центральную часть ДНК. Фланкирующие области усиливают сродство к комплементарным последовательностям. При связывании разрыв ДНК образует гибрид ДНК-РНК, который может рекрутировать РНКазу Н и вызывать расщепление целевой мРНК.
Успешное развитие ASO выиграет от анализа потенциала конкурирующих технологий. Например, ASO могут не быть предпочтительными, если есть ожидание, что конкурирующая малая молекула или антитело могут быть успешно разработаны. Эти более устоявшиеся технологии, вероятно, будут иметь преимущества, по крайней мере, в ближайшей и среднесрочной перспективе. Были проведены исследования, что ASO могут быть перорально биодоступными, но эффективность здесь оказалось низкой. Отсюда следует, что пероральная биодоступность, вероятно, не совсем подходит для текущего состояния технологии ASO. По крайней мере, в ближайшей перспективе ASO незнакомы пациентам, врачам и регулирующим органам. В качестве альтернативы, показания, при которых возможно местное применение, могут потребовать меньшего количества ASO, снижения его стоимости и отделения ASO от воздействия на органы всего организма, то есть снижения вероятности появления системных токсических эффектов и непредвиденных отрицательных результатов. Для неврологии было показано, что интратекальное введение обеспечивает широкое распространение по всей центральной нервной системе. Исследования эффективности ASO, при которых изменения в белковой мишени или биомаркере может быть определено посредством биопсии или взятия крови, обеспечат раннее доказательство того, что ASO взаимодействует с мишенью и вызывает желаемые молекулярные изменения.
Атаксия Фридрейха
Атаксия Фридрейха вызвана расширенным тринуклеотидным повторением AAG в гене фратаксина ( FXN ). Примечательно, что этот расширенный повтор AAG находится в интроне и вызывает снижение экспрессии белка FXN, даже если он не находится в кодирующей области. Нормальный белок FXN производится, но уровень не является достаточным. Следовательно, методы лечения, которые восстанавливают уровни FXN, предлагают подход к лечению, который нейтрализует основную причину заболевания.
Напрашивается вывод, что олигонуклеотиды, которые блокируют расширенный повтор, могут предотвратить образование R-петли и освободить разрыв при транскрипции. Исследователями предлагаются дуплексные РНК или ASO, дополняющие повтор AAG. Оба подхода привели к увеличению экспрессии РНК и белка. Уровни белка FXN были аналогичны уровням, наблюдаемым в клетках дикого типа. Исследование показало, что синтетические нуклеиновые кислоты могут быть использованы для восстановления уровней FXN, обеспечивая отправную точку для терапевтического эффекта. Эти данные предполагают, что механизм действия ASO или дуплексных РНК включает в себя связывание с расширенным повтором и физическое предотвращение его ассоциирования хромосомной ДНК с образованием критической структуры R-петли.
«Антисмысловые олигонуклеотиды» ( ASO) эффективно ингибируют экспрессию генов в печени и центральной нервной системе. Использование их для лечения широкого спектра тканей, необходимых для полного лечения атаксии Фридрейха, потребует более сильнодействующих соединений и более эффективных стратегий доставки олигонуклеотидов во все пораженные ткани.
Спинальная мышечная атрофия
Возможность использования нуклеиновых кислот как лекарственного средства
Интерес к нуклеиновой кислоте, как лекарственному средству, по протяженности укладывается в столетний период. Публикации об особой способности нуклеиновой кислоты повышать общую сопротивляемость организма стали появляться в 1892 году. Горбачевский в 1883 г., и Морек в 1894 г., использовали нуклеиновую кислоту для лечения волчанки. А. Косеель сообщил, что нуклеиновая кислота обладает выраженным бактерицидным действием, поэтому играет основную роль в борьбе с заразным началом.
Г. Воген в 1894 г., Е. Вард в 1910 г., Б и Ф.Г.Буткевич в 1912 г., успешно лечили легочный и костный туберкулез, впрыскивая под кожу нуклеиново-кислый натрий. Исаев в 1894 г., Милке в 1904., Лейн в 1909 г., Писарев в 1910 г., Абелуа и Бадье в 1910 г., расценивали нуклеиновую кислоту как специфически действующее вещество в процессе сопротивляемости организма против таких вредных бактерий, как холерный вибрион, кишечная и бугорчатая палочки, стафилококк, стрептококк, диплококк, сибирская язва, а также против дифтерии и столбнячного токсинов. С. Штерн заменил ртутное лечение сифилиса лечением нуклеиновой кислотой и достиг у больных полного исчезновения всех проявлений сифилиса.
В последующем, открытие роли ДНК, как главного носителя генетической информации, надолго отвлекло исследователей от дальнейшего исследования нуклеиновых кислот как лекарственных средств. Кроме того, недооценка интенсивности обмена нуклеиновых кислот привела к тому, что длительное время нуклеиновые кислоты и нуклеотиды вообще не рассматривались как незаменимые питательные вещества, или нутриенты. Считалось, что организм способен самостоятельно синтезировать необходимое количество нуклеотидов для физиологических потребностей.
Новые научные данные свидетельствуют о том, что это не совсем корректно. В ряде случаев, при интенсивном росте, стрессе, ограниченном питании потребности организма могут значительно превосходить возможности синтеза нуклеотидов.
Каковы же главные источники нуклеотидов? Их три:
1. Нуклеотиды в составе пищи.
2. Утилизация нуклеотидов, высвобождаемых в процессах внутриклеточного метаболизма.
3. Синтез необходимых нуклеотидов из аминокислот и углеводов.
После долгого перерыва вновь началось исследование возможности использования экзогенной ДНК для лечения различных патологий. Так, еще в 1959 году Каназир с сотрудниками опубликовали работу по увеличению выживаемости облученных крыс при введении им изологичной натриевой соли ДНК, полученной из селезенки и печени. При этом выживаемость облученных животных возрастала от 2,6% в контроле до 30-40% в опытной группе.
Таким образом, стимуляция ради стимуляции исключитель- нд вредна. Какой выход из этого тупика? Можно ли поддержать иммунную систему на протяжении всей жизни? Ведь не секрет, что большинство заболеваний имеет инфекционную природу. Даже синдром хронической усталости является вирусным заболеванием.
Нуклеиновые кислоты настолько ценный материал, что все клетки моментально стараются захватить части ДНК или РНК, появляющиеся после распада отживших клеток. Захватывают, и вставляют в свою структуру даже без разбора на составные части. Этот механизм хорошо исследован на бактериях, которые обмениваются генетической информацией с помощью выделенных фрагментов ДНК и РНК.
Высокая, но все еще недостаточная эффективность существующих схем лечения влечет за собой необходимость поиска альтернативных технологий, способных восстанавливать функцию миокарда, таких, например, как использование стволовых клеток. Перспективным представляется также разработка препаратов блокирующих процессы программируемой гибели клеток сердечной мышцы.
Высокий метаболизм клеток сердца делает их чрезвычайно уязвимыми при ишемии, в условиях дефицита энергетических и пластических субстратов. В моделях на животных было показано, что ишемия приводит к уменьшению содержания в сердечной мышце нуклеиновых кислот. Аналогичный дисбаланс нуклеотидов при ишемии отмечается в субэндокардиальных слоях человеческого сердца. Подтверждением тому является исследование Ludith L. соавт., которые изучили содержание нуклеотидов в биопсийных материалах, полученных во время операций на открытом сердце у пациентов, страдающих ишемической болезнью сердца. Исследователи обнаружили, что содержание нуклеиновых кислот в глубоких слоях миокарда было снижено на 20%. Они предположили, что восстановление баланса нуклеотидов с использованием препаратов ДНК и нуклеиновых кислот может оказать защитное влияние на клетки сердца и препятствовать развитию апоптоза.
Эта гипотеза была подтверждена японскими исследователями Satoh К. и соавт. в 1993 году в эксперименте на собаках.
В опытах было показано значительное улучшение сократительной способности сердечной мышцы животных в условиях после внутривенного введения «коктейля» из нуклеиновых кислот. В экспериментах на животных препараты на основе натриевой соли ДНК показали эффективность при аритмиях, возникающих при восстановлении кровотока после ишемии.
Проведенные клинические испытания с препаратами на основе натриевой соли ДНК показали, что препараты способны улучшать клиническое состояние, уменьшать частоту, продолжительность и интенсивность приступов стенокардии, улучшать сократительную способность сердца, увеличивать переносимость физических нагрузок у пациентов, страдающих ишемической болезнью сердца. Несмотря на то, что в эти исследования было включено относительно небольшое количество пациентов, а многие из выявленных различий не имеют статической значимости, полученные данные позволяют предполагать, что исследование препаратов ДНК является перспективным направлением в кардиологии и требует проведения более масштабных клинических исследований.
Старение вызывается вырождением клеток. Наш организм построен из миллионов клеток, каждая из которых живет около двух лет или меньше. Но, прежде чем погибнуть, клетка воспроизводит себя. Почему мы не выглядим так же, как десять лет назад? Причина в том, что при каждом успешном воспроизводстве клетка претерпевает определенное изменение, в сущности, вырождение. Так что, по мере того, как наши клетки меняются или вырождаются, мы стареем.
Доктор Фрэнк рекомендует диету, согласно которой морепродукты едятся семь раз в неделю, с двумя стаканами снятого молока, стаканом фруктового или овощного сока и четырьмя стаканами воды ежедневно. Уже после 2 месяцев дополнительного приема ДНК-РНК и диеты доктор Фрэнк обнаружил, что у пациентов появилось больше энергии, как свидетельство, значительно сократилось количество сладок и морщин, и кожа выглядела более здоровой, розовой и помолодевшей.
Однако важно заметить, что СОД быстро теряет активность при отсутствии таких важных минеральных веществ как цинк, медь и марганец. Дегидроэпиандростерон (ДГЭА), натуральный гормон, вырабатываемый надпочечниками, сегодня тоже стал применяться против старения, так как одним из его свойств является способность «снижать возбуждение» в процессах в организме и, таким образом, замедлять образование способствующих старению жиров, гормонов и кислот.
Область применения нуклеотидов в гастроэнтерологии охватывает широкий спектр заболеваний, которые объединены общими патогенетическими звеньями: воспаление, когда имеется дефицит потребления клеток иммунной системы; дефекты эпителия, когда требуется репарация поврежденных тканей; гормональный дисбаланс и интоксикационный синдром вследствие различных поражений печени, когда требуется пластический материал для восстановления клеток печени и их синтетической функции.
Адекватное питание у тяжелых больных призвано решать следующие задачи:
• Поддержание структуры и функции клеток кишечника (энтероцитов)
• Восстановление барьерной и иммунной функции кишки
• Снижение возможности проникновения патогенных бактерий и токсинов в кровь.
Использование питания, обогащенного нуклеотидами, показано при следующих состояниях:
• Ожоги, травмы, большие операции
• Трансплантация костного мозга
• Инфекции/сепсис
• Воспалительные заболевания кишки
• Некротизирующий энтероколит
• Синдром короткой кишки
• Повреждение слизистой оболочки при критическом состоянии, а также при лучевой и химиотерапии
• Дисфункция иммунной системы, связанная с критическим состоянием, трансплантацией костного мозга.
Так, при использовании иммунопитания у больных с указанными заболеваниями наблюдалось:
• Значительное (в 2 раза) снижение частоты инфекционных осложнений
• Снижение продолжительности госпитализации, в среднем, на 3,86 дня
• Снижение летальности на 30%.
Таким образом, к настоящему времени накоплено большое количество данных, свидетельствующих об эффективности использования фрагментированной ДНК в качестве диетического компонента при самой разнообразной патологии. Имеются доказательства пользы от использования фрагментированной ДНК в качестве стимулятора гемопоэза и иммуномодулятора у пациентов с лучевой болезнью, а также у ослабленных больных. Использование фрагментированной ДНК способствует восстановлению барьерной и иммунной функции кишечника у пациентов, находящихся в критическом состоянии, что позволяет значительно снизить смертность у крайне тяжелых пациентов. Перспективным направлением является использование фрагментированной ДНК в гастроэнтерологии и кардиологии, что диктует необходимость проведения более крупных исследований в этих областях. Мечта о сохранении молодости не оставляла человечество с давних времен. Возможно, что нуклеиновые кислоты окажутся одним из таких «чудо-средств», способных замедлить процессы старения человеческого организма.
Нуклеиновые странники
Что представляют собой свободные, т. е. внеклеточные нуклеиновые кислоты? Для обитающих в почве и в морских отложениях бактерий это – источник азота и фосфора, а для инфицированной патогеном клетки – сигнал «опасность!»
Но, как было выяснено в последние десятилетия, функции и роль нуклеиновых «странников» на этом далеко не исчерпываются. И с каждым годом мы узнаем все больше об этих молекулах, которые во многом определяют функционирование биологических систем, от клетки до популяции
Нуклеиновые кислоты, ДНК и РНК, несут информацию о строении, развитии и размножении всех клеток живого организма, поэтому неудивительно, что клетки тщательно оберегают эти структуры от действия потенциально опасных внешних факторов. Так, у бактерий геномные ДНК компактно упакованы с помощью специальных белков и защищены от окружающей среды прочной клеточной стенкой; в клетках высших организмов ДНК хранится в клеточном ядре в составе сложных структур – хромосом.
Долгие годы считалось, что за пределы клетки нуклеиновые кислоты выходят лишь в случае смерти последней. Конечно, было известно, что у бактерий в ходе размножения ДНК переносится из одной клетки к другой, но и в этом случае она перемещается не свободно, а внутри специального белкового комплекса. Даже ДНК и РНК «условно живых» вирусов, представляющих собой автономные генетические программы, перемещаются во внеклеточном пространстве, упакованные в специальные транспортные структуры.
Однако исследования последних лет показали, что «свободные», т. е. внеклеточные нуклеиновые кислоты встречаются в больших количествах не только в таких природных системах, как почва, но и непосредственно в живых организмах. Какую же роль играют и какие специфические функции выполняют эти нуклеиновые кислоты, находящиеся «в свободном плавании»?
Генетическая «интервенция»?
Нуклеиновые кислоты – довольно стабильные полимерные молекулы, поэтому они могут сохраняться в естественной среде длительное время после гибели организма. Так, в костной ткани относительно длинные фрагменты ДНК остаются практически неизменными в течение десятков тысяч лет (!), что делает возможным проведение палеогенетических исследований, таких как расшифровка генома мамонта или неандертальца.
В почве, где ДНК растительного и бактериального происхождения может сохраняться месяцами и даже годами, ее концентрация достигает 2 мкг/г (Niemeyer, Gessler, 2002). Интерес к такой ДНК сегодня подогревается проблемой генетически модифицированных организмов, ведь после гибели таких растений в окружающую среду попадает рекомбинантная ДНК. Имелись опасения, что подобные «модифицированные» гены будут ассимилироваться почвенными бактериями и переноситься в другие организмы путем так называемого горизонтального переноса генов – своего рода «параллельной» эволюции, характерной для микроорганизмов. Однако прямых доказательств переноса генетической информации от генно-модифицированных растений к бактериям на сегодня нет, и вообще вероятность такого процесса в природных условиях крайне мала.
Но иногда горизонтальный перенос ДНК становится реальным источником проблем. Речь идет о бактериальных пленках (так называемых биофильмах), которые образуются на твердых поверхностях, в том числе на поверхности эндопротезов, зубов (вызывая кариес), а также на стенках бронхов при бронхитах и пневмониях.
Такие пленки состоят из размножающихся бактерий, связанных между собой и с поверхностью полимерным гидратированным веществом из смеси полисахаридов, белков, ДНК и РНК (Nishimura et al., 2003). Причем нуклеиновые кислоты появляются в межклеточном веществе биофильмов не только за счет гибели бактерий, но и в результате специального секреторного процесса, который стимулируется совместным «культивированием» различных видов бактерий (Hamilton et al., 2005). Эти ДНК могут достаточно легко переносится от одной бактерии к другой, поэтому биофильмы – настоящая головная боль терапевтов: входящие в состав пленок болезнетворные бактерии не только скрываются там от действия опасных факторов, но и успешно эволюционируют за счет генетического обмена в устойчивые (в том числе к антибиотикам) штаммы.
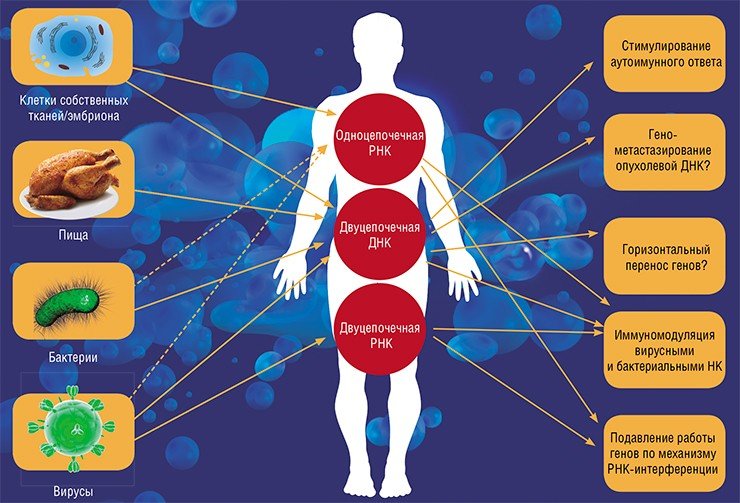
Что касается потребления ГМО человеком, то в наш организм ежедневно с пищей попадает значительное количество чужеродных ДНК различного происхождения. Известно, что у людей, потребляющих в пищу генно-модифицированную сою – самый распространенный трансгенный продукт, специфичный трансген успешно переваривается в желудочно-кишечном тракте (Netherwood et al., 2004).
Однако со «съеденными генами» так проиходит не всегда. Как показали исследования на лабораторных животных, фрагменты ДНК из переваренной пищи спустя двое суток после кормления могут попадать в кровь и задерживаться в клетках печени и селезенки (Hohlweg et al., 2001). Однако в клетках животных не происходит считывания соответствующей РНК и синтеза белков, кодируемых растительными генами. Это справедливо и в отношении трансгенной ДНК, что подтверждается результатами эксперимента по кормлению лабораторных мышей ГМО-продуктами в течение восьми поколений (там же).
Таким образом, непосредственной опасности, связанной с употреблением трансгенных продуктов, на сегодняшний день не выявлено. Безусловно, в процессе эволюции должны были появиться механизмы, защищающие клетки от вторжения чужеродной ДНК, столь широко распространенной в окружающей среде.
Тем не менее отношения между нами и тем, что мы едим, не так просты. Судя по результатам последних исследований, в организмах животных РНК растительного происхождения могут сохранять свою биологическую активность! Так, китайским исследователям удалось обнаружить в клетках желудочно-кишечного тракта и затем в крови лабораторной мыши и человека микроРНК из пищи (риса и растений семейства крестоцветных), причем в значительных концентрациях. Эта чужеродная микроРНК оказалась способна подавлять экспрессию одного из генов, кодирующего белок рецептора липопротеина низкой плотности (Zhang et al., 2012).
На пути агрессоров
Живые клетки не только заботливо охраняют свои генетические программы, но и активно борются с чужими. При заражении вирусами или бактериями первая реакция клетки-хозяина состоит в распознавании и уничтожении чужих нуклеиновых кислот; либо зараженная клетка включает механизмы самоликвидации, чтобы не допустить размножения инфекционных агентов в целом организме.
Система врожденного неспецифического иммунитета, которая реагирует на генетически чужеродные молекулярные субстанции, сформировалась еще на ранних этапах эволюции многоклеточных организмов. Она способна распознать «чужака» по наличию в его РНК или ДНК определенных консервативных последовательностей нуклеотидов. В ДНК бактерий такой узнаваемой последовательностью являются участки, содержащие шестизвенные кластеры цитозин–гуанин–динуклеотидов (CpG). В отличие от млекопитающих у бактерий такие последовательности не метилированы.
Когда фагоцитирующие иммунные клетки (макрофаги, нейтрофилы, эозинофилы и т. д.) разрушают оболочку бактерии, неметилированные CpG становятся «видны» для толл-подобных (TLR) рецепторов фагоцитов, способных распознавать чужеродные нуклеиновые кислоты. Активация внутриклеточного рецептора TLR9 запускает цепочку молекулярных событий, определяющих дальнейшее развитие иммунной реакции. Происходит активация В- и Т-лимфоцитов, которые начинают усиленно вырабатывать специальные вещества – цитокины, координирующие развитие воспалительного процесса; усиливается продукция иммуноглобулинов (Hacker et al., 2002). И, наконец, на последнем этапе происходит выработка антител, специфичных к патогену.
При вирусной инфекции сигналом опасности для иммунной системы служит наличие характерной для вируса двуцепочечной РНК («обычная» для клетки РНК, в отличие от ДНК, состоит из одной цепочки нуклеотидов). Такая РНК либо присутствует в составе вирусных частиц, либо появляется в зараженной клетке в процессе размножения вируса.
Узнавание двуцепочечной РНК как сигнала опасности опосредуется поверхностным фагоцитарным рецептором TRL3, который и запускает сигнальный каскад, активирующий усиленный синтез противоспалительных белков-интерферонов (Yu et al., 2011). Последние, специфически связываясь с клеточными рецепторами, активируют работу определенных генов, ответственных за противовирусный ответ. Например, ген, кодирующий фермент РНК-зависимую протеинкиназу (PKR), который индуцирует апоптоз (клеточное самоубийство), либо белковый комплекс OAS/RNAseL, который угнетает процессы репликации и трансляции вирусной РНК и т. д.
В конечном итоге зараженная вирусом клетка обычно теряет способность к делению и синтезу белков, а зачастую и вовсе элиминируется из организма.
Другой типичной реакцией зараженной клетки, которая активируется проникновением вирусной двуцепочечной РНК, является РНК-интерференция – лавинообразный процесс, приводящий к расщеплению чужеродной РНК и выключению вирусных генов.
Своя рубашка ближе к телу
Все вышесказанное относилось к так называемым экзогенным нуклеиновым кислотам, чужеродным по отношению к организму. Однако достаточно давно было обнаружено присутствие в крови животных и человека, а также в тканях растений, эндогенных, т.е. собственных внеклеточных ДНК и РНК.
У высших растений внеклеточные РНК могут перемещаться между соседними клетками и транспортироваться до отдаленных органов и тканей через флоэму – проводящую сосудистую ткань, которая обеспечивает нисходящий транспорт органических веществ (продуктов фотосинтеза) из листьев к другим органам. Это было доказано в экспериментах по пересадке частей растений; был также обнаружен особый белок флоэмы, связывающий одноцепочечные РНК и способствующий их переносу как между соседними клетками, так и через фильтрующие структуры флоэмы.
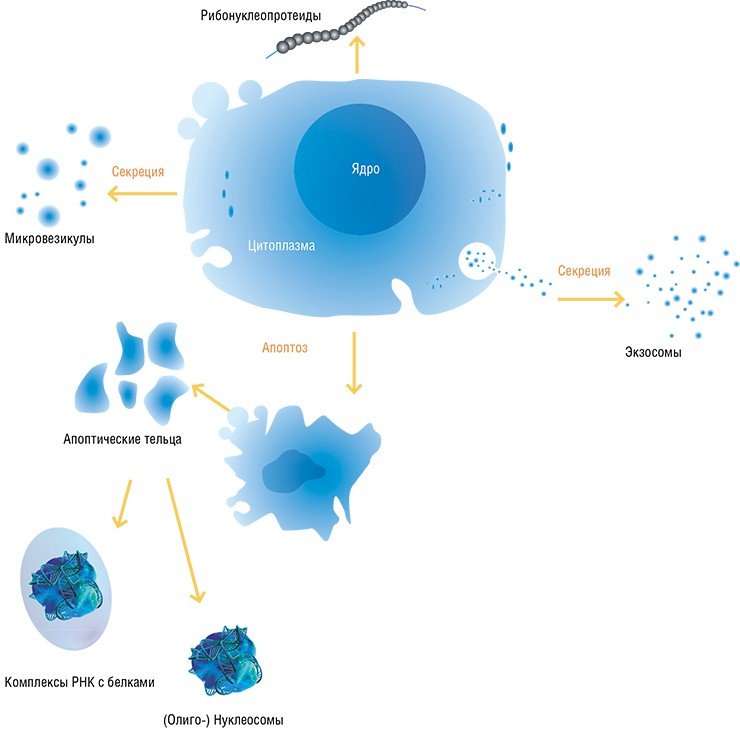
У млекопитающих внеклеточные ДНК представляют собой популяцию молекул размером от 180 до 3500 пар нуклеотидов. Один из источников их появления – клетки, разрушающиеся по механизму апоптоза или некроза (Jahr et al., 2001). Так погибают клетки опухолей, а также пострадавшие в результате травм, инфаркта миокарда, интенсивного воспалительного процесса и даже в результате интенсивной физической нагрузки.
Однако внеклеточные ДНК и РНК активно секретируются и вполне «живыми», функционирующими клетками. В том числе внеклеточная ДНК опухолевого происхождения появляется в крови на ранних этапах канцерогенеза, когда некроз и апоптоз в опухоли практически не наблюдаются. Известно, что при культивировании некоторые клетки человека (например, эндотелиоциты пупочной вены и периферические лимфоциты) секретируют ДНК в инкубационную среду (Morozkin et al., 2004). Кроме того, в процессе появления свободных нуклеиновых кислот участвуют фагоциты, которые поглощают продукты разрушения клеток, а затем повторно их секретируют уже в «переваренном» виде.
На концентрацию внеклеточных ДНК и РНК влияет работа специальных расщепляющих ферментов, которых в крови предостаточно, и ДНК спасает лишь то, что вне клеток она появляется в комплексах с белками (например, с гистонами в виде нуклеосом) либо заключенная в мембранные структуры (экзосомы, микрочастицы и апоптотические тельца) (Stroun, 2000).
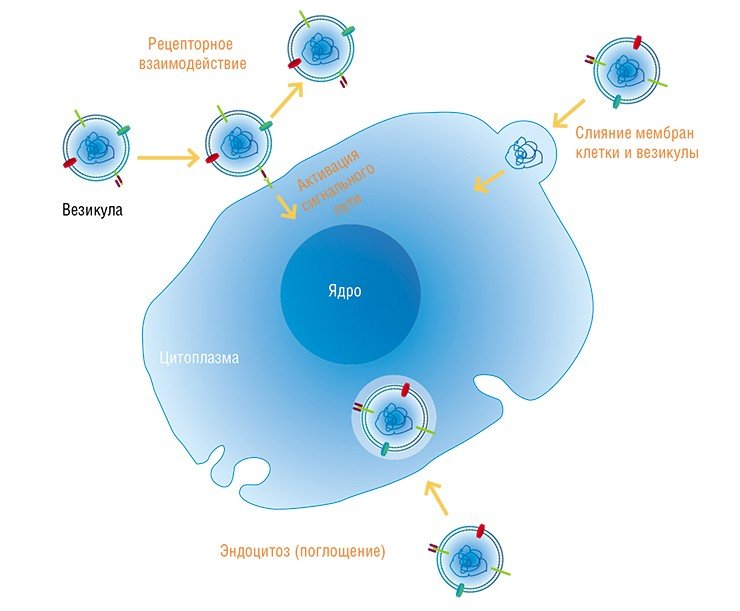
У некоторых примитивных животных, таких как паразитическая нематода C. elegans, интерферирующие РНК распространяются по всему организму за счет транспорта специальным белком sid-1 (Feinberg et al., 2003). У млекопитающих такие РНК переносятся в комплексах с белками, участвующими в РНК-интерференции, или с липопротеинами высокой плотности («хорошим холестерином») (Vickers et al., 2011). Попадая в кровь, содержащие нуклеиновые кислоты комплексы могут связываться с белками плазмы или клеток крови – эритроцитов и лейкоцитов.
Все эти структуры захватываются как близлежащими, так и сравнительно удаленными от секретирующей «родительницы» клетками. Механизмы проникновения нуклеиновых кислот в клетки до сих пор во многом остаются загадкой, так как фосфолипидные клеточные мембраны являются барьером для их пассивной диффузии внутрь клеток. Ключевую роль в этом процессе играет взаимодействие «транспортных средств» – везикул и белковых комплексов, с поверхностными белками самой клетки. (Хотя есть свидетельства, что в некоторых случаях возможно также узнавание и захват «голой» нуклеиновой кислоты).
На благо.
Внеклеточные нуклеиновые кислоты, синтезируемые в организме и участвующие в общей циркуляции (особенно это относится к РНК), играют важнейшую сигнальную роль в локальной и отдаленной регуляции развития органов и тканей, обеспечивая слаженную работу клеток в многоклеточных организмах.
Так, в экспериментах по выявлению факторов, регулирующих клеточную дифференцировку и тканевый морфогенез, были открыты РНК-белковые комплексы, названные ангиотропинами. РНК этих комплексов представляют собой высокомодифицированные короткие (длиной до 200 нуклеотидов) последовательности. Взаимодействие таких молекул с белками в присутствии ионов металлов (Cu, Ca, Na, K) приводит к образованию комплексов, которые выступают в роли противоспалительных факторов (цитокинов) и как регуляторы дифференцировки клеток, выстилающих капилляры, при формировании этих структур (Wissler, 2004).
В последние годы огромное внимание уделяется изучению микроРНК – коротких (19—24 нуклеотида) одноцепочечных или двуцепочечных («незрелая» форма) молекул, которые участвуют в подавлении экспрессии собственных генов клетки по механизму РНК-интерференции. Еще совсем недавно эту специфическую регуляцию синтеза белков было принято считать явлением локального, внутриклеточного масштаба. Однако в последние годы было показано, что активные интерферирующие микроРНК в значительных концентрациях присутствуют в общей циркуляции вопреки высокой активности внеклеточных ферментов, расщепляющих РНК.
Перенос микроРНК между клетками может способствовать формированию самых разных физиологических эффектов, от регуляции иммунного ответа до миграции клеток. У беременной женщины микроРНК, секретируемые тканями эмбриона (правда, это фактически чужеродная для организма РНК), могут участвовать в адаптации материнского организма к беременности (Mincheva-Nilsson et al., 2010), а микроРНК материнского молока, в свою очередь, – в развитии иммунной системы ребенка (Kosaka et al., 2010).
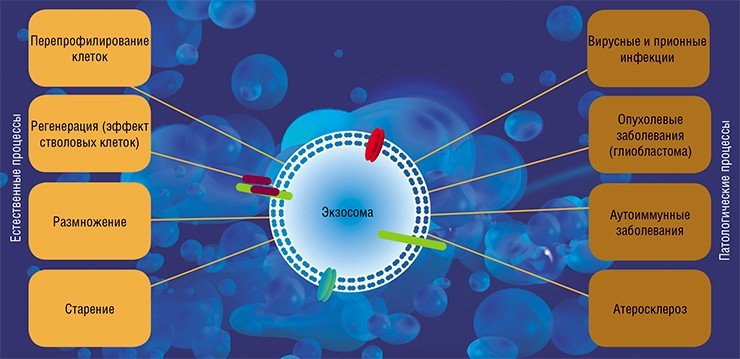
Транспортируемые в экзосомах матричные и микроРНК могут защищать клетки от апоптоза и стимулировать их деление. Как оказалось, именно этот факт объясняет благотворные эффекты инъекций стволовых клеток в поврежденные органы. Ранее считалось, что стволовые клетки дают в поврежденных органах начало новой ткани, а оказалось, что все дело в продуцируемых ими экзосомах, которые помогают выживать и размножаться собственным клеткам поврежденной ткани (Biancone et al., 2012).
Как показали эксперименты, «коктейль» из мРНК и/или микроРНК можно использовать для достижения и «обратного» эффекта: с их помощью можно получить индуцированные стволовые клетки из уже дифференцированных клеток (например, фибробластов) (Jayawardena et al., 2012).
. и во вред
Однако способ межклеточных взаимодействий путем обмена нуклеиновыми кислотами может быть использован и во вред организму. Так, клетки опухолей (например, глиобластом) активно секретируют экзосомы, содержащие микроРНК, которые влияют на клетки стенок кровеносных сосудов и способствуют успешному распространению метастазов (Skog et al., 2008). (Кстати сказать, аналогичным образом может действовать и экзогенная микроРНК: в геноме вируса Эпштейна-Барра закодированы микроРНК, которые, будучи секретируемыми в составе экзосом зараженной клеткой, проникают в окружающие клетки и нарушают экспрессию цитокина, ответственного за активацию клеточного иммунного ответа (Pegtel et al., 2010)).
И это далеко не единственный пример негативного воздействия внеклеточных нуклеиновых кислот. Так, в ряде случаев в развитии патологических процессов непосредственно участвует внеклеточная ДНК. Наиболее известная болезнь такого типа – системная красная волчанка. При этом аутоиммунном заболевании в организме появляются патогенные антитела против собственной ДНК (Rumore et al., 1990). Эти антитела образуют с внеклеточными ДНК комплексы, которые способствуют развитию воспалительных реакций. Считается, что толчком к развитию болезни могут быть нарушения механизмов, регулирующих уровень циркулирующих ДНК, поскольку у многих больных отмечено снижение активности фермента, разрушающего ДНК, и фагоцитов, ее утилизирующих (Napirei et al., 2006).
Поскольку клетки способны захватывать продукты клеточного распада, была выдвинута гипотеза о возможности ракового перерождения клеток вследствие переноса генов из опухолевых клеток, погибших в результате апоптоза. По такому механизму рак мог бы, как инфекционное заболевание, передаваться через кровь от клетки к клетке пораженного организма, формируя отдаленные и соседние метастазы.
В соответствии с этой гипотезой «генометастазов», рак распространяется в организме за счет циркуляции ДНК (или апоптотических телец), а не опухолевых клеток (Garca-Olmo et al., 2012). И хотя эта гипотеза пока не получила четкого экспериментального доказательства, полностью отвергать ее нет оснований.
Все имеющиеся на сегодня данные однозначно свидетельствуют об огромной биологической значимости внеклеточных нуклеиновых кислот. Согласно самым смелым представлениям они являются не просто сигнальными молекулами, а важным действующим звеном механизмов, работающих как на организменном, так и на популяционном и, в конечном итоге, эволюционном уровне.
Генометастазы, горизонтальный перенос генов, перепрограммирование соседних клеток, даже перенос внеклеточного «генома» в следующие поколения в обход неодарвинистских механизмов наследования – все эти на первый взгляд фантастические явления будут, безусловно, детально изучаться в ближайшее десятилетие наряду со ставшими уже традиционными исследованиями источников, причин и механизмов появления нуклеиновых кислот-«путешественников».
Черноловская Е. Л. РНК-интерференция: клин клином… // НАУКА из первых рук. 2008. № 1 (19). С. 54—59.
Rykova E. Y. et al. Cell-free and cell-bound circulating nucleic acid complexes: mechanisms of generation, concentration and content // Expert Opin Biol Ther. 2012 Suppl 1. P. 141—153.
Vlassov V. V., Pyshnyi D. V., Vorobjev P. E. Nucleic acids: structures, functions, and applications. In Handbook of nucleic acids purification, Ed. D. Liu, Boca Raton, CRC Press, 2009.