Почему органических соединений больше чем неорганических
Различия между органическими и неорганическими соединениями
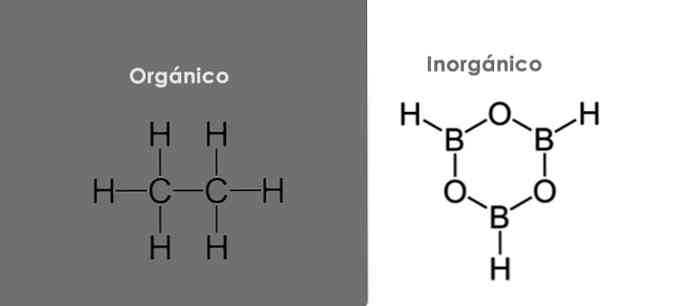
Основное различие между органическими и неорганическими соединениями это присутствие атома углерода.
Органические соединения содержат атом углерода и обычно также имеют атом водорода с образованием углеводородов. Со своей стороны, почти ни одно из неорганических соединений не содержит атомов углерода и / или водорода..
Основные различия между органическими и неорганическими соединениями
Хотя подавляющее большинство неорганических соединений не содержат углерода, есть некоторые исключения. Например, окись углерода и двуокись углерода содержат атомы углерода.
Однако этого количества недостаточно для образования прочных связей с кислородом, присутствующим в молекуле. Из-за этого ученые всегда считали эти соединения неорганическими. Поэтому, даже если соединение содержит уголь, оно не обязательно считается органическим.
Со своей стороны, неорганические соединения включают такие элементы, как соли, металлы и другие необходимые компоненты. Вещества, изготовленные из отдельных элементов, и любое соединение, которое не имеет атомов углерода, связанных с атомами водорода, также считаются неорганическими.
Несмотря на эти характеристики, химики-органики не достигли окончательного согласия между разницей между органическими и неорганическими соединениями. Будучи спорным вопросом, они называют присутствие углерода в молекуле наиболее приемлемым методом идентификации..
Органические соединения
В этих соединениях один или несколько атомов углерода присоединены к атомам других элементов. Наиболее распространенными элементами, к которым они присоединены, обычно являются водород, кислород и азот. Те немногие соединения, которые содержат углерод и не считаются органическими, представляют собой цианиды, карбонаты и карбиды..
Традиционно считается, что органические соединения имеют большое значение, поскольку вся известная жизнь основана на органических соединениях. Самые основные нефтехимические вещества рассматриваются в качестве основы органической химии.
Есть несколько соединений, которые считаются органическими, хотя они не имеют связи водорода и углерода. К ним относятся бензолексол, мезоксалевая кислота и четыреххлористый углерод.
Органические соединения можно классифицировать на природные и синтетические соединения..
Природные соединения
Они относятся к тем соединениям, которые вырабатываются растениями и животными. Многие из этих соединений извлекаются из природных источников, потому что было бы очень дорого производить их искусственно.
Наиболее распространенными являются сахара, некоторые алкалоиды и питательные вещества, такие как витамин B12. Как правило, все они представляют собой соединения, которые имеют большие или сложные молекулы и которые можно найти в разумных количествах в живых организмах..
Синтетические соединения
Соединения, которые получают реакцией других соединений, считаются синтетическими. Это могут быть соединения, встречающиеся в природе, или соединения, которые не встречаются в природе..
Большинство полимеров, таких как пластмассы и резина, являются полусинтетическими органическими соединениями..
биотехнология
Многие органические соединения, такие как этанол и инсулин, производятся в промышленности с использованием организмов из бактерий и дрожжей. Обычно ДНК организма изменяется, чтобы выразить соединения, которые обычно не вырабатываются в организме..
Многие соединения, полученные биотехнологией, ранее не существовали в природе..
Неорганические соединения
Соединение может считаться неорганическим, если оно не содержит в своем составе связи между углеродом и водородом, называемой в химическом цикле C-H. Кроме того, неорганические соединения, как правило, представляют собой минералы или соединения, основанные на геологии, которые не содержат углерод, связанный с молекулами водорода. Вот почему многие из неорганических соединений являются металлами.
Можно сказать, что соединение считается неорганическим, если оно соответствует одному из следующих критериев:
В настоящее время неорганические соединения также могут быть определены как любое соединение, которое не имеет органической природы..
По этой причине некоторые простые соединения, содержащие углерод, называются неорганическими. Некоторые из этих соединений включают монооксид углерода, диоксид углерода, бикарбонат натрия, карбиды, карбонаты и цианиды..
Многие из этих соединений являются нормальными частями многих в основном органических систем, в том числе организмов. Это означает, что химическое вещество может быть описано как неорганическое, но это не означает, что оно не присутствует в живых организмах..
Минералы в основном оксиды и сульфаты, которые являются строго неорганическими, хотя они имеют биологическое происхождение. На самом деле, большая часть планеты Земля неорганическая.
Хотя компоненты слоев Земли хорошо изучены, процесс минерализации и состав глубокого слоя остаются активными областями в исследованиях..
Правда заключается в том, что большинство соединений во вселенной неорганического характера. По этой причине неорганические соединения имеют большое применение и много практического применения в повседневной жизни. Поскольку многие из соединений в мире неорганические, эти соединения могут иметь много различных форм и могут иметь очень разные характеристики.
Например, поскольку многие металлы, они могут передавать электричество. Они также имеют тенденцию иметь высокие точки кипения, а также очень яркие и яркие цвета. Обычно они очень хорошо растворяются в воде, и многие из них обладают способностью образовывать кристаллы..
9 различий между органическими и неорганическими соединениями
но, Какие различия существуют не между типами химии, а непосредственно между типами соединений, которые они изучают? В этой статье мы анализируем основные различия между органическими и неорганическими соединениями.
Химические соединения
Прежде чем увидеть, в чем различия между ними, мы кратко определим каждое из понятий.
Во-первых, под химическим соединением мы понимаем весь этот материал или продукт, возникающий в результате взаимодействия и комбинации двух или более элементов. Существует много различных типов химических соединений, которые могут быть классифицированы в соответствии с различными критериями, такими как элементы, которые его конфигурируют, или способ их объединения. Среди них одно из самых основных разделений происходит между органическими и неорганическими соединениями.
Что касается неорганических соединений, это те, которые не являются частью живых организмов Хотя в них можно найти любой элемент таблицы Менделеева (в том числе в некоторых случаях углерод). В обоих случаях они представляют собой соединения, которые присутствуют в природе или синтезируются из нее в лаборатории (особенно неорганические).
Различия между органическими и неорганическими соединениями
Органическое вещество и неорганическое вещество имеют большое сходство, но они также имеют отличительные элементы, которые позволяют их различать. Ниже приведены некоторые из основных отличий.
1. Элементы, которые обычно настраивают каждый тип соединения
Одним из различий между органическими и неорганическими соединениями, более заметными и в то же время более простыми для понимания, является тип элементов, которые являются их частью.
В случае органических соединений они основаны главным образом на углероде и его сочетании с другими элементами. Они обычно образуются из углерода и водорода, кислорода, азота, серы и / или фосфора.
С другой стороны, неорганические соединения могут быть образованы любым элементом периодической таблицы, хотя они не будут основаны на углероде (хотя в некоторых случаях они могут содержать углерод, например, окись углерода).
2. Тип главной ссылки
Как правило, считается, что все или почти все органические соединения образуются путем объединения атомов через ковалентные связи. В неорганических соединениях, однако, преобладают ионные или металлические связи, хотя могут также появляться другие типы связей.
3. Стабильность
Другое различие между органическими и неорганическими соединениями обнаруживается в стабильности соединений. Хотя неорганические соединения имеют тенденцию быть стабильными и не претерпевать серьезных модификаций, если в игру не вступают более или менее мощные химические реакции, органические соединения легко дестабилизируются и разлагаются.
4. Сложность
Хотя неорганические соединения могут образовывать сложные структуры, они обычно имеют тенденцию поддерживать простую организацию. Однако органические соединения имеют тенденцию образовывать длинные цепи различной сложности.
5. Теплостойкость
Другое различие между органическими и неорганическими соединениями заключается в количестве тепла, необходимого для изменения, такого как плавление. Температура на органические соединения легко воздействует, поэтому для их плавления требуются относительно низкие температуры. Однако неорганические соединения, как правило, требуют очень высокого уровня нагрева, чтобы войти в процесс плавления (например, вода не кипит до ста градусов Цельсия).
6. Растворимость
Растворение органического соединения обычно очень сложно, если не доступен конкретный растворитель (такой как спирт) из-за его ковалентных связей. Однако большинство неорганических соединений, поскольку в них преобладают связи ионного типа, легко растворимы.
7. Электропроводность
Как правило, органические соединения, как правило, не являются электропроводящими и изолирующими, в то время как неорганические компоненты (особенно металлы) делают это с большой легкостью.
8. Изомер
Изомерия относится к способности соединений появляться с различными химическими структурами, несмотря на то, что они имеют одинаковый состав (например, другой порядок в цепи, которая образует соединение, приведет к соединениям с различными характеристиками). Хотя это может происходить как в органических, так и в неорганических соединениях, оно гораздо более распространено в первом из-за его тенденции создавать цепочки связанных атомов.
9. Скорость реакции
Химические реакции в неорганических соединениях имеют тенденцию быть быстрыми и не требуют вмешательства других элементов, кроме реагентов. Напротив, химические реакции неорганических соединений имеют переменную скорость и могут требовать присутствия внешних элементов для инициирования или продолжения реакции, например, в форме энергии.
12. Органические и неорганические вещества (December 2021).
9 различий между органическими и неорганическими соединениями
но, Какие различия существуют не между типами химии, а непосредственно между типами соединений, которые они изучают? В этой статье мы анализируем основные различия между органическими и неорганическими соединениями.
Химические соединения
Прежде чем увидеть, в чем различия между ними, мы кратко определим каждое из понятий.
Во-первых, под химическим соединением мы понимаем весь этот материал или продукт, возникающий в результате взаимодействия и комбинации двух или более элементов. Существует много различных типов химических соединений, которые могут быть классифицированы в соответствии с различными критериями, такими как элементы, которые его конфигурируют, или способ их объединения. Среди них одно из самых основных разделений происходит между органическими и неорганическими соединениями.
Что касается неорганических соединений, это те, которые не являются частью живых организмов Хотя в них можно найти любой элемент таблицы Менделеева (в том числе в некоторых случаях углерод). В обоих случаях они представляют собой соединения, которые присутствуют в природе или синтезируются из нее в лаборатории (особенно неорганические).
Различия между органическими и неорганическими соединениями
Органическое вещество и неорганическое вещество имеют большое сходство, но они также имеют отличительные элементы, которые позволяют их различать. Ниже приведены некоторые из основных отличий.
1. Элементы, которые обычно настраивают каждый тип соединения
Одним из различий между органическими и неорганическими соединениями, более заметными и в то же время более простыми для понимания, является тип элементов, которые являются их частью.
В случае органических соединений они основаны главным образом на углероде и его сочетании с другими элементами. Они обычно образуются из углерода и водорода, кислорода, азота, серы и / или фосфора.
С другой стороны, неорганические соединения могут быть образованы любым элементом периодической таблицы, хотя они не будут основаны на углероде (хотя в некоторых случаях они могут содержать углерод, например, окись углерода).
2. Тип главной ссылки
Как правило, считается, что все или почти все органические соединения образуются путем объединения атомов через ковалентные связи. В неорганических соединениях, однако, преобладают ионные или металлические связи, хотя могут также появляться другие типы связей.
3. Стабильность
Другое различие между органическими и неорганическими соединениями обнаруживается в стабильности соединений. Хотя неорганические соединения имеют тенденцию быть стабильными и не претерпевать серьезных модификаций, если в игру не вступают более или менее мощные химические реакции, органические соединения легко дестабилизируются и разлагаются.
4. Сложность
Хотя неорганические соединения могут образовывать сложные структуры, они обычно имеют тенденцию поддерживать простую организацию. Однако органические соединения имеют тенденцию образовывать длинные цепи различной сложности.
5. Теплостойкость
Другое различие между органическими и неорганическими соединениями заключается в количестве тепла, необходимого для изменения, такого как плавление. Температура на органические соединения легко воздействует, поэтому для их плавления требуются относительно низкие температуры. Однако неорганические соединения, как правило, требуют очень высокого уровня нагрева, чтобы войти в процесс плавления (например, вода не кипит до ста градусов Цельсия).
6. Растворимость
Растворение органического соединения обычно очень сложно, если не доступен конкретный растворитель (такой как спирт) из-за его ковалентных связей. Однако большинство неорганических соединений, поскольку в них преобладают связи ионного типа, легко растворимы.
7. Электропроводность
Как правило, органические соединения, как правило, не являются электропроводящими и изолирующими, в то время как неорганические компоненты (особенно металлы) делают это с большой легкостью.
8. Изомер
Изомерия относится к способности соединений появляться с различными химическими структурами, несмотря на то, что они имеют одинаковый состав (например, другой порядок в цепи, которая образует соединение, приведет к соединениям с различными характеристиками). Хотя это может происходить как в органических, так и в неорганических соединениях, оно гораздо более распространено в первом из-за его тенденции создавать цепочки связанных атомов.
9. Скорость реакции
Химические реакции в неорганических соединениях имеют тенденцию быть быстрыми и не требуют вмешательства других элементов, кроме реагентов. Напротив, химические реакции неорганических соединений имеют переменную скорость и могут требовать присутствия внешних элементов для инициирования или продолжения реакции, например, в форме энергии.
12. Органические и неорганические вещества (December 2021).
Неорганические и органические вещества клетки
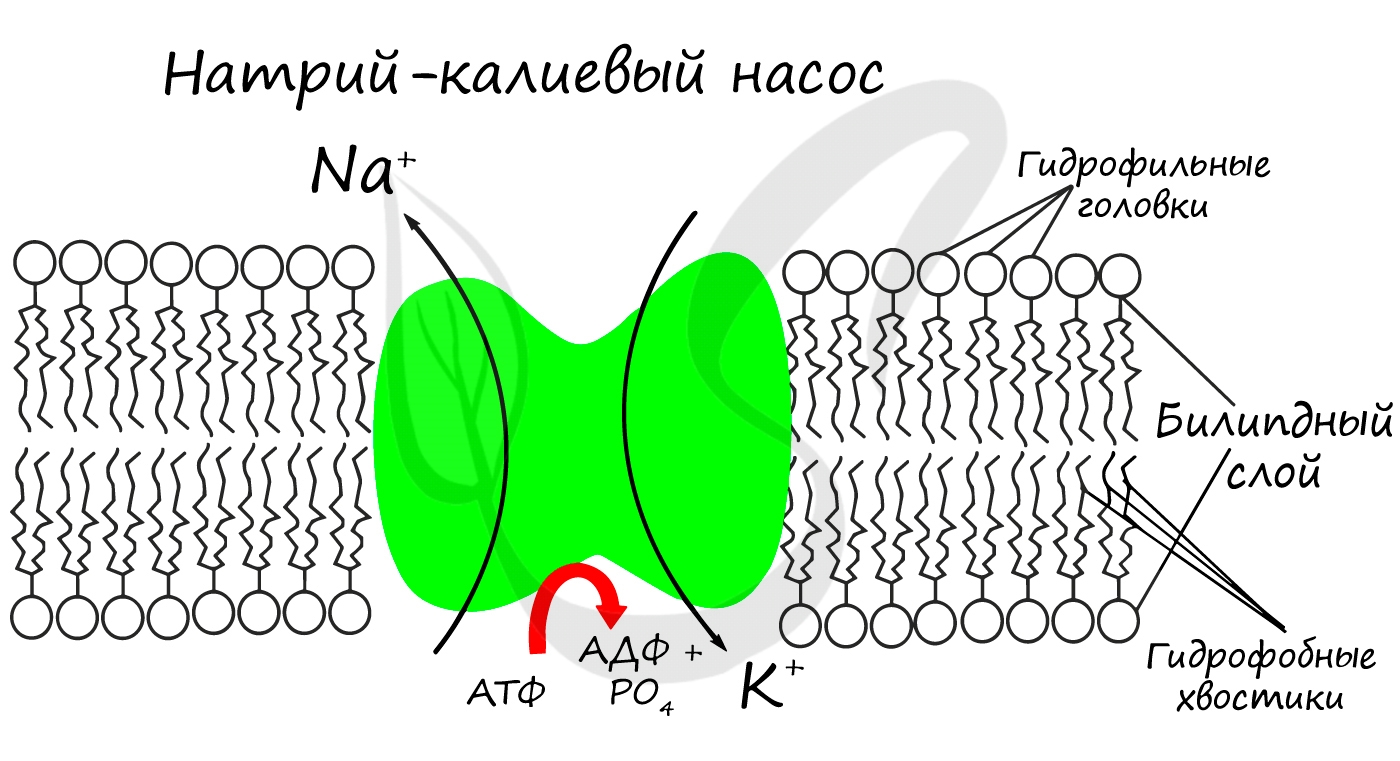
Большинство реакций, которые протекают в клетке, идут в растворе (водной среде). Полярность молекулы воды позволяет ей быть отличным растворителем для других гидрофильных (полярных) веществ.
Вода может поглощать теплоту при минимальном изменении температуры. Это настоящее «спасение» для клеток: чуть только температура меняется, вода начинает поглощать избыток тепла, защищая клетку от перегревания. Выделяясь на поверхность кожи с потом, вода испаряется, поверхность кожи при этом охлаждается.
Питательные вещества, газы перемещаются по организму с током крови. Вода составляет 90-92% плазмы крови, является ее основным компонентом. С помощью воды происходит не только доставка веществ к клеткам, но и удаление из организма побочных продуктов обмена веществ.
Если же клетка окажется в гипотоническом растворе, то вода извне устремится внутрь клетки (опять-таки в сторону большей концентрации солей), приводя при этом к разбуханию (и возможному разрыву) клетки.
Элементы
Процентное содержание элемента не коррелирует с его важностью и биологической значимостью. Так, к примеру, микроэлемент I играет важную роль в синтезе гормонов щитовидной железы: тироксина, трийодтиронина. За нормальные рост и развитие организмов отвечают Zn, Mn, Cu.
Благоприятно влияют на сперматозоиды Zn, Ca, Mg, защищая их от оксидативного стресса (окисления). Невозможным становится нормальное образование эритроцитов без должного уровня Fe и Cu.
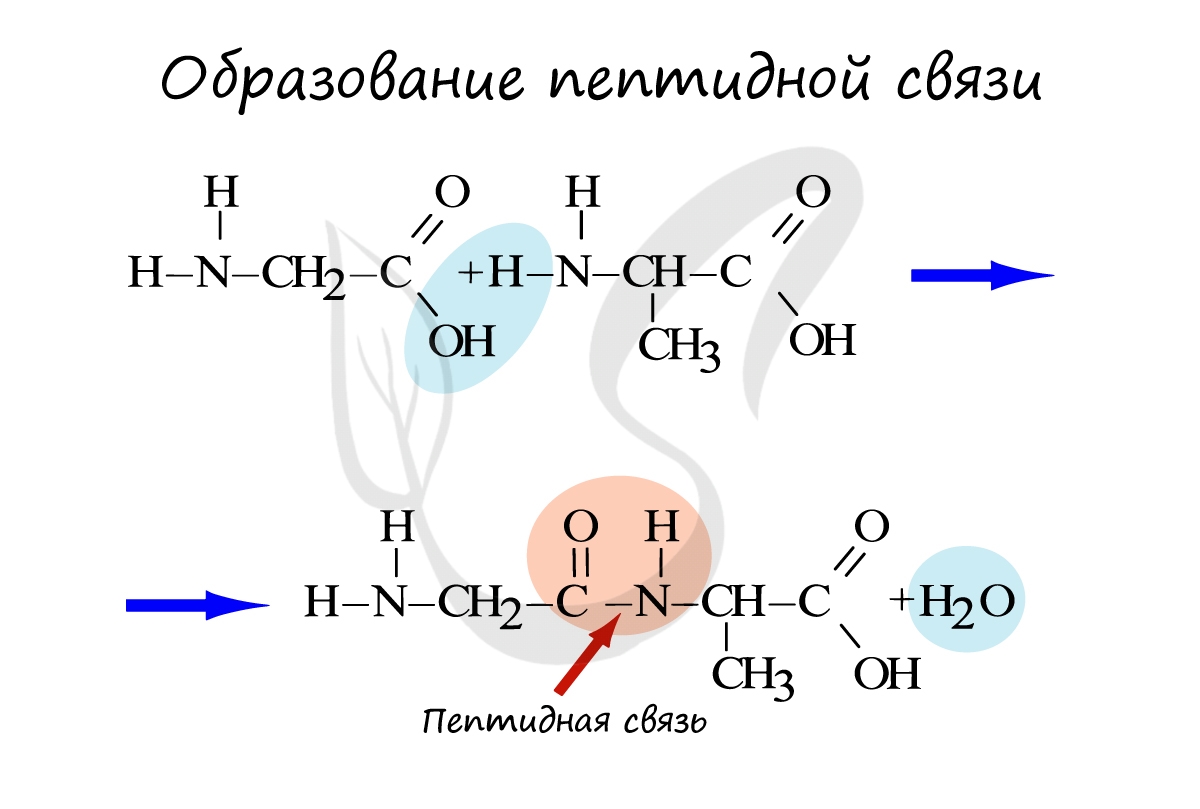
Мы переходим к органическим компонентам клетки, к которым относятся: жиры, углеводы, белки и нуклеиновые кислоты.
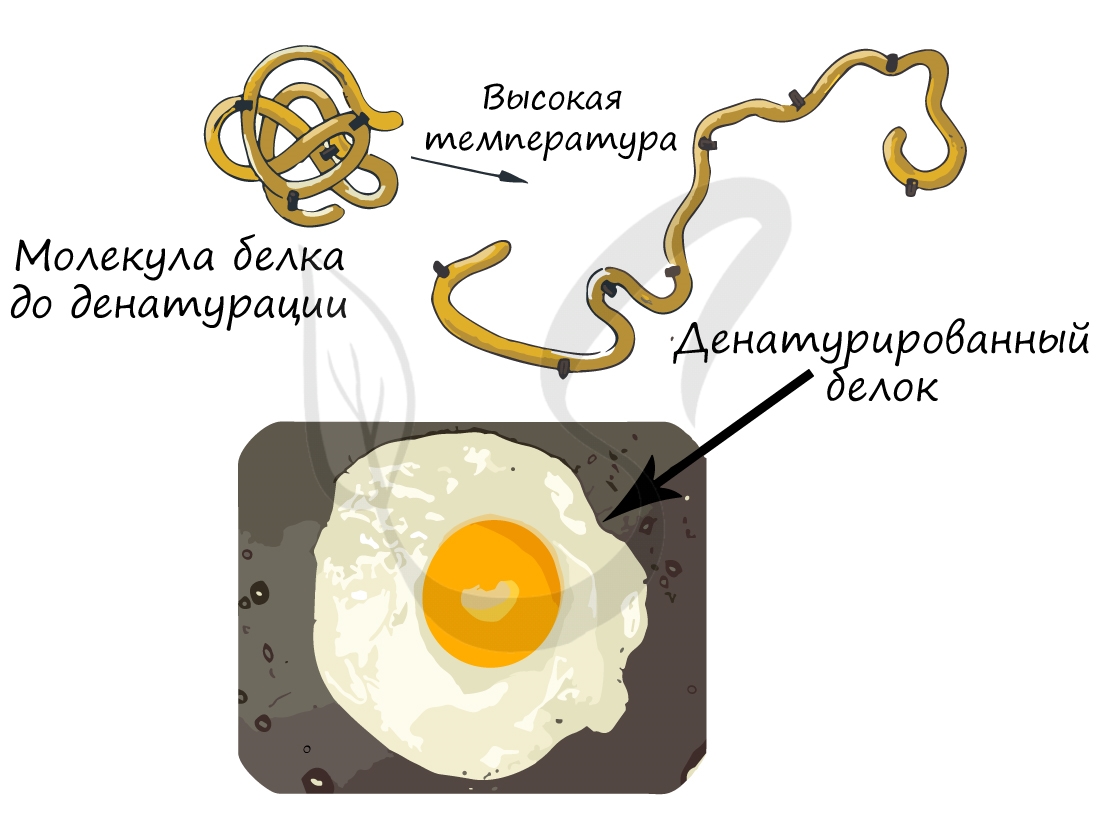
При резком изменении оптимальных для белка условий он подвергается денатурации: при этом происходит переход от высших структур организации к низшим, или «раскручивание белка». Важно заметить, что аминокислотная последовательность (первичная структура белка) при этом не меняется, однако свойства белка меняются кардинально (теряется его гидрофильность).
Некоторые гормоны, регулирующие обменные процессы в организме, имеют белковое происхождение: инсулин, глюкагон, адренокортикотропный гормон (АКТГ).
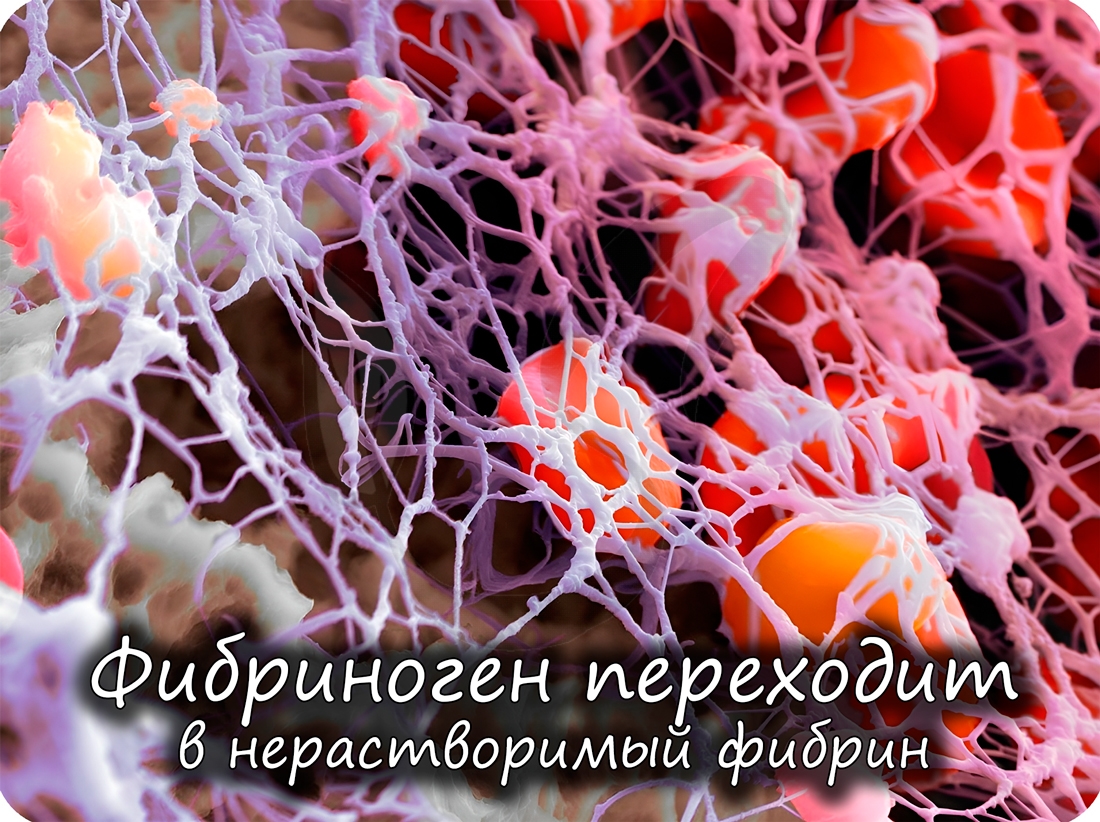
Помимо антител, защитную функцию выполняют также белки свертывающей системы крови (тромбин и фибриноген): они предохраняют организм от кровопотери.
При недостаточном питании в организме начинают окисляться молекулы белков. При расщеплении 1 г белков выделяется 17,6 кДж энергии.
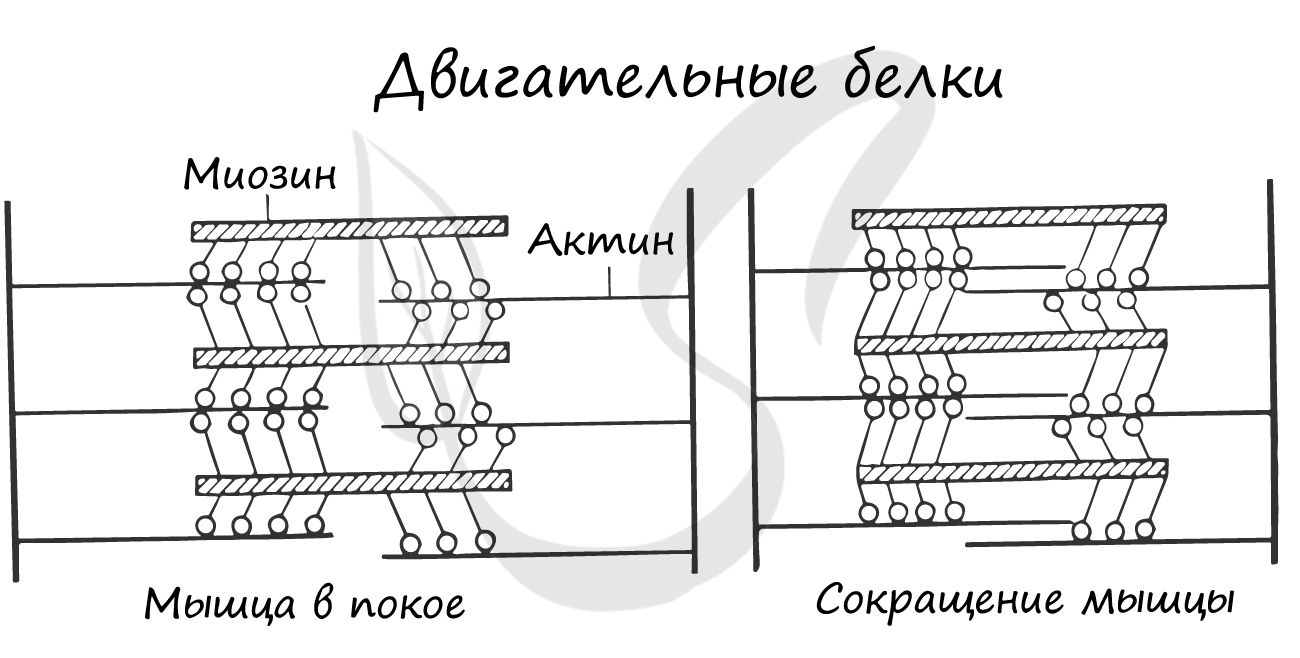
Двигательные белки, актин и миозин, на уровне саркомера обеспечивают сокращение мышц. При возбуждении мышечной ткани тонкие нити актина начинают тереться о толстые нити миозина, приводя к сокращению.
На поверхности мембраны белки образуют многочисленные рецепторы, которые, соединяясь с гормонами, приводят к изменению обмена веществ в клетке. Таким образом, гормоны реализуют воздействие на клетки органов-мишеней.
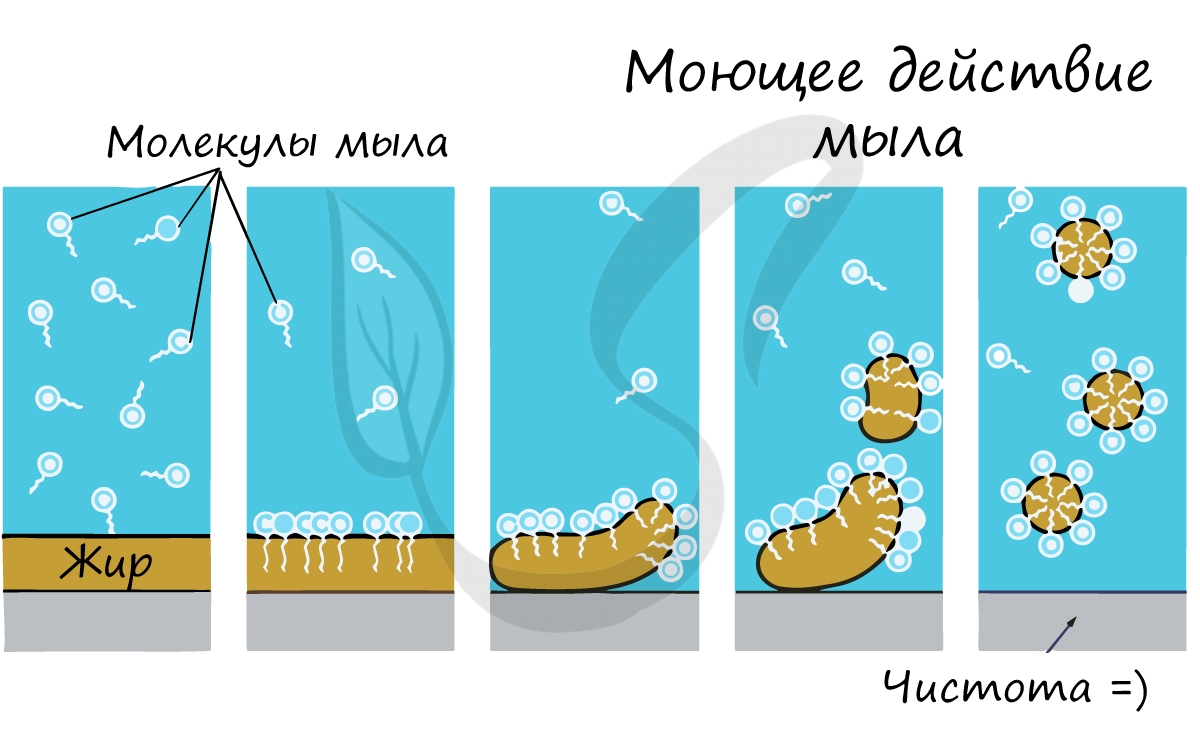
С химической точки зрения жиры являются сложными эфирами, образованными трехатомным спиртом глицерином и высшими карбоновыми кислотами (жирными кислотами). Среди их свойств надо выделить то, что они практически нерастворимы в воде. Вспомните, как тяжело смыть жир с рук водой.
Почему именно мыло смывает жир с рук? Дело в том, что молекула мыла повторяет свойства жира: одна часть ее гидрофобна, а другая гидрофильна. Мыло соединяется с молекулой жира гидрофобной частью, и вместе они легко смываются водой.
Жиры имеют способность накапливаться в клетках, расположенных в подкожно-жировой клетчатке, внутренних органах. Эти запасы являются резервом организма на случай голодания или при недостаточном питании.
В жирах также запасается вода: в 100 г жира содержится 107 мл воды. Многим пустынным животным (верблюдам) жировые запасы помогают длительное время обходиться без воды.
Жиры входят в состав биологических мембран клеток человека вместе с белками. Из фосфолипидов построены мембраны всех клеток органов и тканей!
Жиры обладают плохой теплопроводностью. Располагаясь в подкожно-жировой клетчатке, они образуют термоизолирующий слой. Особенно хорошо он развит у ластоногих (моржи и тюлени), китов, защищает их от переохлаждения.
Углеводы
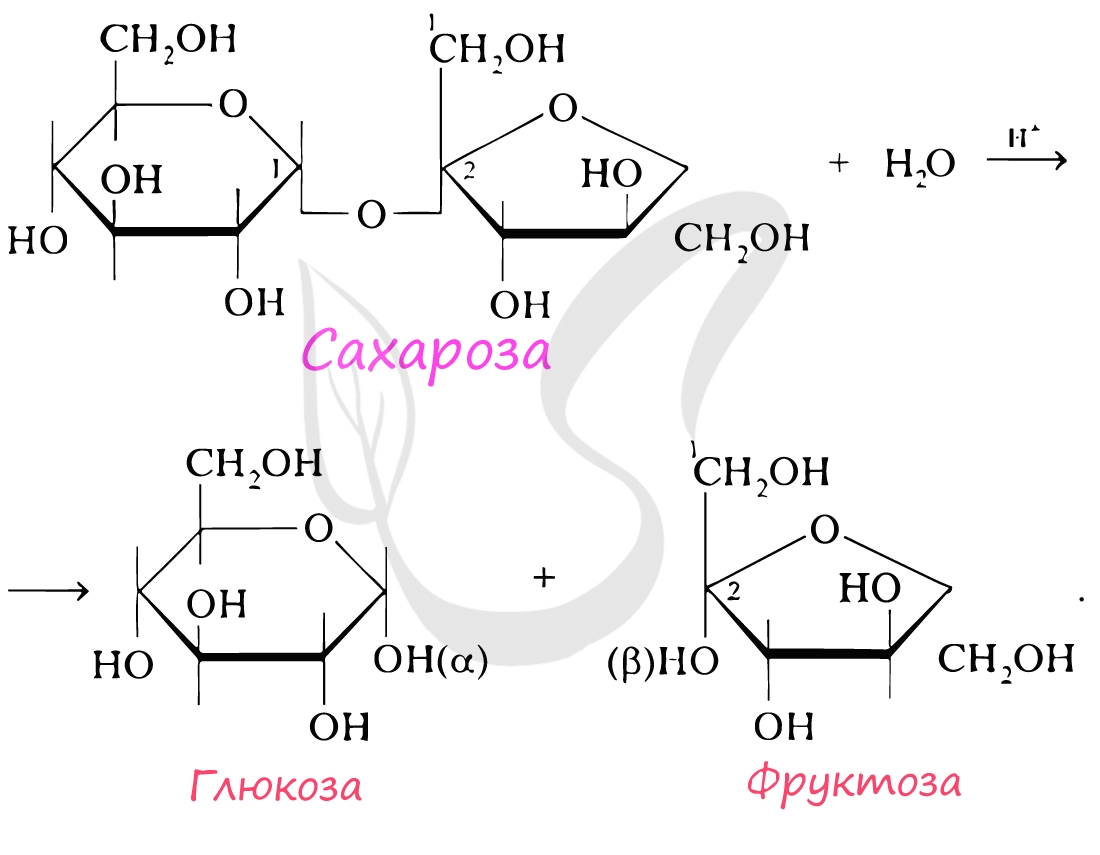
При гидролизе олигосахариды распадаются на моносахариды. В состав олигосахаридов может входить от 2 до 10 моносахаридных остатков. Если в состав олигосахарида входят 2 остатка моносахарида, то его называют дисахарид. К дисахаридам относятся сахароза, лактоза, мальтоза. При гидролизе сахароза распадается на глюкозу и фруктозу.
Это биополимеры, в состав которых входят сотни тысяч моносахаридов. Они обладают высокой молекулярной массой, нерастворимы в воде, на вкус несладкие.
В результате расщепления 1 г углеводов высвобождается 17,6 кДж энергии.
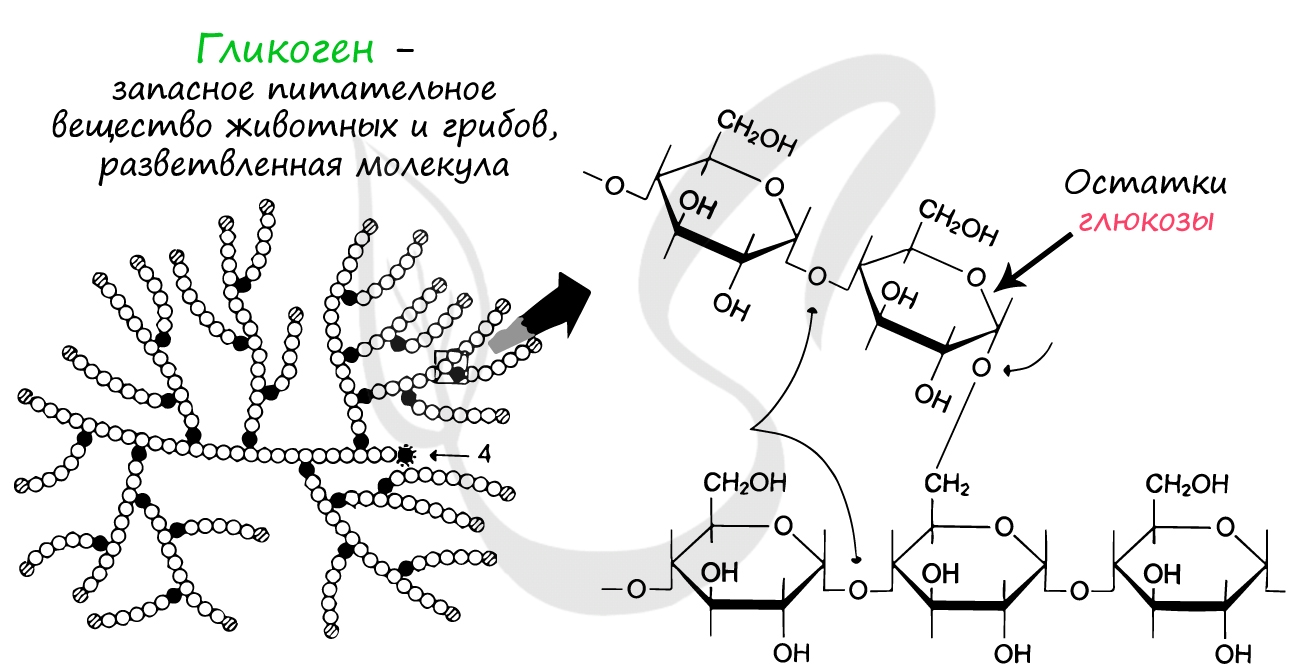
Запасным питательным веществом растений и животных соответственно являются крахмал и гликоген. Расщепление гликогена позволяет нам оставаться в сознании и быть активными между приемами пищи.
Гликоген представляет собой разветвленную молекулу, состоящую из остатков глюкозы. За счет больших размеров такая молекула хорошо удерживается в клетке, а ее разветвленность позволяет ферментам быстро отщеплять множество молекул глюкозы одновременно.
Существуют заболевания, при которых распад гликогена нарушается: в результате нейроны не получают глюкозы (источника энергии, соответственно не синтезируются и молекулы АТФ). Из-за этого становятся возможны частые потери сознания.
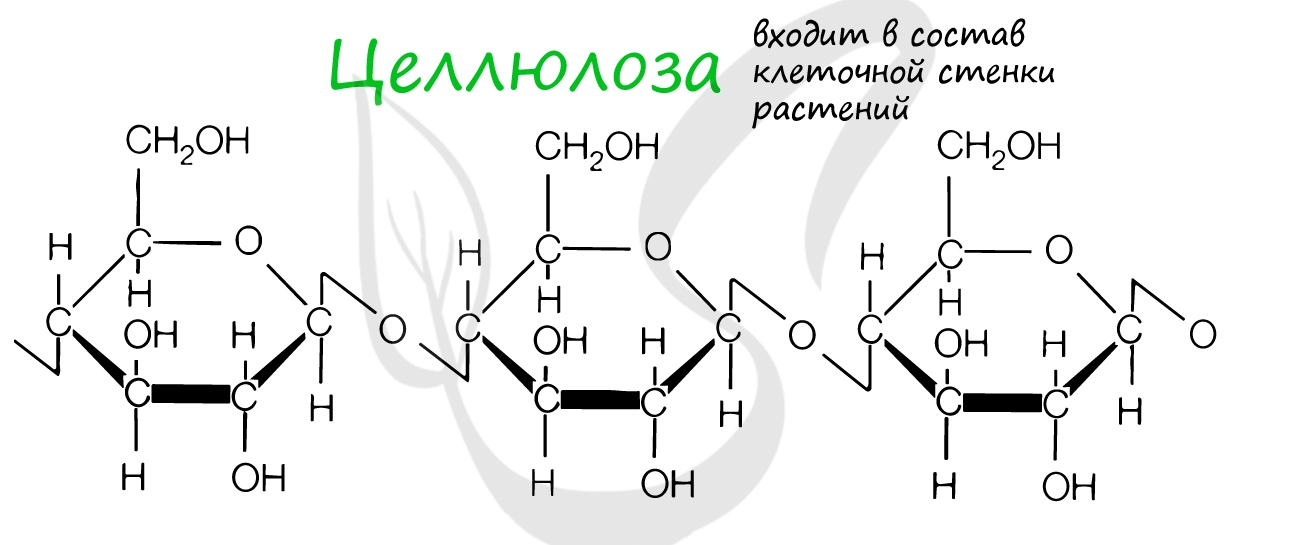
Целлюлоза входит в состав клеточных стенок растений, придавая им необходимую твердость. Хитин образует клеточную стенку грибов и наружный скелет членистоногих.
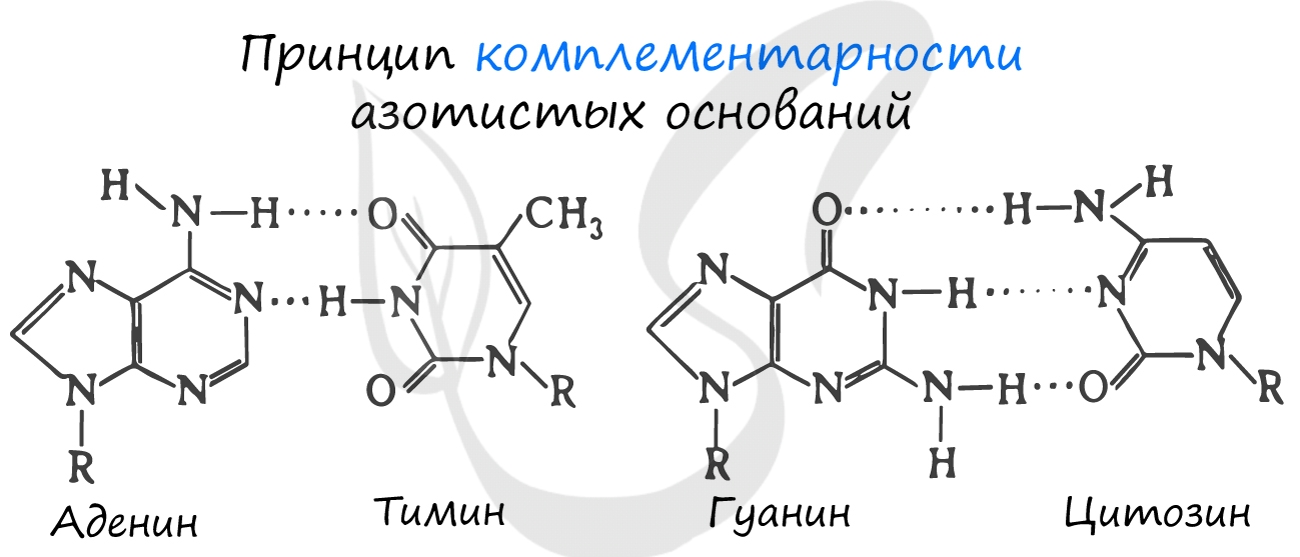
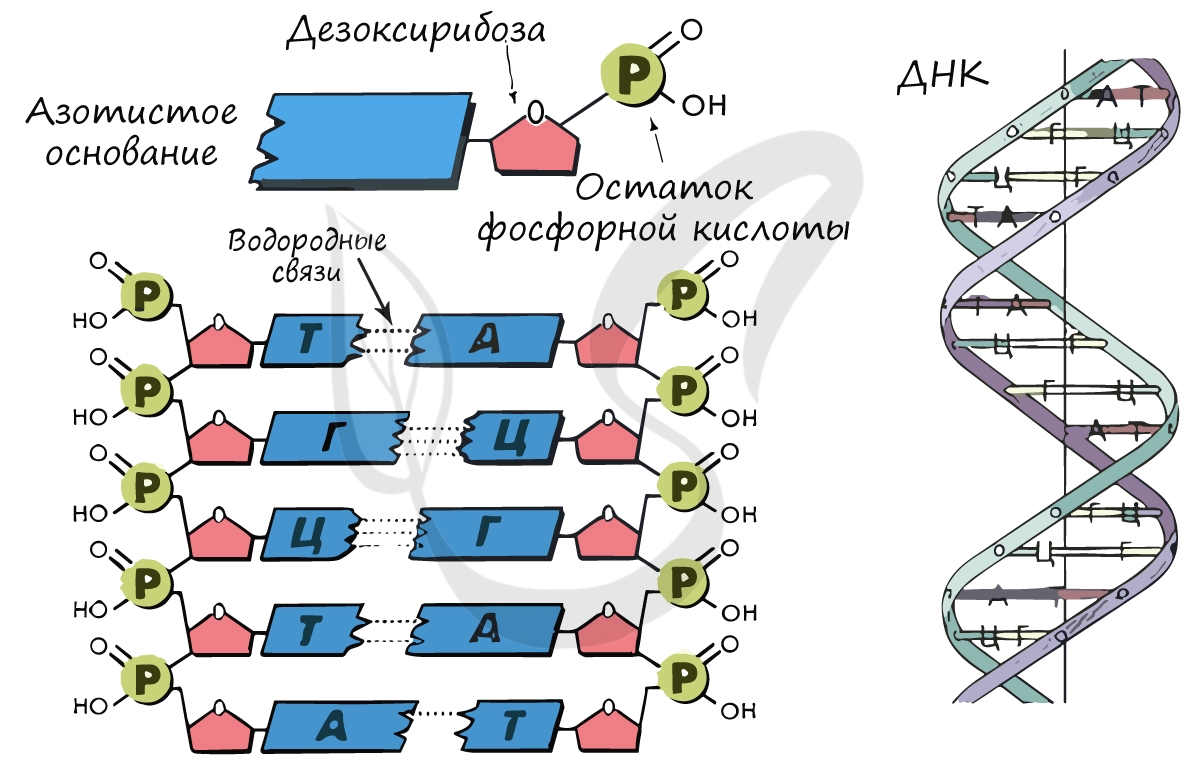
Нуклеиновые кислоты (от лат. nucleus — ядро)
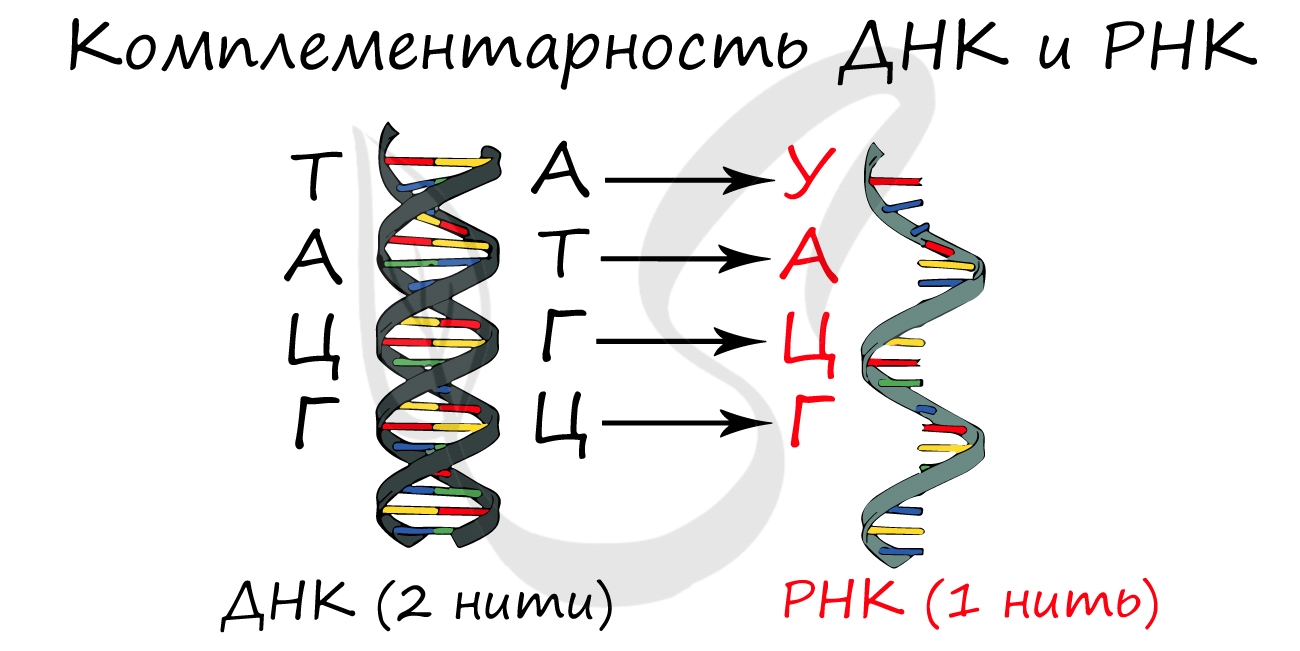
Синтезируется в ядрышке. рРНК входит в состав малых и больших субъединиц рибосом. В процентном отношении рРНК составляет 80-90% всей РНК клетки.
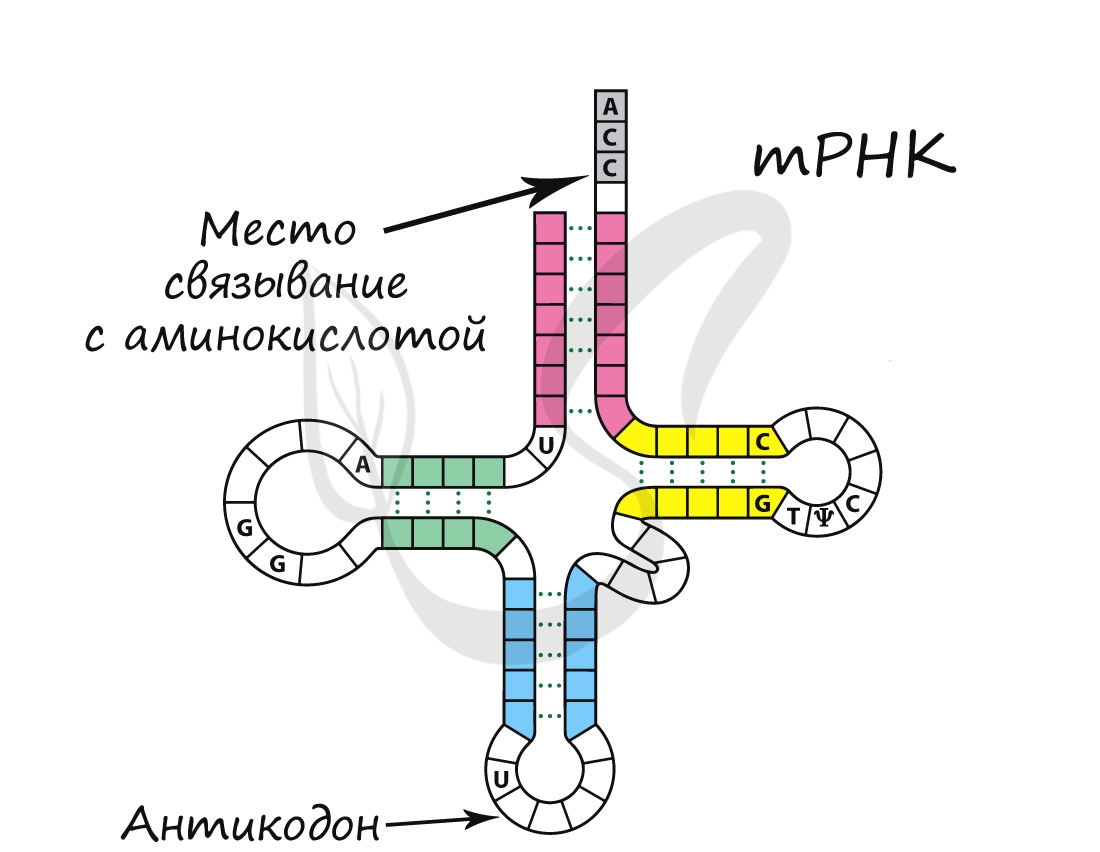
Обеспечивает транспорт аминокислоты к рибосоме во время синтеза белка. Благодаря этому становится возможным соединение аминокислот друг с другом, образуется белок. тРНК имеет характерную форму клеверного листа.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ