Почему миокард левого желудочка толще чем правого
Гипертрофия миокарда сердца — особенности заболевания
Гипертрофия миокарда сердца — это увеличение, разрастание мышечной массы стенки сердца. Такие изменения приводят к изменению размеров, формы органа, утолщению межжелудочковой перегородки.
Симптомы
Как правило, данная патология обнаруживается случайно, в процессе проведения ЭКГ или Эхо-КГ. Специалисты выделяют такие основные признаки гипертрофии миокарда:
Развитие стенокардии происходит в результате сжатия сосудов, обеспечивающих необходимым питанием сердечную мышцу. В конечном итоге происходит увеличение мышцы в размерах. Она начинает потреблять больше кислорода в комплексе с питательными веществами. У пациентов, страдающих от гипертрофии миокарда сердца, также может возникать состояние, в процессе которого замирает сердце на несколько мгновений (не бьется вообще). В этом случае человек теряет сознание.
Диагностика
Как правило, заболевание выявляется при ультразвуковом исследовании. МРТ сердца считается наиболее простым, информативным методом. В определенных случаях заболевание диагностируют при помощи ЭКГ. К дополнительным исследованиям относят: вентрикулографию, коронарографию, а также радиоизотопное исследование.
Профилактика
К числу эффективных профилактических действий по предотвращению развития заболевания относят:
В случае контроля препаратами удается поддерживать нормальный уровень сахара, а также контролировать остальные факторы риска, возникающие при сахарном диабете. Соблюдение таких профилактических мер позволяет избегать развития гипертрофии миокарда сердца.
Лечение гипертрофии миокарда
Для проведения квалифицированного лечения необходимо продиагностировать заболевание, а также определить его характер, особенности течения. На основе этих данных подбирается оптимальный способ лечения. В большинстве случаев лечение гипертрофии миокарда состоит в приеме препарата верампила с бета-блокаторами. Комплексное применение лекарств позволяет снизить симптоматику заболевания, а также нормализовать общее состояние больного. В роли дополнительной терапии необходимо соблюдать назначенную диету, а также отказаться от курения, приема алкоголя. Кроме того, необходимо сокращение количества соли, потребляемых продуктов с максимально высоким содержанием жиров. При лечении физические нагрузки должны быть умеренными.
В особо тяжелых случаях требуется хирургическое вмешательство. В этом случае специалист удаляет гипертрофированную часть мышцы. В процессе лечения состояние пациента отслеживается при помощи ЭКГ.
Реабилитация
Как известно, после проведенного лечения, операционного вмешательства требуется полноценная реабилитация. Лечебная диета является неотъемлемой составляющей реабилитационного процесса. В таком случае питаться необходимо до 6 раз в день небольшими порциями. Мучные изделия при этом нужно ограничить, жирные, копченые блюда также исключаются из рациона. Уровень физических нагрузок необходимо снизить. Полноценная реабилитация позволяет пациенту намного оперативнее восстановиться после проведенного лечения.
Записаться на приём
Запишитесь на приём и получите профессиональное обследование в нашем центре
Как устроено сердце
Венозная кровь из правых отделов сердца по легочным артериям направляется в легкие, где обогащается кислородом, и снова возвращается в сердце – это малый круг кровообращения.
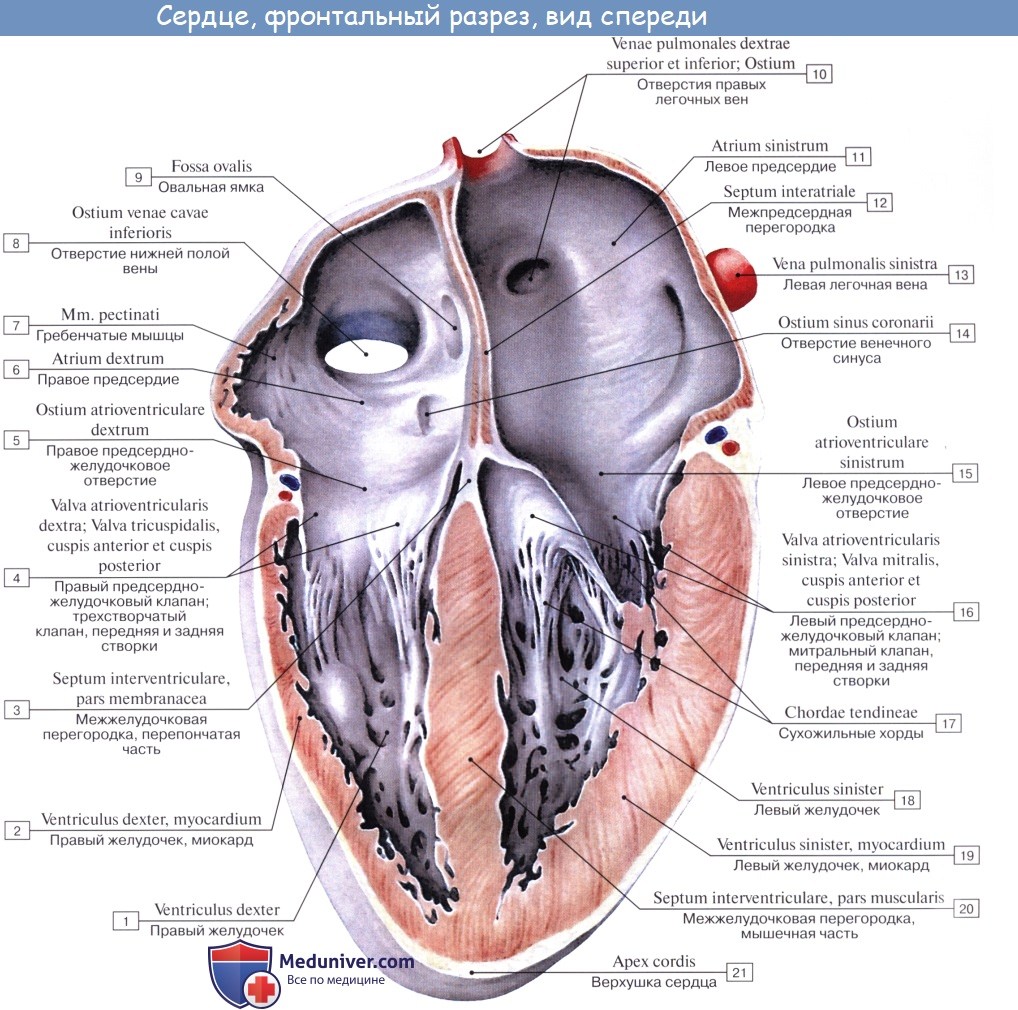
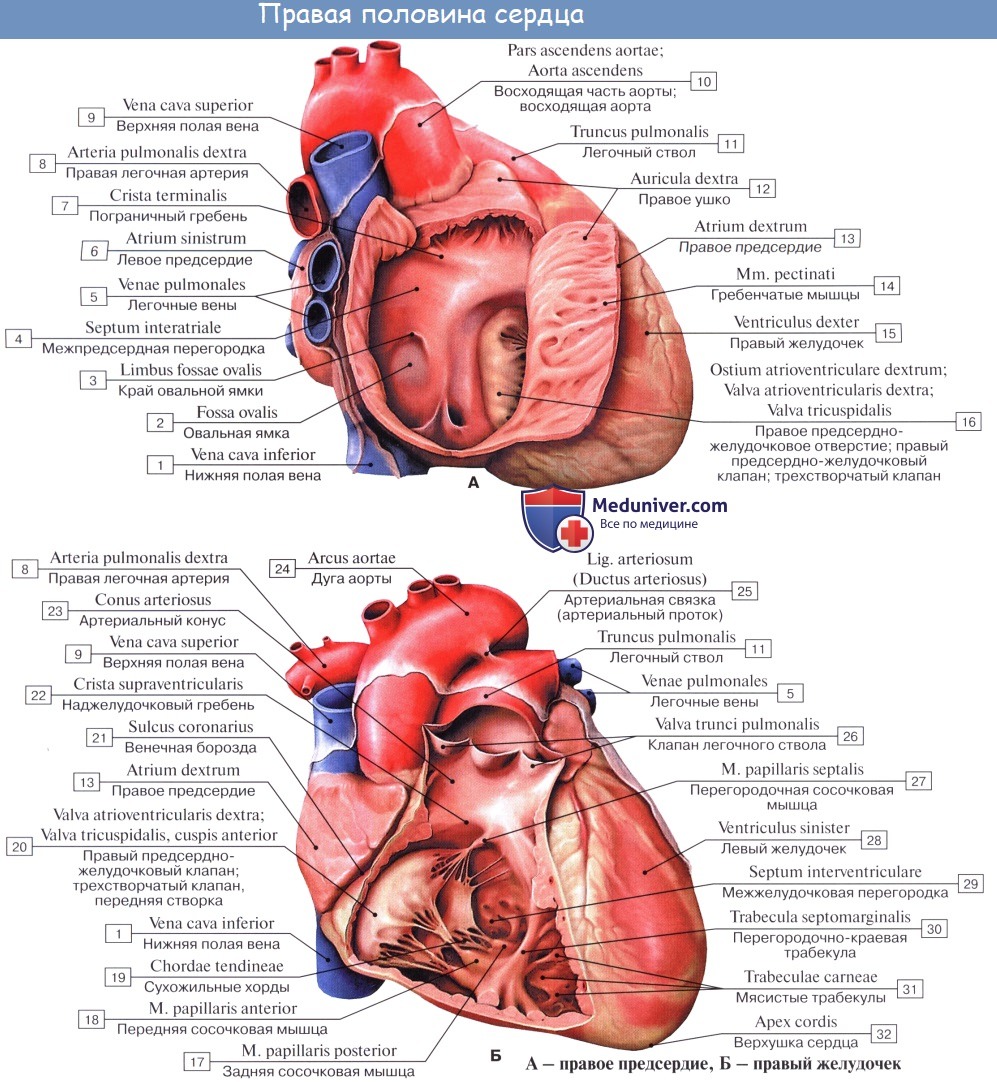
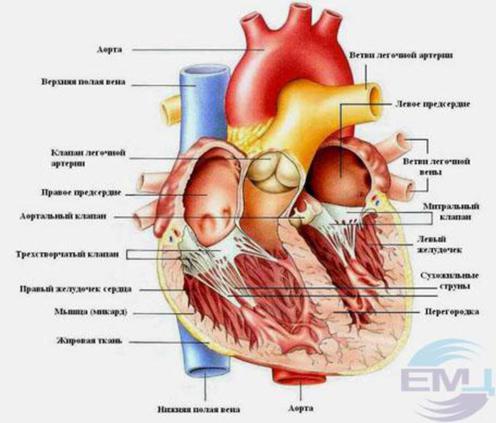
Внутри сердце разделено перегородками на четыре камеры. Два предсердия разделены межпредсердной перегородкой на левое и правое предсердия. Левый и правый желудочки сердца разделены межжелудочковой перегородкой. В норме левые и правые отделы сердца абсолютно раздельны. У предсердий и желудочков разные функции. В предсердиях накапливается кровь, поступающая в сердце. Когда объем этой крови достаточен, она проталкивается в желудочки. А желудочки проталкивают кровь в артерии, по которым она движется по всему организму. Желудочкам приходится выполнять более тяжелую работу, поэтому мышечный слой в желудочках значительно толще, чем в предсердиях. Предсердия и желудочки с каждой стороны сердца соединяются предсердно-желудочковым отверстием. Кровь через сердце движется только в одном направлении. По большому кругу кровообращения из левой части сердца (левого предсердия и левого желудочка) в правую, а по малому из правой в левую.
Правильное направление движения крови обеспечивает клапанный аппарат сердца:
Трехстворчатый клапан
Он расположен между правым предсердием и правым желудочком. Он состоит из трех створок. Если клапан открыт, кровь переходит из правого предсердия в правый желудочек. Когда желудочек наполняется, мышца его сокращается и под действием давления крови клапан закрывается, препятствуя обратному току крови в предсердие.
Легочный клапан
Двустворчатый или митральный клапан
Находится между левым предсердием и левым желудочком. Состоит из двух створок. Если он открыт, кровь поступает из левого предсердия в левый желудочек, при сокращении левого желудочка он закрывается, препятствуя обратному току крови.
Аортальный клапан
Закрывает вход в аорту. Тоже состоит из трех створок, которые имеют вид полулуний. Открывается при сокращении левого желудочка. При этом кровь поступает в аорту. При расслаблении левого желудочка, закрывается. Таким образом, венозная кровь (бедная кислородом) из верхней и нижней полой вен попадает в правое предсердие. При сокращении правого предсердия через трехстворчатый клапан она продвигается в правый желудочек. Сокращаясь, правый желудочек выбрасывает кровь через легочной клапан в легочные артерии (малый круг кровообращения). Обогащаясь кислородом в легких, кровь превращается в артериальную и по легочным венам продвигается в левое предсердие, затем в левый желудочек. При сокращении левого желудочка артериальная кровь через аортальный клапан под большим давлением попадает в аорту и разносится по всему организму (большой круг кровообращения).
Сердечная мышца называется миокардом
Выделяют сократительный и проводящий миокард. Сократительный миокард – это собственно мышца, которая сокращается и производит работу сердца. Для того, чтобы сердце могло сокращаться в определенном ритме, оно имеет уникальную проводящую систему. Электрический импульс для сокращения сердечной мышцы возникает в синоатриальном узле, который находится в верхней части правого предсердия и распространяется по проводящей системе сердца, достигая каждого мышечного волокна
Cначала сокращаются оба предсердия, затем оба желудочка, тем самым обеспечивая поступление крови ко всем органам и тканям организма.
Сердечная мышца имеет две оболочки (наружную и внутреннюю). Внутренняя оболочка сердца называется эндокардом. Наружная оболочка сердца называется перикардом.
Почему миокард левого желудочка толще чем правого
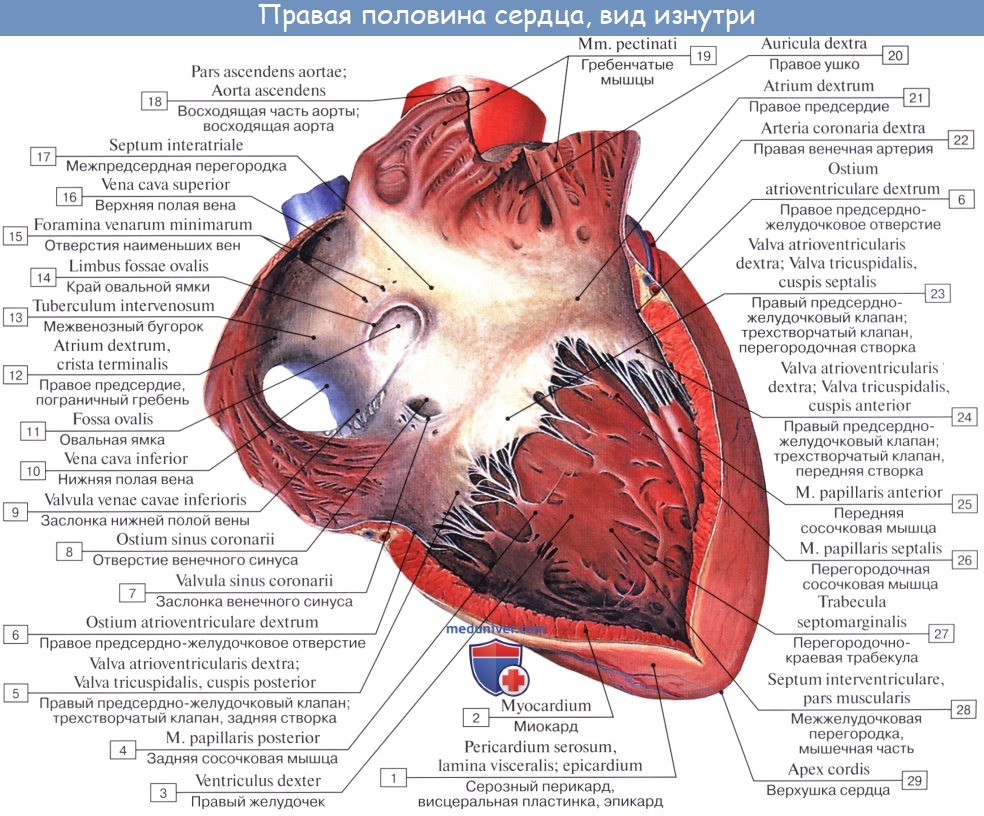
Свободными краями створки обращены в желудочек. К ним прикрепляются тонкие сухожильные нити, chordae tendineae, которые своими противоположными концами прикреплены к верхушкам сосочковых мышц, musculi papillares. Сосочковые мышцы представляют собой конусовидные мышечные возвышения, верхушками своими выступающие в полость желудочка, а основаниями переходящие в его стенки.
В правом желудочке обычно бывают три сосочковые мышцы: передняя, наибольшая по своей величине, дает начало сухожильным нитям к передней и задней створкам трехстворчатого клапана; задняя, меньших размеров, посылает сухожильные нити к задней и перегородочной створкам и, наконец, m. papillaris septalis, не всегда имеющаяся мышца, дает сухожильные нити обыкновенно к передней створке. В случае ее отсутствия нити возникают непосредственно из стенки желудочка.
В области conus arteriosus стенка правого желудочка гладкая, на остальном протяжении внутрь вдаются мясистые трабекулы, trabeculae carneae.
Кровь из правого желудочка поступает в легочный ствол через отверстие, ostium trunci pulmonalis, снабженное клапаном, valva trunci pulmonalis, который препятствует возвращению крови из легочного ствола обратно в правый желудочек во время диастолы. Клапан состоит из трех полу лунных заслонок. Из них одна прикрепляется к передней трети окружности легочного ствола (valvula semilunaris anterior) и две — сзади (valvulae semilunares dextra et sinistra).
На внутреннем свободном краю каждой заслонки имеется посередине маленький узелок, nodulus valvulae semilunaris, по сторонам от узелка тонкие краевые сегменты заслонки носят название lunulae valvulae semilunaris. Узелки способствуют более плотному смыканию заслонок.
Левый желудочек, ventriculus sinister, имеет форму конуса, стенки которого по толщине в 2 — 3 раза превосходят стенки правого желудочка (10—15 мм против 5 — 8 мм). Эта разница происходит за счет мышечного слоя и объясняется большей работой, производимой левым желудочком (большой круг кровообращения) в сравнении с правым (малый круг). Толщина стенок предсердий соответственно их функции еще менее значительна (2 — 3 мм).
Отверстие, ведущее из полости левого предсердия в левый желудочек, ostium atrioventriculare sinistrum, овальной формы, снабжено левым предсердно-желудочковым (митральным) клапаном, valva atrioventricularis sinistra (mitralis), из двух створок которого меньшая расположена слева и сзади (cuspis posterior), большая — справа и спереди (cuspis anterior). Свободными краями створки обращены в полость желудочка, к ним прикрепляются chordae tendineae.
Musculi papillares имеются в левом желудочке в числе двух — передняя и задняя; каждая сосочковая мышца дает сухожильные нити как одной, так и другой створке valvae mitralis. Отверстие аорты называется ostium aortae, а ближайший к нему отдел желудочка — conus arteriosus.
Клапан аорты, valva aortae, имеет такое же строение, как и клапан легочного ствола. Одна из заслонок, valvula semilunaris posterior, занимает заднюю треть окружности аорты; другие две, valvulae semilunares dextra et sinistra, — правую и левую сторону отверстия. Узелки на их свободных краях, noduli valvularum semilunarium aortae, выражены заметнее, чем на клапанах легочного ствола; имеются также lunulae valvularum semilunarium aortae.
Перегородка между желудочками, septum interventriculare, представлена главным образом мышечной тканью, pars muscularis, за исключением самого верхнего участка, где имеется лишь фиброзная ткань, покрытая с обеих сторон эндокардом, pars membranасеa. Pars membranacea соответствует участку неполного развития межжелудочковой перегородки животных. Здесь нередко встречаются аномалии в виде дефектов в перегородке.
Лечение гипертрофии сердца
В России ежегодно умирает 1 млн 300 тыс. человек от болезней сердечно-сосудистой системы. При этом от 2 до 5 человек на 100 000 населения страдают от такого серьезного заболевания, как гипертрофия сердца. И примерно половина из них находится в возрасте от 20 до 35 лет. Больным ставится диагноз «гипертрофическая кардиомиопатия», сокращенно недуг обозначается как ГКМП. Это первичное поражение миокарда, при котором левый или правый желудочки увеличиваются в объеме. При этом медики разделяют ГКМП на симметричную и ассиметричную.
Гипертрофия левого желудочка
Это типичное заболевание среди гипертоников. При грамотном лечении гипертрофия левого желудочка сердца достаточно быстро перестает быть проблемой. Однако если пустить все на самотек, то летальный исход неизбежен. По статистике, 4 % случаев заканчиваются смертью. Опасность болезни в том, что гипертрофия левого желудочка сердца значительно ухудшает эластичность стенки.
Причины увеличения левого желудочка сердца:
Проблема этой патологии в том, что лишь миокард становится больше. При этом сосуды и элементы проводящей системы не меняют свои размеры. Это постепенно приводит к тому, что развивается ишемия мышечных клеток. Сердечный ритм сбивается, а в левом желудочке скапливается много крови. Со временем это приводит к:
Гипертрофия правого желудочка
С этой части сердца и начинается малый круг кровообращения. По статистике врачей различных клиник, болезнь диагностируется обычно у новорожденных или детей постарше. При этом гипертрофия правого желудочка сердца является достаточно редким заболеванием. Оно может развиться также у:
В зависимости от размера желудочка болезнь разделяют на три этапа:
Причины, по которым развивается гипертрофия правого желудочка:
Болезнь опасна тем, что могут быть затронуты легочные сосуды и артерии. Они теряют свою эластичность, что приводит к развитию склеротических процессов. Из-за этого недуга может развиться синдром Эйзенменгера, который особенно опасен для беременных женщин.
Признаки гипертрофии
Болезнь не сразу дает о себе знать определенными нарушениями в привычном образе жизни. Достаточно долго человек может вести себя как обычно. Поэтому так важно сразу распознать первые симптомы. Медики выделяют следующие признаки гипертрофии:
Важно понимать, что гипертрофия сердца может вовсе не проявлять себя долгие годы. Иногда диагноз ставится уже посмертно, после вскрытия. Поэтому необходимо следить за состоянием здоровья и периодически обследоваться в медицинском центре.
Причины гипертрофии миокарда
Постепенно миокард может увеличиться в размерах, потерять эластичность. Это приведет или к серьезным проблемам со здоровьем, или даже к летальному исходу. Поэтому так важно знать, каковы причины гипертрофии миокарда. Медики обычно выделяют следующие факторы:
Опытный врач при осмотре определит одну или несколько причин, а потом отправит на определенные обследования. Они позволят точно выяснить, что у больного гипертрофия сердца.
Диагностика заболевания
Как лечить гипертрофию сердца?
Как правило, болезнь удается купировать при помощи определенных лекарственных препаратов. Как лечить гипертрофию сердца, определяет только кардиолог. Он учитывает множество факторов:
Иногда требуется хирургическое вмешательство. Как можно лечить гипертрофию левого желудочка сердца таким способом, врач подробно расскажет на приеме. Обычно такая радикальная мера нужна тогда, когда симптомы выражены очень ярко, а лекарственные средства не дают должного эффекта.
К какому врачу обратиться?
Гипертрофия миокарда сердца и другие осложнения ГКМП не всегда диагностируются вовремя. В итоге лечение назначают тогда, когда недуг приводит к серьезным проблемам. Поэтому так важно знать, к какому врачу обратиться, чтобы вам была оказана всесторонняя помощь. В МХЦ сети «Открытая клиника» трудятся кардиологи с огромным опытом работы. Они определят признаки гипертрофии еще на первом осмотре. После этого врач выпишет направление на обследование, причем назначит лишь те процедуры, которые вам действительно необходимы.
После получения результатов КТ, МРТ, УЗИ, ЭКГ, анализа крови станет понятно, каким должно быть лечение гипертрофии сердца. После этого врач выпишет лекарственные препараты. Если возникнет вопрос о наблюдении и лечении в стационаре, то в МХЦ сети «Открытая клиника» вам будут предложены лучшие условия. Мы делаем все возможное, чтобы наши пациенты чувствовали себя комфортно в сложные периоды своей жизни.
Другие заболевания, которые мы лечим:
Современные подходы к лечению больных гипертрофической кардиомиопатией
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период тол
Полувековая история изучения проблемы гипертрофической кардиомиопатии (ГКМП) отражает значительную эволюцию знаний в области этиологии, патогенеза, диагностики, клинического течения, прогноза и вариантов лечения этого заболевания. За указанный период только в англоязычных изданиях опубликованы более 1000 крупных научных работ. ГКМП — одна из основных и, вероятно, наиболее распространенных форм кардиомиопатий, заболеваний миокарда, сопровождающихся его дисфункцией (Report of the 1995 WHO/ISFC Task Force on the Definition and Classification of Cardiomyopathy) [1].
В 2003 г. создан Международный комитет (ACC/ESC), объединивший американских и европейских экспертов по ГКМП, и опубликовано сообщение, суммировавшее основные положения, включая стратегию лечебных мероприятий [2].
Определение заболевания носит описательный характер. Так, по современным представлениям, ГКМП является преимущественно генетически обусловленным заболеванием мышцы сердца, характеризующимся комплексом специфических морфофункциональных изменений и неуклонно прогрессирующим течением с высокой угрозой развития тяжелых, жизнеугрожающих аритмий и внезапной смерти (ВС). ГКМП характеризуется массивной гипертрофией миокарда левого и/или реже правого желудочка, чаще асимметричного характера за счет утолщения межжелудочковой перегородки (МЖП), нередко с развитием обструкции (систолического градиента давления) выходного тракта ЛЖ при отсутствии видимых причин (артериальная гипертония, пороки и специфические заболевания сердца). Основным методом диагностики остается эхокардиографическое исследование. В зависимости от наличия или отсутствия градиента систолического давления в полости ЛЖ, ГКМП разделяют на обструктивную и необструктивную, что имеет важное практическое значение при выборе тактики лечения. При этом различают 3 гемодинамических варианта обструктивной ГКМП: с субаортальной обструкцией в покое (так называемой базальной обструкцией); с лабильной обструкцией, характеризующейся значительными спонтанными колебаниями внутрижелудочкового градиента давления без видимой причины; с латентной обструкцией, которая вызывается только при нагрузке и провокационных фармакологических пробах (в частности, вдыханием амилнитрита, при приеме нитратов или внутривенном введении изопротеренола).
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов [3, 4].
В настоящее время наблюдается повсеместный рост числа зарегистрированных случаев этой патологии как за счет внедрения в практику современных методов диагностики, так и, вероятно, в связи с истинным увеличением числа больных ГКМП [8, 9]. Согласно данным последних исследований, распространенность заболевания в общей популяции является более высокой, чем считалось ранее, и составляет 0,2% [10, 11]. ГКМП может диагностироваться в любом возрасте, от первых дней до последней декады жизни, однако преимущественно заболевание выявляется у лиц молодого трудоспособного возраста [12, 13]. Ежегодная смертность больных ГКМП колеблется в пределах от 1 до 6%: у взрослых больных составляет 1–3% [14, 15], а в детском и подростковом возрасте у лиц с высоким риском ВС — 4–6% [16, 17].
Общепризнанна концепция о преимущественно наследственной природе ГКМП [18, 19]. В литературе широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми [20, 21], при этом основной тип наследования — аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
ГКМП — это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата [2, 22]. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии. Мутации, которые ассоциируются с высокой пенетрантностью и плохим прогнозом, выражаются большей гипертрофией левого желудочка и толщиной МЖП, чем те, которые характеризуются низкой пенетрантностью и имеют хороший прогноз. Так, было показано, что лишь отдельные мутации ассоциированы с плохим прогнозом и высокой частотой ВС. К ним относятся замены Arg 403 Gln, Arg 453 Cys, Arg 719 Trp, Arg 719 Gln, Arg 249 Gln в гене тяжелой цепи β-миозина, InsG 791 в гене миозин-связывающего белка С и Asp 175 Asn в гене α-тропомиозина [23, 24, 25, 26]. Для мутаций в гене тропонина Т характерна умеренная гипертрофия миокарда, однако прогноз достаточно неблагоприятен, а вероятность внезапной остановки сердца высока [27]. Другие генетические аномалии, как правило, сопровождаются доброкачественным течением и благоприятным прогнозом или занимают промежуточное положение по тяжести вызываемых ими проявлений.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений. При этом отчетливо выделяются 5 основных вариантов течения заболевания и исходов:
Вариабельность прогноза определяет необходимость детальной стратификации риска фатальных осложнений заболевания, поиск доступных прогностических предикторов и критериев оценки проводимого лечения.
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза (рис.).
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск ВС (в частности, скрытых прогностически значимых аритмий).
К общим мероприятиям относятся ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска ВС. Для предупреждения инфекционного эндокардита в ситуациях, связанных с развитием бактериемии, при обструктивных формах ГКМП рекомендуется антибиотикопрофилактика, аналогичная таковой у больных с пороками сердца.
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью ВС. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции [28, 29]. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики [30, 31]. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов (верапамил). Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид и амиодарон.
β-адреноблокаторы стали первой и остаются и по сей день наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных ГКМП [32, 33, 34], что обусловлено, в основном, способностью этих препаратов уменьшать потребность миокарда в кислороде. Благодаря отрицательному инотропному действию и уменьшению активации симпатоадреналовой системы при физическом и эмоциональном напряжении, β-блокаторы предотвращают возникновение или повышение субаортального градиента давления у больных с латентной и лабильной обструкцией, существенно не влияя на величину этого градиента в покое. Убедительно показана способность β-блокаторов улучшать функциональный статус пациентов в условиях курсового и длительного применения [35]. Хотя препараты не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ косвенно — за счет уменьшения частоты сердечных сокращений и предупреждения ишемии сердечной мышцы [36]. В литературе имеются данные, подтверждающие способность β-блокаторов сдерживать и даже приводить к обратному развитию гипертрофии миокарда [37, 38]. Однако другие авторы подчеркивают, что вызываемое β-блокаторами симптоматическое улучшение не сопровождается регрессией гипертрофии ЛЖ и улучшением выживаемости больных [39]. Хотя эффект этих препаратов в отношении купирования и предупреждения желудочковых и суправентрикулярных аритмий и внезапной смерти не доказан, ряд специалистов все же считают целесообразным их профилактическое назначение больным ГКМП высокого риска, включая пациентов молодого возраста с отягощенным случаями внезапной смерти семейным анамнезом [40].
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
В настоящее время широко изучается возможность эффективного применения нового поколения кардиоселективных β-блокаторов пролонгированного действия, в частности атенолола, конкора и др. При этом существует мнение о том, что кардиоселективные β-блокаторы у больных ГКМП не имеют преимуществ перед неселективными, так как в больших дозах, к достижению которых следует стремиться, селективность практически утрачивается. Следует отметить, что рекомендуемый к применению у больных ГКМП с тяжелыми суправентрикулярными и желудочковыми аритмиями соталол сочетает в себе свойства неселективных β-блокаторов и антиаритмических средств III класса (кордароноподобный эффект).
Применение блокаторов медленных кальциевых каналов при ГКМП основано на снижении уровня свободного кальция в кардиомиоцитах и нивелировании асинхронии их сокращения, улучшении расслабления миокарда и снижении его сократимости, подавлении процессов гипертрофии миокарда. Среди блокаторов кальциевых каналов препаратом выбора, благодаря наибольшей выраженности отрицательного инотропного действия и наиболее оптимальному профилю фармакологических свойств, является верапамил (изоптин, финоптин). Он обеспечивает симптоматический эффект у 65–80% больных, включая случаи рефрактерности к лечению β-блокаторами, что обусловлено способностью препарата уменьшать ишемию миокарда, в том числе безболевую, и улучшать его диастолическое расслабление и податливость ЛЖ [41, 42, 43]. Это свойство верапамила обеспечивает повышение толерантности больных к физической нагрузке и снижение субаортального градиента давления в покое при меньшей по сравнению с β-блокаторами способности к уменьшению внутрижелудочковой обструкции в случаях физического и эмоционального напряжения и провокации изопротеренолом. Одновременно верапамил снижает периферическое сосудистое сопротивление вследствие вазодилататорного действия [44]. И хотя этот эффект чаще всего нивелируется непосредственным положительным влиянием на диастолическую функцию ЛЖ, у отдельных больных с базальной внутрижелудочковой обструкцией в сочетании с повышенным конечно-диастолическим давлением ЛЖ и склонностью к системной артериальной гипотензии при уменьшении постнагрузки внутрижелудочковый градиент давления может резко возрастать. Это способно приводить к развитию отека легких, кардиогенного шока и даже внезапной смерти [45]. Подобные грозные осложнения фармакотерапии верапамилом описаны также у больных необструктивной ГКМП с высоким давлением в левом предсердии, у которых они обусловлены отрицательным инотропным действием препарата. Очевидно, как важно соблюдать осторожность при начале лечения верапамилом этой категории больных. Прием препарата следует начинать в условиях стационара с малых доз — 20–40 мг 3 раза в день с постепенным их повышением при хорошей переносимости до снижения частоты сердечных сокращений в покое до 50–60 уд/мин. Клинический эффект наступает обычно при приеме не менее 160–240 мг препарата в сутки; более удобны в условиях длительного применения пролонгированные формы (изоптин-ретард, верогалид-ретард). С учетом благоприятного влияния верапамила на диастолическую функцию и величину субаортального градиента давления в ЛЖ, а также доказанной способности увеличивать выживаемость больных ГКМП по сравнению с плацебо [46], целесообразно его профилактическое назначение у асимптоматичных больных ГКМП высокого риска.
Место дилтиазема в лечении ГКМП окончательно не определено. Имеются данные, что в средней дозе 180 мг/сут за 3 приема он оказывает столь же выраженное, как 240 мг верапамила, благотворное влияние на диастолическое наполнение ЛЖ и одинаковый симптоматический эффект, однако в меньшей степени улучшает физическую работоспособность больных [47].
В нашей клинике продолжается проспективное наблюдение (от 1 до 5 лет) более 100 больных ГКМП. Больные были рандомизированы на 3 сопоставимые по количеству, полу, возрасту и тяжести клинических проявлений группы. Пациентам произвольно назначались атенолол или изоптин-ретард; в третьей группе преобладали лица с тяжелыми желудочковыми нарушениями ритма, и им был рекомендован прием соталола. Оценка эффективности различных вариантов медикаментозного лечения проводилась в условиях длительного (не менее 1 года) применения препаратов. Суточные дозы при двухкратном режиме приема титровались индивидуально и составили в среднем 85, 187, 273 мг для атенолола, изоптина и соталола соответственно. Длительная терапия привела к улучшению клинического состояния соответственно у 77, 72 и 83% пациентов каждой группы, что выражалось в достоверном уменьшении основных симптомов, проявлений сердечной недостаточности (СН), увеличении мощности и времени выполненной нагрузки и улучшении показателей качества жизни (на 25, 32 и 34% соответственно). При этом выявлены достоверное (p
С. А. Габрусенко, кандидат медицинских наук
Ю. В. Сафрыгина
В. Г. Наумов, доктор медицинских наук, профессор
Ю. Н. Беленков, доктор медицинских наук, профессор
НИИ кардиологии им. А. Л. Мясникова РК НПК МЗ РФ, Москва