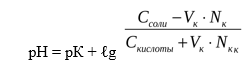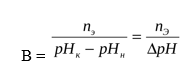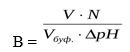Почему буферная емкость крови по кислоте больше чем по щелочи
Почему буферная емкость крови по кислоте больше чем по щелочи
Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Для обеспечения стационарного состояния у всех организмов выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели – сохранению постоянства внутренней среды. Это относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций организма человека и животных называется гомеостазом.
Этот процесс осуществляется преимущественно деятельностью лёгких и почек за счёт дыхательной и выделительной функции. В основе гомеостаза лежит сохранение кислотно-основного баланса. Для нормальной жизнедеятельности большинства клеток необходимы достаточно узкие пределы рН (6,9 – 7,8), и организм вынужден постоянно осуществлять нейтрализацию образующихся кислот. Этот процесс выполняют буферные системы, которые связывают избыток ионов водорода и контролируют их дальнейшие перемещения в организме. Буферные системы играют очень важную роль, т.к. в результате различных метаболических процессов в организме постоянно образуются различные кислоты, которые сразу же нейтрализуются буферными системами: гидрокарбонатной, фосфатной, белковой и гемоглобиновой.
Главной буферной системой организма является гидрокарбонатный буфер, состоящий из Н2СО3 и NaHCО3. При рН около 7,4 в организме преобладает гидрокарбонат-ион, и его концентрация может в 20 раз превышать концентрацию угольной кислоты. По своей природе угольная кислота очень нестойкая и сразу же после образования расщепляется на углекислый газ и воду. Реакции образования и последующего быстрого расщепления угольной кислоты в организме настолько совершенны, что им часто не придают особого значения. Эти реакции катализируется ферментом карбоангидразой, который находится в эритроцитах и в почках. Особенность гидрокарбонатной буферной системы состоит в том, что она открыта. Избыток ионов водорода связывается с гидрокарбонат-ионом, образующийся при этом углекислый газ стимулирует дыхательный центр, вентиляция лёгких повышается, а излишки углекислого газа удаляются при дыхании. Так в организме поддерживается баланс рН. Чем больше в клетках образуется ионов водорода, тем больше расход буфера. На этом этапе метаболизма подключаются почки, которые выводят избыток ионов водорода, и количество гидрокарбоната в организме восстанавливается.
Фосфатный буфер может действовать как в составе органических молекул, так и в качестве свободных ионов. Одна его молекула способна связывать до трёх катионов водорода. Белки могут присоединять к своей полипептидной цепочке как кислотные, так и основные группы.
Буферная ёмкость белковой буферной системы может охватывать широкий диапазон рН. В зависимости от имеющейся величины рН она может связывать как гидроксильные группы, так и ионы водорода. Третья часть буферной ёмкости крови приходится на гемоглобин. Каждая молекула гемоглобина может нейтрализовать несколько ионов водорода. Когда кислород переходит из гемоглобина в ткани, способность гемоглобина связывать ионы водорода возрастает и наоборот: когда в лёгких происходит оксигенация гемоглобина, он теряет присоединённые ионы водорода. Освободившиеся ионы водорода реагируют с гидрокарбонатом, и в результате образуется углекислый газ и вода. Образовавшийся углекислый газ удаляется из лёгких при дыхании.
Буферные свойства гемоглобина обусловлены соотношением восстановленного гемоглобина (ННb) и его калиевой соли (КНb). В слабощелочных растворах, каким является кровь, гемоглобин и оксигемоглобин имеют свойства кислот и являются донорами Н+ или К+. Эта система может функционировать самостоятельно, но в организме она тесно связана с гидрокарбонатной. Когда кровь находится в тканевых капиллярах, откуда поступают кислые продукты, гемоглобин выполняет функции основания: КНb + Н2СО3 ↔ ННb + КНСО3. В легких гемоглобин, напротив, ведет себя, как кислота, предотвращая защелачивание крови после выделения углекислоты.
Таким образом, механизм регуляции кислотно-основного равновесия крови в целостном организме заключается в совместном действии внешнего дыхания, кровообращения, выделения и буферных систем.
Почему буферная емкость крови по кислоте больше чем по щелочи
Кислотно-щелочное равновесие является важным параметром, который поддерживается в крови человека в определенных пределах. Это необходимо для нормального функционирования различных систем организма, протекания биохимических реакций, оптимального функционирования ферментов.
Кислотами называются вещества, которые могут отдавать ионы водорода, а основаниями (щелочами) вещества, присоединяющие данные ионы. Кислотность и щелочность растворов оценивается по шкале рН от 0 (растворы сильных кислот) до 14 (растворы сильных щелочей). По шкале рН нейтральная кислотность равна 7.
Нормальная кислотность крови составляет 7,35 – 7,45 по шкале рН. Смещение данного показателя ниже 7,35 свидетельствует об ацидозе (смещении кислотно-щелочного баланса крови в сторону увеличения кислотности). При отклонении рН выше 7, 45 возникает алкалоз (избыток веществ со свойствами щелочей в крови).
В процессе обмена веществ в организме в больших количествах образуются продукты, которые способны вызывать изменение данного параметра. Главную роль в регуляции кислотно-щелочного равновесия принадлежит легким, почкам и буферным системам крови.
Во время дыхания через легкие осуществляется выделение углекислого газа, который образуется в процессе обмена веществ в организме. Углекислый газ при соединении с водой образует углекислоту, поэтому в случае его избытка в крови развивается ацидоз, а при недостаточной концентрации углекислого газа возникает алкалоз.
Почки выводят с мочой из организма избыток кислот и щелочей. При этом данные органы в определенных пределах могут регулировать количество выделяемых и всасываемых обратно кислот и оснований, за счет чего происходит регуляция уровня рН в крови.
Буферными системами крови называют растворы слабых кислот и щелочей, которые соединяясь с избыточными количествами кислот или оснований (в зависимости от наличия ацидоза или алкалоза) осуществляют их нейтрализацию, чем достигается выравнивание уровня рН.
Причиной ацидоза и алкалоза в большинстве случаев является тяжелое течение основного заболевания, при котором возникающие изменения рН крови превышают возможности механизмов регуляции данного параметра.
Нарушения кислотно-щелочного равновесия крови, нарушения кислотно-щелочного гомеостаза.
Acid-Base Disorders, Acid–base homeostasis.
Проявления ацидоза и алкалоза часто маскируются проявлениями основного заболевания, которое вызвало изменение кислотно-щелочного баланса крови.
При ацидозе могут быть следующие симптомы:
Проявления алкалоза могут включать в себя:
Общая информация о заболевании
Кислотно-щелочное равновесие в крови является жизненно важным параметром, нормальные значения которого составляют 7,35 – 7,45 по шкале рН.
Отклонение рН ниже 7,35 свидетельствует об ацидозе. При смещении рН выше 7,45 возникает алкалоз.
В зависимости от причин развития ацидоз и алкалоз делятся на метаболический (обменный) и респираторный (дыхательный).
Респираторный ацидоз развивается в результате накопления в крови большого количества углекислого газа, который соединяясь с водой, образует углекислоту. Это вызывает повышение кислотности крови. Данное состояние может развиваться при нарушениях дыхания, которые вызывают снижение легочной вентиляции.
Это может быть следствием заболеваний легких (например, при бронхиальной астме), поражений нервной системы (например, при травмах головного мозга), заболеваниях, мышц и нервов, которые приводят к потере способности совершать эффективные дыхательные движения (например, при боковом амиотрофическом склерозе).
Противоположным состоянием является респираторный алкалоз, который возникает при избыточном выведении легкими углекислого газа из организма. В основе механизма развития данного вида алкалоза лежит увеличение ритма и глубины дыхания.
Такое нарушение дыхания может возникать при наличии патологии со стороны различных органов и систем (например, при травмах, опухолях головного мозга, заболеваниях легких, сердечно – сосудистой недостаточности).
Метаболический ацидоз может развиваться по следующим причинам:
При этом организм начинает вырабатывать энергию не из глюкозы, а из жиров – альтернативный путь получения энергии. Расщепление жиров в печени сопровождается образованием больших количеств кетоновых кислот, что приводит к возникновению ацидоза.
Основными причинами метаболического алкалоза являются следующие:
Таким образом, развитие ацидоза или алкалоза часто связано с протеканием патологических процессов, при которых возникающие изменения кислотно-щелочного равновесия превышают компенсационные возможности организма. При этом важную роль в лечении занимает нормализация состояния пациента по основному заболеванию, вызвавшему отклонение рН крови.
Кто в группе риска?
К группе риска развития нарушений кислотно-щелочного баланса крови относятся:
Важную роль в диагностике имеют лабораторные методы исследования, которые позволяют установить уровень рН крови, ее газовый состав, параметры водно-электролитного обмена и другие жизненно важные показатели, мониторинг и коррекция которых необходимы при данных состояниях.
В зависимости от конкретной клинической ситуации может потребоваться проведение других лабораторных анализов для выявления причин ацидоза или алкалоза (например, определение уровня кетоновых тел в крови и в моче, концентрации лактата в крови и других).
высокоинформативные изображения внутренних органов. Это имеет большое значение для выявления заболевания, ставшего причиной возникновения ацидоза или алкалоза (например, нарушение дыхания, возникшие вследствие кровоизлияния в мозг).
Лечение расстройств кислотно-щелочного баланса в крови направлено на терапию основного заболевания, которое привело к развитию ацидоза или алкалоза. Для нормализации уровня рН может проводиться внутривенное введение растворов, нейтрализующих кислоты (при ацидозе) или щелочи (при алкалозе).
Лечение респираторного ацидоза направлено на восстановление ритма и глубины дыхания с возможным переводом пациента на искусственную вентиляцию легких (дыхание с помощью специального аппарата в случаях неэффективности деятельности легких).
При респираторном алкалозе может быть использовано вдыхание воздушных смесей, содержащих углекислый газ.
Специфической профилактики изменений кислотно-щелочного баланса в крови не существует. Пациентам, страдающим заболеваниями, которые могут вызывать изменение рН крови (например, сахарным диабетом) следует строго соблюдать рекомендации лечащего врача, регулярно проходить обследования и лечение.
Рекомендуемые анализы
Буферные системы крови. Кислотно-основное состояние организма.
1. А) Буферная система –протолитическая равновесная система, способная поддерживать постоянное значение рН при разбавлении или добавлении небольшого количества кислоты или щелочи.
Буферный раствор – раствор, содержащий буферную систему.
Б) Буферные системы делятся на кислотные и основные.
Кислотныебуферные системы содержать слабую кислоту и соль это кислоты (напр. Ацетатная – CH3COO-/CH3COOH, гидрокарбонатная HCO3-/H2CO3, гидрофосфатная – HPO4/H2PO4)
Основные БСсодержат слабое основание и соль этого основания (н-р: аммиачная – NH3*H2O/NH4+)
Главное значение гидрокарбонатного буфера заключается в нейтрализации кислот
Нейтрализует кислоты и основания, продукты обмена выводятся через почки
Поддерживает величину pH в физиологических средах с pH 6
Оксигемоглобиновая БС: HbO2-/HHbO2
Имеют большое значение в процессах дыхания, транспорта кислорода в ткани и поддержании постоянства pH в эритроцитах
Действует при pH 6
При добавлении кислоты:
+H3N-CH2-COO- + H+ = +H3N-CH2-COOH
При добавлении щелочи:
+H3N-CH2-COOH + OH- = +H3N-CH2-COO- + H2O
3. А) Гидрокарбонатная БС: HCO3-/H2CO3
Ka – константа диссоциации
[H+] = Ka * [H2CO3] /[ HCO3-]
pH = pKa + lg [HCO3-]/ [H2CO3]
pH = pKa + lg [акцептор протона]/ [донор протона] – уравнение Гендерсона-Гассельбаха
Б) pH буферного раствора зависит от:
· Соотношения концентраций компонентов
4. А) Буферной емкостью (В) –называют число моль-эквивалнетов сильной кислоты или щелочи, которые нужно добавить к 1л буферного раствора, чтобы изменить значение pH на единицу:
Буферная емкость зависит от:
· Абсолютной концентрации компонентов, а следовательно от разбавления
· От pH буферного раствора
Б) Способность буферного раствора сохранять значение рН по мере прибавления сильной кислоты или щелочи приблизительно на постоянном уровне далеко не беспредельна и ограничена величиной буферной емкости.
Плазма крови (рН =7,4), буферная емкость (в %)
Таким образом, 44%) общей буферной емкости приходится на плазму крови.
Эритроцит (рН =7,25), буферная емкость в %
Буферная емкость гемоглобиновой системы 35%
Буферная емкость гидрокарбонатной системы 18%)
Буферная емкость фосфатной системы 3%
Таким образом, 56% общей буферной ёмкости.
В) Зона буферного действия – это отрезок на шкале pH, в пределах которого функционирует данная БС.
Любая БС эффективно функционирует если соблюдается следующее соотношение:
• Гемоглобиновая БС: Hb-/HHb
Оксигемоглобиновая БС: HbO2-/HHbO2
Имеют большое значение в процессах дыхания, транспорта кислорода в ткани и поддержании постоянства pH в эритроцитах
6. Гидрокарбонатная БС: HCO3-/H2CO3
В клетке: KHCO3/ H2CO3
В плазме крови и межклеточной жидкости: NaHCO3/H2CO3
При увеличении концентрации ионов Н:
H+ + HCO3- ↔ H2CO3 ↔ CO2↑ + H2O
CO2↑ выводится через легкие
При поступлении в кровь оснований:
OH- + H2CO3 ↔ HCO3- + H2O
Уравнение расчета pH:
pH = 6,11 + lg [HCO3-]/ spCO2
pCO2 – парциальное давление
s – коэффициент Генри, учитывает растворимость газов в жидкости
В клетке: K2HPO4/KH2PO4
В плазме крови и межклеточной жидкости: Na2HPO4/ NaH2PO4
В результате переработки мясной пищи (при увеличении концентрации ионов Н):
H2PO4- выводится через почки, рН мочи уменьшается
При употреблении растительной пищи (увеличении ионов ОН-):
OH- + H2PO4- ↔ HPO4 2- + H2O
HPO4 2- выводится через почки, рН мочи повышается
Фосфатная БС нейтрализует кислоты и основания, продукты обмена выводятся через почки
Уравнение расчета рН:
pH = 6,8 + lg [HPO4 2-]/ [H2PO4-]
8. Оксигемоглобиновая БС:
В клетке: КHbO2/HHbO2
Действует в эритроцитах, при рН = 7,42 – 7,46
При увеличении концентрации ионов Н+:
H+ + HbO2- → HHbO2 ↔ HHb + O2
O2 из эритроцитов в ткани организма
При увеличении концентрации ионов OH-:
OH- + HHbO2 → H2O + HbO2-
Имеет большое значение в процессах дыхания, транспорта кислорода в ткани и поддержании постоянства pH в эритроцитах
9. А) Гемоглобинова БС:
По мере перемещения крови в периферические отделы происходит отдача кислорода ионизированной формой оксигемоглобином:
Кровь из артериальной становится венозной.
Избыток протонов, образующийся при действии гидрокарбонатной БС в эритроцитах, связывается с гемоглобинат-ионами в слабую кислоту:
При увеличении к крови ионов OH-:
Б) Состояния, характеризующиеся отклонением значения рН крови от нормы, называют ацидемией(уменьшение рН) и алкалиемией(увеличение рН).
В) Большинство буферных систем организма имеет буферную емкость по кислоте больше, чем по основанию, т.к. в результате метаболизма в организме человека образуется больше кислотных продуктов, чем основных, поэтому для нейтрализации кислот БС организма должны обладать большой буферной емкостью по кислоте.
10. Щелочной резерв крови – число мл CO2, содержащееся в 100мл крови (главным образом в виде ионов HCO3-). Норма – 50-70% по объему или 25-30 ммоль/л
В патологии, при ацидозе (уменьшение pH крови) щелочной резерв уменьшается (потеря HCO3-), при алкалозе (увеличение рН крови) щелочной резерв увеличивается (накопление HCO3-).
Вследствие рвоты и диареи у больного произошло падение рН крови до 7, 59 из-за потери H+, что характерно для метаболического алкалоза.
11. Ацидоз – уменьшение кислотной буферной емкости физиологической системы по сравнению с нормой.
Различают компенсированный и некомпенсированный, метаболический и респираторный ацидоз. При компенсированном ацидозе, несмотря на отклонение от нормы, рН крови сохраняет значение в пределах 7,35
Буферные системы крови
Циркулирующая кровь представляет собой взвесь живых клеток в жидкой среде, химические свойства которой очень важны для их жизнедеятельности. У человека за норму принят диапазон колебаний pH крови 7,37-7,44 со средней величиной 7,4. Буферные системы крови слагаются из буферных систем плазмы и клеток крови и представлены [1] :
Содержание
Бикарбонатная буферная система
Фосфатная буферная система
В крови емкость фосфатной буферной системы невелика (составляет не более 1% общей буферной емкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче.
Буфер образован неорганическими фосфатами. Роль кислоты в этой системе выполняет одноосновный фосфат (NaH2PО4). А роль сопряженного основания — двухосновный фосфат (Na2HPО4).
При рН = 7,4 соотношение [Н2РО4-/ НРО42-] равняется 1:4.
Буферные свойства системы при увеличении в крови содержания водородных ионов реализуются за счет их связывания с ионами НРО42- с образованием Н2РО4- (Н+ + НРО42- → Н2РО4-), а при избытке ионов ОН- — за счет связывания их с ионами Н2Р04- (ОН- + Н2РО4- → НРО4-2 + Н2О).
Фосфатная буферная система крови тесно взаимосвязана с бикарбонатной буферной системой.
Белковая буферная система
В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия.
Гемоглобиновая буферная система
Самая мощная буферная система крови (в 9 раз мощнее бикарбонатной), на долю которой приходится 75 % всей буферной ёмкости крови. [H+]=K*[HHbO2]/[KHb]
Механизм действия гемоглобинового буфера 1. [общий механизм] Hb- + H+ = HHb HHbO2 + OH- = H2O + HbO2- 2. Гемоглобин является белком, он амфотерен
Протеин протеин протеин H2CO3 > HHb
См. также
Примечания
Литература
Использованная литература
Ссылки
Полезное
Смотреть что такое «Буферные системы крови» в других словарях:
Буферные системы — буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним … Большая советская энциклопедия
БУФЕРНЫЕ СВОЙСТВА — БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции (см.) раствора, к рое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным… … Большая медицинская энциклопедия
БУФЕРНЫЕ РАСТВОРЫ — буферные системы, р ры, поддерживающие постоянный водородный показатель (рН) среды при разбавлении, концентрировании или добавлении к т или щелочей (не превышая нек рого предела). Примеры Б. р.: р р уксусной к ты и её натриевой соли, р р борной к … Большой энциклопедический политехнический словарь
Газы крови — газы, содержащиеся в крови животных и человека в растворённом состоянии и в химически связанном виде. Полное исследование Г. к. человека было впервые проведено И. М. Сеченовым (1859). Г. к. состоят из газов, поступающих из окружающей… … Большая советская энциклопедия
Группа крови — У этого термина существуют и другие значения, см. Группа крови (значения). Нашивка над левым нагрудным карманом на форме военнослужащего РФ содержит информацию о группе крови и резус факторе бойца (на снимке во … Википедия
Общий анализ крови — Клетки крови под электронным микроскопом. Клинический анализ крови анализ, позволяющий оценить содержание гемоглобина в системе красной крови, количество эритроцитов, цветовой показатель, количество лейкоцитов, тромбоцитов. Клинический анализ… … Википедия
Плазма крови — (от греч. πλάσμα нечто сформированное, образованное) жидкая часть крови, в которой взвешены форменные элементы вторая часть крови. Процентное содержание плазмы в крови составляет 52 61 %. Макроскопически представляет собой… … Википедия
Компоненты крови — составляющие цельной крови, используемые в медицинских учреждениях. В современной службе крови цельная кровь практически не используется, так как ее переливание плохо соответствует принципам этиотропной терапии, дает слишком большое число… … Википедия
Заболевания крови — большая и разнородная группа заболеваний, сопровождающихся тем или иным нарушением функций или строения тех или иных клеток крови эритроцитов, лейкоцитов или тромбоцитов, или патологическим изменением их числа повышением либо снижением, или… … Википедия
Кислородная емкость крови — Кислородная емкость крови количество кислорода, которое может быть связано кровью при её полном насыщении; выражается в объёмных процентах (об%); зависит от концентрации в крови гемоглобина. Определение Кислородной емкости крови важно для… … Википедия
Буферные растворы в организме человека
Буферные растворы − это растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания.
Протолитические буферные растворы представляют собой смеси электролитов, содержащие одноимённые ионы.
Существует два типа протолитических буферных растворов:
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:
С – молярная или эквивалентная концентрация электролита (C = V N)
Механизм действия буферных растворов можно рассмотреть на примере ацетатного буфера: СН3СООН + СН3СООNa [1].
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
Из уравнения видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н + в буфере увеличивается, но очень незначительно, при этом рН сохраняется постоянным.
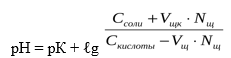
При добавлении кислоты к буферу рН определяется по формуле:
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В. Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н + практически не изменяется, и рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
Таким образом, рН буфера зависит от константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. Стоит отметить, что рН буфера будет наибольшим при соотношении компонентов равным единице [2].
Буферная ёмкость − это способность буферной системы противодействовать изменению рН среды.
Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
где В – буферная ёмкость, nЭ– количество моль-эквивалента сильной кислоты или щелочи, рНН – начальное значение рН ( до добавления кислоты или щелочи), рНК– конечное значение рН (после добавления кислоты или щелочи), ΔрН – изменение рН.
На практике буферная ёмкость рассчитывается по формуле:
где V – объём кислоты или щелочи, N – эквивалентная концентрация кислоты или щелочи, Vбуф.— объём буферного раствора, Δ рН – изменение рН.
Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице [3].
В организме человека действуют следующие буферные системы:
Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие. Взаимодействие буферных систем в организме по стадиям:
который нейтрализуется гидрофофат-ионами и аммиаком (аммиачный буфер):
Следует отметить, что на поддержание постоянства рН различных жидких систем организма оказывают влияние не столько буферные системы, сколько функционирование ряда органов и систем: легких, почек, кишечника, кожи и др. [5].
2. Бончев П. Р. Введение в аналитическую химию. Л.: Химия, 1978.-
4. Крешков А.Н. «Основы аналитической химии» 1-2 том. М.:Химия, 1965.-285 с.
5. Лурье Ю. Ю. Справочник по аналитической химии. М.:Химия, 1989.- 297 с.
6. Янсон Э. Ю., Путнинь Я. К. Теоретические основы аналитической химии. М.: Высшая школа, 1980.