Почему болевых рецепторов в 10 раз больше на пальцах чем на ладонях
Что делать, если болит запястье?
Запястье может болеть в любом возрасте по множеству причин: от артрита до туннельного синдрома. Рассказываем, как правильно определить причину справиться с этой болью.
Дискомфорт в запястье — распространённая жалоба всех возрастов. Он возникает не только из-за болезни суставов: куда чаще запястье болит у тех, кто по работе много пишет или сидит за компьютером. Как правильно определить, из-за чего возникла боль, и как с ней справиться?
Возможные причины боли в запястье
От травм запястья никто не застрахован: зимой можно поскользнуться и приземлиться на руку, спортсмены получают вывихи и переломы запястья на тренировках, а в быту можно сильно ушибить руку даже дома. Основные травмы, от которых возникает боль в руке, это:
Часто растяжения приходят вместе с вывихами — травмированные связки не могут нормально удерживать сустав.
Здоровое запястье болит от спазмов мышц, если рука постоянно напряжена в неудобной позе. Например, если человек целый день держит в руке ручку для письма и компьютерную мышь. Если игнорировать проблему, может развиться «туннельный синдром» — защемление срединного нерва. Это более серьёзная патология, требующая медицинского вмешательства.
Ещё одна причина боли в запястье — заболевания суставов, сухожилий, хрящей и костей. Они могут быть разной природы, затрагивать все суставы и хрящи организма, или наблюдаться только в одном-двух местах. Наиболее распространены:
У заболевания есть множество других симптомов: боль в теле, слабость, повышение температуры, онемение и потеря чувствительности. Поэтому их сложно перепутать с травмами или усталостью мышц.
Как отличить причину боли по симптомам
Боль в запястье может быть резкой или ноющей, проявляться при движении или чувствоваться постоянно. Характер боли, наличие покраснения, повышение температуры и общее самочувствие — хорошие указатели на причину недуга. Окончательный диагноз вам назовёт врач, но самостоятельно вы сможете определить, к кому идти: к неврологу, хирургу или травматологу.
Диагностика заболеваний запястья
Посещения врача требуют все ситуации, кроме мышечных спазмов. В зависимости от симптомов и показаний, вам могут назначить самые разнообразные обследования:
Благодаря этим исследованиям можно будет точно выяснить причину боли, уровень повреждения костей и мягких тканей, наличие заражения или некроза. Если при первом осмотре доктор не сможет сразу определить причину боли, то он назначит и рентген, и анализы крови. А по первым результатам уже будет понятно, как продолжать осмотр и начать лечение.
Что может помочь, когда болит запястье
Самое главное: обеспечьте покой и отсутствие движения больной конечности. Снять первые приступы помогают холодные компрессы. При сильной боли можно принять анальгетик (какой именно принимать — узнайте у лечащего врача).
При травме следует зафиксировать запястье повязкой или гипсом и обеспечить его полный покой на долгое время. Если запястье ноет из-за старого неправильно сросшегося повреждения, то травматолог назначит вам подходящее лечение.
В остальных случаях доктор пропишет вам лекарства, ориентируясь на заболевание. Это могут быть хондропротекторы, противовоспалительные средства, препараты для снятия отёков. Не занимайтесь самолечением, если не знаете диагноз — можно ошибиться с выбранными лекарствами и усугубить проблему.
Ну а если дискомфорт вызван усталостью мышц и неудобной позой — просто разомните и помассируйте руки, сделайте перерыв в работе. Боль пройдёт через пять-десять минут, и к вам вновь вернётся отличное самочувствие.
Механизмы ощущения боли
Все люди рано или поздно сталкиваются с болью, но мало кто знает где и как формируется болевое ощущение.
В данной статье нам хотелось бы приоткрыть завесу тайны механизмов передачи боли.
Как мы чувствуем боль? Давайте на минутку представим себе, что кто-то, конечно же, не Вы, порезал палец острым кухонным ножом. По какому же пути необходимо пройти болевому импульсу от поврежденного пальца, чтобы достигнуть головного мозга, где в конечном итоге и формируется ощущение боли?
Болевые рецепторы, находящиеся в коже в результате травмы активируются, благодаря выходу из поврежденных клеток различных химических веществ, таких как гистамин, субстанцию Р, серотонин (5HT), брадикинин и простагландины.
Болевые импульсы, генерируемые этими рецепторами, передаются затем по чувствительным спинномозговым (сенсорным) нервам, клеточные тела которых сгруппированы в небольшое образование, именуемое спинномозговым ганглием (узлом).
Поступившие в спинной мозг болевые импульсы обрабатываются в заднем роге, после чего ответно формируются импульсы, летящие через двигательные нервы к мышцам руки, приводя к её быстрому отдергиванию от повреждающего агента, в данном случае лезвия ножа. Такую основу имеет под собой безусловный (автоматический) рефлекс, не требующий участия головного мозга, или сознательной деятельности.
В зависимости от функционального состояния заднего рога спинного мозга (см. о воротной теории боли и феномене сенситизации заднего рога ниже), болевые сигналы вместе с тем направляются вверх по спино-таламическому пути спинного мозга к специфической структуре головного мозга, называемой таламус.
В дальнейшем, таламус, обработав посупившие к нему импульсы, отправляет специфические сигналы в центры, контролирующие кровяное давление, пульс, дыхание и эмоции. Вот почему в случае остро возникшей боли происходит учащение сердцебиения и дыхания, повышается кровяное давление, а также происходят знакомые всем нам эмоциональные и поведенческие изменения: появляется болезненная гримаса, человек дует на поврежденный палец или быстро трясет им в воздухе.
Между тем, болевые импульсы не останавливаются в таламусе, а передаются дальше в первичную сенсорную кору – специфическую область полушарий головного мозга, где происходит конечная обработка полученных сигналов.
Принято считать, что в таламусе все же происходит частичное восприятие поступающих болевых импульсов, однако их наиболее тонкая дискриминация (распознавание), происходит в первичной сенсорной коре полушарий головного мозга.
Воротная теория боли
Почему, получив то или иное повреждение мы незамедлительно потираем травмированный участок?
Потирание поврежденного участка приводит к возбуждению тактильных рецепторов (реагирующих на прикосновение) кожи, которые активируются и начинают посылать импульсы в задний рог спинного мозга через А-бета волокна. Эти сигналы, поступив в спинной мозг, блокируют проведение болевых импульсов, поступающих по С-волокнам, то есть закрывают ворота на боль.
На механизме блокирования ворот на боль основаны многие методы лечения, такие как иглоукалывание – стимулирут А-дельта волокна, а также ряд физиопроцедур (чрезкожная нейростимуляция, электромышечная стимуляция и т.д.). Ниже хотелось бы рассмотреть еще один, обратный воротному механизму феномен – сенситизацию заднего рога.
Феномен сенситизации заднего рога
В течение часа после травмы, происходят специфические изменения в заднем роге спинного мозга, получившие название феномена сенситизации, основной смысл которого заключается в том, что все поступающие в спинной мозг стимулы более легко проводятся по спинному мозгу в головной, а не блокируются на уровне заднего рога, препятствуя тем самым информационной перегрузке головного мозга.
Сенситизация обусловлена активацией Н-метил-Д-аспартам (NMDA) рецепторов. На блокаде этих рецепторов основан обезболивающий эффект ряда лекарственных препаратов.
Клинически сенситизация проявляется снижением порога восприятия как болевой, так и любой другой, будь то температурной, тактильной, вибрационной чувствительности в той области, за которую ответственен сенситизированный задний рог.
Порог болевой чувствительности изменяется по двум направлениям:
Стимулы, которые ранее расценивались как безболезненные, воспринимаются как боль;
Самые незначительные болевые импульсы воспринимаются как интенсивная боль.
Исходя из выше сказанного, методами лечения хронических болевых синдромов являются:
Почему мы чувствуем боль по-разному?
Так больно? А сейчас?
Принцессы на горошине
Выученная боль
Группа немецких учёных провела любопытный эксперимент. Испытуемых усаживали за руль автомобиля, а затем, используя разные интерактивные техники, создавали иллюзию столкновения с другой машиной. Ощущения были настолько реалистичными, что спустя месяц после этого случая 10% участников жаловались на дискомфорт в области шеи, который связывали с аварией.
Боль «в возрасте»
Память боли
Гвоздь между пальцами
«Управление болью». Как это происходит
Алан Гордон (далее А. Г.): У вас постоянно болит шея?
Пациентка (П.): Нет, на самом деле нет.
А. Г.: Это очень важный момент. Если бы было что-то не в порядке
с вашей шеей, она бы болела постоянно. Как болит сломанная нога, например.
П.: Ясно.
А. Г.: Понимая это, ответьте, пожалуйста, как вы думаете, у вас что-то не так с шеей или с «нейронной сетью», которая создаёт ощущение боли.
П.: Наверное, с сетью. Но мне от этого не легче.
А. Г.: Я понимаю. А теперь я хочу, чтобы вы поменяли своё отношение к боли. Когда вы в следующий раз повернёте голову и почувствуете боль, скажите себе: это неопасно, моя шея здорова.
П.: Хорошо.
А. Г.: А теперь, пожалуйста, поверните аккуратно голову из стороны в сторону. Вам больно?
П.: Да.
А. Г.: Вы должны понять, что это не боль, это просто физическое ощущение. Вы чувствуете, как работают мышцы вашей шеи,
и мозг ошибочно воспринимает это нейтральное ощущение, как
источник боли и опасности. Эта «боль» совершенно безопасная.
Как вы чувствуете себя теперь?
П.: Намного лучше. Шея перестала болеть…
Терапия ума и тела
Мне не больно
У гипералгезии есть свой антипод – аналгезия, очень высокая толерантность к боли.
Встречаются, хоть и редко, случаи врождённой аналгезии, и это только на первый взгляд кажется благом. Ведь боль – в первую очередь сигнал о болезни, и неспособность воспринять этот сигнал может навредить организму. Патологически «толстокожие» люди страдают от множественных внутренних кровотечений, ожогов и переломов и не замечают заболеваний, которые сопровождаются очень слабыми болевыми ощущениями – например, «тихий» инфаркт.
Учёные установили, что врождённая нечувствительность к боли связана с мутацией в гене SCN11A. Этот ген кодирует ионные каналы в рецепторах, передающих болевые ощущения из периферической нервной системы в центральную.
Известен ещё один пример генетически обусловленной аналгезии (GCH1), когда дискомфорт в теле все-таки ощущается, но в значительно меньшей степени, чем «обычными» людьми.
Он был открыт учёными из Гарварда во время обследования послеоперационных пациентов: 15% из них отличались повышенной толерантностью к боли. В контрольной группе здоровых испытуемых также были обнаружены счастливые носители этого гена.
Сейчас уже открыты десятки других кандидатов, претендующих на гордое звание «ген боли». Возможно, одним из них обладаете и вы… Но даже если вам не так повезло с генетикой, можно попытаться уменьшить свою болевую чувствительность. Для этого существует несколько реальных способов.
Боль – это коктейль из физиологических реакций, приправленный эмоциями, личным опытом и настоянный на культурных традициях общества. Одни его выпивают с лёгкостью, другие страдают от тяжёлого похмелья.
Но, как всем нам хорошо известно, NO PAIN NO GAME – «без боли нет достижений».
Способность правильно воспринимать сигнал «SOS», который посылает наш организм, – прямой путь к здоровью и долголетию.
Как повысить толерантность к боли?
1. Прежде всего поменять отношение к боли – сосредоточиться не на самих ощущениях, а на том, что за ними стоит. Например: боль в мышцах после тренировки свидетельствует о некоторых микроповреждениях мышечных волокон. Боль в первый день менструации связана с повышенной выработкой простагландинов, заставляющих матку сокращаться. Эти и многие другие виды боли естественны,
и не нужно этого бояться!
2. Вести здоровый образ жизни и регулярно заниматься спортом. Это особенно важно. Исследователи из Университета Флориды обнаружили, что после физических упражнений у людей повышаются болевые пороги.
3. Научиться отвлекаться. Подойдут любые методы релаксации, дыхательные техники, медитация. Все они нацелены на улучшение механизмов саморегуляции физиологических функций.
Молекулярная биология боли
Они знают, что такое боль.
Автор
Редакторы
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Какая бывает боль?
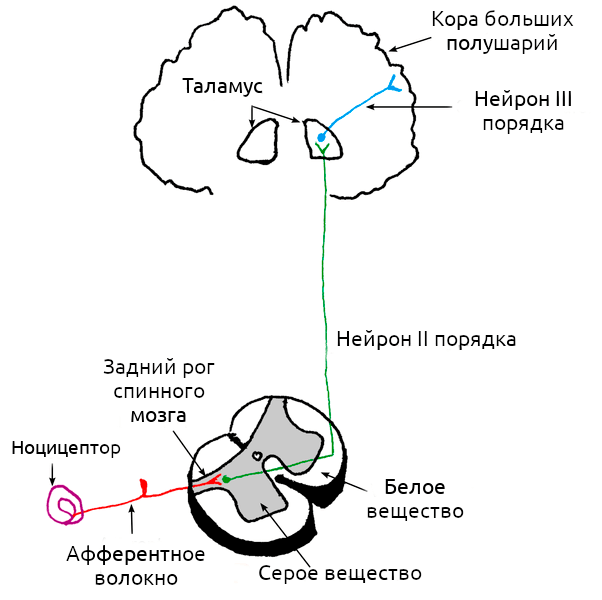
Ни для кого не секрет, что за ощущение боли отвечает нервная система. В общем виде работу этой системы можно представить так: рецепторы улавливают внешний сигнал и преобразуют его в нервный импульс (трансдукция), передают информацию по нерву (кондукция), а далее она обрабатывается в спинном мозге и «отсылается» в головной мозг (проекция) для генерации болезненных ощущений (восприятие) (рис. 1). Почти все помнят, что боль — это реакция на внешний раздражитель, но на самом деле это не всегда так: она может возникать и при поломке самой нервной системы.
Рисунок 1. Схема работы болевого импульса. В простейшем пути передачи сигнала участвуют три группы нейронов, чьи волокна обозначены на схеме разными цветами. За трансдукцию боли отвечает ноцицептор (обозначен на схеме фиолетовым), трансдукция происходит по нервным волокнам, обозначенным красным цветом, в спинном мозге происходит проекция боли на «зеленый» участок схемы, восприятие же боли начинается тогда, когда нейроны третьего порядка передадут нервный импульс от таламуса к коре больших полушарий.
Стоит отметить, что эволюционно боль появилась в качестве полезной адаптации, и на самом деле, до сих пор продолжает играть важную роль в нашей жизни. Задумайтесь, какой бы была жизнь без боли — мы не могли бы отдергивать руку, касаясь горячей поверхности, не замечали бы наносимых ран, а уж как осложнилась бы жизнь врачей, ставящих диагноз — сложно представить. Однако это не вся польза, которую приносит нам наша система восприятия боли. Рука об руку с ощущением боли идут ощущения давления, холода и тепла (то есть осязание) — и возможность организма в ответ на стимул из внешней среды изменить свои параметры. Существует ряд болезней (в основном генетически обусловленных), при которых восприятие боли нарушается. Их тяжесть варьирует в зависимости от того, какой именно рецептор или канал «поломан». Самые тяжелые формы (например, наследственная сенсорно-вегетативная невропатия IV типа) характеризуются полной потерей болевой чувствительности в конечностях и нарушением способности организма регулировать температуру тела. Но обо всем по порядку.
Классификация боли, предложенная Клиффордом Вульфом [1], включает в себя четыре типа: ноцицептивная, воспалительная, невропатическая и функциональная. Кроме того, стоит отметить и психогенную боль.
Поскольку мы решили остановиться на «нормальной» ноцицептивной боли, давайте разберемся поподробнее с каждым из этапов ее появления.
Эпизод I: Пойманная угроза
Чтобы определить любой сигнал, наш организм использует внушительный арсенал белков-рецепторов. Их задача заключается в том, что они реагируют на строго определенный внешний фактор и передают сигнал об этом связывании при помощи конформационных изменений [2], влекущих за собой и изменение биохимических свойств этого рецептора. Переданные от рецептора сигналы усиливаются каскадом белковых взаимодействий в клетке, могут передаваться с помощью нервной или эндокринной систем и, в конечном итоге, приводят к физиологическому ответу.
Нейроны, работающие в ноцицептивной системе, различаются по набору рецепторов. Среди этих нейронов выделяются четыре группы: несущие рецепторы температуры, химического воздействия, механического воздействия и полимодальные (с рецепторами всех раздражителей).
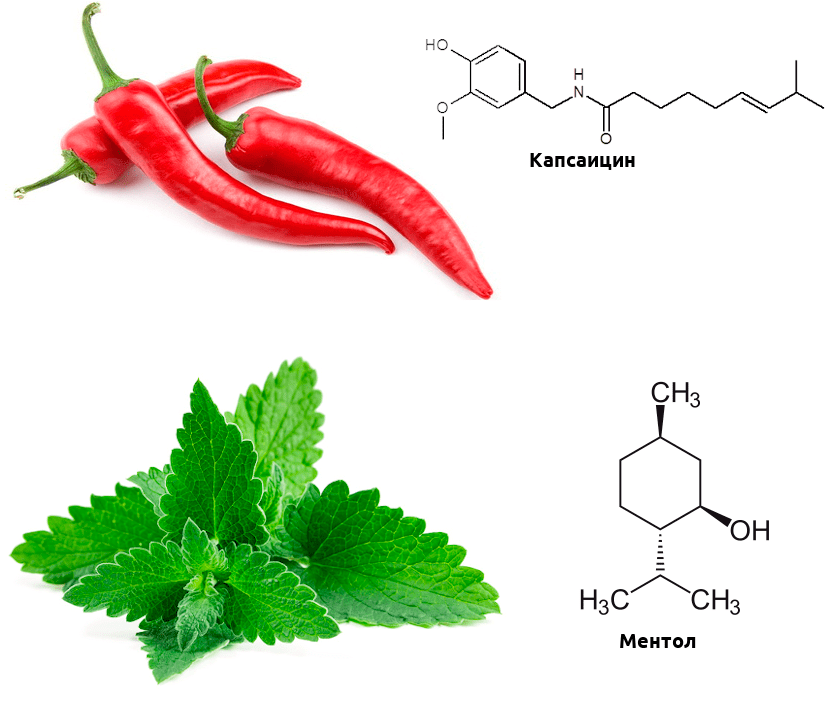
Одни из важнейших рецепторов, реагирующих на тепло, — белки группы TRP. Это ионные каналы, неспецифичные к катиону, — при открытии они пропускают в клетку натрий, магний и кальций, в результате чего в клетке возникает потенциал действия, необходимый для передачи нервного импульса. Этих доблестных воинов термочувствительности несколько: TRPV1–TRPV4 и TRPM8. Первые активируются при повышенной температуре, второй же реагирует на холод. Эти каналы обладают интересной особенностью — помимо температуры, они могут активироваться химическими стимулами.
Биохимические механизмы этой активации отличаются от температурной, но в мозге возникают в ответ на эти химические стимулы практически те же ощущения, что и на изменение температуры. А теперь вспомните, какие продукты питания вызывают ощущение обжигания, а какие — холода? Думаю, почти каждый читатель сталкивался с этими продуктами. Острота перца чили обусловлена тем, что содержащийся в нем капсаицин активирует рецептор TRPV1 (такие вещества называются агонистами) [3]. А ментол, содержащийся в мяте, — агонист TRPM8, и вызывает чувство прохлады (рис. 2) [4].
Рисунок 2. Связывание рецепторами TRP капсаицина и ментола приводит к активации «температурной» ноцицепции. Интересно, что при определенных условиях капсаицин может не только вызывать боль, но и ослаблять ее — он десенсибилизирует (то есть делает менее чувствительными к стимулам) другие каналы семейства TRP, кроме того, провоцирует выброс эндорфинов, а вкупе с другими лекарственными средствами может оказаться. перспективным обезболивающим.
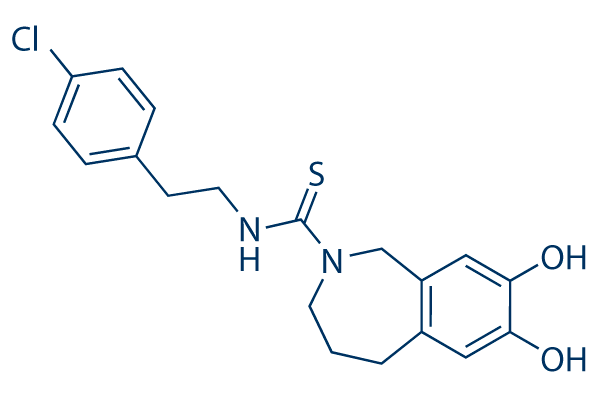
Но если можно с помощью небольших молекул заставить нас чувствовать эффект ноцицепции, то, может, с помощью других молекул можно этот рецептор заблокировать? Да! Разработка антагонистов TRPV1 [3], которые, блокируя рецептор, могут снижать болевые ощущения, например, от капсаицина, ведется с 1990-х годов, однако большинство препаратов пока не достигли рынка (рис. 3). Интересно, что эти препараты предлагается применять для лечения невропатической боли, то есть той, когда рецепторы активируются без внешней причины. Достигнут ли фармкомпании успеха — покажет время.
Рисунок 3. Один из первых разработанных антагонистов TPRV1 — капсазепин. Этот препарат находится сейчас на стадии клинических испытаний. Вообще, успех подобного рода лекарств может стать новой вехой в истории фармакологии анальгетиков — блокирование ноцицепторов вместо ослабления болевого импульса на более поздних стадиях.
Механоноцицепторы — куда более разнородная и многообразная группа рецепторов, чем терморецепторы. Среди них стоит отдельно выделить рецепторы, активируемые, помимо давления, сигнальным олигопептидом брадикинином. Его рецептор В-1 синтезируется в поврежденных клетках — например, при получении травмы. Связывая брадикинин, он активирует сигнальный каскад, приводящий к возникновению боли. Интересно, что в число прямых эффектов от связывания рецептора входит усиление воспаления — то есть поддержание стимула для дальнейшей активации болевых рецепторов: чем больше боли, тем больше боли. Поэтому частая активация В-1 (например, постоянным воспалением при аутоиммунных заболеваниях) может стать причиной развития хронической боли [5].
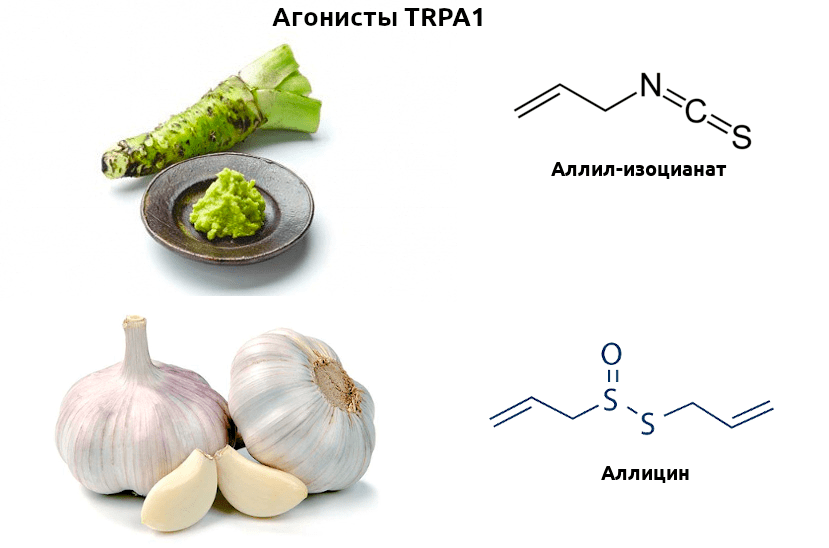
Рецепторы, воспринимающие различные химические раздражители (ирританты), тоже разнообразная, а местами малоизученная группа. Среди них особо примечателен член уже знакомого нам семейства TRP — TRPA1. Этот рецептор активируется совершенно разными молекулами, зачастую, вступая с ними в реакцию, что приводит к необратимости эффекта. В числе широко известных ирринантов, активирующих TRPA1, — аллилизоцианат, содержащийся в знаменитой японской приправе васаби, и аллицин, содержащийся в чесноке (рис. 4).
Рисунок 4. Вкус васаби сильно отличается от чесночного, однако за восприятие остроты этих приправ отвечает один рецептор — TRPA1. Серосодержащие летучие вещества этих растений способны активировать рецептор и дальнейшую ноцицептивную передачу. Эти агенты пригождаются ученым при изучении химических основ работы рецепторов.
Отдельно стоит упомянуть боль, возникающую при воспалении. Ключевое вещество, на которое реагируют ноцицепторы, — гистамин, который некоторые клетки нашей иммунной системы (например тучные) выбрасывают в кровь в ответ на стимулы к воспалению. Гистамин связывается со своими рецепторами (из семейства GPCR). Активация гистаминового рецептора 1 типа (H1) приводит к активации фосфолипазы С (PLC) и гидролизу фосфатидилинозитолбисфосфата (PIP2) с образованием инозитолтрифосфата (IP3), который затем запускает высвобождение Ca 2+ из эндоплазматической сети. Кальций, связавшись с кальмодулином, активирует протеинкиназу С, которая, при помощи дальнейшего фосфорилирования регуляторных киназ, подавляет экспрессию потенциал-зависимых калиевых каналов 7 типа (Kv1.7), что приводит к деполяризации мембраны и проведению болевого импульса [7]. Интересно, что гистаминовые рецепторы 3 типа, которые локализованы в ЦНС, могут ингибировать проведение определенных ноцицептивных импульсов [8].
Стоит отметить, что другие активные игроки воспалительного процесса — простагландины — действуют похоже: в результате связывания простагландина Е2 с рецептором PTGER2 активируется протеинкиназа А, которая, в свою очередь, увеличивает экспрессию уже знакомого нам TRPV1 [9].
Эпизод II: Атака нервных волокон | Кондукция
На примерах мы разобрались, как работают ноцицептивные рецепторы, но ведь они расположены «на переднем крае», близко к раздражителю, а приказ о болевых ощущениях отдается из мозга. Значит, необходимо донести сигнал до верховных инстанций. Для этого только что полученный потенциал действия рецептора активирует множество потенциал-управляемых ионных каналов. Натриевые и калиевые каналы необходимы для генерации потенциалов действия, которые передают ноцицепторные сигналы синапсам в дорсальном роге спинного мозга. Они — еще одна потенциальная терапевтическая мишень для новых групп анальгетиков. Кальциевые же каналы играют ключевую роль в высвобождении нейромедиаторов из центральных или периферических ноцицепторных синапсов, вызывая боль или воспаление соответственно.
В этом месте важно отметить, что нервные волокна, по которым ноцицепторный сигнал идет до спинного мозга, бывают трех типов — Aδ (а-дельта), Aβ (а-бета) и C. Эти волокна отличаются друг от друга по толщине, наличию или отсутствию «изолирующей» миелиновой оболочки и, как следствие, по скорости проведения нервного импульса и типу импульса, который по ним проводится.
Аδ-волокна проводят импульс быстро (10–30 м/с) и «специализируются» на сигналах о сильной механической боли и изменении температуры.
Aβ-волокна работают еще быстрее (30–100 м/с) и сильно миелинизированы. Механорецепторы, расположенные в этих волокнах, крайне чувствительны, поэтому функция этих волокон — проведение сигналов о слабых раздражителях. Избыточная активация волокон Aβ вызывает аллодинию — боль, возникающую от причин, обычно ее не вызывающих, — например, от сидения на стуле.
Волокна типа C проводят нервный импульс медленно (0,5–2 м/с); в основном это сигналы от высокочувствительных механорецепторов и хеморецепторов.
Волокна C и Aδ работают синергично, обеспечивая основную массу болевых ощущений.
Эпизод III: Месть эндорфинов
Сигнал о боли достиг нейронов задних рогов спинного мозга, и уже очень скоро будет жарко. Хотя постойте, может, можно что-нибудь сделать? Может, сигнал несет организму чрезмерные страдания, превышающие пользу? А может, наоборот, сигнал недостаточен для осознания всей беды? В спинном мозге происходит модуляция ноцицептивного сигнала. Это поле для нейрохимической битвы двух сил — тормозящей и усиливающей.
По своей природе опиоидные рецепторы тоже являются GPCR, однако — ингибиторными. Будучи активированными, они подавляют работу аденилатциклазы, снижают уровень внутриклеточного цАМФ и, через киназных посредников активируют работу калиевых каналов, которая приводит к реполяризации клеточной мембраны. В конечном итоге эти меры замедляют проведение нервного импульса.
Кроме описанной системы, в ослаблении боли принимают участие всем известные тормозные нейромедиаторы — гамма-аминомаслянная кислота (ГАМК) [11] и глицин [12]; а опосредованно — многие другие сигнальные молекулы.
Помимо «голубей», тормозящих проведение импульса, есть в спинном мозге и «ястребы», его усиливающие. Самый известный из них — глутамат [13]. В случае проведения ноцицептивного импульса, работа глутамата осуществляется через рецепторы NMDA и AMPA.
Глутамат действует хитро: связываясь с рецепторами АMPA, он вызывает в нейроне активацию уже знакомой нам протеинкиназы С, которая, в свою очередь, приводит к возрастанию уровня внутриклеточного кальция и поляризации мембраны. Помимо того, что это ускоряет проведение болевого импульса, это влияет на NMDA-рецепторы. В норме потенциал-зависимый канал закрыт магниевой «пробкой» и не открывается даже при связанном глутамате. Когда мембрана деполяризируется, магниевая пробка вылетает, и NMDA-рецептор запускает внутрь клетки катионы натрия и кальция, а наружу — калия, что способствует дальнейшей деполяризации мембраны. Самый известный антагонист NDMA-рецепторов — кетамин. Он нашел обширное применение в качестве операционного анестетика, но в последние годы из-за многочисленных нежелательных эффектов (в том числе наркотических), его применяют все реже. В ветеринарной же медицине кетамин, напротив, один из самых широко применяемых анестетиков.
То, в каком виде сигнал дойдет до головного мозга, определяется балансом между противоборствующими сторонами и силой изначального сигнала.
Часть IV: Новая проекция
В сером веществе спинного мозга различают 10 слоев (пластин Рекседа), каждый из которых отличается от других функционалом входящих в его состав нейронов, и, как следствие, — выполняемыми функциями. Чтобы нервный импульс попал на кору больших полушарий, сначала он должен пройти по восходящим путям этих пластин.
Синапс волокон Aδ и C со вторичными афферентными нейронами находится в дорсальном роге спинного мозга. Волокна Aδ и C передают информацию ноцицептивно-специфическим нейронам в I и II пластинах. Кроме того, импульс проецируется и на нейроны других пластин. Это нужно для того, чтобы впоследствии задействовать вторичные системы реакции мозга на боль (благодаря этому боль запоминается).
После того, как импульс проходит модуляцию в задних рогах, он передается нейронам восходящих трактов спинного мозга, каждый из которых имеет определенную функцию в распознавании боли.
Наиболее важны среди них спиноталамический тракт, участвующий в узнавании боли, спинопарабрахиальный тракт, участвующий в вегетативной и мотивационной регуляции реакции на боль, и спиномезенцефалический тракт, участвующий в активации нисходящих анальгетических путей, о действии которых мы говорили раньше.
Часть V: Головной мозг наносит ответный удар
Обработка информации о боли в головном мозге — самая разнообразная и индивидуальная для каждого человека часть работы ноцицепторной системы.
Сначала таламус и парабрахиальное ядро получают информацию от проекционных нейронов в различных пластинах, а затем передают эту сенсорную информацию в корковые и миндалевидные области, где информация расшифровывается как «болезненный стимул».
Стоит отметить, что у боли есть два разных компонента, за восприятие которых отвечают разные области мозга. Сенсорно-дискриминационные аспекты включают силу боли и ее локализацию, в то время как аффективно-эмоциональный компонент боли включает неприятный характер восприятия.
Для того чтобы мозг правильно локализовал источник боли, нервный импульс затем обрабатывается соматосенсорной корой.
Аффективно-мотивационный аспект боли опосредуется медиальным болевым путем, включающим внутриламинарные ядра таламуса, которые проецируются на соматосенсорные структуры коры и лимбической системы. Пластина V же передает ноцицептивные сообщения парабрахиальному внутреннему латеральному ядру. Нервные волокна этого ядра связаны с областями коры, отвечающими за когнитивные функции (например, поведенческую реакцию на боль) и агрессивное поведение [16].
Помимо «осознания боли» ответом часто является реакция «бей или беги», связанная с активацией норадреналинергических нейронов в голубом пятне. Кроме того, после «обработки» болевого сигнала соматосенсорной корой, информация о болевом сигнале передается в гиппокамп — чтобы затем отправиться в долговременную память.
На данный момент мы не можем с точностью сказать, какие молекулярные процессы, происходящие в мозге, отвечают за «субъективное восприятие» боли, поэтому вмешиваться с помощью лекарств на этом уровне восприятия боли никто не решается — слишком опасно.
Часть VI: Возвращение к наболевшему
С помощью одних и вопреки другим нейробиохимическим механизмам, болевой импульс дошел до мозга. На некоторое время организм ждут ощущения от неприятных до ужасающих. Сейчас кажется, что человечество овладело огромным количеством фармакологических методов для остановки боли — однако это лишь иллюзия, и как только противовоспалительные средства — ингибиторы циклооксигеназы — перестают снимать боль, врачам приходится применять «тяжелую артиллерию» опиоидных анальгетиков.
Как мы уже выяснили, сейчас выявлено очень много рецепторов, которые вовлечены в процесс передачи боли, но еще большее количество факторов пока ускользает от всевидящего взгляда ученых. Другой печальный факт заключается в том, что у многих из известных нам болевых рецепторов есть и другие физиологические функции, блокировка которых приведет к значительным побочным эффектам. Разработка антагонистов TRP, а также «опиоидов нового поколения», не вызывающих зависимость, может оказаться настоящим прорывом — но может и повлечь новые невзгоды. Сегодня нам ясно одно — в борьбе за повышение качества жизни боль рано или поздно должна быть взята под контроль, а для того чтобы оседлать этого страшного зверя, его нужно узнать.