срок жизни клеток человека
Факты о крови и клетках крови
Эта информация поможет вам узнать о различных компонентах крови и их функциях.
Ваша кровь разносит кислород и питательные элементы ко всем клеткам организма. Кроме того, клетки крови противостоят инфекциям и останавливают кровотечение.
Большинство клеток крови вырабатываются в костном мозге. Их образование и замещение происходит непрерывно. Время существования клетки крови до ее замещения называется продолжительностью жизни клетки.
Кровь состоит из четырех компонентов: эритроцитов, лейкоцитов, тромбоцитов и плазмы.
Компоненты крови
Эритроциты (красные кровяные тельца)
Красные кровяные тельца несут кислород из легких к тканям организма. Также они несут углекислый газ обратно в легкие.
Эритроциты составляют почти половину от общего объема крови. Продолжительность жизни этих клеток — около 120 дней.
Лейкоциты (белые кровяные тельца)
Лейкоциты противостоят инфекциям и являются важным элементом иммунной системы. Они составляют очень малую часть от общего объема крови (менее 1 %).
Существует три типа лейкоцитов: гранулоциты, моноциты и лимфоциты. Каждый тип играет важную роль.
Продолжительность жизни лейкоцитов варьируется в широких пределах — от часов до нескольких лет.
Тромбоциты
Тромбоциты — это небольшие фрагменты клеток. Их основной функцией является остановка кровотечения. Они составляют очень малую часть от общего объема крови (менее 1 %). Продолжительность жизни тромбоцитов — около 9–12 дней.
Плазма
Плазма — это бледно-желтая жидкая часть крови, в которой содержатся все клетки крови. Она составляет чуть больше половины от общего объема крови.
Плазма помогает разносить воду, питательные элементы, минеральные вещества, лекарства и гормоны по всему организму. Также она переносит отходы к почкам. Затем почки фильтруют кровь, очищая ее от этих отходов. Плазма состоит из воды, белка, липидов (жиров). Она несет воду, жирорастворительные питательные элементы и другие вещества к различным органам и от них.
Сколько вам лет?
Юрий Фролов
По материалам журнала «New Scientist» (Великобритания)
«Наука и жизнь» №7, 2007
Не торопитесь отвечать на этот простой, как кажется, вопрос, потому что за вас на него ответил шведский невролог Йонас Фрисен: каждому взрослому человеку в среднем пятнадцать с половиной лет. Если по паспорту вам, например, шестьдесят, то хрусталики ваших глаз в среднем на 22 недели старше, мозг примерно ваш ровесник, а вот вашей коже всего две недели от роду.
Из одной научно-популярной книги в другую кочует утверждение: наше тело почти полностью обновляется за семь лет. Старые клетки постепенно отмирают, их места занимают новые.
Клетки действительно обновляются, но откуда взялась мифическая цифра «семь», никто толком не знает. Для некоторых клеток срок обновления установлен более или менее точно, а именно: 150 дней для клеток крови, за постепенным замещением которых можно проследить после переливания крови, и две недели для клеток кожи, которые появляются в ее глубинных слоях, постепенно мигрируют на поверхность, отмирают и отшелушиваются.
Опыты по измерению продолжительности жизни клеток ведутся уже около полувека, но только на крысах и мышах. Животным вводят через шприц или дают в пище меченые (радиоактивные) нуклеотиды — строительные блоки ДНК. Новые клетки встраивают в свой генетический материал эти метки. Их количество в разных тканях и органах можно измерить и рассчитать долю клеток, которые появились на свет за время, прошедшее после введения радиоактивной ДНК.
Разумеется, к человеку такой метод неприменим. Пытались определять возраст клеток человека по длине теломер — конечных участков хромосом. Теломеры (см. «Наука и жизнь» № 12, 2001 г.) укорачиваются при каждом делении клетки. Но выработать на этой основе надежный способ определения возраста клетки не удалось, тем более что некоторые клетки, как выяснилось, способны «отращивать» теломеры после деления.
Шведский исследователь Йонас Фрисен решил воспользоваться методом археологов и историков, умеющих определять возраст предметов, содержащих органику, по углероду-14 ( 14 С). Этот редкий и слабо радиоактивный изотоп углерода постоянно образуется в стратосфере, где космические лучи выбивают из ядер атомов азота по одному протону. Постепенно (период полураспада 5730 лет) 14 С снова превращается в азот. Растения в процессе фотосинтеза поглощают из атмосферы 14 С и встраивают его в молекулы сахаров. Животные поедают растения, и потому все живые существа содержат немного этого изотопа. Примерно один из триллиона атомов углерода в вашем теле — это углерод-14 на месте обычного углерода-12. Когда организм гибнет, он перестает получать новый 14 С, а тот, что уже накоплен за время жизни, постепенно распадается. Этот распад, идущий с известной скоростью, и позволяет определить, как давно живая материя стала мертвой. Например, когда срубили дерево, из которого сделана доисторическая лодка, или когда забили теленка, чтобы из его шкуры изготовить пергамент для рукописи. Однако из-за крайне малых количеств изотопа и медленности его распада метод годится только для больших промежутков времени.
Насколько опасен распад радиоактивного углерода в организме? В теле человека весом 75 килограммов около 300 триллионов триллионов (3•10 26 ) атомов углерода, из них всего 350 триллионов (3,5•10 14 ) — углерода 14 С. Если не считать минеральную составляющую (в основном это кости) и принять, что по остальным тканям тела 14 С распределен равномерно, то в каждой клетке в среднем всего 11 атомов 14 С. ДНК по весу составляет около 1% клеток. Изотоп 14 С распадается так редко, что если взять отдельную выбранную наугад клетку, то в составе ее ДНК один атом 14 С распадется раз в 18 000 лет (мы берем именно тот 14 С, который входит в ДНК, так как изменения в составе этой молекулы могут быть важными для здоровья организма и его потомства). Если считать, что вы проживете 70 лет, то шансы на то, что какая-то конкретная отдельная клетка вашего тела когда-либо испытает «атомный взрыв» одного атома углерода в своей ДНК, составляют 1 против 260.
При своем появлении клетка получает набор хромосом, которые остаются с ней всю ее жизнь. Поэтому содержание 14 С в ДНК прямо пропорционально его содержанию в атмосфере в то время, когда данная клетка появилась, минус небольшое количество, исчезнувшее в результате естественного распада. Анализы проводятся методом атомной масс-спектрометрии.
В 2005 году Фрисен и его сотрудники опубликовали предварительные результаты анализов клеток людей, живших во времена пика 14 С. Как и следовало ожидать, короче всего срок жизни клеток, непосредственно соприкасающихся с внешней средой, — клеток эпидермиса кожи (две недели, как мы об этом упоминали) и клеток эпителия кишечника, постоянно истираемых проходящими пищевыми массами (5 дней). Красные кровяные тельца, по Фрисену, живут 150 дней. Мышечные клетки межреберных мышц у людей 37–40 лет, как оказалось, в среднем имеют возраст 15,1 года, а клетки кишечника (кроме эпителия) — 15,9 года.
Фрисена как невролога больше всего, разумеется, интересует головной мозг. Из исследований, проведенных на животных, а также на одном пациенте, умиравшем от рака и согласившемся на введение ему в мозг слабо радиоактивного изотопа, известно, что после рождения новые нейроны возникают только в двух областях — в гиппокампе и вокруг желудочков мозга.
Пока новым методом измерен возраст лишь немногих участков головного мозга. По данным Фрисена, клетки мозжечка моложе самого человека в среднем на 2,9 года. Мозжечок, как известно, отвечает за координацию движений, а она постепенно улучшается с возрастом у ребенка, поэтому можно предположить, что примерно к трем годам мозжечок формируется окончательно. Кора головного мозга имеет тот же возраст, что сам человек, то есть на протяжении жизни в ней не появляются новые нейроны. Остальные отделы мозга еще только изучаются.
Измерение возраста отдельных тканей и органов проводится не из любопытства. Зная скорость оборота клеток, мы, возможно, научимся лечить катаракту, ожирение и некоторые нервные болезни. В 2004 году исследователи из Колумбийского университета (США) обнаружили, что при депрессии в гиппокампе возникает слишком мало новых нейронов, а некоторые лекарства от депрессии стимулируют этот процесс. Болезнь Альцгеймера также связывают с недостаточным нейрогенезом в гиппокампе. При болезни Паркинсона, насколько известно, отмирание старых клеток не уравновешивается появлением новых.
Знание о том, как часто у людей возникают новые жировые клетки, поможет лечить ожирение. Пока никто не знает, связана ли эта болезнь с увеличением числа или размеров жировых клеток. Знание частоты появления новых клеток печени и поджелудочной железы позволит создать новые методы диагностики и лечения рака печени и диабета.
Весьма актуален вопрос о возрасте мышечных клеток сердца. Специалисты считают, что отмирающие клетки заменяются фиброзной соединительной тканью, поэтому сердечная мышца со временем слабеет. Но точных данных нет. Фрисен и его группа сейчас работают над определением возраста сердца.
Американцы научились измерять возраст хрусталика глаза. Его центральная часть формируется из прозрачных клеток на шестой неделе жизни эмбриона и остается на всю жизнь. Но по периферии хрусталика постоянно добавляются новые клетки, делая хрусталик более толстым и менее гибким, что сказывается на его способности фокусировать изображение. Изучив этот процесс, мы, возможно, найдем способы оттянуть начало катаракты на пять лет — считает Брюс Буххольц из Ливерморской национальной лаборатории (США), где проводятся масс-спектрометрические измерения образцов, поставляемых из Калифорнийского университета и лаборатории Фрисена.
Но если многие «детали» нашего организма постоянно обновляются и в результате оказываются значительно моложе самого их обладателя, то возникают некоторые вопросы. Например, если верхнему слою кожи всего две недели, почему она не остается всю жизнь гладкой и розовой, как у двухнедельного младенца? Если мышцам примерно 15 лет, почему 60-летняя женщина менее ловка и подвижна, чем 15-летняя девочка? Причина — в митохондриальной ДНК. Она накапливает повреждения быстрее, чем ДНК клеточного ядра. Именно поэтому кожа со временем стареет: мутации в митохондриях приводят к ухудшению качества ее важного составного материала, коллагена.
Разные органы и ткани человека обновляются с разной скоростью, и потому можно сказать, что имеют разный возраст.
Старение — плата за подавление раковых опухолей?
Старение — плата за подавление раковых опухолей?
Деление клетки. Клеточный цикл.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Уже более 50 лет прошло с тех пор, как на культуре фибробластов доказан феномен старения клеток, но существование старых клеток в организме долгое время подвергалось сомнению. Не было доказательств, что старение отдельных клеток играет важную роль в старении всего организма. В последние годы были открыты молекулярные механизмы старения клеток, их связь с онкологическими заболеваниями и воспалением. По современным представлениям, воспаление играет ведущую роль в генезе практически всех возраст-зависимых заболеваний, которые в конечном итоге приводят организм к смертельному исходу. Оказалось, что старые клетки, с одной стороны, выступают в качестве супрессоров опухолей (поскольку необратимо перестают делиться сами и снижают риск трансформации окружающих клеток), а с другой — специфический метаболизм старых клеток может вызывать воспаление и перерождение соседних предраковых клеток в злокачественные. В настоящее время проходят клинические испытания лекарственных препаратов, избирательно элиминирующих старые клетки в органах и тканях, тем самым предотвращая дегенеративные изменения органов и рак.
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
В организме человека присутствует примерно 300 типов клеток, и все они делятся на две большие группы: одни могут делиться и размножаться (то есть, они митотически компетентны), а другие — постмитотические — не делятся: это достигшие крайней стадии дифференцировки нейроны, кардиомиоциты, зернистые лейкоциты и другие.
В нашем организме существуют обновляющиеся ткани, в которых есть пул постоянно делящихся клеток, которые заменяют отработанные или погибающие клетки. Такие клетки есть в криптах кишечника, в базальном слое эпителия кожи, в костном мозге (кроветворные клетки). Обновление клеток может происходить довольно интенсивно: так, клетки соединительной ткани в поджелудочной железе заменяются каждые 24 часа, клетки слизистой желудка — каждые три дня, лейкоциты — каждые 10 дней, клетки кожи — каждые шесть недель, примерно 70 г пролиферирующих клеток тонкого кишечника удаляется из организма ежедневно [1].
Стволовые клетки, существующие практически во всех органах и тканях, способны делиться неограниченно. Регенерация тканей происходит за счет пролиферации стволовых клеток, которые могут не только делиться, но и дифференцироваться в клетки той ткани, регенерация которой происходит. Стволовые клетки есть в миокарде, в головном мозге (в гипокампе и в обонятельных луковицах) и в других тканях. Это открывает большие надежды в плане лечения нейродегенеративных заболеваний и инфаркта миокарда [2–4].
Постоянно обновляющиеся ткани способствуют увеличению продолжительности жизни. При делении клеток происходит омоложение тканей: новые клетки приходят на место поврежденных, при этом интенсивнее происходит репарация (устранение повреждений ДНК) и возможна регенерация при повреждении тканей. Не удивительно, что у позвоночных значительно выше продолжительность жизни, чем у беспозвоночных — тех же насекомых, у которых во взрослом состоянии клетки не делятся.
Стоит, в прочем, помнить, что мутация мутации рознь, и согласно новейшим геномным исследованиям в каждом поколении человек приобретает около 60 новых мутаций (которых не было в ДНК у его родителей). Очевидно, что большая часть из них вполне нейтральная (см. «Перевалило за тысячу: третья фаза геномики человека»). — Ред.
В целях защиты от самого себя, в организме сформировались специальные клеточные механизмы супрессии опухолей. Один из них — репликативное старение клеток (сенесценция), заключающееся в необратимой остановке деления клетки в стадии G1 клеточного цикла. При старении клетка перестает делиться: она не реагирует на ростовые факторы и становится устойчивой к апоптозу.
Лимит Хейфлика
Эта концепция считалась неопровержимой во многом благодаря экспериментам Карреля, который поддерживал культуру клеток сердца цыпленка 34 года (ее выбросили лишь после его смерти). Однако, как выяснилось впоследствии, бессмертие культуры Карреля было артефактом, поскольку вместе с эмбриональной сывороткой, которая добавлялась в культуральную среду для роста клеток, туда попадали и сами эмбриональные клетки (и, скорее всего, культура Карреля стала уже далеко не тем, чем была в начале).
О захватывающей истории бессмертия Генриетты Лакс см. в статье «Бессмертные клетки Генриетты Лакс», а также «Наследники клеток HeLa». — Ред.
Как выяснилось, лимит Хейфлика зависит от возраста: чем старше человек, тем меньшее число раз удваиваются его клетки в культуре. Интересно, что замороженные клетки при разморозке и последующем культивировании как будто помнят число делений до замораживания. Фактически, внутри клетки существует «счетчик делений», и по достижении определенного предела (лимита Хейфлика) клетка перестает делиться — становится сенесцентной. Сенесцентные (старые) клетки имеют специфическую морфологию — они крупные, уплощенные, с большими ядрами, сильно вакуолизированы, у них меняется профиль экспрессии генов. В большинстве случаев они устойчивы к апоптозу.
Однако старение организма нельзя свести только к старению клеток. Это значительно более сложный процесс. Старые клетки есть и в молодом организме, но их мало! Когда же с возрастом сенесцентные клетки накапливаются в тканях, начинаются дегенеративные процессы, которые приводят к возраст-зависимым заболеваниям. Один из факторов этих заболеваний — так называемое старческое «стерильное» воспаление, которое связано с экспрессией провоспалительных цитокинов старыми клетками.
Еще один важный фактор биологического старения — строение хромосом и их кончиков — теломеров.
Теломерная теория старения
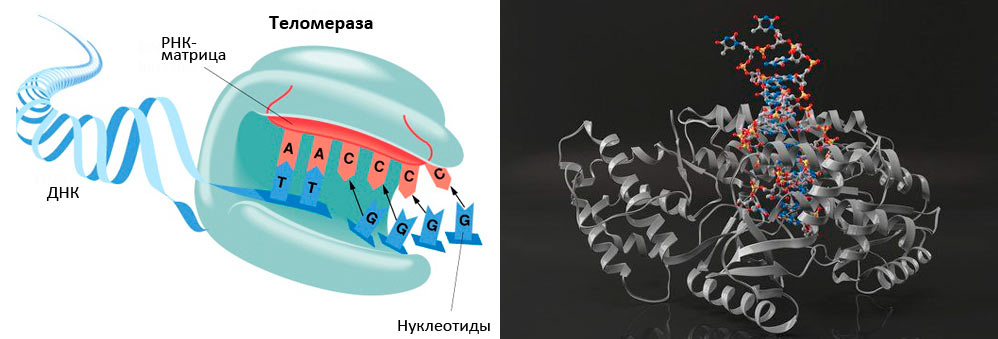
Рисунок 1. Теломеры — концевые участки хромосом. Поскольку хромосом у человека 23 пары (то есть, 46 штук), теломер получается 92.
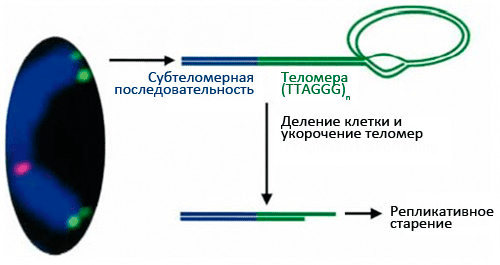
В 1971 году наш соотечественник Алексей Матвеевич Оловников предположил, что лимит Хейфлика связан с «недорепликацией» концевых участков линейных хромосом (они имеют специальное название — теломеры). Дело в том, что в каждом цикле деления клетки теломеры укорачиваются из-за неспособности ДНК-полимеразы синтезировать копию ДНК с самого кончика [8], [9]. Кроме того, Оловников предсказал существование теломеразы (фермента, добавляющего повторяющиеся последовательности ДНК на концы хромосом), исходя из того факта, что иначе в активно делящихся клетках ДНК быстро бы «съелась», и генетический материал был бы утерян. (Проблема в том, что активность теломеразы угасает в большинстве дифференцированных клеток.)
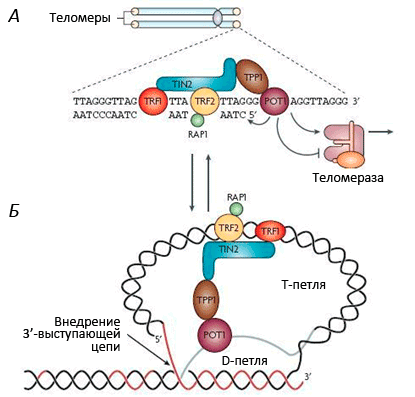
Теломеры (рис. 1) играют важную роль: они стабилизируют кончики хромосом, которые иначе, как говорят цитогенетики, стали бы «липкими», т.е. подверженными разнообразным хромосомным аберрациям, что приводит к деградации генетического материала. Теломеры состоят из повторяющихся (1000–2000 раз) последовательностей (5′—TTAGGG—3′), что в сумме дает 10–15 тысяч нуклеотидных пар на каждый хромосомный кончик. На 3′-конце теломеры имеют довольно длинный однонитевой участок ДНК (150–200 нуклеотидов), участвующий в образовании петли по типу лассо [10], [11] (рис. 2). С теломерами связано несколько белков, образующих защитный «колпачок» — этот комплекс называется шелтерином (рис. 3). Шелтерин предохраняет теломеры от действия нуклеаз и слипания и, видимо, именно он сохраняет целостность хромосомы.
Рисунок 2. Состав и структура теломер. Многократное деление клетки в случае отсутствия активности теломеразы ведет к укорочению теломер и репликативному старению.
Рисунок 3. Строение теломерного комплекса (шелтерина). Теломеры находятся на концах хромосом и состоят из тандемных повторов TTAGGG, которые заканчиваются 32-членным выступающим одноцепочечным фрагментом. С теломерной ДНК связан шелтерин — комплекс из шести белков: TRF1, TRF2, RAP1, TIN2, TPP1 и POT1.
Незащищенные концы хромосом воспринимаются клеткой как повреждение генетического материала, что активирует репарацию ДНК. Теломерный комплекс вместе с шелтерином «стабилизирует» хромосомные кончики, защищая всю хромосому от разрушения. В сенесцентных клетках критическое укорочение теломер нарушает эту защитную функцию [12], [13], в связи с чем начинают формироваться хромосомные аберрации, которые часто приводят к малигнизации. Чтобы этого не произошло, специальные молекулярные механизмы блокируют клеточное деление, и клетка переходит в состояние сенесцентности — необратимой остановки клеточного цикла. При этом клетка гарантированно не может размножаться, а значит, не сможет и сформировать опухоль. В клетках с нарушенной способностью к сенесценции (которые размножаются, несмотря на дисфункцию теломер), образуются хромосомные аберрации.
Длина теломер и скорость их укорочения зависит от возраста. У человека длина теломер варьирует от 15 тысяч нуклеотидных пар (т.н.п.) при рождении до 5 т.н.п. при хронических заболеваниях. Длина теломер максимальна у 18-месячных детей, а затем она быстро снижается до 12 т.н.п. к пятилетнему возрасту. После этого скорость укорачивания снижается [14].
Теломеры укорачиваются у разных людей с разной скоростью. Так, на эту скорость сильно влияют стрессы. Э. Блекберн (лауреат Нобелевской премии по физиологии и медицине 2009 г.) установлено, что женщины, постоянно испытывающие стресс (например, матери хронически больных детей), имеют значительно более короткие теломеры по сравнению со сверстницами (примерно на десять лет!). Лабораторией Э. Блекберн разработан коммерческий тест для определения «биологического возраста» людей на основании длины теломер.
Любопытно, что у мышей очень длинные теломеры (50–40 т.н.п., по сравнению с 10–15 т.н.п. у человека). У некоторых линий лабораторных мышей длина теломер достигает 150 т.н.п. Более того, у мышей теломераза всегда активна, что не дает теломерам укорачиваться. Однако это, как всем известно, не делает мышей бессмертными. Мало того: у них опухоли развиваются намного чаще, чем у людей, что позволяет предположить, что укорачивание теломер как механизм защиты от опухолей у мышей не работает [15].
При сравнении длины теломер и теломеразной активности у разных млекопитающих оказалось, что виды, для которых характерно репликативное старение клеток, имеют большую продолжительность жизни и большой вес. Это, например, киты, продолжительность жизни которых может достигать 200 лет. Таким организмам репликативное старение просто необходимо, поскольку слишком большое число делений порождает множество мутаций, с которыми необходимо как-то бороться. Предположительно, репликативное старение и есть такой механизм борьбы, который сопровождается к тому же репрессией теломеразы [16].
Старение диференцированных клеток происходит иначе. Стареют и нейроны, и кардиомиоциты, а ведь они не делятся! Например, в них накапливается липофусцин — старческий пигмент, который нарушает функционирование клеток и запускает апоптоз. В клетках печени и селезенки с возрастом накапливается жир.
Связь репликативного старения клеток со старением организма, строго говоря, не доказана, но возрастная патология сопровождается и старением клеток (рис. 4). Злокачественные новообразования пожилого возраста в большинстве своем связаны с обновляемыми тканями. Онкологические заболевания в развитых странах — одна из основных причин заболеваемости и смертности, причем независимым фактором риска раковых заболеваний является просто. возраст. Число смертей от опухолевых заболеваний увеличивается с возрастом по экспоненте, так же как и общая смертность. Это говорит нам, что между старением и канцерогенезом существует фундаментальная связь.
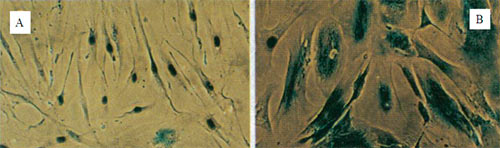
Рисунок 4. Гистохимически окрашенные на наличие β-галактозидазной активности фибробласты человека линии WI-38. A — молодые; B — старые (сенесцентные).
Теломераза — фермент, который был предсказан
В организме должен существовать механизм, компенсирующий укорочение теломер, — такое предположение сделал А.М. Оловников. Действительно, в 1984 г. такой фермент был открыт Кэрол Грейдер и назван теломеразой. Теломераза (рис. 5) — это обратная транскриптаза, которая увеличивает длину теломер, компенсируя их недорепликацию. В 2009 году Э. Блэкберн, К. Грэйдер и Д. Шостак за открытие этого фермента и цикл работ по изучению теломер и теломеразы была присуждена Нобелевская премия (см: «„Нестареющая“ Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе»).
Рисунок 5. Теломераза содержит каталитический компонент (обратную транскриптазу ТERT), теломеразную РНК (hTR или TERC), содержащую две копии теломерного повтора и являющуюся матрицей для синтеза теломеров, и белок дискерин.
По данным Э. Блекберн, теломераза участвует в регуляции активности примерно 70 генов. Теломераза активна в зародышевых и эмбриональных тканях, в стволовых и пролиферирующих клетках. Ее обнаруживают в 90% раковых опухолей, что обеспечивает неудержимое размножение раковых клеток. В настоящее время среди препаратов, которые используют для лечения рака, есть и ингибитор теломеразы. Но в большинстве соматических клеток взрослого организма теломераза не активна.
В состояние сенесценции клетку могут привести многие стимулы — дисфункция теломер, повреждения ДНК, причиной которых могут быть мутагенные воздействия окружающей среды, эндогенные процессы, сильные митогенные сигналы (сверхэкспрессия онкогенов Ras, Raf, Mek, Mos, E2F-1 и др.), нарушения хроматина, стрессы и др. Фактически, клетки перестают делиться — становятся сенесцентными — в ответ на потенциально вызывающие рак события.
Страж генома
Дисфункция теломер, которая происходит при их укорачивании либо нарушении работы шелтерина, активирует белок р53. Этот транскрипционный фактор приводит клетку в состояние сенесценции, либо вызывает апоптоз. При отсутствии р53 развивается нестабильность хромосом, характерная для карцином человека. Мутации в белке р53 обнаруживаются в 50% аденокарцином груди и в 40–60% случаев колоректальной аденокарциномы. Поэтому p53 зачастую называют «стражем генома».
Теломераза реактивируется в большинстве опухолей эпителиального происхождения, которые характерны для пожилых людей. Считается, что реактивация теломеразы — важный этап злокачественных процессов, поскольку это позволяет раковым клеткам «не обращать внимания» на лимит Хейфлика. Дисфункция теломер способствует хромосомным слияниям и аберрациям, что в отсутствии p53 чаще всего приводит к злокачественным новообразованиям.
О молекулярных механизмах старения клеток
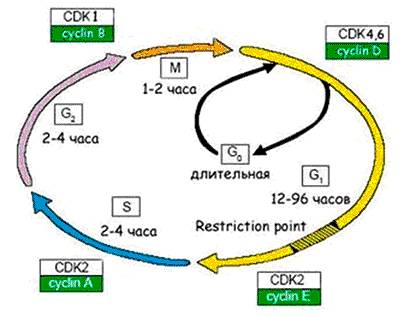
Рисунок 6. Схема клеточного цикла. Клеточный цикл подразделяют на четыре стадии: 1. G1 (предсинтетическая) — период, когда клетка готовится к репликации ДНК. В этой стадии может произойти остановка клеточного цикла в случае обнаружения повреждений ДНК (на время репарации). Если обнаруживаются ошибки в репликации ДНК, и они не могут быть исправлены репарацией, клетка не переходит на стадию S. 2. S (cинтетическая) — когда происходит репликация ДНК. 3. G2 (постсинтетическая) — подготовка клетки к митозу, когда происходит проверка точности репликации ДНК; если обнаружены недореплицированные фрагменты или другие нарушения в синтезе, переход на следующую стадию (митоз) не происходит. 4. М (митоз) — формирование клеточного веретена, сегрегация (расхождение хромосом) и формирование двух дочерних клеток (собственно деление).
Чтобы были понятны молекулярные механизмы перехода клетки в состояние сенесцентности, я напомню вам, как происходит деление клетки.
Процесс размножения клеток называют пролиферацией. Время существования клетки от деления до деления именуют клеточным циклом. Процесс пролиферации регулируется как самой клеткой — аутокринными ростовыми факторами, — так и ее микроокружением — паракринными сигналами.
Активация пролиферации происходит через клеточную мембрану, в которой присутствуют рецепторы, воспринимающие митогенные сигналы — это в основном ростовые факторы и межклеточные контактные сигналы. Ростовые факторы обычно имеют пептидную природу (к настоящему времени их известно около 100). Это, например, фактор роста тромбоцитов, который участвует в тромбообразовании и заживлении ран, эпителиальный фактор роста, различные цитокины — интерлейкины, фактор некроза опухолей, колониестимулирующие факторы и т.д. После активации пролиферации клетка выходит из фазы покоя G0 и начинается клеточный цикл [19] (рис. 6).
Клеточный цикл регулируется циклин-зависимыми киназами, разными для каждой стадии клеточного цикла. Они активируются циклинами и инактивируются рядом ингибиторов. Цель такой сложной регуляции — обеспечить синтез ДНК с как можно меньшим числом ошибок, чтобы и дочерние клетки имели абсолютно идентичный наследственный материал. Проверка правильности копирования ДНК осуществляется в четырех «контрольных точках» цикла: если обнаруживаются ошибки, то клеточный цикл останавливается, и включается репарация ДНК. Если нарушения структуры ДНК удается исправить — клеточный цикл продолжается. Если нет — клетке лучше «покончить с собой» (путем апоптоза), чтобы избежать вероятности превращения в раковую.
Молекулярные механизмы, приводящие к необратимой остановке клеточного цикла, контролируются генами-супрессорами опухолей, среди которых p53 и pRB, связанные с ингибиторами циклин-зависимых киназ. Супрессию клеточного цикла в фазе G1 осуществляет белок p53, действующий через ингибитор циклин-зависимой киназы р21. Транскрипционный фактор р53 активируется при повреждениях ДНК, и функция его заключается в удалении из пула реплицирующихся клеток тех, которые являются потенциально онкогенными (отсюда и прозвище р53 — «страж генома»). Данное представление подтверждается тем фактом, что мутации р53 обнаруживают в
50% случаев злокачественных опохолей. Другое проявление активности р53 связано с апоптозом наиболее поврежденных клеток.
Сенесценция клеток и возраст-зависимые заболевания
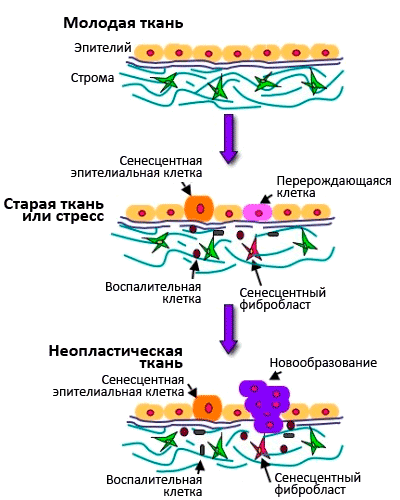
Рисунок 7. Взаимосвязь между старением клеток и старением организма.
Сенесцентные клетки накапливаются с возрастом и способствуют возрастным заболеваниям. Они снижают пролиферативный потенциал ткани и истощают пул стволовых клеток, что приводит к дегенеративным нарушениям ткани и снижает способность к регенерации и обновлению.
Сенесцентные клетки характеризуются специфической экспрессией генов: они секретируют воспалительные цитокины и металлопротеиназы, разрушающие межклеточный матрикс. Получается, что старые клетки обеспечивают вялотекущее старческое воспаление, а накопление старых фибробластов в коже служит причиной возрастного снижения способности к заживлению ран (рис. 7). Старые клетки также стимулируют пролиферацию и малигнизацию близлежащих предраковых клеток, благодаря секреции эпителиального фактора роста [20].
Сенесцентные клетки накапливаются во многих тканях человека, присутствуют в атеросклеротических бляшках, в язвах кожи, в пораженных артритом суставах, а также в доброкачественных и пренеопластических гиперпролиферативных поражениях простаты и печени. При облучении раковых опухолей некоторые клетки также переходят в состояние сенесценции, тем самым обеспечивая рецидивы заболевания.
Таким образом, клеточное старение демонстрирует эффект отрицательной плейотропии, суть которого состоит в том, что хорошее для молодого организма, может стать плохим для старого. Самый яркий пример — процессы воспаления. Выраженная реакция воспаления способствует быстрому выздоровлению молодого организма при инфекционных заболеваниях. В пожилом же возрасте активные воспалительные процессы приводят к возрастным заболеваниям. Сейчас принято считать, что воспаление играет определяющую роль практически при всех возраст-зависимых заболеваниях, начиная с нейродегенеративных.
Получается парадокс: старение клеток в молодом организме предохраняет от рака, а в старом — способствует ему! В настоящее время в США в клинике Майо ведутся исследования влияния «ликвидации» старых клеток из организма. На животных получены обнадеживающие результаты об увеличении продолжительности жизни и замедлении клинических проявлений возраст-зависимых заболеваний, если из тканей старых животных селективно устранять сенесцентные клетки — хороших граждан, но плохих соседей.