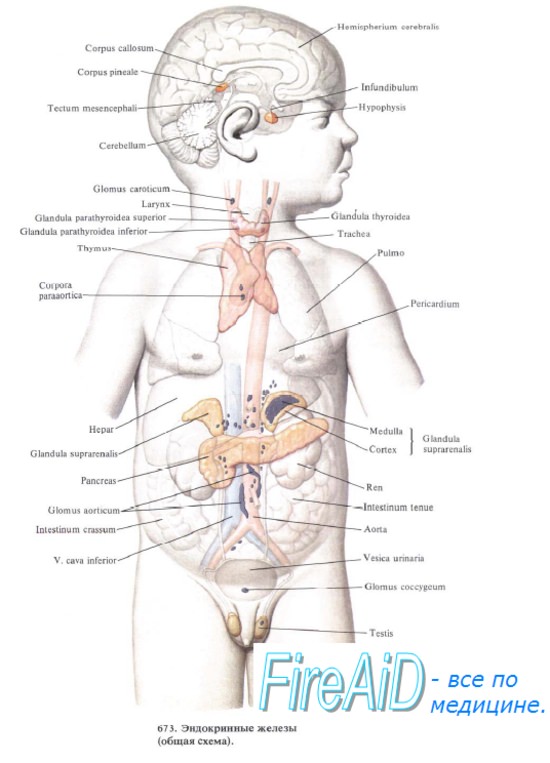
размер тимуса в течение жизни
Размер тимуса в течение жизни
Тимус — центральный орган лимфоидного кроветворения и иммунной защиты организма. В тимусе происходит антигеннезависимая дифференцировка костномозговых предшественников Т-лимфоцитов в иммунокомпетентные клетки — Т-лимфоциты. Последние осуществляют реакции клеточного иммунитета и участвуют в регуляции гуморального иммунитета, что происходит, однако, не в тимусе, а в периферических органах кроветворения и иммунной защиты. Кроме того, в экстрактах тимуса обнаружено более 20 биологически активных веществ, в том числе дистантного действия, что позволяет отнести тимус к железам эндокринной системы.
Развитие тимуса. Тимус закладывается на 2-м месяце эмбриогенеза в виде небольших выпячиваний стенок 3-й и 4-й пар жаберных карманов. На 6-й неделе зачаток железы имеет отчетливо выраженный эпителиальный характер. На 7-й неделе он утрачивает связь со стенкой головной кишки. Эпителий закладки железы, образуя выросты в мезенхиму, приобретает сетевидное строение. Вначале плотная эпителиальная закладка железы разрыхляется благодаря заселению ее лимфоцитами. Число их быстро нарастает, и железа приобретает структуру лимфоэпителиалъного органа.
Врастающая мезенхима с кровеносными сосудами подразделяет тимус на дольки. В каждой дольке различают корковое и мозговое вещество. В гистогенезе тимуса в мозговом веществе долек образуются слоистые эпителиальные образования — эпителиальные жемчужины, или тельца Гассаля. В их составе определяются плотные эпителиальные клетки, концентрически наслаивающиеся друг на друга.
Строение тимуса. Снаружи вилочковая железа покрыта соединительнотканной капсулой. Отходящие от нее перегородки — септы — подразделяют тимус на дольки. Основу дольки составляют отростчатые эпителиальные клетки — эпителиоретикулоциты, в сетевидном остове которых находятся тимические лимфоциты (тимоциты). Источником развития Т-лимфоцитов являются костномозговые стволовые кроветворные клетки. Далее предшественники Т-лимфоцитов (претимоциты) поступают с кровью в тимус и превращаются здесь в лимфобласты.
В корковом веществе тимуса одни из них под действием выделяемых эпителиальными клетками пептидных гормонов — тимозина, тимопоэтина и др., а также макрофагов превращаются в антиген-реактивные Т-лимфоциты — приобретают рецепторы к строго определенным антигенам. Они выходят из тимуса, не попадая в мозговое вещество, и заселяют тимусзависимые зоны лимфатических узлов и селезенки. Здесь в периферических органах иммуногенеза происходит их дальнейшее созревание в Т-киллеры (цитотоксические), Т-хелперы, после чего они способны к рециркуляции, клонированию (пролиферации), образованию клеток-памяти.
Другие Т-лимфобласты превращаются в аутоиммунокомпетентные клетки, реактивные к аутоантигенам. Они подвергаются разрушению путем апоптоза (примерно 95% клеток) и фагоцитируются макрофагами.
Процесс специализации Т-лимфоцитов в корковом веществе долек тимуса происходит в условиях, предохраняющих от избыточного действия на них антигенов. Это достигается за счет образования гематотимического гистиона (барьера), состоящего из эндотелия гемокапилляров с отчетливо выраженной непрерывной базальной мембраной, перикапиллярного пространства с межклеточным веществом и макрофагами, а также из эпителиоретикулоцитов с их базальной мембраной. Корковое вещество тимуса имеет самостоятельное микроциркуляторное русло. Напротив, в мозговом веществе тимуса капиллярная сеть не выполняет барьерной роли, и через эндотелий этих капилляров зрелые лимфоциты могут уходить и возвращаться в тимус, т. е. рециркулировать.
В тимусе эти лимфоциты находятся в мозговом веществе. Зрелые лимфоциты покидают тимус через стенку посткапиллярной венулы.
Мозговое вещество тимуса имеет более светлую окраску, так как лимфоцитов здесь меньше, чем в корковом веществе. Эпителиальный остов выступает более отчетливо, а эпителиоретикулоциты здесь более крупные и многочисленные. В средней части мозгового вещества встречаются слоистые эпителиальные тельца Гассаля. С возрастом количество и размеры их увеличиваются. В строме тимуса кроме эпителиоретикулоцитов находятся макрофаги, дендритные клетки костномозгового происхождения, нейроэндокринные клетки — производные нервного гребня, а также миоидные клетки.
Возрастные изменения и реактивность тимуса.
После 20 лет происходит возрастная инволюция тимуса. Это сопровождается уменьшением количества лимфоцитов и развитием жировой ткани. В тех случаях, когда вилочковая железа не подвергается обратному развитию, возникает пониженная сопротивляемость организма к инфекциям и интоксикациям.
Ткани тимуса являются высокореактивными структурами. При действии повреждающих факторов (интоксикации, травмы и др.) наблюдаются выброс Т-лимфоцитов в кровь и массовая их гибель преимущественно в корковом веществе. Возникающая при таких стресс-воздействиях инволюция тимуса называется временной, быстропроходящей, или акцидентальной. Наблюдаемые при этом явления лимфоцитолиза и фагоцитоза макрофагами гибнущих лимфоцитов рассматриваются как возможные способы высвобождения факторов роста и ДНК, необходимых для восстановительных процессов в тканях. С гибелью лимфоцитов в этих условиях связывают также селекцию Т-лимфобластов.
Реактивные изменения вилочковой железы находятся в тесной корреляции с функциональными изменениями коры надпочечников и уровнем глюкокортикоидов в крови. В тимусе выявлены адренергические и холинергические нервные волокна, входящие в орган вместе с сосудами.
Самый загадочный орган иммунной системы
Вплоть до средних веков одним из претендентов на роль телесного вместилища души считался тимус. В наши дни самой удивительной особенностью этого органа называют его склонность к раннему старению и полной деградации с возрастом. Почему так происходит? Если взрослые могут обходиться без этой железы, то зачем она нужна детям?
Вилочковая железа
Тимус относится к центральным элементам иммунной системы. Свое название железа получила в честь душистого растения чебрец (Thymus), из клеток которой было выделено азотистое основание тимин, входящее в состав ДНК. Это небольшой орган розовато-серого цвета, мягкой консистенции, расположенный в центральной части грудной клетки. Он покрыт капсулой из плотной соединительной ткани, от которой в глубину отходят перемычки, делящие его на дольки. Верхние, более узкие, концы долей выходят за пределы грудной полости, иногда достигая щитовидной железы. Доли тимуса напоминают двузубую вилочку, что и дало название этому органу — «вилочковая железа».
Если тимус недостаточно развит, как, например, при таком генетическом заболевании, как синдром ДиДжорджи, то у детей развивается врожденный иммунодефицит. Болезнь приводит к уменьшению количества Т-лимфоцитов в крови и проявляется повышенной чувствительностью к вирусным, грибковым и некоторым бактериальным инфекциям. Иногда в зрелом возрасте наблюдается особое нарушение иммунологических процессов, связанное с патологией тимуса и других лимфоидных органов, что может быть причиной внезапной смерти от наркоза во время операции.
Его задача — обнаружить клетки, которые в силу различных повреждений превратились в чужеродные, например, под воздействием вируса
Клетки-няньки и школа для лимфоцитов
В отличие от костного мозга, который дает начало практически всем клеткам иммунной системы (эритроцитам, тромбоцитам, гранулоцитам, моноцитам, лимфоцитам), тимус «специализируется» на продукции исключительно Т-лимфоцитов. Буква Т в названии указывает 
Часовые клеточного иммунитета
На внешней оболочке Т-лимфоцитов находятся белки, распознающие специфичные молекулы тканевой совместимости данного организма. Т-лимфоцит похож на часового, который охраняет организм от чужаков, спрашивая «пароль» у каждой клетки, встречающейся на его пути. Его задача — обнаружить клетки, которые в силу различных повреждений превратились в чужеродные, например, под воздействием вируса. Если клетка выглядит подозрительно, то она незамедлительно подлежит разрушению. Для выполнения этой функции Т-лимфоциты должны быть способны распознать собственные антигены тканевой совместимости, специфичные для каждого организма. При этом Т-лимфоциты не должны реагировать на аутоантигенные пептиды, связанные с собственными антигенами тканевой совместимости. Из широчайшего спектра вариантов антигенов тканевой совместимости лишь немногие экспрессированы на клетках данного индивида и нуждаются в распознавании Т-лимфоцитами. Именно поэтому селекция тимоцитов сопровождается большими энергетическими затратами и 95% гибелью. Зато зрелые периферические Т-лимфоциты живут долго и способны отвечать клональной экспансией в случае встречи со специфическим чужеродным антигеном.
Размеры тимуса являются максимальными в детском возрасте, но после начала полового созревания этот орган подвергается значительной атрофии и инволюции
Инволюция тимуса
Размеры тимуса являются максимальными в детском возрасте, но после начала полового созревания этот орган подвергается значительной атрофии и инволюции. У новорожденного тимус уже полностью развит и в течение первого года жизни достигает максимальных размеров — 25 см3: его длина составляет 5 см, ширина — 4 см, толщина — 6 мм. У 6-месячного ребенка масса тимуса достигает от 12 до 20 г, что составляет 0,5% массы тела. Сложная структура и напряженное функционирование железы сохраняются в течение первых 2–3 лет жизни. Самая высокая продукция Т-лимфоцитов происходит до 2 лет, а затем быстро уменьшается. Тимус продолжает расти до наступления половой зрелости, достигая максимального размера (длина до 7,5–16 м) и массы (35–40 г), а после 14–15 лет начинается процесс инволюции. К 20 годам половина функционирующей ткани тимуса замещается жировой тканью и у 25-летних масса железы уменьшается до 25 г с сохранением ее общих очертаний. В течение первых 50 лет жизни ежегодно теряется по 3% истинно тимической ткани. К 50–60 годам инволюция тимуса завершается, его масса составляет менее 15 г, а к 70–75 — около 6 г. Атрофии подвергаются главным образом латеральные участки железы и отчасти нижние, так что железа у взрослого человека принимает более удлиненную форму. По мере инволюции тимус утрачивает былой цвет и за счет увеличения в нем доли стромы и жировых клеток становится более желтым. Вместе с деградацией органа значительно уменьшается и почти полностью прекращается выработка Т-лимфоцитов, с чем отчасти связывают снижение иммунитета у лиц пожилого возраста.
Почему тимус деградирует?
Из всех органов иммунной системы только для тимуса характерна возрастная инволюция. Однако следует отметить, что количество Т-лимфоцитов долгое время сохраняется на достаточном уровне. Дело в том, что значительную часть популяции Т-лимфоцитов составляют долгоживущие клетки, которые не нуждаются в постоянном обновлении. Более того, зрелые Т-лимфоциты подвергаются так называемой колониальной экспансии, то есть избирательной пролиферации при встрече со своим антигеном, за счет чего их численность увеличивается, поэтому количество Т-клеток может поддерживаться во взрослом организме и при отсутствии тимуса. Кроме того, иммунная система располагает некоторыми компенсаторными возможностями для замещения отдельных функций недостающих Т-лимфоцитов. Да и в целом необходимость в генерации новых Т-лимфоцитов с возрастом снижается. Первичные контакты с инфекционными агентами происходят в основном в первые годы жизни, а в дальнейшем встреча с новыми патогенами случается не так часто, поэтому энергозатраты на содержание тимуса становятся нецелесообразными. К тому же постоянная активность тимуса с возрастом чревата развитием стрессовой гиперчувствительности иммунной системы, имеющей патологические последствия.
Тимусзависимая старость
Как видим, возрастная инволюция тимуса не вызывает катастрофического снижения иммунитета. Однако встреча с вирусами кори или ветрянки приводит к более тяжелым осложнениям у взрослых по сравнению с детьми, у которых тимус функционирует в полную силу. Не зря именно в течение первых трех лет жизни, то есть в период «расцвета» тимуса, врачи стараются вакцинировать ребенка против всех наиболее опасных и частых инфекционных заболеваний: туберкулеза, полиомиелита, дифтерии, столбняка, коклюша, кори. В этом возрасте иммунная система организма, как правило, отвечает на введение вакцины выработкой активного иммунитета, в частности путем формирования клонов долгоживущих Т-клеток. Благодаря этому впоследствии при встрече с болезнетворным микроорганизмом включается сигнал колониальной экспансии, активирующий Т-лимфоциты. Несмотря на это, предполагают, что возрастное ослабление иммунной системы, проявляющееся в виде слабой устойчивости к инфекциям, невосприимчивости к вакцинам и аутоиммунным заболеваниям, обусловлено прежде всего старением тимуса. Ведь разнообразные инфекции атакуют человека на протяжении всей его жизни, и «запастись» специфичными иммунными клетками на все случаи практически невозможно, да и запас Т-лимфоцитов постепенно исчерпывается.
Из всех органов иммунной системы только для тимуса характерна возрастная инволюция. Однако следует отметить, что количество Т-лимфоцитов долгое время сохраняется на достаточном уровне
Можно ли «омолодить» тимус?
Фактически тимус начинает деградировать с первых лет жизни, однако это становится заметно в период полового созревания. Закономерно, что инволюция тимуса напрямую связана с влиянием половых гормонов. Отмечено, что инволюцию тимуса способны замедлить пептиды шишковидной железы. Аналогичным образом действует ее гормон мелатонин, способный даже вызывать «омоложение» органа. Поскольку с возрастом ткань тимуса заменяется жировыми клетками, логично, что тимус довольно хорошо восстанавливается при соблюдении низкокалорийной диеты. Способствует этому, скорее всего, «гормон голода» — грелин, правда, у него есть побочный эффект в виде ослабления сексуальной мотивации. У людей старше 70 лет отмечен более разнообразны набор Т-клеточных рецепторов по сравнению с теми, которые еще не преодолели 70-летний рубеж. Удивительно, что продукция Т-лимфоцитов тимусом, пусть и в небольшом количестве, сохраняется даже у людей 100-летнего возраста. При этом у долгожителей менее выражены популяции клеток-клонов — то есть клеток, произошедших от одного активированного Т-лимфоцита. Возможно, именно эти особенности иммунитета позволяют долгожителям лучше противостоять инфекциям и быть более здоровыми. При этом возникает «тимусная селекция», в результате которой люди со сниженным иммунитетом реже становятся долгожителями.
Теперь понятно, почему тимус деградирует с возрастом. Во-первых, производство каждого Т-лимфоцита является слишком энергозатратным процессом. Во-вторых, клетки, прошедшие все этапы созревания, дифференцировки и отбора, могут жить долго и в случае необходимости размножаться клонированием. В-третьих, специфичные наборы клеточных рецепторов практически на все случаи чужеродных антигенов способны сформироваться в течение первого десятилетия жизни, а затем шанс столкнуться с новым инфекционным агентом значительно уменьшается. В-четвертых, подвергать организм иммунологическому стрессу без острой на то необходимости не только нецелесообразно, но и крайне опасно
Татьяна Кривомаз, канд. биол. наук
Список литературы находится в редакции
Тимус – что это? Роль тимуса на первому году жизни ребенка
Ультразвуковая чистка кожи лица со скидкой 50%
Первичная консультация педиатра со скидкой
Консультация педиатра со скидкой 20%
Тимус (вилочковая железа) – важный орган иммунной системы детей. Он расположен в верхнем отделе грудной клетки и состоит из двух долей, соединяющихся в передней части трахеи. Железа растет до наступления половой зрелости, достигая массы 30–40 грамм, затем постепенно уменьшается (обратное развитие).
Она играет доминирующую роль в иммунной, эндокринной системе. Тимус продуцирует тимозин, тимопоэтин, стимулирующие выработку антител, а также производит Т-лимфоциты – белые клетки крови, уничтожающие аномальные клетки с чужеродными антигенами. Другая функция вилочковой железы – предотвращение патологического роста клеток и предупреждение рака. Следует отметить, что тимус играет ведущую роль в иммунитете ребенка до трех лет.
Роль тимуса в жизни ребёнка
До рождения и в детстве тимус ответственен за производство плюс созревание Т-лимфоцитов, защищающих организм от определенных угроз, включая вирусы, бактерии. Тимус является крупнейшим лимфоидным органом у новорожденных, так как активнее других тканей продуцирует лимфоциты. Железа выступает «первой скрипкой» в развитии и улучшении иммунной системы ребенка.
Тимус производит и секретирует тимозин – гормон, необходимый для выработки Т-клеток. После «созревания» в железе они поступают в кровь и мигрируют в лимфоузлы и селезенку, где помогают иммунной системе бороться с болезнью.
В некоторых случаях функции вилочковой железы снижены, что ослабляет иммунную систему, увеличивая склонность к инфекциям и аллергии. Ребенок страдает затяжными ОРВИ, патология легко переходит в хроническую. Недостаток Т-лимфоцитов в организме может привести к иммунодефицитным заболеваниям, характеризующимися сильной потливостью, отечностью и/или болезненностью горла, припухлостью лимфатических узлов, депрессией.
Недоедание и дефицит белка в раннем возрасте обусловливает медленный или ограниченный рост тимуса, «подрывая» тем самым нормальное функционирование лимфоцитов. Вот почему важно сбалансированное питание с достаточным количеством белка.
Доктора данного направления
Патология тимуса
Основные виды патологии тимуса:
Увеличение тимуса у детей
Отклонение в размере тимуса в большую сторону и снижение его функции обозначают термином «синдром увеличенной вилочковой железы» (СУВЖ) у детей. Проблему увеличенного тимуса чаще рассматривают в свете дифференциальной диагностики с плевритом, перикардитом, опухолями средостения, другими патологиями.
Ошибочно считают, что увеличенный тимус у детей грудного или раннего возраста является физиологическим состоянием. Особенности протекания инфекционных заболеваний у маленьких пациентов с СУВЖ заставляют классифицировать синдром, как патологию. Дети с СУВЖ имеют большую вероятность развития дисбаланса нейроэндокринной плюс иммунной систем. Поэтому пациенты с выявленным увеличением тимуса требуют полного обследования и диспансерного наблюдения у эндокринолога, иммунолога.
Симптомы заболевания или нарушения развития вилочкой железы
Для того, что бы вовремя выявить патологию тимуса, родителям стоит обратить внимание на отклонения, имеющие различную степень выраженности, которые могут свидетельствовать о заболевании или нарушении развития вилочковой железы:
При возникновении подозрений на патологию тимуса, врач может назначить дополнительные методы обследования:
Тимическая недостаточность поддается иммунокорекции, которая индивидуально подбирается врачом аллергологом-иммунологом. Стоит обратить внимание, что своевременная диагностика патологии вилочковой железы особенно актуальна на первом году жизни ребенка, когда ребенку начинают проводить вакцинацию.
Для получения подробных консультаций о роли тимуса в жизни ребёнка на первом году жизни обращайтесь к педиатрам медицинских центров «Президент-Мед»
ТИМОМЕГАЛИЯ И СИНДРОМ ПЛАТТЕРА
История относительно интенсивного изучения вилочковой железы ( glandula thymus, thymus ) насчитывает около 400 лет. Начало его относится к 1614 г., когда профессор Базельского университета Феликс Платтер описал происшедшую у него
В середине XIX в. профессор Венского университета Карл Рокитанский высказал предположение об инкреторной функции вилочковой железы. Данная концепция была положена в основу представлений о тимико-лимфатическом статусе [1, 2] как врожденной особенности конституции, предрасполагающей к внезапной смерти от незначительных причин. В симптомокомплекс тимико-лимфатического статуса включались первичная гиперфункция вилочковой железы, гипоплазия надпочечников, сердца и аорты [1–5]. С этого времени причиной тимической смерти стали считать острую надпочечниковую недостаточность [3, 4]. Однако отсутствие характерных для тимико-лимфатического состояния признаков во многих случаях при такой смерти, в том числе и симптомов надпочечниковой недостаточности, позволило поставить под сомнение и данную концепцию.
В начале 1960-х гг. было доказано, что тимус является центральным органом иммунной системы. С этого времени вилочковая железа рассматривается в качестве железы внутренней секреции, действие гормонов которой направлено на дифференцировку тимических лимфоцитов. Открытие основной функции вилочковой железы — продукции Т-лимфоцитов и регуляции иммунитета, а также принадлежность ее к системе эндокринных желез позволяют рассматривать данный орган как коммутатор иммунной и эндокринной систем. В серии работ отечественных исследователей последних 20 лет доказывается, что дети с большой вилочковой железой относятся к числу иммунодефицитных лиц.
В 1970 г. проф. Т. Е. Ивановской [6] для обозначения увеличенной вилочковой железы вместо вышеуказанных терминов был предложен термин «тимомегалия». Под тимомегалией российские морфологи понимают увеличение объема и массы тимуса выше предельных возрастных значений с сохранением нормальной гистоархитектоники органа. Начиная с 1970 г., этот термин стал широко использоваться как морфологами, так и клиницистами.
Однако проведенные исследования показали, что тимомегалия является лишь одним из симптомов того состояния, которое существует у детей, имеющих увеличенную вилочковую железу [7]. В связи с отсутствием другого термина, отражающего сущность состояния, которое имеет место у детей с увеличенной вилочковой железой (соответствующей тимомегалии в понимании патологоанатомов), предлагаем называть его синдромом Платтера.
Термином «синдром Платтера» следует обозначать состояние, при котором клинические и параклинические методы обследования позволяют выявить у детей и подростков ряд специфических изменений организма, сочетающихся с первичной длительно сохраняющейся тимомегалией. Клиническое понимание тимомегалии при синдроме Платтера отражает морфологическое состояние вилочковой железы, при котором масса и объем тимуса превышают предельные возрастные значения при сохранении нормальной гистоархитектоники органа.
Диагностика тимомегалии в клинической практике
Ориентировочная диагностика тимомегалии может быть проведена с помощью объективного исследования: осмотра, пальпации, перкуссии. Однако оценка результатов во многом субъективна и зависит от опыта исследователя [7].
Из инструментальных методов, позволяющих объективно выявить тимомегалию, используются рентгенодиагностика и ультразвуковое исследование (УЗИ).
Рентгенодиагностика. Методологической основой рентгенодиагностики увеличенного тимуса является следующее положение: в норме у детей любого возраста на стандартных рентгенограммах грудной клетки в прямой проекции тень тимуса не должна выходить за пределы тени сосудистого пучка и сердца.
В целях диагностики тимомегалии на рентгенограммах грудной клетки в прямой проекции мы применяли кардио-тимико-торакальный индекс (КТТИ) по J. Gewolb [8] и вазокардиальный индекс (ВКИ) [7]. Оба индекса определяются на стандартных рентгенограммах грудной клетки в прямой проекции. КТТИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на ширину грудной клетки на уровне купола диафрагмы. ВКИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на максимальную ширину тени сердца. Максимальная ширина тени сердца определяется как сумма двух перпендикулярных отрезков, опущенных на вертикальную линию (проведенную через середину позвоночного столба) из максимально удаленных от нее точек сердца слева и справа (рис. 1).
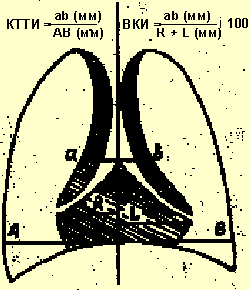 |
| Рисунок 1. Схема вычисления индексов КТТИ и ВКИ |
Выявление в средостении характерной овальной, треугольной или лентовидной тени с прямым, волнообразным или неровным контуром, расположенной с одной или обеих сторон сосудистого пучка, искажающей линию «сердечной талии» слева и/или вазокардиальный угол справа, позволяет сделать заключение о существовании у пациента тимомегалии. Наличие увеличенных значений КТТИ и ВКИ подтверждает данный диагноз. Рентгенологический метод, однако, информативен только для детей грудного и раннего возраста, поскольку у детей в возрасте старше 3 лет, как правило, тимус располагается за тенью сосудистого пучка и сердца. В таблице 1 приведены значения КТТИ и ВКИ у детей первых 3 лет жизни при разных степенях увеличения тимуса.
УЗИ. УЗИ тимуса в нашей стране впервые было проведено у новорожденных детей С. М. Воеводиным [9]. Путем клинико-морфологических сопоставлений нами были разработаны коэффициенты пересчета линейных параметров тимуса в более привычные для клиницистов формы (объема и массы органа). Округленные величины указанных коэффициентов, по нашим данным, равны 0,7 (для массы) и 0,5 (для объема). Таким образом, величины массы и объема тимуса при ультразвуковом сканировании вычисляются следующим образом:
М = 0,7 в a в b в c;
V = 0,5 в a в b в c,
где a, b, c — линейные параметры тимуса (ширина, длина, передне-задний размер, выраженные в см); 0,7 и 0,5 коэффициенты пересчета линейных параметров на массу и объем органа соответственно [10]. Для практических целей массу и объем вилочковой железы достаточно определять так, как это указано выше: без вычисления объема и массы отдельных долей.
Методом центильного распределения нами были определены нормальные значения массы и объема тимуса для детей в возрасте 1–24 мес (табл. 2). При превышении массы и объема тимуса выше верхних предельных значений нормы состояние ребенка следует расценивать как тимомегалию.
На основании анализа более 5000 рентгенограмм, выполненных у детей грудного возраста при подозрении на пневмонию, диагноз которой рентгенологически не был подтвержден, тимомегалия нами была выявлена у 35% пациентов 1 — 3 мес, у 15% детей в возрасте 3–6 мес, у 8% — в возрасте 7–15 мес, у 2% — в возрасте 16 — 36 мес, а в популяции детей старше 3 лет частота выявления тимомегалии не превышала 0,5% [8].
Наблюдение за одними и теми же детьми на протяжении длительного отрезка времени позволило нам сделать вывод, что тимомегалия в детском возрасте может быть как транзиторной, так и стойкой.
В 1993 г. нами совместно с О. В. Зайратьянцем была предложена классификация тимомегалии в детском возрасте на основе клинико-морфологических данных. Несколько измененный вариант указанной классификации приведен в табл. 3 (см. рубрику «Под стекло»). Наиболее частым вариантом тимомегалии в детском возрасте является синдром Платтера.
Анализ родословных позволил выявить у родственников первой и второй линии родства детей с синдромом Платтера высокую частоту встречаемости злокачественных новообразований, аутоиммунных заболеваний и заболеваний системы эндокринных органов. Так, злокачественные новообразования встречаются в каждой третьей семье, где есть дети с синдромом Платтера, с такой же частотой в этих семьях регистрируются эндокринные заболевания (преимущественно сахарный диабет и заболевания щитовидной железы). В семьях детей с синдромом Платтера статистически чаще, чем в семьях детей из выборки общей популяции, распространены аутоиммунные заболевания (диффузные болезни соединительной ткани) и туберкулез. Помимо этого, многие родители детей с указанным синдромом в дошкольном и младшем школьном возрасте относились к группе часто болеющих, т. е. к группе детей имевших повышенную склонность к острым респираторным вирусным инфекциям (ОРВИ).
Характер перечисленных заболеваний (склонность к вирусным, аутоиммунным, онкологическим заболеваниям, туберкулезу) может указывать на существование у близких родственников детей с синдромом Платтера недостаточной активности клеточного звена иммунной системы, поскольку, согласно современным воззрениям, все перечисленные заболевания находятся под контролем Т-клеточного иммунитета, формируемого вилочковой железой. При этом не совсем ясно, чем объясняется высокая отягощенность родственников детей с синдромом Платтера болезнями системы эндокринных органов. Однако не следует забывать о том, что эндокринные заболевания (в том числе сахарный диабет, диффузный токсический зоб, гипотиреоз) могут иметь аутоиммунный генез.
В таком случае у близких родственников детей с синдромом Платтера отчетливо просматривается тенденция к заболеваниям, связанным с иммунными механизмами клеточного типа, контролирующимися вилочковой железой. Это позволяет предполагать возможность передачи детям, у которых развился синдром Платтера, какого-то дефекта Т-звена иммунной системы.
Антенатальный период у большинства детей с синдромом Платтера осложняется хронической гипоксией, обусловленной острыми инфекционными заболеваниями или обострением хронических экстрагенитальных заболеваний матерей, наличием у них сосудистой дистонии, анемии, гестозов.
Осложненное течение интранатального периода отмечается не менее чем у 2/3 детей с синдромом Платтера. Наиболее частыми осложнениями этого периода явились стремительные или затяжные роды, приведшие к наложению щипцов или экстренному кесареву сечению.
Группа детей с указанным синдромом по фенотипу гетерогенна. 90% детей имеют мягкие округлые формы тела, некоторую пастозность тканей, относительно крупные черты уплощенного лица, прямой тип лба, широкоовальные глаза, относительно короткий нос с низким переносьем, средней величины или толстые губы, слабый изгиб профиля, короткую шею. Дети этой группы имеют как бы увеличенные поперечные размеры тела: широкое лицо, широкая грудная клетка, широкие плечи, широкие ладони и стопы, относительно короткие и широкие пальцы. Около 3/4 детей-европеоидов этой подгруппы имеют нежную, но несколько утолщенную, слабопигментированную белую кожу, для которой характерно быстрое развитие ожога после инсоляции, светлую окраску волос и глаз, слабое развитие мускулатуры, сниженную физическую активность. Дети данной подгруппы отличаются хорошим (и даже избыточным) аппетитом и высокими темпами роста.
В дошкольном и младшем школьном возрасте у них отмечаются хорошее развитие подкожного жирового слоя, слабое развитие мускулатуры, снижение общего тонуса и тургора тканей, а также физической активности, замедленная реакция на внешние раздражители, замедленное образование новых условных рефлексов, ослабление процессов внутреннего торможения с преобладанием реакций внешнего торможения.
Клиническая характеристика детей с синдромом Платтера включает характеристику системы лимфоидных органов, которая, согласно мнению большинства исследователей, отличается генерализованной гиперплазией системы лимфоидных органов: лимфатических узлов, лимфатических фолликулов корня языка, задней поверхности глотки, поверхности надгортанника, гипертрофией небных и глоточной миндалин. Наши наблюдения, однако, показали, что состояние периферических лимфоидных органов зависит от воздействия антигенного стимула — при отсутствии такого воздействия генерализованная гиперплазия периферического лимфоидного аппарата не развивается [7].
К числу особенностей физического развития детей грудного и раннего возраста относятся: высокие темпы увеличения длины тела, слабое развитие скелетной мускулатуры, несвоевременность и неправильный порядок прорезывания молочных зубов, относительно позднее начало самостоятельной ходьбы.
В эмоциональной сфере в первые 2–3 мес жизни обращает внимание менее выраженный комплекс оживления (за счет снижения двигательной активности).
Начало становления речи у детей с синдромом Платтера не отличалось от такового у детей соответствующего возраста в популяции в целом: гуление, слоги и первые слова у них появлялись своевременно.
К возрасту 10–11 мес они начинали произносить первые одно- и двусложные слова, к 1 году количество активно произносимых слов достигало 10–12. В дальнейшем 8% детей данной группы до 2-летнего возраста продолжали пользоваться только этими 10–12 словами. В возрасте 4,5–6 лет 25% детей этой группы страдали дислалией, требующей проведения корригирующих логопедических занятий в условиях детской поликлиники или в условиях специализированного детского сада. У отдельных пациентов нарушение, связанное с произношением звуков, сохранялось и в подростковом возрасте.
Состояние здоровья детей с синдромом Платтера. Здесь рассматриваются только те заболевания и патологические состояния, которые достоверно чаще встречались у детей с указанным синдромом, по сравнению с детьми из общей популяции. При анализе структуры выявленных заболеваний наибольшую по численности группу составили аномалии развития (выявлены у 80% наблюдавшихся пациентов) — пороки развития, множественные стигмы дизэмбриогенеза, биохимические дефекты. Пороки развития чаще проявлялись гипоплазией органов и тканей: широкие отверстия паховых каналов и пупочного кольца, септальные дефекты в сердце, гипоплазия аорты, сердца, легких, почек, щитовидной железы и др.
Вторая группа заболеваний была представлена патологическими состояниями нервной системы. Наряду с заболеваниями нервной системы, обусловленными биохимическими дефектами (синдром Менкеса; ганглиозидоз Gm1; фенилкетонурия; галактоземия), обращали на себя внимание такие синдромы, как гипертензионно-гидроцефальный (у 49%), фебрильных судорог (у 20%), мышечной гипотонии (у 18%) и вегетативно-висцеральной дисфункции (у 12,5%). Включение в комплекс обследования электрофизиологических методов, компьютерной и ядерно-магнитно-резонансной томографии привело к существенному увеличению частоты выявления гипертензионно-гидроцефального синдрома (выявлен у 90%). Указанный синдром у 2/3 детей сочетался с синдромами фебрильных судорог и вегетативно-висцеральных дисфункций, однако последние два синдрома у части детей встречались и изолированно.
Изолированный синдром вегетативно-висцеральных дисфункций характеризовался крайне выраженным полиморфизмом проявлений: нарушение терморегуляции, дыхания, сердечной деятельности, функции желудочно-кишечного тракта, пароксизмальное повышение артериального давления и другие расстройства. Мы склонны считать, что синдром вегето-висцеральных дисфункций у детей с синдромом Платтера встречается значительно чаще, чем у указанных 12,5% пациентов. На существование гиподиагностики синдрома вегето-висцеральных дисфункций могут указывать выявленные нами фенотипические особенности детей, в том числе очень хороший (скорее избыточный) аппетит, склонность к задержке жидкости, как бы немотивированный субфебрилитет. Наши наблюдения показали, что у большинства детей с якобы немотивированным субфебрилитетом последний хорошо контролировался мочегонными средствами, что явно указывает на связь этого симптома с ликворной гипертензией, в том числе с повышением давления в области третьего желудочка мозга — месте локализации центра терморегуляции.
У детей с синдромом Платтера обращал на себя внимание и синдром мышечной гипотонии, который у ряда пациентов был настолько сильно выражен, что специалисты высказывали предположение о наличии у них болезни Верднига–Гоффманна или миелодисплазии.
Таким образом, частое выявление у детей с синдромом Платтера внутренней гидроцефалии, изолированного синдрома вегето-висцеральных дисфункций, наличие вегетативных нарушений указывает на возможность нарушения функции диэнцефальной области. Изменения со стороны скелетной мускулатуры трактовать сложнее. Однако если учесть, что средний мозг, примыкающий к области сильвиева водопровода, контролирует регуляцию мышечного тонуса и сигналы к мышцам поступают через ретикулярную формацию по двум ретикулоспинальным путям [11], то это нарушение может быть рассмотрено с позиции существования у данного контингента детей внутренней гидроцефалии и расстройства ликвородинамики, поскольку гипоталамус, таламус и ретикулярная формация являются звеньями единой суперфункциональной системы, корригирующей гомеостатические программы наиболее сложных вегетативных, эндокринных, трофических и психических функций [12].
У 9% пациентов школьного возраста с синдромом Платтера зарегистрированы заболевания нейроэндокринной и эндокринной системы (диэнцефальный синдром, несахарный диабет, транзиторный несахарный диабет, транзиторный гипопаратиреоз, инсулинозависимый сахарный диабет, поликистоз яичников, эутиреоидная струма, диффузный токсический зоб, субкомпенсированный гипокортицизм). У детей с синдромом Платтера, отмечается тенденция к высоким показателям роста и слабой пигментации кожи, что может также указывать на дисфункцию гипоталамо-гипофизарной системы. Кроме того, у этих детей существует ряд симптомов, которые мы назвали торакальными и к числу которых относится синдром сдавления средостения. Этот синдром мы наблюдали только у детей первых 2–2,5 мес жизни при значительном увеличении тимуса.
Все исследователи, занимавшиеся изучением особенностей лиц со стойкой тимомегалией (а основную группу в них, вне всякого сомнения, составляют дети с синдромом Платтера), обращали внимание на их пониженную физическую активность.
При специальном опросе 72 пациентов в возрасте 10–24 лет с синдромом Платтера у 46% из них было отмечено негативное отношение к физическим нагрузкам, особенно к бегу на длинные дистанции и езде на велосипеде. Подростки и лица молодого возраста, способные передать ощущения, появлявшиеся при физической нагрузке, отмечали на ее фоне чувство слабости, ощущение нехватки воздуха.
Когда у 30 подростков с синдромом Платтера, не имевших органических заболеваний сердца, было проведено эхокардиографическое исследование сердца на аппарате 128 х Р — ACUSON (США) с определением массы миокарда левого желудочка сердца, у 27 из них индексированная (относительно массы тела) масса миокарда левого желудочка сердца оказалась достоверно меньше (р
Л. Г. Кузьменко, доктор медицинских наук, профессор
РУДН, Москва