Псевдофакия что это такое
Псевдоэксфолиативная глаукома
Автор:

Этим заболеванием в большей степени страдают женщины. Риск глаукомы увеличивается после возникновения псевдоэксфолиативного синдрома.
Примерно в 25% случаев ПЭГ у пациентов выявляется офтальмогипертензия. Частота данного заболевания у лиц с глаукомой напрямую связана с распространенностью в регионе проживания псевдоэксфолиативного синдрома. Методов профилактики ПЭГ не существует.
Механизм развития заболевания
Факторами развития псевдоэксфолиативной глаукомы являются деструктивные процессы, происходящие в базальной мембране хрусталикового эпителия, трабекул, цилиарного тела или радужки.
Активация данных процессов, приводит к выработке псевдоэксфолиативного материала. Этот, сероватого оттенка материал, состоит из фибрилл, при грануляции, откладывающихся на конъюнктиве и стекловидном теле. Такими отложениями перекрывается межтрабекулярное пространство и отток внутриглазной жидкости блокируется. Это становится причиной увеличения уровня внутриглазного давления.
Классификация ПЭГ
Специалисты-офтальмологи имеют разные взгляды на развитие данного заболевания, что и отразились в существующих ее классификациях. Отечественные ученые, склонны рассматривать ПЭГ, как один из видов первичной открытоугольной глаукомы. При этом, основным фактором развития заболевания признается псевдоэксфолиативный синдром (ПЭС).
В зарубежных источниках, глаукому на фоне ПЭС называют вторичной и не ограничивают открытым углом.
Мировая и российская научная офтальмология не продвинулись дальше попыток применения ПЭС классификационных схем.
К первому пункту относится стадия раннего, скрытого ПЭС. В этот период выявляются отложения псевдоэксфолиативного материала на передней камере гомогенным слоем, получившим определение «матового стекла». Скрытый ПЭС сопровождается появлением задних синехий.
Дальнейшее развитие болезни приводит к стадии «мини-ПЭС», которая заканчивается формированием классического синдрома. Этот период характеризуется локальным возникновением нарушений прекапсулярного слоя, появляющихся, как правило, в верхней хрусталиковой зоне.
Благодаря электронной микроскопии удалось определить и доклиническую стадию заболевания.
Более адаптированной к практике представляется классификация, предложенная проф. Е. Б. Ерошевской. Она учитывает характер и выраженность атрофии в радужке, а также объем эксфолиативных отложений. Согласно ей:
Необходимо упомянуть, что характеристики ПЭС, не ограничиваются биомикроскопией. Четвертая стадия ПЭС была установлена по итогам ультразвуковых исследований, опираясь на данные об интенсивности эксфолиативных отложений, их локализации, состояния волокон цинновой связки, а также наличия иных типов структурных изменений переднего сегмента глаза.
Симптомы заболевания
При псевдоэксфолиативной глаукоме больные могут ощущать следующее:
Кроме того, отмечается болезненность в глазном яблоке, появление красных кругов перед глазами при взгляде на яркий свет, «пелена» на глазах.
При возникновении приступа, из-за повышения давления начинаются головные боли. При прогрессировании глаукомы ухудшается периферическое зрение, что влечет за собой необратимое снижение остроты зрения всей области зрительного поля. Эти патологические изменения, в итоге приводят к слепоте.
Диагностика заболевания
Диагностика заболевания начинается со сбора анамнеза с учетом жалоб больного на ухудшение зрения, возникновение «пелены» перед глазами, чувство давления. Для подтверждение диагноза, проводят детальное исследование с применением таких методов, как:
Диагноз считается подтвержденным, если тонометрия выявляет повышенное внутриглазное давление, а визуально устанавлено наличие псевдоэксфолиативных отложений на радужке, трабекулах, хрусталике.
Лечение ПЭГ
Терапия псевдоэксфолиативной глаукомы преследует цель торможения прогрессирования процесса или снижения его скорости, так как полностью ликвидировать процесс невозможно.
Наши врачи, которые сохранят Вам зрение при глаукоме:
В лечении заболевания применяют следующие методы:
Консервативное лечение предусматривает назначение следующих групп препаратов:
Лазерное лечение применяют при невозможности медикаментозной терапии (непереносимость препаратов) или ее неэффективности. Это направление обычно включает:
Хирургическую операцию назначают в случае отсутствия результатов медикаментозного и лазерного лечения ПЭГ. В этом случае может быть назначена операция, призванная облегчить отток внутриглазной жидкости или вмешательство, в результате которого, выработка влаги сократится.
Раннее обнаружение и своевременная терапия данного заболевания, в большинстве случаев позволяет стабилизировать снижение зрения.
В медицинском центре «Московская Глазная Клиника» все желающие могут пройти обследование на самой современной диагностической аппаратуре, а по результатам – получить консультацию высококлассного специалиста. Клиника открыта семь дней в неделю и работает ежедневно с 9 ч до 21 ч. Наши специалисты помогут выявить причину снижения зрения, и проведут грамотное лечение выявленных патологий.
Уточнить стоимость той или иной процедуры, записаться на прием в «Московскую Глазную Клинику» Вы можете по телефонам в Москве 8 (800) 777-38-81, 8 (499) 322-36-36 (ежедневно с 9:00 до 21:00) или воспользовавшись формой онлайн-записи.
Псевдофакия что это такое
1, 2 Веселовская З.Ф., 1, 2 Веселовская Н.Н.
1 Киевский медицинский университет, Украина;
2 Киевский городской офтальмологический центр Киевской городской клинической больницы № 1, Украина; e-mail: Ця електронна адреса захищена від спам-ботів. Вам потрібно увімкнути JavaScript, щоб побачити її.
Резюме. В работе представлены современные положения относительно вторичной глаукомы – так называемой глаукомы артифакичного и/или афакичного типа. Представлено достаточно подробное описание главных механизмов развития этих видов глаукомы. Изложены основные представления о возможных интраоперационных осложнениях, а также их профилактике как до, так и во время операции.
Ключевые слова: глаукома, псевдофакия, афакия, патогенез, профилактика, лечение.
Артифакичная и афакичная глаукома – это вторичная глаукома, которая проявляется стойким повышением внутриглазного давления (ВГД). Термин «артифакичная и афакичная глаукома» достаточно широко применяют в хирургии катаракты, учитывая прогрессивный рост количества операций, связанных с удалением катаракты с и без имплантации интраокулярной линзы (ИОЛ). Например, в США ежегодно выполняют более двух миллионов таких операций [1]. Сегодня развитие глаукомы в послеоперационном периоде становится не такой уже редкостью.
Афакия и артифакия сами по себе не являются непосредственными причинами развития афакичной и артифакичной (псевдофакичной) глаукомы [3]. Достаточно высокая частота развития афакичной глаукомы наблюдается после удаления врожденной катаракты [2]. Анализ вышеуказанных состояний свидетельствует о существовании иных механизмов, которые могут либо самостоятельно, либо в комплексе способствовать развитию таких видов глаукомы.
Механизмы развития вторичной артифакичной и афакичной глаукомы
Деформация угла передней камеры
Краткосрочное повышение ВГД после удаления катаракты связывают с образованием в углу передней камеры глаза в проекции операционного разреза белого, снегоподобного «гребня» [3]. Чаще всего его рассматривают как результат шовной фиксации операционного доступа, длительно существующего отека стромы роговицы, образования периферических передних синехий, витреальных волокон, гифемы и др. [4, 5]. Как правило, деформация угла передней камеры возникает после экстра- и интракапсулярной экстракции катаракты, выполненной через большие роговичные и корнео-склеральные разрезы. Современные технологии малых и очень малых доступов обычно не приводят к такой деформации [6].
Вискоэластики
Их широко используют в современной технологии мануального и ультразвукового удаления катаракты для защиты эндотелия, поддержания объема передней камеры и капсульного мешка. Неполное вымывание из передней камеры на завершающем этапе операции вискоэластиков, преимущественно дисперсионных, приводит к частичной обструкции трабекулярной сети и повышению ВГД в послеоперацинном периоде [5]. В основном такая офтальмогипертензия краткосрочна.
Послеоперационные воспалительные и геморрагические осложнения
Послеоперационная воспалительная (увеальная) реакция может привести к клеточной и белково-фибринной обструкции трабекулярной сети, провоцируя повышение ВГД. Кроме того, развитие увеальной глаукомы (увеит–глаукома– гифема: UGH) в результате дистрофических изменений тканей в месте расположения/фиксации ИОЛ [5, 7, 8], а также неоваскуляризации внутренней поверхности роговицы в зоне доступа и к углу передней камеры может способствовать образованию спонтанной гифемы (синдром Свана), что в свою очередь повышает ВГД [8].
Дисперсия пигмента
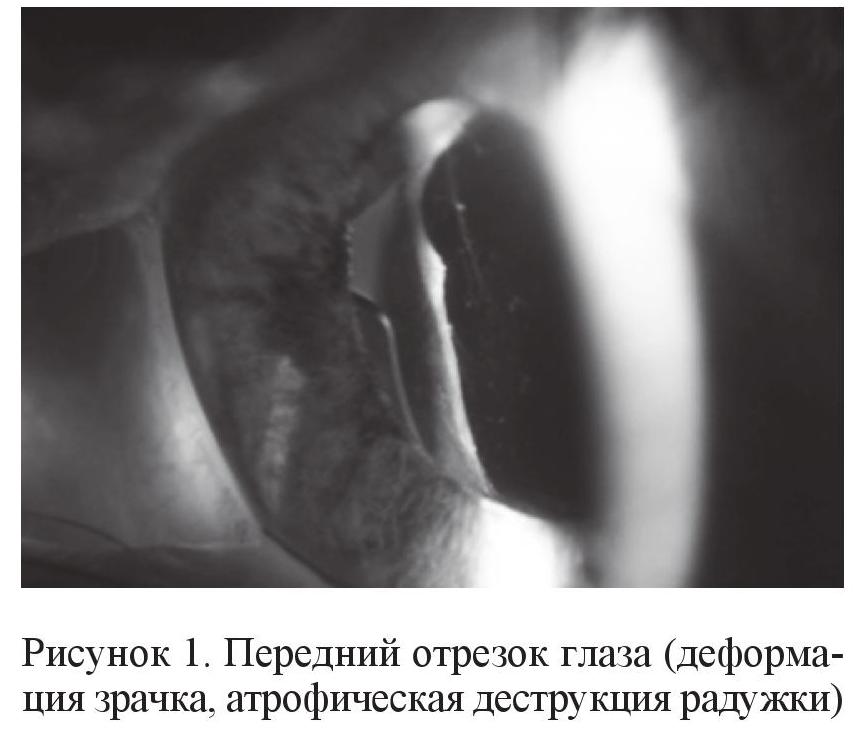
Как правило, обструкция трабекулы пигментом, который вымывается из пигментного эпителия радужки во время операции, часто приводит к стойкому повышению ВГД (рис. 1, Sunir Garg) [5]. Повышенная дисперсия пигмента – частая причина глаукомы послеоперационного периода у больных катарактой [9].
Выпадение стекловидного тела
Такое осложнение хорошо известно офтальмологам, когда из-за разрыва задней капсулы и гиалоидной мембраны стекловидного тела происходит острое закрытие угла передней камеры и резкое повышение ВГД. Это состояние нуждается в хирургическом или лазерном вмешательстве (иридотомия, репозиция стекловидного тела, передняя витрэктомия или лазерный витреолизис) [5].
Зрачковый блок
Данное состояние чаще всего развивается на глазах с афактичной глаукомой при отсутствии иридэктомии и попадании стекловидного тела в переднюю камеру. В результате адгезии радужки и деформации зрачкового края волокнами стекловидного тела происходит блокада угла передней камеры, скопление внутриглазной жидкости в задней камере глаза и смещение радужки кпереди. Наличие неравномерной по глубине передней камеры позволяет дифференцировать зрачковый блок от приступа злокачественной глаукомы при афакии [5]. В условиях псевдофакии такое состояние чаще всего возникает при наличии переднекамерных ИОЛ. Как правило, такая глаукома возникает в раннем послеоперационном периоде и требует хирургического или лазерного разблокирования угла передней камеры. При заднекамерных ИОЛ зрачковый блок может развиться на фоне дислокации или так называемого частичного захвата оптической части линзы зрачковым краем. Зрачковый блок в более позднем периоде может быть результатом вялотекущего увеита, передних синехий и частичного/полного захвата оптики ИОЛ с полной обструкцией зрачка.
Периферические передние синехии в области угла передней камеры
Длительно существующая мелкая передняя камера на фоне послеоперационного увеита часто сопровождается образованием синехий в углу передней камеры, смещением иридо-хрусталиковой диафрагмы и стекловидного тела кпереди, способствуя хроническому закрытию угла передней камеры и развитию хронической закрытоугольной глаукомы.
Влияние альфа-химотрипсина
Альфа-химотрипсин, как правило, использовали ранее при интракапсулярном удалении катаракты. В настоящее время это вещество является редким фактором развития послеоперационной глаукомы [5].
Остаточные хрусталиковые массы
Наличие остаточных хрусталиковых масс в передней камере и/или более крупных фрагментов ядра в стекловидном теле при возникших во время операции осложнениях может привести к послеоперационной гипертензии и вторичной глаукоме в результате обтурации трабекулярной сети, блокады оттока внутриглазной жидкости, повышения ВГД и развития воспалительной увеальной реакции.
Капсулотомия с использованием неодимового YAG-лазера
Применение данной техники для капсулотомии при вторичной катаракте глаза с афакичной или артифакичной глаукомой может быть причиной повышения ВГД, которое носит транзиторный характер, хотя в некоторых случаях возможна серьезная проблема. Стойкое повышение ВГД после лазерной капсулотомии связывают с наличием глаукомы или высоких значений этого показателя перед операцией, а также с миопией, отсутствием заднекамерной ИОЛ, с непосредственным влиянием лазерной энергии на окружающие ткани, увеальной реакцией и другими факторами [5]. Точный механизм повышения ВГД в настоящее время остается неясным, однако возникновение такого давления при открытом угле передней камеры чаще всего объясняют вялотекущей воспалительной реакцией с блокадой трабекулярной сети субстратами воспаления [5].
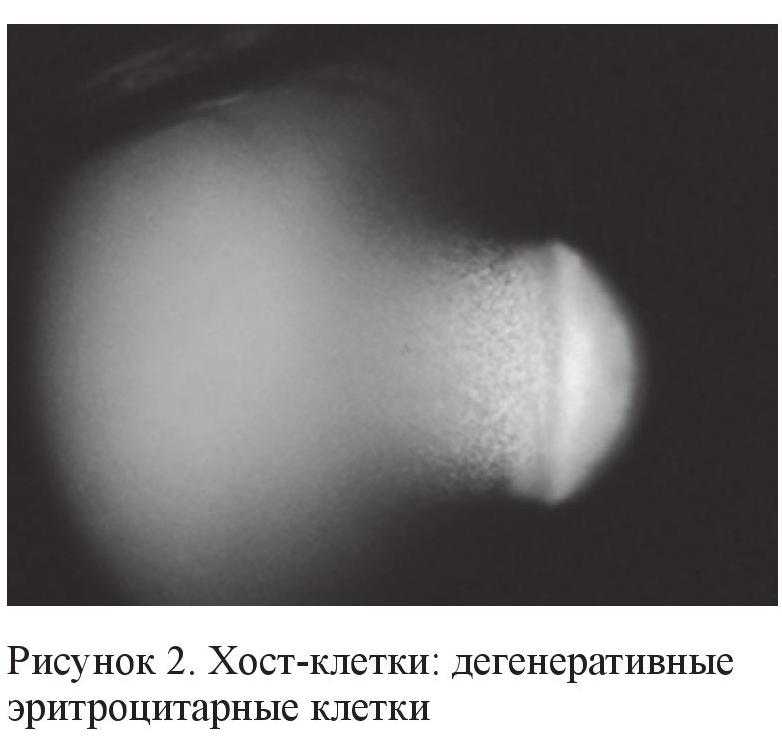
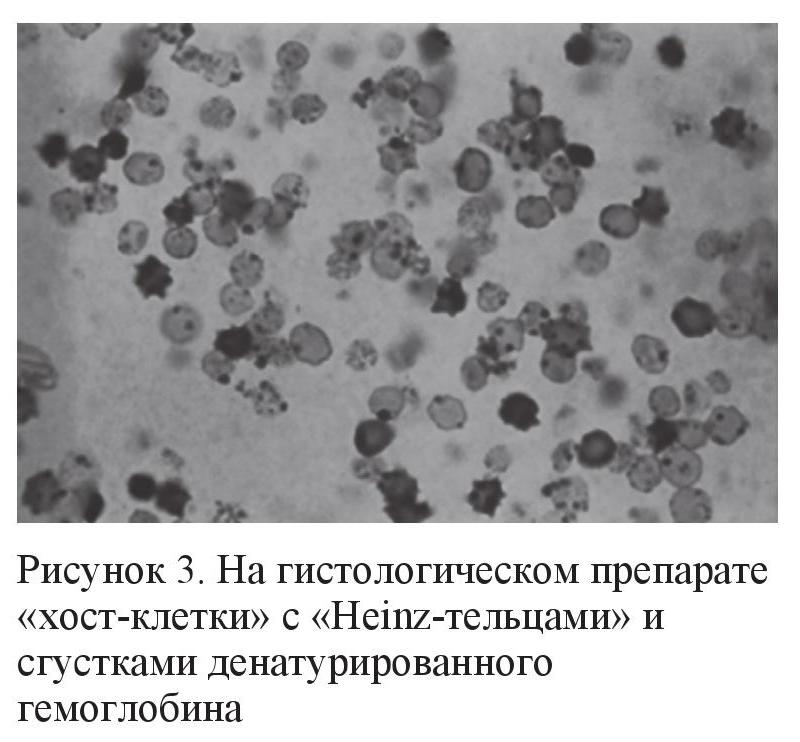
Трабекулярная вторичная глаукома (хост-клеточная или гемолитическая глаукома, согласно ICD (International Classification of Diseases) 365.63)
Этот вид вторичной глаукомы развивается в результате обтурации трабекулярной сети видоизмененными, выщелоченными или гемолизированными эритроцитами (рис. 2, 3) на фоне хронического воспаления и рецидивирующих гифемы и гемофтальма (операционные осложнения при удалении катаракты на фоне травмы, сосудисто-эндокринной патологии, заболеваний крови, вялотекущих увеитов, недиагностированных онкологических состояний глаза, UGH-синдроме и т. д.). Однако иногда такая глаукома может развиваться и спонтанно, хотя основным фактором риска являются рецидивирующие кровоизлияния в стекловидное тело [2, 3].
Эпидемиология
Оценка распространенности вторичной глаукомы после удаления катаракты колеблется в широких пределах: у пациентов с афакией в зависимости от метода удаления катаракты: по одним данным – менее 3 % [5], по другим – в пределах 5–41 % [2]; при артифакии после экстракапсулярной экстракции катаракты с ИОЛ – на уровне 11,3 %, а после мануального и ультразвукового удаления – в пределах 2,1–4 % [5].
Обследование пациентов с афакичной/псевдофакичной глаукомой для постановки диагноза существенно не различается [7, 8]. Особое значение имеет анамнез. При осмотре очень важно оценить состояние передней камеры, ее содержимого, а при артифакии – положение оптики и гаптики ИОЛ.
Анализ причины развития вторичной глаукомы у пациентов с артифакией и афакией
Высокое ВГД на 1–7-й неделе: дооперационная ПОУГ (первичная открытоугольная глаукома), остатки вискоэластика в передней камере, трабекулярный отек или деформация угла передней камеры, послеоперационная гифема и увеит, зрачковый блок, хориоидальное кровоизлияние и/или экссудат.
Высокое ВГД на 2–7-й неделе: дооперационная ПОУГ, стекловидное тело в передней камере, стероидная глаукома, трабекулярная, хост-клеточная глаукома (хост-клетки, хрусталиковые массы, неоваскуляризация угла передней камеры).
Высокое ВГД после 2 месяцев: дооперационная ПОУГ, трабекулярная хостклеточная глаукома, хрусталиковые массы, UGH-синдром, пигментная дисперсия, хронический увеит, эпителиальные прорастания, зрачковый блок [10].
Таким образом, в зависимости от структуры и топографии препятствия оттоку внутриглазной жидкости выделяют две формы вторичной артифакичной и афакичной глаукомы:
– претрабекулярную – блокада угла передней камеры соединительной тканью, клеточными элементами: эпителиальными клетками радужки и роговицы; эпителиальная регенерация;
– трабекулярную – блокада трабекулы пигментом (пигментная глаукома), эритроцитами (эритроцитарная глаукома), разрушенными эритроцитами (хост-клеточная глаукома), макрофагами (факолитическая глаукома), белками (острый передний увеит), псевдоэксфолиативным материалом.
Ведение пациентов с афакичной и артифакичной глаукомой
Дооперационная профилактика. Максимальное снижение ВГД до операции по поводу катаракты для снижения риска развития интра- и послеоперационных осложнений, используя местные и системные гипотензивные и осмотические препараты.
Интраоперационная профилактика. Совершенствование техники удаления катаракты с использованием современных оборудования и расходных материалов.
Послеоперационная. Терапия послеоперационной гипертензии зависит от причины.
Транзиторное повышение ВГД без ПОУГ в анамнезе не требует особого лечения. В глазах с ПОУГ в анамнезе рекомендуется применение антиглаукомных препаратов, предпочтительно из группы аналогов простагландинов, учитывая их противовоспалительные свойства. При выраженном повышении ВГД, отеке роговицы, дискомфорте целесообразно произвести пункцию передней камеры в асептических условиях для снижения в ней напряжения (глазные капли анестетика, обработка бетадином и антибиотиком).
При наличии увеального и геморрагического проявлений желательно чередование капель миотиков и мидриатиков для массажа зрачка и исключения захвата оптики, хотя такая манипуляция в большинстве случаев неэффективна. Рекомендована местная и системная противовоспалительная терапия на основе нестероидных противовоспалительных препаратов для исключения стероидного повышения ВГД.
Зрачковый блок, как правило, можно купировать методом иридотомии при афакичной глаукоме, а при артифакичной и при неэффективности применения терапии мидриатиками выполнить либо иридотомию, либо иридо-зонуло-гиалоидную витрэктомию.
В позднем послеоперационном периоде целесообразно для купирования высокого ВГД комбинировать известные группы антиглаукомных препаратов и системные осмо- и противовоспалительные средства. К хирургическому лечению прибегнуть можно в крайних случаях при неэффективности медикаментозной терапии. Микроинвазивные вмешательства обычно нерезультативны.
Имплантация дренажных устройств при неэффективности трабекулэптомии или в качестве первой линии среди хирургических методов лечения вторичной глаукомы отличаются достаточно высоким уровнем эффективности на глазах с артифакией заднекамерными ИОЛ. Объемные рандомизированные исследования подтвердили более высокую эффективность дренажных устройств в течение 5 лет при псевдофакичной глаукоме в сравнении с трабекулэктомией и митомицином С [12]. Диодная циклофотокоагуляция может быть использована на глазах с очень низкими зрительными функциями.
ВЫВОДЫ
Афакичная и артифакичная глаукома глаза относится к вторичным видам глаукомы и является достаточно частым осложнением раннего и позднего послеоперационного периода у больных катарактой. Учитывая негативные последствия длительной и плохо контролируемой офтальмогипертензии, своевременная диагностика, регулярное наблюдение и назначение патогенетически ориентированной терапии позволит обеспечить положительный долгосрочный прогноз состояния зрительных функций.
Псевдоэксфолиативный синдром
Псевдоэксфолиативный синдром – это увеопатия, характеризующаяся отложением амилоидоподобного вещества на структурах переднего сегмента глазного яблока. Клиническая картина представлена зрительной дисфункцией, появлением «помутнений» и «радужных кругов» перед глазами, затуманиванием зрения. Диагностика базируется на проведении ультразвуковой биомикроскопии, классической биомикроскопии с использованием щелевой лампы, скополаминовой пробы, УЗИ, визометрии, тонометрии, периметрии, гониоскопии. Консервативная терапия основывается на применении антиоксидантов, антигипоксантов, гипотензивных средств, витаминов группы В, А, Е.
Общие сведения
Псевдоэксфолиативный синдром впервые был описан финским ученым Дж. Линдбергом в 1917 году. Наблюдается взаимосвязь между развитием болезни и возрастом пациента. В 50-59 лет вероятность возникновения патологии составляет 1-2,5%, в 60-69 лет – 30%, после 70 лет – 42%. Согласно статистическим данным, заболевание диагностируется у 30% россиян старше 50 лет. Риск развития глаукомы у пациентов с псевдоэксфолиативным синдромом равен 64,6%. Патология чаще встречается среди представителей женского пола, однако тяжелее протекает у мужчин. Распространенность наиболее высока в серверных регионах.
Причины псевдоэксфолиативного синдрома
Этиология заболевания до конца не изучена. Продолжительное время ученые связывали развитие патологии с изменениями строения эпителия хрусталика, однако диагностика псевдоэксфолиативного синдрома после интракапсулярной экстракции катаракты позволила опровергнуть эту теорию. На сегодняшний день ведущая роль в развитии болезни отводится действию следующих факторов:
Ученые полагают, что развитию болезни способствует курение и аутоиммунные патологии. Удается проследить взаимосвязь между возникновением ПЭС и артериальной гипертензией, атеросклерозом, аневризмой аорты в анамнезе. Некоторые исследователи полагают, что данные изменения – это следствие системной васкулопатии, поэтому пациенты с ПЭС часто страдают кардиоваскулярными заболеваниями.
Патогенез
Ключевая роль в механизме развития заболевания отводится образованию и депонированию аномального экстрацеллюлярного микрофибриллярного белка на поверхности передней капсулы хрусталика и радужки, цилиарном теле, цинновых связках, по краю зрачкового отверстия. Реже визуализируются патологические отложения в области передней камеры. Установлено, что белок относится к амилоидоподобной субстанции, за его синтез отвечает пигментный эпителий и меланоциты радужки. Согласно современным представлениям, патогенез ПЭС связан с нарушением эпителио-мезенхимальных взаимоотношений в структурах глазного яблока. Проникновение белковых структур в толщу его оболочек ведет к их дистрофическому перерождению.
Псевдоэксфолиативный синдром принято рассматривать как системное нарушение метаболизма соединительной ткани. Подтверждением этой теории является обнаружение специфических отложений в паренхиматозных органах (печень, почки, сердце, головной мозг) и кожных покровах. Учеными было обнаружено 14 антигенов главного комплекса гистосовместимости (HLA) при наследуемой форме патологии. Прогрессирование заболевания ведет к атрофии пигментной каймы, что проявляется выраженной дисперсией пигмента. Пигментоциты удается обнаружить в УПК и на радужной оболочке. Из-за поражения дренажной сети нарушается отток водянистой влаги с последующим повышением внутриглазного давления.
Классификация
В офтальмологии различают генетически детерминированный и иммуноопосредованный вариант развития. Вне зависимости от патогенеза болезнь всегда возникает в преклонном возрасте. По выраженности дистрофических изменений выделяют следующие степени псевдоэксфолиативного синдрома:
Клиническая классификация базируется на результатах ультразвуковой биомикроскопии. Различают следующие стадии патологического процесса:
Симптомы псевдоэксфолиативного синдрома
Для заболевания характерно длительное бессимптомное течение. Вначале поражается один глаз (зачастую левый). Вовлечение второго глазного яблока, как правило, наблюдается спустя 5-10 лет после развития первых симптомов. Жалобы обычно возникают уже после массивного отложения амилоида. Пациенты отмечают появление «помутнений» перед глазами. При взгляде на источник света появляются специфические «радужные круги». Снижение остроты зрения обусловлено поражением хрусталика, повышением ВГД и атрофией сфинктера радужки. Нарушается аккомодационная способность, в дальнейшем расстройства аккомодации сопровождаются затуманиванием зрения, нарушением рефракции. Болевой синдром появляется только при повреждении связочного аппарата.
Заболевание очень медленно прогрессирует. Пациенты часто игнорируют клинические проявления. Помимо жалоб со стороны глаз при отложении белка во внутренних органах возникают симптомы их поражения. При депонировании амилоида в печени отмечается чувство тяжести в правом подреберье, реже – желтушность кожных покровов. Боль в пояснице по типу почечной колики, нарушения мочеиспускания являются типичными признаками скопления белковых масс в паренхиме почек. При распространении патологического процесса в толщу миокарда наблюдается ощущение сдавливания за грудиной, покалывание в области сердца. Доказано, что ПЭС широко распространена среди больных сенильной деменцией, когнитивными расстройствами, хронической ишемией головного мозга, болезнью Альцгеймера.
Осложнения
Отложение белка в толще хрусталиковых масс провоцирует развитие вторичной катаракты ядерного типа, которая зачастую сопровождается слабостью связочного аппарата. Это приводит к тому, что более чем у половины больных катарактой возникает сублюксация, реже – люксация хрусталика. В большинстве случаев патология осложняется офтальмогипертензией. Поражение трабекулярной сети ведет к возникновению псевдоэксфолиативной открытоугольной глаукомы, а с прогрессированием заболевания – к глаукомной оптической нейропатии или слепоте. Поражение мейбомиевых желез становится причиной ксерофтальмии.
Диагностика
Постановка диагноза на доклинической стадии затруднена. Выявить первые признаки можно только при помощи ультразвуковой биомикроскопии. Специфические методы диагностики включают:
Пациентам с данной патологией в анамнезе показана консультация невропатолога, ревматолога, кардиолога, гастроэнтеролога, отоларинголога. Необходимость проведения комплексного обследования вызвана системным поражением фиброзной ткани. Часто выявление первых симптомов поражения глаза позволяет диагностировать отложения амилоида в других паренхиматозных органах.
Лечение псевдоэксфолиативного синдрома
Этиотропная терапия псевдоэксфолиативного синдрома не разработана. Цель консервативного лечения – предупредить развитие тяжелых осложнений. На ранних стадиях показано применение:
При длительном течении патологии целью лечения является устранение или снижение выраженности вторичных осложнений. Медикаментозная терапия псевдоэксфолиативной глаукомы зачастую не оказывает должного эффекта. Возникает необходимость в лазерном или хирургическом вмешательстве. Наиболее целесообразно проведение ранней лазерной трабекулопластики, однако спустя 3-4 года возникают рецидивы повышения ВГД. При выборе метода удаления сублюксированного хрусталика следует отдавать предпочтение факоэмульсификации. Методикой резерва остается экстракапсулярная экстракция.
Прогноз и профилактика
Исход заболевания зависит от степени тяжести, характера поражения структур переднего отдела глаз и типа осложнений. При своевременной диагностике и лечении осложнений прогноз в отношении зрительных функций благоприятный. Возникновение вторичной глаукомы ассоциировано с резистентностью к консервативной терапии и риском необратимой потери зрения. Специфическая профилактика не разработана. Даже при ранних симптомах псевдоэксфолиативного синдрома необходима постановка на диспансерный учет у офтальмолога из-за высокой вероятности развития глаукомы. Показан регулярный контроль внутриглазного давления. Больные должны проходить комплексное офтальмологическое обследование не реже, чем два раза в год.