Простых веществ больше чем сложных
Разнообразие веществ. Простые и сложные, неорганические и органические вещества
Веществ существует очень много. Если химических элементов более ста, то веществ — более 10000000! Чтобы облегчить изучение и использование веществ, их разделяют на группы (классифицируют).
Какие вещества относятся к простым?
Вещества разделяют на простые и сложные. Рассмотрим примеры таких веществ: углерод, железо, кислород. Углерод образован атомами углерода. Из него изготавливают графитовые стержни карандашей. Железо, из которого сделано гвоздь, состоит из атомов железа. Эти тела, а следовательно, и вещества, из которых они образованы, вы видели не раз. Кислород мы не видим, но его недостаток чувствуем сразу. Это вещество состоит из молекул кислорода, образованных атомами кислорода.
Каждое из рассмотренных веществ образовано атомами одного химического элемента. Графит образуют атомы углерода, железо — атомы железа, кислород — атомы кислорода. Такие вещества называют простыми.
Молекулы некоторых простых веществ состоят из нескольких атомов. Например, молекула водорода состоит из двух атомов водорода, молекула кислорода — из двух атомов кислорода. Но несмотря на это, они остаются простыми веществами, так как их молекулы образовали атомы одного химического элемента.
Сложные вещества
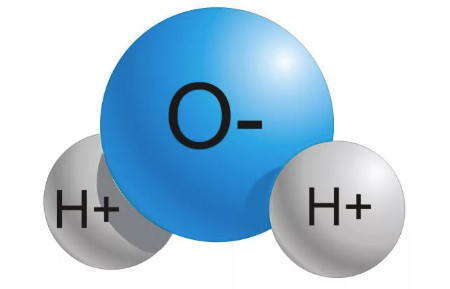
Вещества, образованные из атомов двух и более химических элементов, называют сложными. Например, каждая молекула воды содержит два атома водорода и один атом кислорода. Ее состав обозначают записью H2O, который читается «аш-два-о».
Другим примером сложных веществ является углекислый газ. Его выдыхают все живые организмы, а растениям он нужен для питания. Молекула углекислого газа образована одним атомом углерода и двумя атомами кислорода. Этот состав молекулы отражают записью СО2, который читается «це о два».
Почему сложных веществ больше, чем простых?
Ученые доказали, что атомы различных химических элементов способны соединяться друг с другом в разном количестве и последовательности. Подобно тому, как в языке сочетанием букв образуется разнообразие слов, сочетанием различных атомов и в разном количестве образовалось более 10000000 веществ. Так что неудивительно, что сложных веществ существует гораздо больше, чем простых.
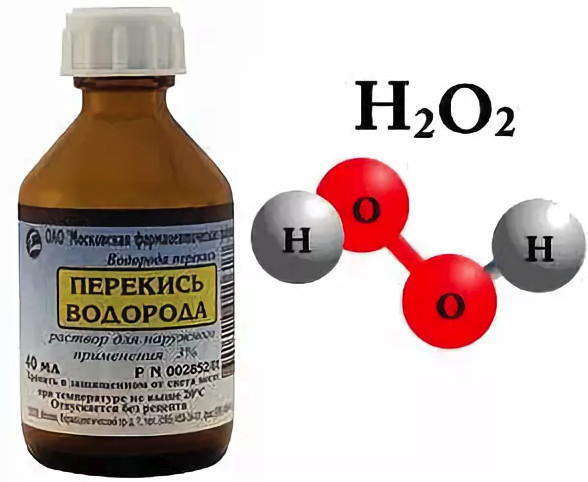
Рассмотрим еще раз рисунок и увидим, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Из таких же атомов состоит и вещество водород пероксида, однако она имеет совсем другие свойства, чем вода. Например, водород пероксида имеет температуру кипения выше на 50°С, обладает обеззараживающими свойствами. Ни одна аптечка не обходится без него, ведь раствором этого вещества под названием «перекись водорода» обрабатывают раны, чтобы они быстрее заживали. Такие отличные от воды свойства перекиси водорода обусловленные различиями в строении его молекулы. Ведь молекула этого вещества состоит из двух атомов водорода и двух атомов кислорода.
Органические и неорганические вещества
Вещества разделяют также на органические и неорганические. В состав всех органических веществ входят атомы углерода и, чаще всего, водорода. Так, из них образованы природный газ, вещества в составе нефти. В составе многих органических веществ содержатся еще и атомы кислорода. Это жиры, крахмал, сахар, уксус и другие. В состав важных для живых существ белков, кроме упомянутых элементов, обязательно входит азот.
Откуда такое название — органические вещества? Все очень просто. Первые из этих веществ ученые обнаружили в организмах — телах живой природы.
Есть и исключения. Некоторые вещества, содержащие атомы углерода, относят к неорганическим. Примерами являются углекислый газ, сода и еще несколько веществ.
Все тела природы, за исключением горных пород, воздуха и воды, состоят из органических веществ. Среди них больше всего углеводов (например, глюкозы и сахарозы), жиров (например, масла), белков (например, белок куриного яйца).
Многие органические вещества человек создал сам, например пластмассы, резину, полиэтилен. Они широко используются в машино- и самолетостроении, при сооружении зданий и мостов, а также в быту.
Без атомов углерода не существует никакой органического вещества. Так, атомы углерода вместе с атомами водорода и кислорода входят в состав органического вещества сахара, или сахарозы. Причем 1 молекула сахарозы состоит из 45 атомов. Среди них 12 атомов углерода, 22 атома водорода и 11 атомов кислорода. В том, что в составе сахара содержатся атомы углерода, убеждает черный цвет при сгорания кусочка сахара. Картофель или мясо, под действием высоких температур также обугливаются, приобретая черный цвет. Это является доказательством наличия углерода в составе органических веществ продуктов питания.
Заключение
Вещества разделяют на простые и сложные. Простые вещества образуются из атомов одного химического элемента. Сложные вещества образуются из атомов различных химических элементов.
Одной из классификаций веществ является разделение их на органические и неорганические. Органические вещества обязательно содержат атомы углерода.
Белки, жиры, углеводы — жизненно необходимые человеку органические вещества.
Простые и сложные вещества. Аллотропия. Химические соединения и смеси
Все вещества делятся на простые и сложные.
Простые вещества — это вещества, которые состоят из атомов одного элемента.
В некоторых простых веществах атомы одного элемента соединяются друг с другом и образуют молекулы. Такие простые вещества имеют молекулярное строение. К ним относятся: водород H2, кислород O2, азот N2, фтор F2, хлор Cl2, бром Br2, йод I2. Все эти вещества состоят из двухатомных молекул. (Обратите внимание, что названия простых веществ совпадают с названиями элементов!)
Другие простые вещества имеют атомное строение, т. е. состоят из атомов, между которыми существуют определенные связи. Примерами таких простых веществ являются все металлы (железо Fe, медь Сu, натрий Na и т. д.) и некоторые неметаллы (углерод С, кремний Si и др.). Не только названия, но и формулы этих простых веществ совпадают с символами элементов.
Существует также группа простых веществ, которые называются благородными газами. К ним относятся: гелий Не, неон Ne, аргон Аr, криптон Kr, ксенон Хе, радон Rn. Эти простые вещества состоят из не связанных друг с другом атомов.
Каждый элемент образует как минимум одно простое вещество. Некоторые элементы могут образовывать не одно, а два или несколько простых веществ. Это явление называется аллотропией.
Аллотропия — это явление образования нескольких простых веществ одним элементом.
Разные простые вещества, которые образуются одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Аллотропные модификации могут отличаться друг от друга составом молекул. Например, элемент кислород образует два простых вещества. Одно из них состоит из двухатомных молекул О2 и имеет такое же название, как и элемент— кислород. Другое простое вещество состоит из трехатомных молекул О3 и имеет собственное название — озон.
Кислород О2 и озон О3 имеют различные физические и химические свойства.
Аллотропные модификации могут представлять собой твердые вещества, которые имеют различное строение кристаллов. Примером являются аллотропные модификации углерода С — алмаз и графит.
Число известных простых веществ (примерно 400) значительно больше, чем число химических элементов, так как многие элементы могут образовывать две или несколько аллотропных модификаций.
Сложные вещества — это вещества, которые состоят из атомов разных элементов.
Примеры сложных веществ: НCl, Н2O, NaCl, СО2, H2SO4 и т. д.
Сложные вещества часто называют химическими соединениями. В химических соединениях свойства простых веществ, из которых образуются эти соединения, не сохраняются. Свойства сложного вещества отличаются от свойств простых веществ, из которых оно образуется.
Например, хлорид натрия NaCl может образоваться из простых веществ — металлического натрия Na и газообразного хлора Сl Физические и химические свойства NaCl отличаются от свойств Na и Cl2.
В природе, как правило, встречаются не чистые вещества, а смеси веществ. В практической деятельности мы также обычно используем смеси веществ. Любая смесь состоит из двух или большего числа веществ, которые называются компонентами смеси.
Например, воздух представляет собой смесь нескольких газообразных веществ: кислорода О2 (21 % по объему), азота N2 (78%), углекислого газа СО2 и др. Смесями являются растворы многих веществ, сплавы некоторых металлов и т. д.
Смеси веществ бывают гомогенными (однородными) и гетерогенными (неоднородными).
Гомогенные смеси — это смеси, в которых между компонентами нет поверхности раздела.
Гомогенными являются смеси газов (в частности, воздух), жидкие растворы (например, раствор сахара в воде).
Гетерогенные смеси — это смеси, в которых компоненты разделяются поверхностью раздела.
К гетерогенным относятся смеси твердых веществ (песок + порошок мела), смеси нерастворимых друг в друге жидкостей (вода + масло), смеси жидкостей и нерастворимых в нем твердых веществ (вода + мел).
Важнейшие отличия смесей от химических соединений:
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Явление аллотропии вызывается двумя причинами:
Основные классы неорганических веществ
Бинарные соединения
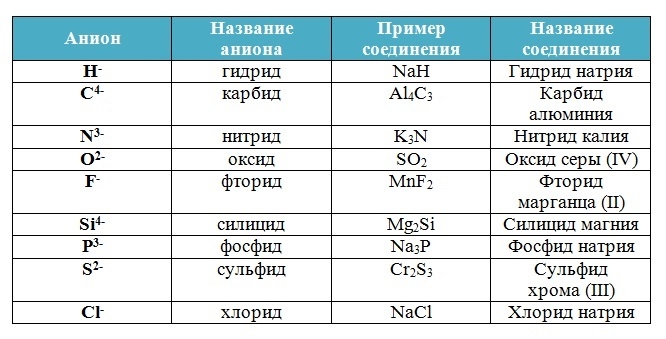
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Оксиды
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
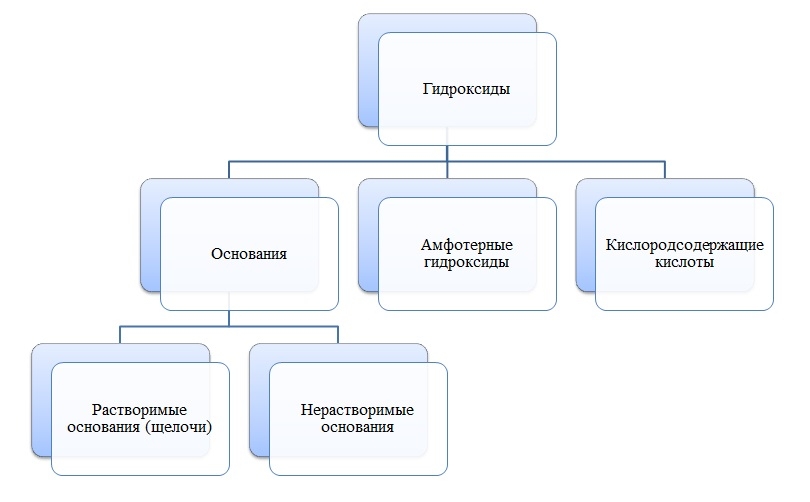
Гидроксиды
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Дополнительные материалы
Станьте первым, кто оставит
комментарий к данному материалу.
Виды простых и сложных веществ
Простые и сложные вещества в химии
В неорганической химии вещества по составу делятся на простые и сложные.
Сложные вещества — соединения:
Классификация простых веществ
1. Простые вещества условно делят на две группы: металлы и неметаллы.
Неметаллы в Периодической системе — это все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы V А-группы: азот, фосфор, мышьяк; углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
Отличия свойств металлов и неметаллов приведены в таблице 1:
Амфотерные элементы находятся в А-группах Периодической системы: бериллий Be, алюминий Al, галлий Ga, германий Ge, олово Sn, свинец Pb, сурьма Sb, висмут Bi, полоний Po и др., а также большинство элементов Б-групп: хром Cr, марганец Mn, железо Fe, цинк Zn, кадмий Cd, золото Au и др., проявляют и металлические (оснóвные для соединений), и неметаллические (кислотные для соединений) свойства.
Благородные (инертные) газы (VIII А-группа Периодической системы): гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
2. Сложные соединения и их отличия от простых веществ.
Сложные вещества бывают органические, в основе которых лежит углерод, и неорганические (безуглеродные и некоторые углеродсодержащие соединения: карбиды, карбонаты, оксиды углерода и другие). Неорганические чаще всего подразделяют на оксиды, основания, кислоты и соли.
Главные отличия сложных неорганических веществ:
Классификация неорганических соединений и их основные свойства приведены в таблице 2.
Классы и номенклатура неорганических веществ
Номенклатура — способ называния веществ.
Химическая формула — представление состава вещества с использованием символов химических элементов, числовых индексов и других знаков. Химическое название определяется составом вещества и изображается с помощью слова или группы слов. Названия строятся по номенклатурным правилам, с использованием русских названий элементов, кроме случаев, когда традиционно употребляются латинские корни (таблица 3):
Li+1 и O-2→ Li2O; Al+3 и O-2→ Al2O3; N+5 и O-2→ N2O5.
Название оксида: слово «оксид» в именительном падеже + название элемента Э в родительном падеже: оксид лития Li2O, оксид алюминия Al2O3.
Если элемент образует несколько оксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Оксиды, которым соответствуют кислоты, также называют ангидридами: серный ангидрид SO3, азотный ангидрид N2O5 и др.
K+1 и OH- → KOH, Mg+2 и OH- → Mg(OH)2.
Название: слово «гидроксид» в именительном падеже + название элемента в родительном падеже: гидроксид калия, гидроксид магния.
Если элемент образует несколько гидроксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
Fe(OH)2 — гидроксид железа (II), Cr(OH)3 — гидроксид хрома (III).
Названия бескислородных кислот: корень русского названия элемента, образующего кислоту + суффикс «о» + «-водородная кислота», например: HBr — бромоводородная кислота, HCl — хлороводородная кислота, H2S — сероводородная кислота.
Названия кислородсодержащих кислот: русское название образующего элемента + «кислота», с учетом правил:
Названия наиболее распространенных кислот и их остатков приведены в таблице 4:
| Формула и название кислоты | Название кислотного остатка, образующего соль |
| HAlO2 метаалюминиевая | метаалюминат |
| H3AlO3 ортоалюминиевая | ортоалюминат |
| HAsO3 метамышьяковая | метаарсенат |
| H3AsO4 ортомышьяковая | ортоарсенат |
| H3BO3 ортоборная | ортоборат |
| HBr бромоводородная | бромид |
| HBrO бромноватистая | гипобромит |
| HBrO3 бромноватая | бромат |
| HCN циановодородная | цианид |
| H2CO3 угольная | карбонат |
| HCl хлороводородная | хлорид |
| HClO хлорноватистая | гипохлорит |
| HClO2 хлористая | хлорит |
| HClO3 хлорноватая | хлорат |
| HClO4 хлорная | перхлорат |
| HF фтороводородная | фторид |
| HJ йодоводородная | йодид |
| HMnO4 марганцовая | перманганат |
| HNO2 азотистая | нитрит |
| HNO3 азотная | нитрат |
| HPO3 метафосфорная | метафосфат |
| H3PO4 ортофосфорная | ортофосфат |
| H2S сероводородная | сульфид |
| H2SO3 сернистая | сульфит |
| H2SO4 серная | сульфат |
| H2SiO3 метакремниевая | метасиликат |
| H3SiO4 ортокремниевая | ортосиликат |
Название образуется в зависимости от типа соли.
Бинарные соединения — сложные вещества, состоящие из двух элементов. В таких соединениях встречается два типа химической связи: ковалентная полярная (для неметаллов и некоторых амфотерных элементов) или ионная (для солей бескислородных кислот).
Для некоторых есть тривиальные названия: NH3 — аммиак, SiН4 — силан, PH3 — фосфин и др.
Строение и химические свойства
Простые вещества состоят из атомов одного химического элемента:
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения. Немолекулярное строение имеют все металлы и большинство их соединений, графит, красный фосфор, алмаз, кремний Si и др. Большинство неметаллов и их соединений состоят из молекул, т. е. имеют молекулярное строение.
Химические свойства металлов и неметаллов
1. Химические свойства металлов определяются способностью отдавать свободные электроны с внешнего уровня. Они являются восстановителями. Взаимодействие идет с:
2. Химические свойства неметаллов обусловлены свободными электронами (от 3 до 7) на внешнем электронном уровне.
Химические свойства благородных газов
Строение и основные химические свойства сложных веществ
Сложные соединения имеют ионную или ковалентную связь между атомами.
ZnO + H2SO4 → ZnSO4 + H2О,
ZnO+ 2NaOH + H2O → Na2[Zn(OH)4].
Все основания реагируют с кислотами (реакция нейтрализации):
1. Щелочи взаимодействуют с:
2. Нерастворимые основания разлагаются при нагревании: Cu(OH)2 → CuO + H2O.
Также о химических свойствах неорганических соединений можно почитать в статье «Классы неорганических соединений».
Простых веществ больше чем сложных
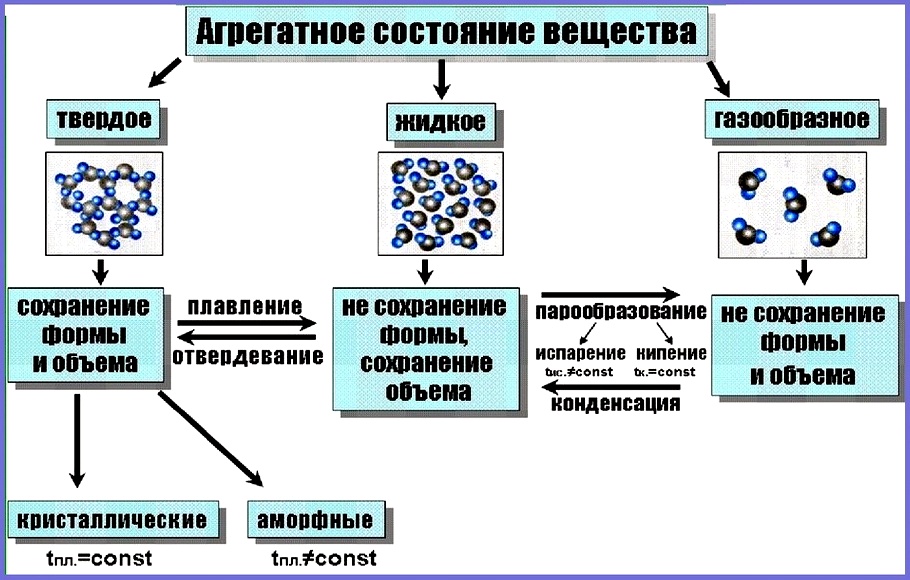
Вещества могут существовать только в трёх агрегатных состояниях: газообразном, жидком и твёрдом.
В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. В то время как частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
Вещества, которые состоят из молекул, — это вещества молекулярного строения. А вещества, которые состоят из атомов или ионов, — это вещества немолекулярного строения.
Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах.
Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
Простые и сложные вещества
Сложные вещества — это вещества, которые образованы атомами разного вида. Например, такое сложное вещество, как вода, состоит из атомов кислорода и водорода, углекислый газ — из атомов углерода и кислорода.
Такие вещества, как, например, сера, железо, кислород и водород, нельзя ни получить из более простых веществ, ни разложить. Эти вещества относят только к простым веществам.
Простые вещества — это вещества, которые образованы атомами одного вида. Например, простое вещество кислород состоит только из атомов кислорода, простое вещество графит — только из атомов углерода.
Сложные вещества и простые вещества молекулярного строения часто называют химическими соединениями.
Аллотропия
Аллотропия — это явление образования химическим элементом нескольких простых веществ, различных по строению и свойствам. Образующиеся вещества называются аллотропными видоизменениями. Примеры аллотропии:
С (углерод) — алмаз, графит, карбин, фуллерен, графин;
О (кислород) — собственно кислород, озон;
Р (фосфор) — белый, красный, черный, фиолетовый;
S (сера) — ромбическая, моноклинная, пластическая;
Si (кремний) — аморфный, кристаллический;
As (мышьяк) — желтый, серый, черный.
К примеру, у азота аллотропных модификаций нет.
Конспект урока «Простые и сложные вещества».