Простых веществ больше чем сложных да или нет
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Явление аллотропии вызывается двумя причинами:
Основные классы неорганических веществ
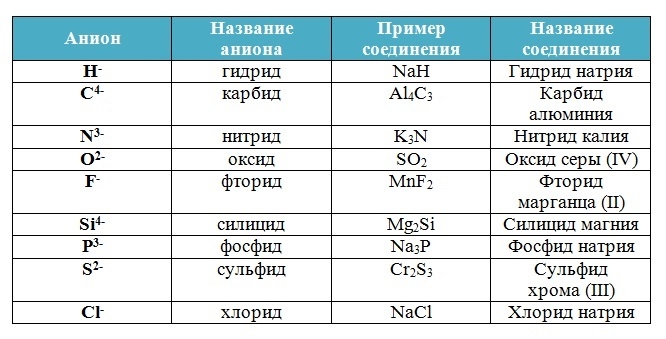
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Оксиды
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
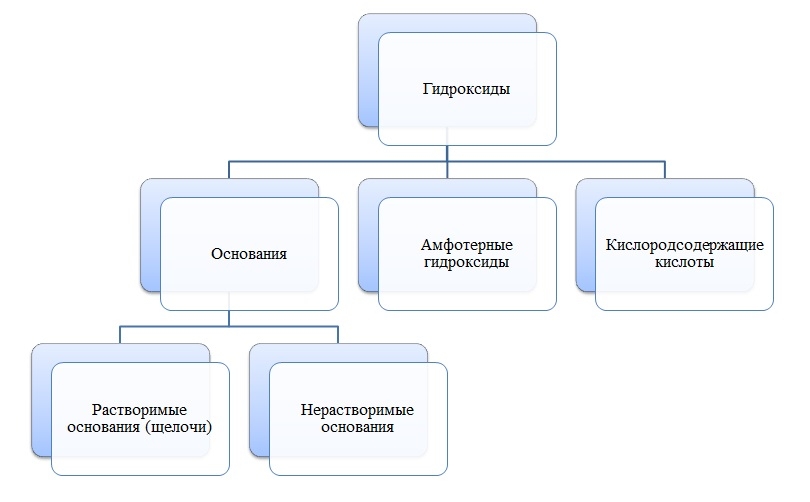
Гидроксиды
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Дополнительные материалы
Станьте первым, кто оставит
комментарий к данному материалу.
Простых веществ больше чем сложных да или нет
Выберите два высказывания, в которых говорится о фосфоре как о химическом элементе:
1) Молекула фосфина состоит из трёх атомов водорода и одного атома фосфора
2) Фосфор входит в состав смеси, наносимой на стенку спичечной коробки
3) Фосфор имеет несколько аллотропных модификаций
4) Фосфор входит в состав растительных и животных белков
5) Чёрный фосфор обладает полупроводниковыми свойствами
Запишите в поле ответа номера выбранных высказываний.
В предложениях 1 и 4 о фосфоре говорится как о химическом элементе, а в остальных — как о простом веществе.
Фраза «Фосфор имеет несколько аллотропных модификаций» относится к фосфору как веществу, а не как к элементу.
Выберите два высказывания, в которых говорится о сере как о химическом элементе:
1) Сера входит в состав некоторых аминокислот
2) Сера — это порошок жёлтого цвета, который не смачивается водой
3) Молекула сероводорода состоит из двух атомов водорода и одного атома серы
4) Сера не притягивается магнитом
5) Серу применяют для вулканизации каучука
Запишите в поле ответа номера выбранных высказываний.
В предложениях 1 и 3 о сере говорится как о химическом элементе, а в остальных — как о простом веществе.
Выберите два высказывания, в которых говорится о водороде как о химическом элементе:
1) Водород входит в состав большинства органических соединений
2) Водород — самый лёгкий газ
3) Водородом заполняют воздушные шары
4) Водород содержится в вулканических газах
5) Молекула метана содержит четыре атома водорода
Запишите в поле ответа номера выбранных высказываний.
В предложениях 1 и 5 о водороде говорится как о химическом элементе, а в остальных — как о простом веществе.
Выберите два высказывания, в которых говорится о хлоре как о химическом элементе:
1) Хлор — жёлто-зелёный удушающий газ
2) Атомная масса хлора составляет 35,453 а. е. м.
3) Молекула соляной кислоты содержит один атом хлора
4) Хлор использовался как боевое отравляющее вещество
5) Хлор при попадании в лёгкие вызывает ожог лёгочной ткани
Запишите в поле ответа номера выбранных высказываний.
В предложениях 2 и 3 о хлоре говорится как о химическом элементе, а в остальных — как о простом веществе.
Выберите два высказывания, в которых говорится о броме как о химическом элементе:
1) Бром принадлежит к главной подгруппе VII группы — галогенам
2) Бром ядовит, при соприкосновении с кожей образуются ожоги
3) При обычных условиях бром — красно-бурая летучая жидкость с резким неприятным запахом
4) Бром входит в состав боевых отравляющих веществ
5) Препараты брома имеют солёный вкус и оказывают седативный и снотворный эффект
Запишите в поле ответа номера выбранных высказываний.
В предложения 1 и 4 о броме говорится как о химическом элементе, а в остальных — как о простом веществе.
§ 2. Молекулы. Простые и сложные вещества. Химические формулы. Относительная молекулярная масса
1. Приведите примеры молекул, каждая из которых состоит из: а) двух атомов; б) трех атомов; в) четырех атомов.
а) водород, азот;
б) озон;
в) фосфор.
2. Каких веществ известно больше: простых или сложных?
3. Какие вещества в химии называют сложными?
Вещества в химии называют сложными, если они состоят из атомов разных химических элементов.
4. Выпишите из приведенного списка по отдельности формулы простых и сложных веществ и назовите их: CO2, H2O, O2, Cu, NaCl, SiO2, H2SO4, O3, NaOH, CuO.
Простые вещества:
O2 — кислород;
Cu — медь;
O3 — озон.
Сложные вещества:
CO2 — оксид углерода (IV), углекислый газ;
H2O — оксид водорода, вода;
NaCl — хлорид натрия;
SiO2 — оксид кремния (IV);
H2SO4 — серная кислота;
NaOH — гидроксид натрия;
CuO — оксид меди (II).
5. Приведите названия трех: а) простых веществ; б) сложных веществ.
а) кальций, водород, алюминий;
б) азотная кислота, поваренная соль, вода.
6. Приведите пять формул известных вам веществ.
HCl (соляная кислота), CO2 (углекислый газ), NaCl (хлорид натрия/поваренная соль), H2O (вода), CaCO3 (карбонат кальция/мел).
7. Что следует понимать под качественным и количественным составом вещества?
Качественный состав вещества показывает, из атомов каких химических элементов оно состоит.
Количественный состав характеризует число атомов каждого элемента в составе мельчайшей частицы вещества.
Урок№9. Простые и сложные вещества.
ОТЛИЧИТЕЛЬНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА СООТВЕТСТВУЮЩИХ ПРОСТЫХ ВЕЩЕСТВ
1. Твёрдое агрегатное состояние (исключение – ртуть)
2. Металлический блеск
3. Хорошие проводники тепла и электричества.
4. Пластичные и ковкие.
2. Металлическим блеском не обладают (исключение йод)
3. Не проводят тепло и электрический ток – ИЗОЛЯТОРЫ.
Об атомах и химических элементах
Другого ничего в природе нет
ни здесь, ни там, в космических глубинах:
все — от песчинок малых до планет —
из элементов состоит единых.
С. П. Щипачев, «Читая Менделеева».
В настоящее время известно более 107 видов атомов, то есть более 107 химических элементов. Нужно различать понятия “химический элемент”, “атом” и “простое вещество”
Простые и сложные вещества
К 70-м гг. XIX в. было уже известно более 60 химических элементов. Их условно классифицировали на металлы и неметаллы
На 2019 год в периодической таблице – 118 химических элементов, которые образуют около 500 простых веществ.
Итак, подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые – молекулы таких веществ состоят из атомов одного вида. В химических реакциях не могут разлагаться с образованием нескольких более простых веществ.
2. Сложные – молекулы таких веществ состоят из атомов разного вида. В химических реакциях могут разлагаться с образованием более простых веществ.
Различие понятий “химический элемент” и “простое вещество”
Отличить понятия “химический элемент” и “простое вещество” можно при сравнении свойств простых и сложных веществ. Например, простое вещество – кислород – бесцветный газ, необходимый для дыхания, поддерживающий горение. Мельчайшая частица простого вещества кислорода – молекула, которая состоит из двух атомов. Кислород входит также в состав оксида углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит химически связанный кислород, который не обладает свойствами простого вещества, в частности он не может быть использован для дыхания. Рыбы, например, дышат не химически связанным кислородом, входящим в состав молекулы воды, а свободным, растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических соединений, следует понимать, что в эти соединения входят не простые вещества, а атомы определенного вида, то есть соответствующие элементы.
При разложении сложных веществ, атомы могут выделяться в свободном состоянии и соединяясь, образовывать простые вещества. Простые вещества состоят из атомов одного элемента. Различие понятий «химический элемент» и «простое вещество» подтверждается и тем, что один и тот же элемент может образовывать несколько простых веществ. Например, атомы элемента кислорода могут образовать двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно различные простые вещества. Этим объясняется тот факт, что простых веществ известно гораздо больше, чем химических элементов.
Пользуясь понятием «химический элемент», можно дать такое определение простым и сложным веществам:
Простыми называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными называют такие вещества, которые состоят из атомов разных химических элементов.
Отличие понятий «смесь» и «химическое соединение»
Сложные вещества часто называют химическими соединениями.
Попробуйте ответить на вопросы:
1.Чем отличаются по составу смеси от химических соединений?
2. Сопоставьте свойства смесей и химических соединений?
3. Какими способами можно разделить на составляющие компоненты смеси и химического соединения?
4. Можно ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная характеристика смесей и химических
Химия 8 класс
1. Выберите два высказывания, в которых говорится о водороде как о простом веществе.
1) водород самый легкий газ
2) водород располагается в 1 периоде
3) водород чаще всего имеет степень окисления (-1)
4) водород входит в состав серной кислоты
5) водородом используют в химической промышленности
2. Укажите два примера твердых смесей
1) железные и древесные опилки
2) смесь воды и соли
3) смесь серебра и золота
3. Укажите относительная молекулярная масса, какого вещества больше
4. Укажите два примера реакций обмена:
1) Al(OH)3 + 3HCl→ AlCl3 + 3H2O
3) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
4) 2Na + 2H2O → 2NaOH + H2
5) SiO2 + 4HF → SiF4 + 2H2O
5. Составьте уравнения бинарных соединений по названиям:
фторид алюминия, хлорид железа (III), карбид магния, оксид азота (IV),
оксид бора, нитрид лития
6. Перепишите уравнения химических реакций. Расставьте коэффициенты в уравнениях. Укажите тип химических реакций.
1) TiO2 + Ca → CaO + Ti
4) Al2(SO4)3 + Ba(NO3)2 → Al(NO3)3 + BaSO4
7. Составьте уравнения реакций соединения.
8. Укажите массовая доля кислорода, в каком веществе больше: в оксиде лития Li2O или оксиде серы (VI) SO3 Проведите вычисления.
1) 1.5
2) 1.3
3) 1 (120г/моль)
4) 1,5
5)
AlF3 фторид алюминия,
AlCl3 хлорид железа (III),
MgC2 карбид магния,
N2O5 оксид азота (IV),
B2O3 оксид бора,
Li3N нитрид лития
6)
TiO2 + 2Ca = 2CaO + Ti
2S + C = CS2
P2O5 + 3H2O= 2H3PO4
Al2(SO4)3 + 3Ba(NO3)2 =2Al(NO3)3 + 3BaSO4
7)
2Al + 3S =Al2S3
2Mg + O2 =2MgO
2Li + F2=2LiF
2H2 + C =H4C (карбид водорода) = CH4 (метан)
8)
M(Li2O) =7*2+16=30
w(O)=16/30=0.53 =>53%
M(SO3)=32+16*3=80
w(O)=16*3/80=48/80=0.6 =>60%
Ответ: массовая доля кислорода больше в соединении SO3 (оксид серы VI)