Простагландин что это за гормон у женщин
Гормоны в организме человека. За что они отвечают
Гормоны – биологически активные вещества, вырабатывающиеся клетками эндокринных желез (желез внутренней секреции). Оттуда они поступают в кровь и с кровотоком попадают в клетки и ткани-мишени.
Там они связываются со специфическими рецепторами и таким образом регулируют обмен веществ и множество физиологических функций. Так, они отвечают:
Как работает эндокринная система
Разные внешние или внутренние раздражители действуют на чувствительные рецепторы. В результате формируются импульсы, которые действуют на гипоталамус (отдел головного мозга). В ответ на них в гипоталамусе вырабатываются биоактивные вещества, поступающие по локальным сосудам в другой отдел головного мозга – гипофиз.
В ответ на их поступление в гипофизе вырабатываются гормоны гипофиза. Они попадают в кровь и, достигнув с кровотоком конкретной эндокринной железы, стимулируют в ней синтез того или иного гормона. А затем уже этот гормон поступает с кровью к гормональным рецепторам органов-мишеней, как описано выше.
По химическому строению гормоны делят на 4 вида
Стероиды – производные холестерина. Вырабатываются в коре надпочечников (кортикоиды) и половых железах (андрогены, эстрогены). В эту же группу входит кальцитриол.
Производные жирных кислот– эйкозаноиды. К ним относятся простагландины – повышают чувствительность рецепторов к боли и воспалительным процессам, тромбоксаны – участвуют в процессах свертывания крови, лейкотриены – участвуют в патогенезе бронхоспазма.
Производные аминокислот, преимущественно тирозина – гормон стресса адреналин, предшественник адреналина норадреналин и гормоны щитовидной железы.
Белково-пептидные соединения – гормоны поджелудочной железы инсулин и глюкагон, а также гормон роста соматотропин и кортикотропин – стимулятор синтеза гормонов коры надпочечников. В эту же группу входит антидиуретический гормон вазопрессин, «гормон материнства» окситоцин и ТТГ и АКТГ.
По месту образования выделяют гормоны:
По механизму действия различают гормоны:
По биологическим функциям различают гормоны, регулирующие:
Функции основных гормонов в организме
Список по названиям
Тестостерон — вырабатывается и у мужчин, и у женщин. Отвечает:
Эстрогены – женские половые гормоны. Отвечают за формирование первичных половых признаков у женщин. Обеспечивают репродуктивные функции и эмоциональное состояние. У мужчин вырабатываются в жировой ткани живота из тестостерона. Стимулируют синтез коллагена и обеспечивают эластичность кожи. Принимают участие в работе кровеносной системы.
Прогестерон – сохраняет беременность и обеспечивает менструальный цикл у женщин. Кроме этого, и у женщин, и у мужчин он:
Дигидроэпиандростерон – вырабатывается в головном мозге и надпочечниках.
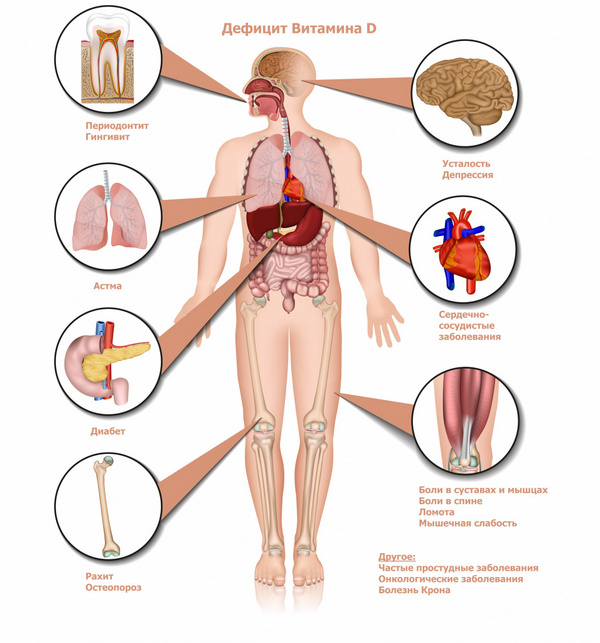
Д-гормон (так называемый витамин Д):
ТТГ — тиреотропный гормон гипофиза. Регулирует выработку гормонов щитовидной железы трийодтиронина Т3 и тироксина Т4. При дисбалансе гормонов щитовидной желез развиваются гипер- и гипотиреоз.
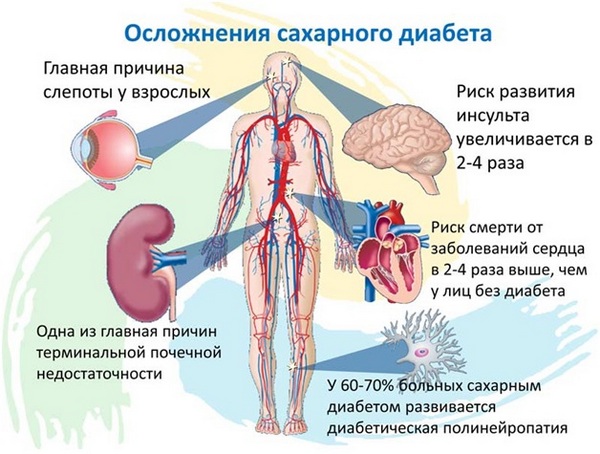
Инсулин – отвечает за усвоение глюкозы клетками. Стимулирует мышечный рост и аппетит. При нехватке инсулина развивается сахарный диабет. Избыток инсулина приводит к инсулинорезистентности (снижение чувствительности инсулинозависимых клеток к действию инсулина с последующим нарушением метаболизма глюкозы и поступления ее в клетки), что ведет к ожирению и развитию сахарного диабета 2 типа.
Дигидротестостерон – влияет на рост волос, образование акне, увеличение простаты у мужчин.
Кортизол – образуется из прогестерона. Адаптирует организм к влиянию стресса, защищает от воспалений, аллергических реакций, поддерживает в норме артериальное давление.
Альдостерон – гормон коры надпочечников; образуется из прогестерона. Отвечает за обмен солей и воды в организме.
СТП (соматотропный гормон) – гормон роста, избыток которого ведет к развитию акромегалии.
В каких случаях нужно сдавать анализы на гормоны
Если баланс эндокринной системы нарушается, в организме развиваются изменения. Нередко достаточно предельно малых отклонений от нормы, чтобы запустить патологический процесс.
Достаточно долго такие патпроцессы могут протекать бессимптомно. Когда же появляется симптоматика, то нередко патогенез уже необратим. Чтобы выявлять бессимптомные гормональные нарушения на ранних стадиях современная доказательная медицина настоятельно рекомендует пакетные проверки. Один раз в 6-12 месяцев достаточно сдать кровь на анализ, чтобы оценить состояние эндокринной системы и не допустить развития гормональных заболеваний.
Кроме этого, о необходимости сдать анализ на гормоны может свидетельствовать ряд признаков:
Также обязательно контролировать уровень гормонов при беременности, чтобы не допустить аномалий развития плода.
При планировании беременности необходимо пройти обследование щитовидной железы: сделать УЗИ щитовидной железы, пройти исследования гормонов ТТГ, Т4 свободный (свободный тироксин) и АТ к ТПО (антитела к тиреопероксидазе)
Во время беременности, если есть нарушение функций щитовидной железы, необходимо 1 раз в триместр проводить скрининг гормона ТТГ и консультироваться у эндокринолога.
Простагландины – универсальные биорегуляторы в организме человека (обзор литературы)
Авторы
Ключевые слова:
Аннотация
В последнее время учеными разных отраслей уделяется огромное внимание проблеме простагландинов.
Цель работы – на основе анализа данных отечественной и зарубежной литературы изучить и систематизировать основные вопросы структуры, биологического действия, метаболизма простагландинов в организме человека и применение их аналогов в фармации.
Простагландины – биологически активные вещества, близкие по своему действию к гормонам, но, в отличие от гормонов, они синтезируются не в эндокринных железах, а в клетках различных тканей организма. Простагландины как универсальные клеточные медиаторы широко распространены в организме, синтезируются в минимальных количествах практически во всех тканях, имеют как местное, так и системное воздействие. Для каждого простагландина существует свой орган-мишень. По химическому строению они небольшие молекулы, относящихся к эйкозаноидам – группе жироподобных веществ (липидов). В зависимости от химической структуры простагландины делятся на серии (A, B, C, D, E, F, G, H, I и J) и три группы (1–3); изомеры типа F обозначаются дополнительно буквами α и β.
Простагландины обладают чрезвычайно широким спектром физиологических эффектов, относятся к самым активным биогенных веществам, выполняют в организме три основные функции: поддерживающую, молекулярную, медиаторную. Большинство простагландинов взаимодействуют со специфическими рецепторами цитоплазматических мембран, однако некоторые простагландины (группа А) могут действовать нерецепторно. Запас простагландинов в организме отсутствует, жизненный цикл их короткий, они быстро образуются в ответ на воздействие биологических стимуляторов, проявляют свое действие в чрезвычайно скудных количествах и быстро инактивируются, попадая в кровь. В связи с чрезвычайно быстрым распадом в организме простагландины действуют в основном вблизи места их секреции. Препараты простагландинов и их производных используют в экспериментальной и клинической медицине для прерывания беременности и стимуляции родовой деятельности, терапии язвы желудка, бронхиальной астмы, некоторых сердечно-сосудистых заболеваний, врожденных пороков сердца у новорожденных, глаукомы, атеросклероза, ревматических, неврологических заболеваний, болезнях почек, сахарном диабете, коррекции гемостаза, как антикоагулянты при операциях с искусственным кровообращением, а также при гемодиализе.
Выводы. Простагландины – самые активные универсальные биогенные вещества в организме человека с чрезвычайно широким спектром физиологических эффектов. Они имеют как местное, так и системное воздействие, реализуют свое действие различными путями, их рецепторы содержатся практически во всех органах организма, для каждого простагландина существует свой орган-мишень. Указанные свойства простагландинов отражаются в их широком применении в медицине и фармации. Несмотря на активные исследования в данном направлении, у ученых остается много вопросов относительно механизмов действия, функций простагландинов и их аналогов в организме человека.
Библиографические ссылки
Bondarenko, O. A. (2012). Riven prostahlandyniv ta tsyklichnykh nukleotydiv u syrovattsi krovi khvorykh na khronichnyi pankreatyt, spoluchenyi z ozhyrinniam v dynamitsi zahalnopryiniatoho likuvannia [The level of prostaglandinums and cyclic nucleotides in serum blood of the patients with chronic pancreatitis, combined with obesity]. Ukrainskyi medychnyi almanakh, 15(2), 31–34 [in Ukrainian].
Victorov, О. P., Deyak, S. I., Bazyka, O. Y., Kashuba, O. V., & Matveyeva, О.V. (2011). Efektyvne ta bezpechne medychne zastosuvannia analhetykiv-antypiretykiv (pohliad na problemu) [Effective and safe analgetics-antipyretics use (problem view)]. Ukrainskyi medychnyi chasopys, 6(86), 90–93. [in Ukrainian].
Zharkova, T. S. (2015). Klinichne znachennia prostahlandyniv u formuvanni variantiv perebihu bakterialnykh kyshkovykh infektsii u ditei [Clinical significance of prostaglandins in the formation of courses of bacterial intestinal infections in children]. Zdorov’e rebenka, 62, 120–122. [in Ukrainian].
Zhuk, S. I., Khoroshaeva, N. E., & Salnikov, S. N. (2012). Dosvid dopolohovoi pidhotovky shyiky matky preparatamy, shcho mistiat promestryn [Experience of prenatal preparation of the cervix with drugs containing promestrin]. Reproduktivnaya e’ndokrinologiya, 4(6), 70–73 [in Ukrainian].
Ilkiv, I. I., Panasiuk, N. B., Biletska, L. P., & Skliarov, O. Ya. (2014). Zminy pokaznykiv systemy NO-syntaza/arhinaza za umov poiednanoi dii hostroho stresu ta blokuvannia tsyklooksyhenazy/lipooksyhenazy u tonkii kyshtsi [Changes indicators of NO-synthase/arginase under conditions combined effects of acute stress and blocking cyclooxygenase/lipooksyhenazе in the small intestine]. Eksperymentalna ta klinichna fiziolohiia i biokhimiia, 4, 19–25 [in Ukrainian].
Kuznietsov, S. V., & Zharkova, T. S. (2010). Rol prostahlandyniv u formuvanni klinichnoho variantu perebihu shyhelozu u ditei [The role of prostaglandins in the formation of the clinical alternative course of shigellosis in children]. Sovremennaya pediatriya, 3(31), 58–60 [in Ukrainian].
Pertseva, T. O., & Sanina, N. A. (2012). Rol systemnykh zapalnykh protsesiv u patohenezi khronichnoho obstruktyvnoho zakhvoriuvannia lehen [The role of systemic inflammation in the pathogenesis of chronic obstructive pulmonary disease]. Ukrainskyi pulmonolohichnyi zhurnal, 4, 48–50. [in Ukrainian].
Svintsitskyi, A. S., Kozak, N. P., & Antonenko, A. V. (2011). Adaptatsiia slyzovoi obolonky shlunka do dii nesteroidnykh protyzapalnykh preparativ [Adaptation of gastric mucosa to nonsteroidal anti-inflammatory drugs]. Ukrainskyi revmatolohichnyi zhurnal, 46(4), 1–3 [in Ukrainian].
Austin, S. C., Sanchez-Ramos, L., & Adair, C. D. (2010) Labor induction with intravaginal misoprostol compared with the dinoprostone vaginal insert: a systematic review and metaanalysis. Am J Obstet Gynecol, 202, 624.e1-9. doi: 10.1016/j.ajog.2010.03.014.
Brenneis, C., Coste, O., Altenrath, K., Angioni, C., Schmidt, H., Schuh, C. D., et al. (2011) Anti-inflammatory role of microsomal prostaglandin E synthase-1 in a model of neuroinflammation. J Biol Chem, 286(3), 2331–42. doi: 10.1074/jbc.M110.157362.
Brock, J. S., Hamberg, M., Balagunaseelan, N., Goodman, M., Morgenstern, R., Strandback, E., et al. (2016) A dynamic Asp-Arg interaction is essential for catalysis in microsomal prostaglandin E2 synthase. Proc Natl Acad Sci,113(4), 972–977. doi: 10.1073/pnas.1522891113.
Diakowska, D., Markocka-Mączka, K., Nienartowicz, M., Lewandowski, A., & Grabowski, K. (2014) Increased level of serum prostaglandin-2 in early stage of esophageal squamous cell carcinoma. Arch Med Sci., 10(5), 956–961. doi: 10.5114/aoms.2013.34985.
Facchinetti, F., Fontanesi, F., & Del Giovane, C. (2012) Pre-induction of labour: comparing dinoprostone vaginal insert to repeated prostaglandin administration: a systematic review and meta-analysis. J Matern Fetal Neonatal Med., 25, 1965–9. doi: 10.3109/14767058.2012.668584.
Hui, Y., Ricciotti, E., Crichton, I., Yu, Z., Wang, D., Stubbe, J., et al. (2010) Targeted deletions of cyclooxygenase-2 and atherogenesis in mice. Circulation, 121, 2654–2660. doi: 10.1161/CIRCULATIONAHA.109.910687.
Johansson, J. U., Woodling, N. S., Wang, Q., Panchal, M., Liang, X., Trueba-Saiz, A., et al. (2015) Prostaglandin signaling suppresses beneficial microglial function in Alzheimer’s disease models. J Clin Invest., 125(1), 350–364. doi: 10.1172/JCI77487.
Legler, D. F., Bruckne, M., Uetz-von Allmen, E., & Krause, P. (2010) Prostaglandin E2 at new glance: Novel insights in functional diversity offer therapeutic chances. Int J Biochem Cell Biol., 42, 198–201. doi: 10.1016/j.biocel.2009.09.015.
Rania, N., Ramzi, H., & Hébert, R. L. (2014) Chronic kidney disease: targeting prostaglandin E2 receptors. Am J Physiol Renal Physiol, 307, 243–250. doi: 10.1152/ajprenal.00224.2014.
Regner, K. R. (2012) Dual Role of Microsomal Prostaglandin E Synthase 1 in Chronic Kidney Disease. Hypertension, 59(1), 12–14. doi: 10.1161/HYPERTENSIONAHA.111.180034.
Ricciotti, E., & FitzGerald, G. A. (2011) Prostaglandins and Inflammation. Arterioscler Thromb Vasc Biol., 31(5), 986–1000. doi: 10.1161/ATVBAHA.110.207449.
Rooney Thompson, M., Towers, C. V., Howard, B. C., Hennessy, M. D., Wolfe, L., & Heitzman, C. (2015) The use of prostaglandin E1 in peripartum patients with asthma. Am J Obstet Gynecol, 212, 392.e1-3. doi: 10.1016/j.ajog.2014.11.042.
Samuelsson, B., Morgenstern, R., & Jakobsson, P. J. (2007) Membrane prostaglandin E synthase-1: a novel therapeutic target. Pharmacol Rev., 59, 207–24. doi: 10.1124/pr.59.3.1.
Satoh, H., Amagase, K., Ebara, S., Akiba, Y., & Takeuchi, K. (2013) Cyclooxygenase (COX)-1 and COX-2 both play an important role in the protection of the duodenal mucosa in cats. J. Pharmacol. Ther., 344(1), 189–195. doi: 10.1124/jpet.112.199182.
Простагландин что это за гормон у женщин
В перечислении свойств простагландинов заметна полярность их биологических эффектов. Это зависит от типа простагландина и их баланса между собой. Простагландинов есть несколько видов. Обратите внимание, что они вырабатываются, как у мужчины, так и у женщины многими тканями в разных органах по мере их необходимости. Но самое важное: эта группа гормонов из-за своей химической структуры может существовать или быть активной очень кратковременный период времени, поэтому простагландины действуют только местно или же на уровне тех клеток, которыми вырабатываются.
Роль простагландинов в регуляции репродуктивной системы женщины:
Участие в процессе овуляции. Под воздействием эстрогенов содержание простагландинов в клетках гранулезы достигает максимума к моменту овуляции и обеспечивает разрыв стенки зрелого фолликула (простагландины повышают сократительную активность гладкомышечных элементов оболочки фолликула и уменьшают образование коллагена). Простагландинам также приписывается способность к лютеолизу — регрессу желтого тела.
Транспорт яйцеклетки. Простагландины оказывают влияние на сократительную активность маточных труб: в фолликулиновой фазе вызывают сокращение истми-ческого отдела труб, в лютеиновой — его расслабление, усиление перистальтики ампулы, что способствует проникновению яйцеклетки в полость матки. Кроме этого, простагландины воздействуют на миометрий: от трубных углов по направлению ко дну матки стимулирующий эффект простагландинов сменяется тормозящим и, таким образом, способствует нидации бластоцисты.
Регуляция менструального кровотечения. Интенсивность менструаций определяется не только структурой эндометрия к моменту его отторжения, но и сократительной активностью миометрия, артериол, агрегацией тромбоцитов.
Расширение и сокращение сосудов происходит у всех, но болевой порог у разных людей разный. Некоторые вообще не ощущают спазматических болей. Но у ряда женщин вырабатывается больше простагландинов, так как у них рецепторы связывают простагландины таким образом, что их действие усиливается.
Обычно лекарственные средства типа ибупрофена и анапрокса снимают боль, вызываемую спазмами, потому что они являются антипростагландинами, то есть блокируют выработку простагландинов или предотвращают связывание их с рецепторами. Эти лекарства также уменьшают диарею и тошноту, а иногда и приливы, которые бывают у некоторых женщин.
В терапевтических дозах простагландины не оказывают неблагоприятного влияния на мать и плод. Чувствительность матки к введению простагландинов различна на разных сроках беременности. На очень ранних и поздних сроках стимулирующий эффект вызывается легко, а в промежутке между ними на введение препаратов простагландина миометрий реагирует слабо.
Яичники молоденькой девушки только начинают вырабатывать зрелые яйцеклетки. В это время овуляция может происходить не каждый месяц, поэтому и менструации могут быть не каждый месяц или бывают нерегулярными. Если нет регулярных овуляций, не будет и регулярных менструаций, что характерно для начала и конца детородного периода жизни женщины. Тем не менее, если менструальные циклы нерегулярны — отсутствуют, становятся редкими, если менструации очень болезненны или сопровождаются слишком сильным кровотечением — необходимо обратиться к врачу.
Существуют и другие причины ненормальных кровотечений. Это могут быть миомы, при которых часто бывают чрезмерно обильные кровотечения, это могут быть доброкачественные разрастания в яичниках, другие доброкачественные новообразования в слизистой матки. Аденомиоз, врастание эндометрия в стенку матки, может приводить к обильным кровотечениям и чаще всего бывает у женщин после сорока лет. Эндометриоз также может вызывать очень сильные кровотечения, а также кровотечения в интервале между овуляцией и менструацией. Может начаться ненормальное кровотечение, если в матке или на шейке матки есть полип. Это все проблемы функционального характера.
Кровотечения и нерегулярная овуляция могут быть и не связаны с дисфункцией репродуктивной системы. Заболевания щитовидной железы, диабет, заболевания крови могут приводить к нерегулярным менструациям.
На овуляцию влияют гормональные нарушения, которые имеют много причин, включая опухоль гипофиза; в результате также могут происходить обильные или нерегулярные кровотечения.
Прежде чем начать лечение, нужно убедиться, что не беременны ли вы, особенно если у вас не было одной или более менструаций или они отличались нерегулярностью; важно выяснить, нет ли внематочной беременности, когда оплодотворенная яйцеклетка имплантируется за пределами матки, что создает угрозу не только вашей способности рожать, но и самой вашей жизни. Боли в тазовой области—один из первых признаков внематочной беременности, при их появлении необходимо незамедлительно обратиться к врачу.
Например можно сначала принималть свободно продающийся ибупрофен и отпускаемый по рецепту анапрокс и получить некоторое облегчение, но если врач выпишит еще один антипростагландин для снятия болей в шее, то возможно, что он избавил также и от спазматических болей перед и во время менструаций. И в дальнейшем врач может продолжить выписывать это средство именно для снятия менструальных болей.
Некоторым женщинам помогают физические занятия. Они способствуют лучшему снабжению тканей кислородом, поэтому токсины и отходы жизнедеятельности организма выводятся быстрее.
Существует ряд нетрадиционных методов, не связанных с употреблением лекарств, которые некоторым помогают. Это медитация, выпивание восьми — десяти стаканов воды в день, переход на диету с низким содержанием жиров и сахара, с очень малым количеством алкоголя и полным отсутствием кофеина, диету, которую многие клиницисты находят полезной при предменструальном синдроме.
Эстрогены и окситоцин усиливают синтез простагландинов, прогестерон и пролактин оказывают тормозящее воздействие. Мощным антипростагландиновым действием обладают нестероидные противовоспаданельные препараты.
Проверенное качество финской фармацевтической компании
Прогестерондефицитные состояния
Прогестерон в организме женщины – основной гормон, обеспечивающий наступление беременности и ее поддержание. Фактически более не для чего этот гормон не нужен. Его дополнительные свойства дублированы другими гормонами, имеющими с ним сходную химическую структуру. Прогестерондефицитные состояния время от времени возникают в организме любой женщины. Проявляется это нарушениями в менструальном цикле и гиперпластическими процессами в эндометрии и молочной железе и снижением фертильности. В рамках этой книги мы решили выделить в одну главу описание этой проблемы и пути ее решения, поскольку нам показалось нецелесообразным разбивать эту тему на несколько глав.
Адекватная секреторная трансформация эндометрия является неотъемлемым условием процесса имплантации во время, так называемого, «имплантационного окна». Однако не только полноценное секреторное превращение эндометрия играет роль в процессе имплантации эмбриона. Не менее важным является синхронность трансформации эндометрия созреванию яйцеклетки и в последующем развитию эмбриона на преимплантационной стадии. Другими словами, если этапы секреторной трансформации отстают от стадии развития яйцеклетки или эмбриона, то имплантация может не случиться совсем, или произойти с погрешностями, которые в дальнейшем могут стать причиной прерывания беременности.
Секреторная трансформация эндометрия и соответственно его способность к адекватной имплантации эмбриона зависят от двух факторов: полноценного воздействия эстрогенов во время первой фазы менструального цикла и достаточной концентрации и длительности секреции прогестерона в лютеиновую фазу.
Эстрогены являются «подготовительными» гормонами. Они готовят ткани к «разрешающему», если использовать музыкальные сравнения, эффекту прогестерона. В частности эстрогены индуцируют появление рецепторов прогестерона в тканях, а также рецепторов факторов роста, выработка которых стимулируется прогестероном.
Итак, прогестерон это единственный гормон в организме, основная функция которого развитие и поддержание беременности, другие же его свойства дублируются другими гормонами. В связи с тем, что развитие и поддержание беременности требует мобилизации практически всех систем организма, прогестерон прямо или косвенно способен запускать и контролировать множество разносторонних биологических процессов, ряд которых мы перечислим ниже:
Хотя прогестерон способен воздействовать на множество процессов в организме, основной его функций является подготовка репродуктивной системы для инициации и поддержания беременности. На уровне матки эти эффекты проявляются в следующем:
Итак, начало и продолжение беременности невозможно без адекватного воздействия прогестерона на организм женщины. Как отмечалось выше, основным источником прогестерона является желтое тело.
Желтое тело, по сути, является финальной стадией развития фолликула и, таким образом, основной эндокринной железой яичника. Как известно, яичники содержат около 6-7 на 106 примордиальных фолликулов и только в среднем 350 смогут достичь стадии образования желтого тела, остальные же подвергнутся атрезии.
После преовуляторной ЛГ-волны происходит лютеинизация гранулезных и тека клеток, которые начинают синтезировать прогестерон и в малых количествах эстрадиол.
Процесс синтеза прогестерона желтым телом крайне сложен и имеет множество «тонких мест», повреждение которых может нарушить функцию железы.
Лютеинизация гранулезных и тека клеток в клетки, способные производить в больших количествах прогестерон, сопровождается активизацией ферментов, ответственных за конверсию холестерола в прогестерон. К этим ферментам относятся цитохром Р-450scc и 3 бета гидроксистероиддегидрогеназа. В то же время в этих клетках резко снижается экспрессия ферментов, превращающих прогестерон в эстрадиол (17 альфа гидроксилаза и ароматаза).
В процессе лютеинизации клеток фолликула происходит образование двух типов клеток: тека-лютеиновых и гранулезо-лютеиновых. Они отличаются друг от друга по своим морфологическим и функциональным качествам. Кроме этого, базальная мембрана фолликула разграничивает эти два вида клеток, выступая в свою очередь в качестве барьера.
Пролиферация клеток в развивающемся желтом теле по своей интенсивности сравнима с таковой в стремительно растущей опухоли. Под воздействием VEGF в желтом теле развивается богатая капиллярная сеть. Считается, что кровоснабжение этой железы превышает таковое любой другой ткани организма. Большинство мембран лютеиновых клеток прямо прилежит к капиллярам или контактирует с интерстициальным пространством в непосредственной близости с капиллярами. Подобное соположение обеспечивает высокий метаболический «оборот» в желтом теле, так потребление кислорода единицей массы желтого тела в 2-6 раз превышает потребление кислорода печенью, почками или сердцем.
Основным субстратом для стероидогенеза в желтом теле является холестерин. В норме наибольшее количество холестерина синтезируется в печени, который в виде липопротеинов транспортируется в надпочечники, фолликулы, желтое тело и яички. Транспорт холестерина к желтому телу обеспечивается липопротеидами низкой и высокой плотности. Поглощение липопротеидов лютеиновыми клетками осуществляется посредством рецепторного эндоцитоза. В клетке от липопротеидов отщепляется холестерин, который в свою очередь эстерифицируется, образуя запасы холестерина в клетке в виде эфиров. В дальнейшем холестеролэстераза по мере необходимости высвобождает холестерин, создавая в клетке необходимое количество свободного холестерина.
Синтез всех стероидных гормонов в большой степени зависит от процесса транспорта холестерина в митохондрии и дальнейшего прохождения холестерина от наружной мембраны митохондрии к внутренней, где расположен ферментный комплекс, отвечающий за отделение от холестерина боковой цепочки, что превращает его в прегненолон.
В процессе синтеза прогестерона клетками желтого тела в ответ на стимулы, поступающие от тропных гомонов, существует несколько регулируемых точек или этапов, определяющих интенсивность процесса. На этих этапах происходит оперативное изменение скорости и количества образования промежуточных продуктов синтеза. Первой такой точкой является перенос холестерина от наружной мембраны митохондрий к внутренней. Этот процесс регулируется короткоживущим белком StAR (steroidogenic acute regulatory proteine). Как стало известно сравнительно недавно, стимуляция стероидогенеза тропными гормонами нуждается в образовании в клетке, так называемых, короткоживущих белков, которые регулируют определенные этапы синтеза гормонов. Они способны во времени оперативно изменять интенсивность протекания отдельных этапов, тем самым контролируя количество конечного продукта.
После того, как холестерин переносится от наружной мембраны митохондрии к внутренней ферментным комплексом, состоящим из цитохрома Р-450scc, от него отделяется боковая цепочка, и он превращается в прегненолон. Прегненолон покидает митохондрию и попадает в гладкий эндоплазматический ретикулум, который обычно находится в тесном контакте с митохондрией. В этой органелле прегненолон под воздействием 3 бета гидроксистероиддегидрогеназы превращается в прогестерон, который поступает в цитоплазму клетки и затем посредством диффузии выходит за ее пределы в капиллярное русло.
С момента своего образования желтое тело постепенно увеличивается в размере, параллельно этому возрастает секреция прогестерона. Когда желтое тело достигает максимума своего развития, оно несколько дней продолжает функционировать, а затем, если не произошло оплодотворение яйцеклетки, постепенно регрессирует.
Концентрация прогестерона в плазме крови зависит от целого ряда факторов: размера желтого тела, а точнее количества лютеиновых клеток в нем, их функциональных способностей и кровотока в железе. Ключевыми ферментами в процессе синтеза прогестерона является: StAR, Р-450scc и 3 бета ГСД.
В случае развития беременности концентрация прогестерона прогрессивно возрастает до 7 недели беременности, после чего наступает плато вплоть до 10 недели гестационного периода, и затем происходит постепенное возрастание уровня прогестерона вплоть до момента родов.
На ранних этапах беременности основным источником прогестерона является желтое тело, при этом пик его секреции приходится на 6 неделю гестации. Как было показано в эксперименте, удаление желтого тела до 6 недели беременности во всех случаях приводит к выкидышу. После 16 недель беременности секреция прогестерона плацентой становится достаточной чтобы продолжать развитие беременности. Таким образом, адекватное функционирование желтого тела является неотъемлемым условием развития беременности, особенно в первые 6 недель гестации.
Совершенно не случайно мы привели выше подробное описание нормальной физиологии желтого тела. Мы показали всю сложность и уязвимость организации секреции прогестерона. Самые различные факторы способны нарушить эти тонкие механизмы. В частности к ним относятся: перенесенные ранее и текущие в настоящий момент воспалительные процессы в придатках матки. В первую очередь это связано с тем, что наиболее мощным лютеолитическим эффектом обладают простагландины, и в частности просталгандин F 2альфа. Как известно, воспалительный процесс сопровождается выраженным накоплением простагландинов. Кроме воспалительного процесса накопление простагландинов наблюдается при эндометриозе.
В свою очередь нарушения во время созревания фолликула могут привести к тому, что сформировавшееся желтое тело будет содержать неполноценные лютеиновые клетки, которые не способны будут синтезировать прогестерон в должных количествах.
В желтом теле может быть нарушена рецепция к лютеотропным гормонам или к липопротеидам. В конечном итоге могут наблюдаться дефекты в основных ферментах синтеза прогестерона.
Таким образом, визуализация желтого тела при УЗ исследовании еще не является залогом его полноценного функционирования.
За последние годы было создано множество различных аналогов прогестерона, некоторые из которых до сих пор используются в клинической практике. Ниже мы хотим привести сравнительную характеристику прогестерона и синтетических прогестинов в аспекте клинического использования при терапии прогестерондефицитных состояний.
Уже с середины 70-х годов было известно, что изолированное повышение концентрации эстрогенов в крови или экзогенное введение только эстрогенов в значительной степени повышает риск развития рака эндометрия. В связи с этим с начала 80-х годов основной целью клинического использования прогестерона стала защита эндометрия. В частности, был хорошо известен тот факт, что рецепторы эстрогенов, расположенные в ядрах клеток, контролируют клеточный цикл эпителия желез эндометрия, то есть эстрогены индуцируют начало клеточного цикла, а прогестерон блокирует этот процесс, при этом экзогенно введенные синтетические прогестины также обладают этой способностью, но только в другой дозе.
В процессе подбора оптимальной дозы прогестагенов основное значение придавалось их способности вызывать у женщины в постменопаузе такую же гамму морфологических и биохимических изменений в эндометрии, как во время лютеиновой фазы менструального цикла женщины пременопаузального возраста. Начало кровотечения после 11 дней введения прогестагенов являлось доказательством эффективной защиты эндометрия и наилучшим свидетельством клинической эффективности.
Однако в процессе накопления опыта фармакологические критерии эффективности и надежности различных прогестагенов претерпели существенные изменения. В контролируемых исследованиях на животных и человеке было показано, что концентрация натурального прогестерона, находящаяся в физиологических рамках лютеиновой фазы менструального цикла, не приводит к развитию каких-либо побочных эффектов. В то же время множество рандомизированных контролируемых исследований, произведенных на животных и человеке, показали, что некоторые из наиболее часто использующихся в клинической практике синтетических прогестинов в обычных дозах вызывают значительные изменения в концентрациях липидов, метаболизме глюкозы, а также оказывают воздействие на стенку артериальных сосудов.
Для предсказания возможности развития побочных эффектов, исследователи сконцентрировали свое внимание на анализе химической структуры стероидных молекул и их способности связываться с различными рецепторами, используя классические опыты на животных. Однако ценность полученной информации была относительно низкой, поскольку результаты было затруднительно экстраполировать на человеческую модель.
Основным побочным эффектом различных синтетических прогестинов является остаточная андрогенная активность (дериваты 19-нортестостерона). Несмотря на уменьшение дневной дозы (по сравнению с прогестероном) некоторые прогестины, отличные по структуре от 19-нортестостерона, могут влиять на метаболизм глюкозы (Wagner 1998) и холестерина (Bongard 1998), а также индуцировать дисфункцию эпителия (Sullivan 1995, Miyagawa 1997). Имевшие место ранее предположения о том, что факторами, обеспечивающими надежность и эффективность прогестинов могут быть: более выраженный эффект при меньшей дозе и низкая андрогенная активность, в настоящий момент не могут быть использованы в качестве критерия для выбора оптимального прогестагена.
В целом основные эффекты прогестерона на кожу, мозг и миометрий обусловлены его двумя метаболитами.
Частичный антиандрогенный эффект осуществляется посредством конкурентного ингибирования процесса метаболического превращения андрогенов в более активные формы (имеется в виду конкуренция за фермент 5-альфа редуктаза), а также за счет конкурентного ингибирования связывания наиболее активного андрогена дигидротестостерона с его рецептором, что обусловлено действием 5-альфа прегнандиона (5-альфа редуцированного метаболита прогестерона). Надо отметить, что эти механизмы не способны оказывать влияние на прямые эффекты тестостерона, однако ингибирование 5-альфа редуктазы имеет большее значение, поскольку именно этот фермент играет ключевую роль в половой дифференцировке плода с 12 по 28 неделю гестации. Кроме этого, указанный выше фермент также регулирует синтез дигидротестостерона в мозговой ткани, который в свою очередь определяет такие эмоциональные явления как злость и агрессивность.
Релаксирующий эффект (вероятнее всего имеет значение при высоких концентрациях эстрадиола в плазме крови) обусловлен активностью 5-альфа прегнанолона, который связывется с рецепторами ГАМК в головном мозге. Этот метаболит прогестерона обладает антидисфорической активностью, участвует в регулировании процессов сна и бодрствования и, вероятно, оказывает нейропротективный эффект после повреждения мозговой ткани.
Токолитический эффект осуществляется 5-бета метаболитом прогестерона (5-бета прегнандион и прегнанолон).
В почках, и в особенности в миометрии и артериальной стенке прогестерон проявляет антиальдостероновый эффект, основанный также на конкурентном механизме.
Не малое значение имеет способность прогестерона противодействовать эффектам эстрогенов на эндотелий сосудов, при этом синтетические прогестины, за счет своего более выраженного прогестагенного эффекта, способны в значительной степени усиливать проявление этого свойства прогестерона. В частности известно, что прогестерон угнетает пролиферацию эндотелиальных клеток, таким образом, избыточный прогестагенный эффект, обусловленный действием синтетических прогестинов, приводит к нарушениям функций эндотелия (вазодилятация, отложение холестерина, адгезия различных молекул и.т.д.) с последующим изменением морфологии сосудистой стенки.
В то же время, прогестерон в своей физиологической концентрации оказывает благоприятный эффект на активность различных цитокинов, пролиферацию гладкомышечных клеток артерий и накопление липидов в макрофагах.
При создании различных синтетических прогестинов особый акцент делался на более высокий, чем у прогестерона, аффинитет молекулы к рецептору прогестерона, что помимо положительных моментов несет в себе и отрицательный, обусловленный повышением риска развития сердечно-сосудистых заболеваний по механизму, описанному выше. Целый ряд гинекологических заболеваний требует восполнения недостаточности эндогенного прогестерона. Широко применяющиеся с этой целью препараты несут в себе достаточное количество неудобств для пациентки, проявляющиеся наличием выраженных побочных эффектов, неудобством приема или высокой стоимостью, что во многом обусловлено недостаточным сродством входящих в них активных компонентов с натуральным прогестероном.
Приведенные выше факты во многом подчеркивают очевидную целесообразность более широкого использования в клинической практике натурального прогестерона, который представлен на отечественном рынке препаратом Дюфастон®.
Дюфастон® имеет дополнительную двойную связь между 6 и 7 атомом углерода. Основной метаболит Дюфастона (дигидродидрогестерон) – также ретростероид с аналогичной селективной прогестагенной активностью. Дюфастон® является высокоэффективным пероральным прогестагеном, связывающимся избирательно только с прогестероновыми рецепторами. При этом у дюфастона отсутствуют побочные гормональные влияния на органы-мишени.
При принятии внутрь Дюфастона в организме наблюдается незначительная стероидная нагрузка. К другим характеристикам Дюфастона, делающим его наиболее удобным и эффективным в клинической практике, стоит отнести наличие у него метаболитов с прогестагенной активностью, отсутствие влияния на овуляцию, отсутствие эстрогенной и кортикоидной активности.
Дюфастон®, в отличии от других прогестагенов, высоко специфичен. Он не обладает маскулинизирующим эффектом на плод женского пола, не обладает антиандрогенным эффектом на плод мужского пола, не вызывает гирсутизма, акне, себореи, алопеции, безопасен при гипертензии и тромбоэмболии в анамнезе.
На основании многочисленных исследований не было получено доказательств отрицательного воздействия дидрогестерона при применении во время беременности. Согласно статистическим данным 7,5 миллионов беременностей на фоне приема Дюфастона закончились успешно.
Дюфастон® имеет дополнительную двойную связь между 6 и 7 атомом углерода. Основной метаболит Дюфастона (дигидродидрогестерон) – также ретростероид с аналогичной селективной прогестагенной активностью. Дюфастона является высокоэффективным пероральным прогестагеном, связывающимся избирательно только с прогестероновыми рецепторами. При этом у Дюфастона отсутствуют побочные гормональные влияния на органы-мишени.
К другим характеристикам Дюфастона, делающим его наиболее удобным и эффективным в клинической практике, стоит отнести наличие у него единственного активного метаболита с с выраженным прогестагенным действием, отсутствие влияния на овуляцию, отсутствие эстрогенной и кортикоидной активности.
Суммируя все выше сказанное, можно сделать заключение, что для нормального начала и последующего развития беременности на ранних этапах необходимо нормально функционирующее желтое тело. Основной функцией желтого тела является продукция прогестерона. Множество факторов способны нарушить функцию этой железы, при этом подчас обнаружить скрытые дефекты практически невозможно. Учитывая тот факт, что роль прогестерона в инициации и поддержании беременности ключевая, то «полагаться» на сложно устроенное и столь уязвимое желтое тело в случае невынашивания беременности несколько опрометчиво. Одним из самых простых и надежных способов решения данной проблемы является заместительная терапия Дюфастоном, начиная с лютеиновой фазы менструального цикла. Как показали исследования, использование синтетических аналогов прогестерона в репродуктивной гинекологии нежелательно в связи с побочными эффектами и тератогенным воздействием на плод.
Некоторые примеры использования Дюфастона в клинической практике.
Дюфастон может быть назначен для снятия тонуса миометрия, к примеру, если он визуализируется при УЗИ или беременная жалуется на тянущие боли в нижних отделах живота. Доза дюфастона в этом случае подбирается индивидуально.
Дюфастон® можно принимать до 20 недели беременности.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.