Проникает через гэб что значит
Проникает через гэб что значит
Гематоэнцефалический барьер разграничивает нервную систему от общего кровотока, обеспечивая постоянную и оптимальную по химическому составу среду для ее функционирования.
Межклеточная жидкость занимает 15 % общего объема мозга и окружает нейроны и нейроглию. Схема межклеточных пространств представлена на рисунке ниже. Секретируемая сосудистыми сплетениями спинномозговая жидкость циркулирует в системе желудочков и субарахноидальном пространстве и через пахионовы грануляции проникает в синусы твердой мозговой оболочки.
Затем спинномозговая жидкость путем пассивного транспорта через выстилающую стенки желудочков эпендимоглиальную мембрану проходит во внеклеточные пространства мозга, где смешивается с межклеточной жидкостью, продуцируемой клетками капилляров, и в процессе клеточного метаболизма распространяется через пиаглиальную мембрану в субарахноидальное пространство. «Стекание» спинномозговой жидкости компенсирует отсутствие лимфатических сосудов в ЦНС.
Единственная составляющая спинномозговой жидкости, которая не проникает через гематоэнцефалический барьер,— метаболическая жидкость. В ее состав входят нейромедиаторы, высвобожденные нейронами и не подвергнувшиеся обратному захвату, что обусловливает наличие неспособных преодолеть гематоэнцефалический барьер медиаторов и их метаболитов в субарахноидальном пространстве.
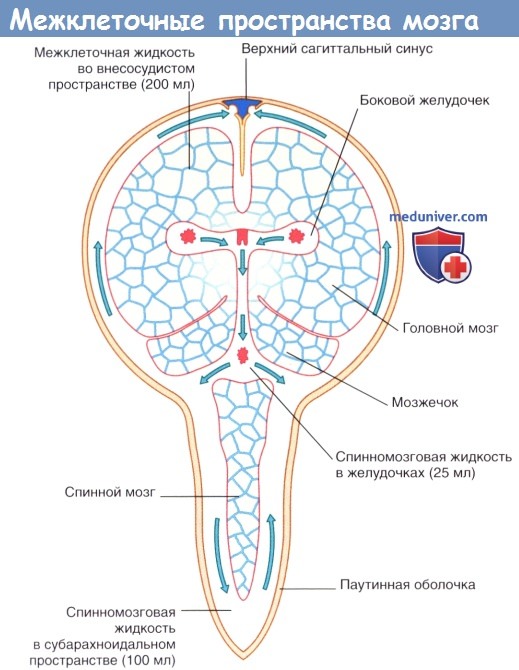
Стрелками показаны направления циркуляции спинномозговой жидкости.
Компоненты спинномозговой жидкости распределены следующим образом (по результатам поясничной пункции):
• жидкость, продуцированная клетками сосудистых сплетений, — 60 %;
• жидкость, продуцированная клетками капилляров, — 30 %;
• метаболическая жидкость — 10%.
(Б) Ультраструктура эпителия сосудистого сплетения. В эпителиальных клетках расположены множество митохондрий и гранулярная эндоплазматическая сеть.
Клетки соединены плотными контактами в апикальной части.
Гематоэнцефалический барьер состоит из двух компонентов. Первый представлен барьером между кровью и спинномозговой жидкостью на уровне сосудистых сплетений, а второй — барьером между кровью и межклеточной жидкостью на уровне капилляров ЦНС.
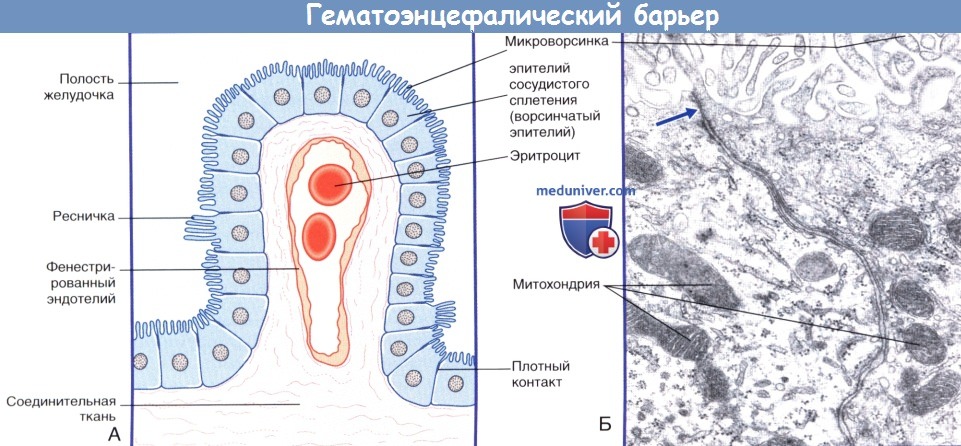
а) Барьер между кровью и спинномозговой жидкостью. Барьер между кровью и спинномозговой жидкостью представлен эпендимальным эпителием сосудистых сплетений, который характеризуется следующими особенностями строения.
1. Практически все реснички замещены микроворсинками.
2. Клетки образуют плотные контакты. Именно эти места плотного соединения мембран клеток разграничивают кровь и спинномозговую жидкость.
3. Клетки эпителия содержат ферменты, обеспечивающие транспорт ионов и продуктов метаболизма.
б) Барьер между кровью и межклеточной жидкостью. Барьер между кровью и межклеточной жидкостью представлен эндотелием капилляров ЦНС, который характеризуется следующими особенностями строения.
1. Эндотелиоциты образуют плотные контакты.
2. В состав клеток входит небольшое количество пиноцитозных пузырьков, а также отсутствуют фенестрации.
3. Транспортные системы в клетках аналогичны таковым в эпителии сосудистых сплетений.
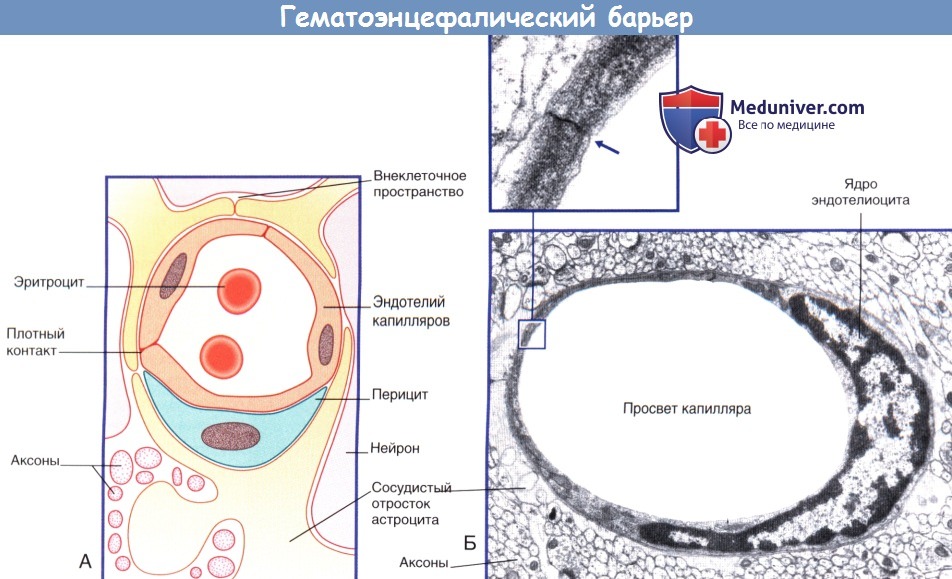
(Б) Капилляр центральной нервной системы. На поперечном срезе показан одиночный эндотелиоцит, полностью окружающий просвет сосуда.
Края эндотелиоцитов образуют плотный контакт. Эндотелиоцит окружен базальной мембраной. Капилляр окружен отростками астроцитов.
в) Функции перицитов капиллярного русла. Перициты и клетки эндотелия связаны с помощью щелевидных контактов. В ходе исследований культур клеток было достоверно доказано, что перициты играют ключевую роль в ангиогенезе капилляров, а также в формировании и поддержании плотных контактов между эндотелиоцитами.
Перициты принимают участие в саморегуляции мозгового кровотока за счет того, что на их поверхности экспрессируются рецепторы к вазоактивным медиаторам: норадреналину, вазопрессину, ангиотензину II. При хронической артериальной гипертензии развиваются гипертрофия и гиперплазия перицитов, а также происходит внутриклеточная продукция цитоплазматических сократительных филаментов, что обеспечивает компенсаторное расширение капилляров.
Поверхность клеточной стенки перицитов способна обеспечивать связывание протромбинового комплекса, за счет чего перициты могут принимать участие в процессе свертывания крови.
Кроме того, перициты обладают способностью к фагоцитозу и свойствами иммунорегуляторных цитокинов.
Общая площадь капиллярного русла головного мозга соответствует размерам теннисного корта! Наличие такой огромной поверхности объясняет тот факт, что мозг потребляет 20 % поступающего кислорода. Плотность капилляров коры головного мозга можно оценить на изображении латексного слепк.
г) Функции гематоэнцефалического барьера:
• Контроль проникновения метаболических веществ. Основной источник питания нейронов — глюкоза. При повышении уровня глюкозы в крови специфический белок-переносчик связывает ее, а при низком уровне — обеспечивает более активный захват.
• Предотвращение поступления в мозг токсических веществ и периферических нейромедиаторов, выделяемых вегетативными нервными окончаниями в системный кровоток.
Корковые капилляры имеют вид извилистых белесоватых нитей.
д) Состояния, связанные с нарушением гематоэнцефалического барьера:
1. Пациенты с артериальной гипертензией подвержены приступам гипертонической энцефалопатии в связи с тем, что степень повышения давления превосходит компенсаторные способности стенок артериол. Вследствие такого повышения давления может произойти нарушение плотных межклеточных контактов эндотелия капилляров, что приводит к отеку мозга за счет быстрого выхода плазмы. Клинически эта ситуация проявляется сильной головной болью, рвотой и, в некоторых случаях, появлением судорог и развитием комы.
2. У пациентов с повышенным содержанием углекислого газа в крови (при заболеваниях дыхательной или сердечно-сосудистой системы, а также после хирургических вмешательств) причиной отека мозга даже при нормальном уровне артериального давления может стать расслабление мышечного слоя артериол. Данная ситуация клинически проявляется спутанностью сознания и сонливостью, в дальнейшем переходящими в кому.
3. Повреждения мозга (травмы или спонтанные кровоизлияния) приводят к отеку мозга вследствие осмотического повреждения тканей мозга (и других факторов).
4. Инфекционные заболевания мозга или его оболочек сопровождаются нарушением гематоэнцефалического барьера, предположительно из-за усиленного перемещения лейкоцитов в капиллярном русле мозга. Несостоятельность гематоэнцефалического барьера играет и положительную роль: стенки капилляров проницаемы для жирорастворимых антибиотиков.
Кроме того, капилляры опухолей мозга характеризуются наличием фенестраций, что позволяет идентифицировать злокачественное новообразование при помощи рентгеноконтрастного вещества, неспособного пройти через капилляры непораженных отделов мозга.
Редактор: Искандер Милевски. Дата публикации: 10.11.2018
МЕХАНИЗМЫ ТРАНСПОРТА ВЕЩЕСТВ СКВОЗЬ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР
Система ГЭБ представлена различными структурами, в первую очередь эндотелиоцитами, выстилающими стенку кровеносного сосуда, между которыми существуют плотные и адгезивные контакты. Затем следует энзимный барьер, представленный совокупностью ферментов, находящихся в пространстве между эндотелиоцитами и нервными клетками. Данный барьер отвечает за поглощение и расщепление нежелательных веществ, которые могли бы проникнуть через стенку сосуда. Немаловажную роль играют и перициты — клетки, входящие в состав стенки капилляров и обеспечивающие нормальную функцию плотных контактов, регулируя проницаемость ГЭБ.
Астроциты — глиальные клетки нервной системы, продуцирующие различные факторы формирования и поддержания барьера, а также обеспечивающие питание нейронов и удаление продуктов их метаболизма.
Благодаря такой сложной структуре ГЭБ имеет низкую и избирательную проницаемость, но, несмотря на это, все же существует множество механизмов проникновения как гидрофильных, так и липофильных веществ в ткани мозга.
В настоящий момент все чаще встречаются случаи заболеваний ЦНС. Для таких больных необходимы препараты, непосредственно воздействующие на ткани мозга. В этом случае существует две методики введения лекарственных средств пациенту. Интратекальное — позволяет вводить препараты непосредственно в эпидуральное либо субарахноидальное пространство, но при этом существует множество отрицательных факторов. Техника таких инъекций чрезвычайно сложна, риск травмирования тканей мозга и перепадов внутричерепного давления высок, скорость проникновения медикаментов в клетки-мишени слишком низкая и лекарственное средство из ликвора быстро всасывается в кровь.
Учитывая вышеперечисленное, прибегают к способу внутривенного введения препаратов, но и здесь существует преграда — попавшие в кровь вещества транспортируются в мозговые капилляры и не могут проникнуть к месту назначения.
Специфичность ГЭБ с физиологической точки зрения представляет собой надежную защиту для тканей мозга, но в клиническом плане такая избирательность снижает эффективность проводимой медикаментозной терапии при различных заболеваниях ЦНС. По данным Калифорнийского университета в Лос-Анджелесе, лишь 2% известных лекарственных средств могут самостоятельно проникнуть через ГЭБ.
Таким образом, знание методов прохождения лекарственных средств сквозь гематоэнцефалический барьер чрезвычайно важно для медицины.
Целью работы является выяснение механизмов проникновения веществ через ГЭБ и возможные способы изменения проницаемости барьера для лекарственных веществ.
Мириады транспортных белков встроены в мембраны эндотелия мозговых капилляров. Эти белковые каналы могут активно переносить одни вещества, в то время как блокируются для других. Причиной этому является высокая селективность гематоэнцефалического барьера, обусловленная множеством различных механизмов транспорта. Одним из таких механизмов является простая диффузия липофильных веществ сквозь эндотелиоциты.
Глюкоза и аминокислоты проникают в ткани мозга с помощью белков-переносчиков. Один из них – LAT1 (L-aminoacid transporter). Некоторые лекарственные средства пересекают ГЭБ посредством данного белка-переносчика, например:
• Леводопа – противопаркинсоническое средство, предшественник дофамина
• Габапентин – противоэпиллептическое средство
• Мелфалан – полярный алкилирующий агент, используется для лечения рака
Гидрофильные гормоны, как инсулин, и другие вещества, например, глутатион, трансферрин, а также некоторые патогены, как токсин дифтерии проникают через ГЭБ с помощью механизма интернализации. На поверхности мембраны находятся рецепторы к различным соединениям. Когда молекула взаимодействует с соответствующим рецептором, происходит инвагинация и образуется транспортный пузырек, который переносит содержимое к тканям мозга.
Наряду с вышеперечисленным существует другой способ транспорта, получивший название «Троянский конь».
Периваскулярные макрофаги, находящиеся рядом с астроцитами первоначально происходят от циркулирующих в крови моноцитов, которые способны пересекать интактный гематоэнцефалический барьер. Их постоянная миграция играет важную роль в развитии врожденного и приобретенного иммунитета для защиты центральной нервной системы от патогенов. Данные макрофаги используются как средство транспорта для патогенов и доставки таких противовирусных препаратов, как Индинавир и Диданозин.
Помимо естественных механизмов, существуют способы насильственного проведения лекарственных средств через ГЭБ.
Один из таких методов заключается в введении в сосуды мозга мелких пузырьков газа и воздействие на нужные области ультразвуком под контролем томографа. Клетки эндотелия слегка раздвигаются, под механическим воздействием пузырьков и ультразвуковых волн, и в образующиеся щели могут проникать лекарственные вещества.
Еще один способ основан на введении маннитола, который обезвоживает клетки эндотелия, благодаря чему между ними также появляются щели. В течение 1-2 ч можно вводить необходимые препараты, пока клетки не пришли в исходное состояние и пространства между ними не затянулись.
Также, для увеличения проницаемости гематоэнцефалического барьера используют препарат Cereport (RMP-7) (в России не зарегестрирован), который воздействует на плотные контакты и способствует проникновению в ткани мозга таких лекарственных веществ, как Карбоплатин (цитостатический препарат алкилирующего действия) и Циклоспорин (иммунодепрессант).
Поэтому, предпочтение отдается нативным механизмам. Кроме того, для различных препаратов оптимальными являются разные, соответствующие им виды транспорта, так что невозможно выбрать какой-либо один универсальный способ, для каждого лекарственного вещества он свой.
Существует множество естественных и искусственных способов преодоления гематоэнцефалического барьера: простая и облегченная диффузия, интернализация, «Троянский конь», использование различных физических и химических свойств ГЭБ, для увеличения его проницаемости. Приоритетными являются нативные механизмы, так как их работа происходит и в норме при этом, не нарушая естественную защиту центральной нервной системы от различных патогенов и опасных влияний на ткани мозга. Следует продолжать изучение барьера на предмет естественных методов транспорта и, основываясь на них, модифицировать лекарственные препараты и развивать соответствующие фармакологические направления.
Список используемых источников
1. Chen Y., Liu L. Modern methods for delivery of drugs across the blood-brain barrier. Advanced Drug Delivery Rev. 2012. P. 640-65.
2. Georgieva J.V., et al. Smuggling Drugs into the Brain: An Overview of Ligands Targeting Transcytosis for Drug Delivery across the Blood-Brain Barrier. Pharmaceutics. 2014. P. 557-83.
3. Corraliza I. Recruiting specialized macrophages across the borders to restore brain functions. Front Cell Neuroscience. 2014. Vol. 8. P. 262.
4. Meairs S. Facilitation of Drug Transport across the Blood-Brain Barrier with Ultrasound and Microbubbles. Pharmaceutics. 2015. Vol. 7(3). P. 275–93.
5. McCaffrey G. and Davis T.P. Physiology and pathophysiology of the bloodbrain barrier: P-glycoprotein and occluding trafficking as therapeutic targets to optimize central nervous system drug delivery. Journal of Investigative Medicine. 2012. Vol. 60(8). P. 1131-40
6. Williams D.W., et al. Monocytes mediate HIV neuropathogenesis: mechanisms, that contribute to HIV associated neurocognitive disorders. Curr HIV Res.2014. Vol. 12(2). P. 85-96.
7. Choi M.R., Bardhan R. et al. Delivery of nanoparticles to brain metastases of breast cancer using a cellular Trojan horse. Cancer Nanotechnology. December 2012. Vol. 3(1). P. 47-54.
8. Gabathuler R. Approaches to transport therapeutic drugs across the blood-brain barrier to treat brain diseases. Neurobiol Dis. 2010 Jan. Vol. 37(1). P. 48-57
9. Dean R.L., Emerich D.F., Hasler B.P., Bartus R.T. Cereport® (RMP-7) increases carboplatin levels in brain tumors after pretreatment with dexamethasone. Neuro Oncology. 1999 Oct. Vol. 1(4). P. 268-274.
10. Zavitz K. Crossing the Blood-Brain Barrier: Profiling Cognitive Safety in Clinical Development. Clinical Trials. March 26, 2015.
Гематоэнцефалический барьер и лекарства
Поделиться:
Нормальная деятельность головного мозга возможна лишь в условиях биохимического и электролитного гомеостаза (равновесия). Поэтому жизненно необходимо, чтобы мозг был надежно защищен от попадания веществ, способных изменить работу центральной нервной системы. Для этого и существует гематоэнцефалический барьер, или сокращенно ГЭБ.
Для чего нам нужен ГЭБ
ГЭБ — это полупроницаемая мембрана, которая отделяет мозг от кровеносного русла. Этот барьер состоит из эндотелиальных клеток, астроцитов и перицитов. Мембрана имеет особо «плотное» расположение капилляров, что и является основой барьера, предохраняющего мозг от проникновения большинства веществ, циркулирующих в крови.
ГЭБ сохраняет специфическую внеклеточную среду вокруг нейронов, поддерживая концентрацию аминокислот, аскорбиновой и фолиевой кислот даже при снижении их концентрации в сыворотке крови.
Читайте также:
Инновации в нейронауках
Кроме того, абсолютно необходимо, чтобы никакие патогенные микробы не могли попасть в головной мозг. Иначе наступает катастрофа. Типичный пример: микроб менингита, так называемый менингококк, вполне мирно может проживать в носоглотке, но при ослаблении защитных сил (и нарушении проницаемости ГЭБ) менингококк попадает в центральную нервную систему, поражая оболочки головного мозга и вызывая потенциально смертельную болезнь — гнойный менингит.
Повышение проницаемости ГЭБ также характерно и для других заболеваний нервной системы. Например, при рассеянном склерозе активированные Т-лимфоциты легко преодолевают ГЭБ и вызывают поражение мозга.
Как ГЭБ работает на практике
Проницаемость гематоэнцефалического барьера напрямую зависит от величины молекул. Маленькие молекулы кислорода, углекислого газа проходят вообще без проблем. Но чем крупнее молекула вещества, тем труднее ей пробраться. Впрочем, существуют способы облегчить эту задачу. Например, давно замечено, что жирорастворимые вещества диффундируют через барьер на ура. Это свойство используется при создании некоторых лекарств, например снотворных барбитуратов.
Интересна ситуация с таким важным веществом, как глюкоза. Пониженный ее уровень — гипогликемия мозга — проявляет себя в виде головной боли, нарушений внимания, спутанности сознания и эпилептических приступов. При этом концентрация сахара в крови может оставаться нормальной (!). Тут «заупрямился» ГЭБ и возникли нарушения в системе переноса глюкозы.
Кстати, все больше и больше свидетельств, что классическая эпилепсия, происхождение которой в известной мере остается загадкой для врачей, является «болезнью ГЭБ», когда нарушен транспорт глюкозы в тканях мозга.
ГЭБ и фармакология
Давайте сразу уясним, что большинству лекарств незачем преодолевать этот барьер. К примеру, средство от расстройства желудка должно держаться подальше от мозга и заниматься своим прямым делом в пищеварительном тракте. Но если возникло серьезное поражение центральной нервной системы, «тогда мы идем к вам!».
Антибиотикам желательно добраться до мозга при инфекционных поражениях, противоконвульсивным препаратам — для лечения судорог и, уж конечно, нейролептикам — для купирования острых психозов. Эффективность вышеперечисленных препаратов напрямую зависит от проницаемости ГЭБ.
А вот при болезни Паркинсона, для которой характерен недостаток допамина в мозге, не удастся восполнить этот дефицит ни таблетками, ни уколами, потому что допамин через ГЭБ, к сожалению, не проходит. Хотя, например, предшественник допамина — Л-допа — способен преодолеть ГЭБ. Но все-таки это не совсем то, что нужно.
Кстати, похожая ситуация при депрессиях, в патогенезе которых большую роль играет глютамат. Глютамат также не проникает через через ГЭБ. Поэтому глотать его бессмысленно.
Когда ГЭБ может рухнуть?
Существует ряд ситуаций, при которых страдает ГЭБ и мозг остается незащищенным. Это может случиться при высоком артериальном давлении, поэтому стоит держать его под контролем. Внутривенное введение гиперосмолярных растворов также несет в себе угрозу нарушения барьера. Длительное воздействие микроволнового излучения и радиации доказанно считается причинами нарушений ГЭБ. Инфекции центральной нервной системы типично дают сбои в работе барьера. Также нарушения возможны при травмах мозга, его ишемии, воспалении и инсультах.
А если ГЭБ не пускает, но нам очень нужно?
Существует ряд заболеваний головного мозга, когда жизненно важно пропихнуть лекарство в определенный участок мозга. Чаще всего это онкология. Для этого используется метод «локального открытия ГЭБ». Лучше всего работают маннитол и его аналоги, которые вводятся в артерию мозга под контролем компьютерного томографа.
Маннитол открывает ГЭБ примерно на час, и за это время опухоль подвергается воздействию химиотерапии. С уходом маннитола дверь в мозг закрывается. И правильно — нельзя оставлять мозг без защиты.
Подобным эффектом открытия ГЭБ обладают Лейкотриен С4 и брадикинин. В определенной дозе ГЭБ открывает и гистамин. Кстати, «закрыть дверь» за гистамином можно его антиподом — цимедином. Имейте в виду, что все эти препараты вводятся прицельно в надлежащий кровеносный сосуд. Если принимать их в виде таблеток или инъекций, результата не будет.
Информация для простого пациента
Не ведитесь на рекламу деятелей «народной медицины», утверждающих, что нашли средства, улучшающие состояние психики. Далеко не всякая таблетка, вами проглоченная, вообще доберется до головы. На страже вашего мозга стоит ГЭБ, и чаще всего это только на пользу.
Гематоэнцефалический барьер с позиции анестезиолога-реаниматолога. Обзор литературы. Часть 1
В.И. Горбачев, Н.В. Брагина
Иркутская государственная медицинская академия последипломного образования — филиал ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Иркутск, Россия
Для корреспонденции: Горбачев Владимир Ильич — д-р мед. наук, профессор, заведующий кафедрой анестезиологии и реаниматологии ИГМАПО — филиала ФГБОУ ДПО РМАНПО МЗ РФ, Иркутск, Россия; e-mail: gorbachevvi@ya.ru
Для цитирования: В.И. Горбачев, Н.В. Брагина. Гематоэнцефалический барьер с позиции анестезиолога-реаниматолога. Обзор литературы. Часть 1. Вестник интенсивной терапии им. А.И. Салтанова. 2020;3:35–45. DOI: 10.21320/1818-474X-2020-3-35-45
Реферат
Гематоэнцефалический барьер (ГЭБ) предотвращает проникновение нейротоксичных компонентов плазмы, клеток крови и патогенов в мозг. В то же время он регулирует транспорт молекул в центральной нервной системе, поддерживая строго контролируемый химический состав нейрональной среды. В этом обзоре рассматриваются молекулярные и клеточные механизмы, лежащие в основе функционирования ГЭБ, физиология транспортных систем ГЭБ, структурные компоненты гематоликворного барьера и особенности интратекального введения лекарственных средств. На основании физико-химических свойств антибактериальных препаратов оценивается, какие соединения в настоящее время являются наиболее перспективными для лечения инфекций центральной нервной системы.
Ключевые слова: гематоэнцефалический барьер, нейроваскулярная единица, гематоликворный барьер, интратекальный путь введения препаратов, спинномозговая жидкость
Поступила: 08.08.2020
Принята к печати: 02.09.2020
Гематоэнцефалический барьер (ГЭБ) — это сложная гетерогенная система головного мозга (ГМ) с несколькими уровнями избирательного транспорта, регуляции и защиты, способная поддерживать гомеостаз центральной нервной системы (ЦНС). Впервые идею о существовании разделительного барьера высказал П. Эрлих в 1885 г., доказав, что краситель трипановый синий после введения в кровь не обнаруживается в мозге. В данной публикации гематоэнцефалический барьер рассмотрен с точки зрения анестезиолога-реаниматолога. Поиск источников для данного обзора литературы проводился с использованием электронных ресурсов российской научной электронной библиотеки eLIBRARY.ru, библиографической базы статей по медицинским наукам (MEDlars onLINE) Национальной медицинской библиотеки США (U.S. National Library of Medicine, NLM), базы данных Cochrane Reviews, а также информационных ресурсов UpToDate. Глубина поиска составляла 30 лет. При отборе источников сделан акцент на данные рандомизированных контролируемых исследований и метаанализов. Найдено 88 источников, из них 3 метаанализа, включавших 728 публикаций, 38 из которых использованы для обзора и указаны в списке литературы.
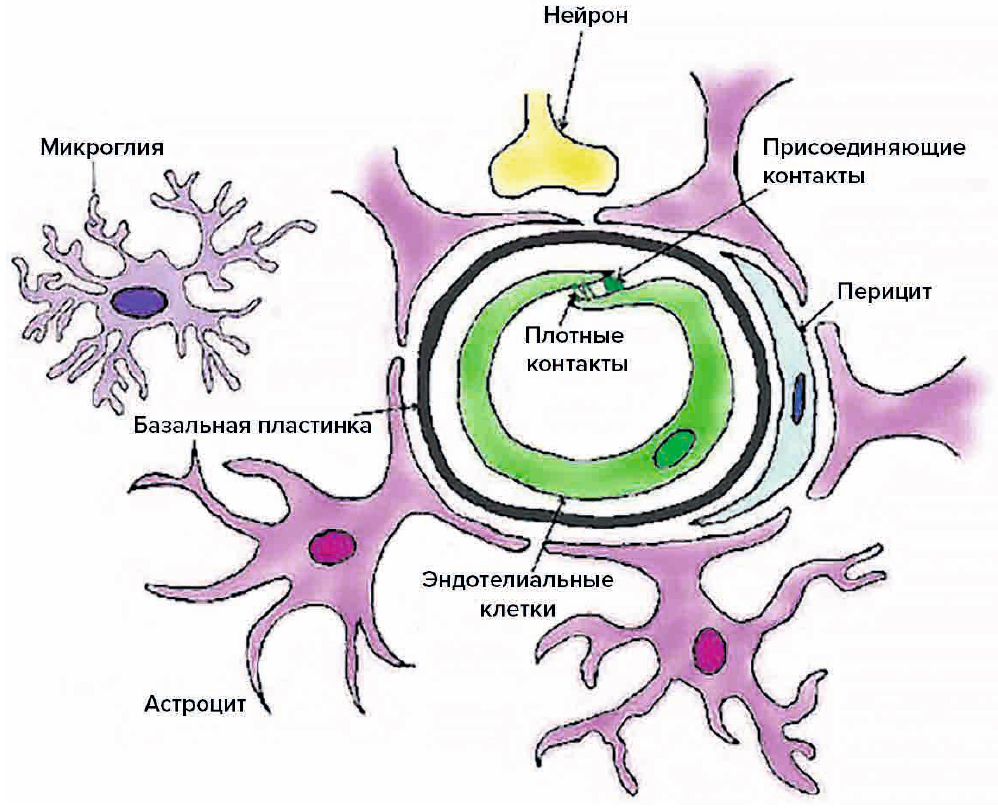
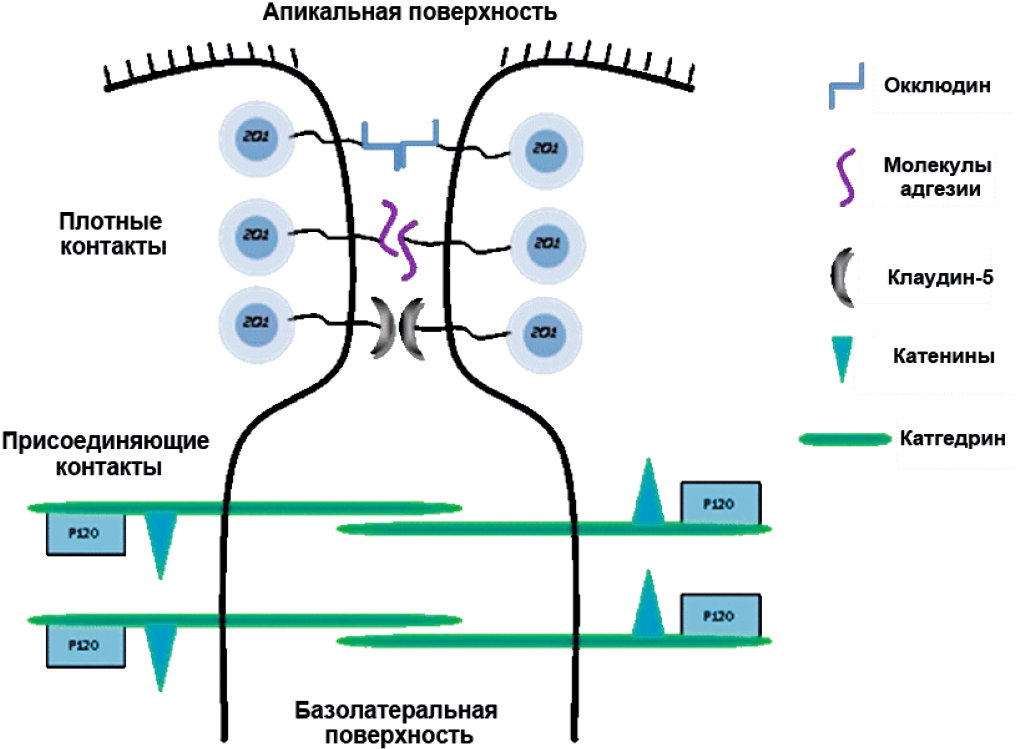
Структурные единицы, из которых складывается ГЭБ, выполняют не только защитную, но регуляторную, питательную и выделительную функцию. Основными функциональными и анатомическими элементами ГЭБ являются эндотелиоциты капилляров ГМ, астроциты, нейроны и перициты, представляющие собой «нейроваскулярную единицу» (рис. 1) [1]. Плотные контакты (ПК) являются наиболее апикальными межклеточными соединениями в эндотелиоците. Их основными трансмембранными компонентами являются клаудины, окклюдин и молекулы адгезии (JAM), тогда как их цитоплазматические компоненты являются белками zonula occludens (ZO). Присоединяющие контакты локализуются чуть ниже ПК; их трансмембранные белки — кадгерины и нектины — образуют цитоплазматические комплексы α- и β-катенин и афадин (рис. 2). Все компоненты ГЭБ находятся в тесной взаимосвязи между собой, что и обеспечивает уникальность данного биологического барьера [2, 3].
Рис. 1. Нейроваскулярная единица. Адаптировано из [1]
Fig. 1. The most important cellular elements of blood-brain barrier [1]
Рис. 2. Схематическое изображение белков, которые участвуют в формировании плотных и присоединяющих контактов в эндотелиальных клетках микрососудов головного мозга. Адаптировано из [1]
Fig. 2. Schematic representation of proteins that are involved in the formation of the tight junction and adherens junctions in brain microvessel endothelial cells [1]
Трансцеллюлярный транспорт биологически активных веществ через ГЭБ может осуществляться следующими путями (рис. 3) [6, 7]:
1) простая диффузия в направлении градиента концентраций. Необходимым условием для нее является высокая липофильность вещества. Так, быстро проникают через ГЭБ неорганические молекулы O2, CO2, H2O;
2) облегченная диффузия, опосредованная переносчиком, в направлении градиента концентраций. Молекулы, самостоятельно не способные проникнуть через мембрану, связываются с белками-переносчиками и транспортируются посредством эндоцитоза (аминокислоты, нуклеотиды, глутатион, пептиды малого размера);
3) эндоцитоз — движение молекул и ионов через клеточную мембрану против любого из градиентов (электрохимических, осмотических и т. д.) с использованием энергии АТФ (трансферрин, лептин, инсулин, белок gp120);
4) эффлюксный транспорт — передвижение в направлении «мозг — кровь». В последние годы исследованиям данного пути трансцеллюлярного транспорта стало уделяться гораздо больше внимания. Возможность оказывать влияние на эффлюкс может помочь в разработке новых лекарственных препаратов и методов их доставки. Липофильные вещества покидают мозг через ГЭБ путем простой диффузии. Наиболее важным транспортным эффлюксным механизмом, являющимся главной помехой для действия многих фармакологических агентов, считается опосредованное переносчиком выделение. В его основе лежат так называемые транспортеры ABC (ATP-Binding Cassette), связанные с АТФ: белки неспецифической лекарственной устойчивости (multidrug-resistance proteins, MDR), P-гликопротеин (P-gp); белок устойчивости к раку молочной железы (breast cancer resistance protein, BCRP).
Рис. 3. Возможные механизмы транспорта через гематоэнцефалический барьер. Адаптировано из [5]
Fig. 3. Potential transport mechanisms across the blood-brain barrier [5]
Эти белки играют ключевую роль в функционировании активного выведения разнообразных биологических агентов из ЦНС. Их физиологическая роль заключается в экспорте из нейронов метаболитов, нейротоксинов (ксенобиотиков) и избыточного количества нутриентов.
Третьим эффлюксным механизмом является конвективно-опосредованное выделение, когда вещество минует прохождение через биологические мембраны. На сегодняшний день многие его аспекты остаются неизученными [7].
Избирательность транспортных систем ГЭБ позволяет предотвратить воздействие некоторых медиаторов на ЦНС. Например, через ГЭБ не может проходить глутаминовая кислота, повышенное выделение которой наблюдается при инсульте. Проницаемость ГЭБ зависит от возраста человека: она очень высока в первые недели жизни ребенка и очень мала в старости. Это обусловливает частоту возникновения и тяжесть протекания определенных заболеваний, а также протекание определенных биохимических процессов: у детей чаще возникают инфекционные заболевания мозга и его оболочек (менингит, энцефалит), а болезнь Альцгеймера характерна для людей пожилого возраста [8]. Важно отметить, что ГЭБ не статичен, а скорее динамичен, взаимодействует с микросредой и отвечает потребностям ЦНС. Его проницаемость частично контролируется внутри- и межклеточной передачей сигналов между эндотелиальными клетками и окружающими астроцитами и нейронами. Конкретные транспортеры позволяют необходимым водорастворимым молекулам, таким как глюкоза, быстро проходить ГЭБ и опосредовать транспорт больших молекул (например, некоторых белков) [9].
Общий белок в ликворе (ОБЛ) — один из самых чувствительных индикаторов патологии ЦНС. Альбумины легко проходят через ГЭБ, тогда как поступление крупных белковых молекул, например иммуноглобулинов, существенно затруднено. ОБЛ составляет всего лишь 0,1–0,2 % количества белка крови, и в норме основной белок СМЖ — альбумин (35–80 %). Повышение концентрации ОБЛ наблюдается в следующих ситуациях.
Для определения степени прорыва ГЭБ предложены различные расчетные формулы, простейшей из которых является расчет альбуминового индекса: (альбумин СМЖ / альбумин крови) х 100 [10]. В норме он не должен превышать 9 единиц. При выраженных повреждениях ГЭБ он составляет от 30 до 100 единиц. Есть данные, что у больных с тяжелой черепно-мозговой травмой индекс может достигать 80–100 ед.
ГЭБ отсутствует в шести анатомических образованиях:
Большинство из них — нейроэндокринные структуры, участвующие в процессах нейрогуморальной регуляции. Наличие ГЭБ препятствовало бы исполнению данными анатомическими образованиями своих функций [7].
В ЦНС существует несколько барьерных образований с характерными структурно-функциональными особенностями. К ним относятся собственно гематоэнцефалический (или гематонейрональный), гематоликворный (ГЛБ) и ликвороэнцефалический (или нейроликворный) барьеры (рис. 4) [6]. Благодаря их существованию головной мозг в значительной степени изолирован от клеток иммунной системы, циркулирующих в крови [8].
Рис. 4. Взаимосвязь гематоликворного и гематоэнцефалического барьера. Адаптировано из [5]
Fig. 4. Overview of the blood-brain barrier and blood-cerebrospinal fluid barrier [5]
Площадь ГЛБ составляет 1/5000 общей площади ГЭБ [5]. Он образован эпителиальными клетками, выстилающими сосудистое сплетение желудочков мозга. Так как поверхность ГЛБ почти в 5000 раз меньше площади ГЭБ, вклад ГЛБ в поддержании гомеостаза мозга невелик.
Внутричерепное-интраспинальное пространство (intracranial-intraspinal space) состоит из нескольких отделов, или компартментов. Даже в отдельных областях одного компартмента, например спинномозговой жидкости (СМЖ), существуют сильные различия в концентрациях лекарственного средства (ЛС) между желудочковым, цистернальным и поясничным отсеками. Таким образом, внутричерепное пространство и позвоночный канал нельзя рассматривать как единый физиологический компартмент: он разделен на пространство СМЖ, внеклеточные и внутриклеточные пространства головного и спинного мозга (рис. 5) [11].
Рис. 5. Внутричерепные жидкостные компартменты. Непрерывные стрелки представляют направление потока спинномозговой жидкости (СМЖ). Прерванные стрелки указывают, где может произойти диффузия воды или растворенных веществ между мозговыми капиллярами, ликвором и нервной тканью: a — через гематоэнцефалический барьер; b — через эпителий сосудистого сплетения; c — через эпендиму; d — через пиа-глиальные мембраны на поверхности головного и спинного мозга; е, f — через клеточные мембраны нейронов и глиальных клеток. Толстая линия представляет твердую мозговую оболочку (ТМО) и паутинную оболочку. Адаптировано из [12]
Fig. 5. Intracranial fluid compartments. Continuous arrows represent the direction of the cerebral spinal fluid flow. Interrupted arrows indicate where a diffusion of water or solutes can occur between brain capillaries, CSF, and nervous tissue: a — across the blood-brain barrier; b — across the epithelium of the choroid plexus; c — across the ependyma; d — across the pia-glial membranes at the surface of the brain and spinal cord; e, f — across the cell membranes of neurons and glial cells. The thick line represents the dura mater and arachnoidea surrounding the system [12]
При внутривенном введении большинство ЛС достигает более высоких концентраций в поясничном, а не в желудочковом компартменте СМЖ. В настоящее время для многих соединений неизвестно, как именно после системного введения концентрация ЛС в интерстициальном пространстве мозга коррелирует с концентрацией в СМЖ.
Когда на продукцию и абсорбцию СМЖ не оказывают серьезного влияния неблагоприятные факторы, средний объем ликвора составляет 20–30 мл/ч. На скорость влияют возраст, церебральное перфузионное давление и некоторые ЛС, например, диуретики. Для большинства противоинфекционных препаратов концентрация в СМЖ существенно ниже, чем в плазме. Соотношение клиренса поступления–выведения для лекарственного средства определяется соотношением его «площади под фармакокинетической кривой (концентрация–время)» (AUC) в CМЖ и в плазме крови (пл) после внутривенного введения:
CL in / CL out = AUC СМЖ / AUC пл.
Для людей отношение AUC СМЖ / AUC пл является наиболее точным параметром для характеристики проникновения препарата в СМЖ [11]. Данный показатель положительно коррелирует с липофильностью препарата (logP) и отрицательно — с его молекулярной массой [12].
Фармакокинетические данные о поступлении многих лекарств во внутричерепные компартменты являются неполными. По этой причине необходимо иметь представление о физико-химических свойствах препаратов, которые помогут оценить, какие соединения наиболее перспективны для лечения инфекций ЦНС.
Проникновение лекарственных препаратов в ЦНС в отсутствие воспаления. Поступление лекарств, в том числе антибиотиков, в СМЖ и внеклеточное пространство мозга регулируется следующими факторами.
Молекулярная масса (ММ). Молекулы с массой более 500 г/моль обычно не могут свободно проникать через ГЭБ. Хотя проникновение крупных гидрофильных соединений в СМЖ низкое, молекулы размера IgM присутствуют в нормальном ликворе приблизительно в 1/1000 от их концентрации в плазме крови.
Липофильность соединения увеличивает его способность проникать через липидный бислой мембран клеток. Значение коэффициента липофильности определяется с помощью стандартной системы «октанол — вода» при pH 7,0. Логарифм коэффициента липофильности обозначается как log PO/W.
Связывание с белками плазмы. При наличии неповрежденного ГЭБ свободно может проникать только несвязанная фракция плазмы, поскольку связывающие белки (в частности, альбумин и глобулины) проходят через ГЭБ/ГЛБ лишь в небольшой степени. В сравнительном исследовании на людях проникновение в СМЖ цефтриаксона (связывание с белками плазмы от 90 до 95 %) было на 1 порядок ниже, чем у цефотаксима (связывание с белками 90
80 %, а период его полувыведения — от 12 до 25 ч. В небольших исследованиях доксициклин не уступал по эффективности цефтриаксону в лечении нейроборрелиоза. Является частью стандартных протоколов лечения нейробруцеллеза и нейросифилиса.
Линезолид, первый оксазолидинон, который активен в отношении грамположительных бактерий, обладает амфифильными свойствами и легко проникает в СМЖ. Несмотря на то что препарат в основном обладает бактериостатическими свойствами, линезолид успешно применяется для лечения инфекций ЦНС, вызванных мультирезистентными организмами.
Метронидазол — небольшое липофильное соединение, эффективное против анаэробных бактерий, хорошо проникает в большинство тканей, включая содержимое абсцесса. В исследованиях на животных и людях метронидазол легко проникал через ГЭБ/ГЛБ. Является частью стандартной терапии бактериального абсцесса мозга.
Гликопептиды — гидрофильные антибиотики с высокой молекулярной массой (более 1400 Да). Хотя токсичность не так велика, как у аминогликозидов, она достаточно высока для того, чтобы ограничить увеличение дозы. Для пациентов с воспаленными мозговыми оболочками при высоких внутривенных дозах достигаются бактерицидные концентрации ванкомицина в СМЖ против чувствительных патогенов [19].
Полипептиды состоят из крупных гидрофильных соединений с высокой системной токсичностью. Колистиметат натрия используется у детей и взрослых для элиминации устойчивого к карбапенемам Acinetobacter sp. Как при отсутствии, так и при наличии воспаления менингеальных оболочек, проникновение колистиметата натрия в СМЖ из системного кровотока недостаточное. Поскольку относительно высокая токсичность не позволяет увеличить системную суточную дозу, колистиметат натрия часто вводят интратекально. Однако до настоящего времени фармакокинетика препарата после внутрижелудочкового введения не исследована.
Самый простой способ увеличить концентрацию препарата в ЦНС — увеличить системную дозу. Некоторые АБП обладают низкой токсичностью. Следовательно, суточная доза может быть увеличена без серьезных побочных эффектов: так, для экстрацеребральных инфекций стандартная доза меропенема составляет три дозы по 1 г в сутки, тогда как для менингита (у взрослых) — три дозы по 2 г в сутки. Менингит, ассоциированный с Acinetobacter baumannii, успешно лечили 2 г ампициллина и 1 г сульбактама каждые 3 ч без серьезных побочных эффектов [20]. Суточная доза флюконазола может быть увеличена до 1600 мг с переносимыми побочными эффектами [21].
Эффективным, но инвазивным методом для достижения высоких концентраций в ЦНС является интратекальное введение АБП в дополнение к внутривенному. Термин «интратекальное введение» (от лат. teka — оболочка) означает доставку вещества в подоболочечное пространство, т. е. субарахноидально после прокола твердой мозговой оболочки. Значимыми преимуществами интратекального пути введения являются возможность получения максимальных концентраций ЛС в ткани мозга и СМЖ, а также введение АБП, не проникающих через ГЭБ. Препараты, вводимые интратекально, не должны содержать консервантов. Инъекции должны выполняться медленно, небольшим объемом, чтобы избежать повышения внутричерепного давления у пациентов с нарушенным оттоком СМЖ [11]. При введении через вентрикулярный дренаж необходима экспозиция в течение 15–60 мин.
Основным показанием для эндолюмбального введения антибиотиков в СМЖ является бактериальный менингит (при отсутствии клинического и лабораторного улучшения состояния больного в течение 72 ч после начала парентерального введения АБП). Показаниями для этого вида лечения также являются вентрикулит, позднее начало лечения и рецидив менингита [22]. В детской практике показаниями для интратекального введения антибиотиков в первые 3 дня являются выраженные изменения СМЖ (цитоз 20 000–30 000 ×10 6 /л, высокий уровень белка), отсутствие положительной динамики. Интратекально вводят гентамицин 1мг/кг и ванкомицин 4–10 мг/сут в 1–2 мл 0,9% раствора NaCl.
Этот метод также показан при использовании АБП с низким проникновением в СМЖ и/или высокой токсичностью, что исключает увеличение системной дозы (например, аминогликозиды, ванкомицин, амфотерицин В, полимиксины). Ванкомицин и другие препараты с большой ММ и гидрофильностью имеют длительный период полувыведения из СМЖ, что обеспечивает достижение терапевтической концентрации при однократном интратекальном введении в течение суток [11].
Не существует АБП, одобренных FDA (US Food and Drug Administration) для внутрижелудочкового введения, а также до сих пор не определены четкие показания для их интратекального использования. Антимикробные дозы определены опытным путем на основе способности АБП достигать адекватных концентраций в СМЖ (табл. 2) [19].
Таблица 2. Интравентрикулярное применение антибиотиков для достижения эффективных концентраций в центральной нервной системе [23, 24]
Table 2. Intraventricular administration of antibiotics to achieve effective concentrations in the central nervous system [23, 24]
Антибиотик
Дозировка
Серьезный зарегистрированный побочный эффект
Обычная суточная доза составляет 1–2 мг для младенцев и детей и 4–8 мг для взрослых
Потеря слуха (временная), эпилептические припадки, асептический менингит, эозинофильный плеоцитоз СМЖ
5–20 мг каждые 24 ч
5–50 мг каждые 24 ч
(обычная суточная доза составляет 30 мг)
До 1 мг/кг каждые (24–48 ч)
Потеря слуха (временная), эпилептические припадки, радикулит, поперечный миелит, арахноидит, параплегия
5–20 мг каждые 24 ч
Потеря слуха (временная)
Дозировка у детей составляет 2 мг в сутки
Менингеальное асептическое воспаление
Колистиметат натрия (полимиксин Е) метансульфонат (12500 МЕ = 1 мг)
10 (1,6–20) мг каждые 24 ч
Менингеальное воспаление; при применении высоких доз — эпилептические припадки, потеря аппетита, возбуждение, альбуминурия
5–10 мг каждые 72 ч
0,1–0,5 мг каждые 24 ч
Звон в ушах, лихорадка, дрожь, синдром Паркинсона
В настоящее время в Российской Федерации отсутствуют клинические рекомендации по диагностике и лечению бактериального гнойного менингита у взрослых, однако в 2013 г. были утверждены Федеральные рекомендации по диагностике и лечению бактериальных менингитов у детей [25]. В клинической практике иногда руководствуются рекомендациями Американского общества по инфекционным болезням (IDSA) по диагностике и лечению менингитов и вентрикулитов, а также рекомендациями Европейского общества по микробиологии и инфекционным заболеваниям [26–28]. Отечественные рекомендации НИИ нейрохирургии им. акад. Н.Н. Бурденко и НИИ скорой помощи им. Н.В. Склифосовского по лечению тяжелой черепно-мозговой травмы включают в себя раздел «профилактики и лечения внутричерепных гнойных осложнений». Так, в 2014 г. внутрижелудочковое введение АБП предлагалось осуществлять нейрохирургам с кратностью 2–6 раз в сутки. Интратекальное введение, наряду с парентеральным, считалось основным методом введения антибиотика при развитии гнойных осложнений. В зависимости от результатов посева ликвора предпочтительными АБП были названы ванкомицин в разовой дозе 5 мг (суточная доза 10 мг), амикацин в разовой дозе 100 мг (суточная доза 300 мг), меронем в разовой дозе 10 мг (суточная доза 40 мг) [29]. В рекомендациях НИИ нейрохирургии им. акад. Н.Н. Бурденко и НИИ скорой помощи им. Н.В. Склифосовского по лечению тяжелой черепно-мозговой травмы от 2016 г. уточнено, что интратекальное введение АБП допустимо лишь в особых случаях при тяжелом течении менингита и отсутствии противопоказаний. Рекомендуется использование специально адаптированных к интратекальному введению солей антибиотиков: ванкомицин (10–20 мг/сут), гентамицин (4–8 мг/сут), тобрамицин (5–20 мг/сут), амикацин (5–30 мг/сут), полимиксин В (5 мг/сут), колистин (10 мг/сут) [23].
Усложняет создание единого алгоритма к интратекальному использованию антибиотиков и то, что в официальных инструкциях по их применению данный метод введения практически не представлен, а АБП, рекомендуемые для лечения менингитов, не охарактеризованы с точки зрения переносимости при введении в ликворопроводящее пространство. Прямых противопоказаний к интратекальному пути введения АБП нет, однако возможность токсического воздействия на ЦНС значительно сузила спектр используемых лекарственных средств [22].
До настоящего времени продолжаются исследования эффективности и безопасности интратекального использования АМП. Khan с соавт. (2017) показали, что сочетание внутривенного и интратекального способов введения АБП при грамотрицательном менингите ускоряет санацию ликвора и практически исключает рецидивы [30]. Brian с соавт. (2016) описали успешный случай лечения бактериального менингита с использованием линезолида в дозировке 10 мг/сут (концентрация — 2 мг/мл) [31]. В исследовании Wang с соавт. (2017) показано, что цефтриаксон и ванкомицин обладают хорошей клинической эффективностью при лечении нейроинфекций [32]. Mader с соавт. (2018) утверждают, что проникновение меропенема и ванкомицина в СМЖ является низким, в то же время демонстрируя высокую индивидуальную вариабельность. У ряда пациентов не удалось достигнуть целевого уровня концентрации в ликворе. Для оптимизации интратекального введения пациентам с вентрикулитом авторы рекомендуют непрерывную инфузию антибиотика до достижения целевых концентраций в сыворотке 20–30 мг/л для ванкомицина и 16–32 мг/л для меропенема [33]. В последнем исследовании Zhang с соавт. (2019) авторы приводят аргументы, подтверждающие эффективность и безопасность интратекального введения меропенема и ванкомицина [34]. Некоторые исследования демонстрируют, что внутрижелудочковое или интратекальное введение АБП (например, полимиксина В, колистиметата натрия, гентамицина и ванкомицина) не связано с тяжелой или необратимой токсичностью [35]. При туберкулезном менингите возможно интратекальное введение изониазида (до 2,5 мг/кг), хотя в реальной клинической практике это встречается редко [22].
В консенсусном руководстве Британского общества по внутрижелудочковому применению антибактериальных препаратов для лечения нейрохирургических инфекций (2000) было рекомендовано подбирать начальную дозу ванкомицина и гентамицина на основании верифицированного при нейровизуализации объема желудочков:
щелевидные желудочки: 5 мг ванкомицина и 2 мг гентамицина;
нормальный размер: 10 мг ванкомицина и 3 мг гентамицина;
увеличенные желудочки: 15–20 мг ванкомицина и 4–5 мг гентамицина.
Также кратность введения АБП предлагалось корригировать на основании количества СМЖ, полученного из вентрикулярного дренажа за предыдущие сутки. При сбросе ликвора, не превышающем 50 мл/сутки, рекомендовалось вводить АБП интравентрикулярно каждый третий день; от 100 до 150 мл — один раз в день. При количестве СМЖ 150–200 мл/сутки предлагалось увеличить дозу ванкомицина на 5 мг, гентамицина — на 1 мг и вводить препараты один раз в день. При сбросе 200–250 мл/сутки дозу ванкомицина увеличивали на 10 мг, гентамицина — на 2 мг один раз в день. Однако данные рекомендации, основанные исключительно на мнении экспертов, не были подтверждены в клинических исследованиях [36].
Имеется и не столь позитивный опыт данного метода введения АБП. Так, у детей с грамотрицательным менингитом и вентрикулитом рутинное интратекальное введение аминогликозидов в дополнение к внутривенным антибиотикам приводило к увеличению смертности в 3 раза по сравнению со стандартным лечением только системными препаратами [37, 38]. По этой причине внутрижелудочковое введение антибиотиков не должно использоваться в случае, когда доступна эффективная системная терапия. До сих пор является предметом споров целесообразность лечения инфекций ЦНС с помощью интратекального введения препаратов. Общепринятым считается использование данной методики при наличии мультирезистентной флоры, когда другие варианты лечения оказались неэффективны. Разрешенные к введению препараты перечислены в табл. 2. В случае применения других АБП врач должен ознакомиться с литературными данными о безопасности используемой группы антибиотиков при непосредственном введении в ликвор. Если данные отсутствуют, необходимо убедиться, что рН и осмолярность раствора совместимы с интратекальным введением.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Горбачев В.И., Брагина Н.В. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.








 Читайте также:
Читайте также: