Профилактика втэо в онкологии что это
тБЪДЕМ 3. рТПЖЙМБЛФЙЛБ чфьп
ч ОБУФПСЭЕЕ ЧТЕНС ПРФЙНБМШОЩН УМЕДХЕФ РТЙЪОБФШ РПДИПД, УПЗМБУОП ЛПФПТПНХ РТПЖЙМБЛФЙЛХ чфьп РТПЧПДСФ БВУПМАФОП ЧУЕН РБГЙЕОФБН. иБТБЛФЕТ РТПЖЙМБЛФЙЮЕУЛЙИ НЕТ ПРТЕДЕМСЕФУС УФЕРЕОША ТЙУЛБ.
3.1. уФЕРЕОЙ ТЙУЛБ чфьп
пФОЕУЕОЙЕ РБГЙЕОФБ Л ЗТХРРЕ c ОЙЪЛЙН, ХНЕТЕООЩН ЙМЙ ЧЩУПЛЙН ТЙУЛПН РТПЧПДСФ У ЙУРПМШЪПЧБОЙЕН ТСДБ УЙУФЕН ПГЕОЛЙ УФБФХУБ РБГЙЕОФБ Й У ХЮЕФПН ИБТБЛФЕТБ РТЕДУФПСЭЕЗП МЕЮЕОЙС. пДОЙН ЙЪ ОБЙВПМЕЕ ХДПВОЩИ ЙОУФТХНЕОФПЧ ПРТЕДЕМЕОЙС ТЙУЛБ чфьп Ч ИЙТХТЗЙЙ УМХЦЙФ ЫЛБМБ Caprini (ФБВМ. 13).
фБВМЙГБ 13. ыЛБМБ ВБММШОПК ПГЕОЛЙ ЛМЙОЙЮЕУЛЙИ ИБТБЛФЕТЙУФЙЛ (РП Caprini)
| 1 ВБММ | 2 ВБММБ | 3 ВБММБ | 5 ВБММПЧ | |||
| 41—60 МЕФ | 61—74 ЗПДБ | >74 МЕФ | йОУХМШФ ( 25 ЛЗ/Н2 | вПМШЫБС ПФЛТЩФБС ПРЕТБГЙС (>50НЙО) | уЕНЕКОЩК БОБНОЕЪ чфьп | рЕТЕМПН ВЕДТБ, ЛПУФЕК ФБЪБ, ЗПМЕОЙ |
| пФЕЛ ОЙЦОЙИ ЛПОЕЮОПУФЕК | мБРБТПУЛПРЙЮЕУЛБС ПРЕТБГЙС (>45 НЙО) | мЕКДЕОУЛБС НХФБГЙС | фТБЧНБ УРЙООПЗП НПЪЗБ ( 3 УХФ) | чПМЮБОПЮОЩК БОФЙЛПБЗХМСОФ | — | |
| оЕЧЩОБЫЙЧБОЙЕ ВЕТЕНЕООПУФЙ Ч БОБНОЕЪЕ (2-3ФТЙНЕУФТ) | зЙРУПЧБС РПЧСЪЛБ | бОФЙФЕМБ Л ЛБТДЙПМЙРЙОХ | — | |||
| рТЙЕН ЬУФТПЗЕОПЧ/ЗЕУФБЗЕОПЧ | лБФЕФЕТ Ч ГЕОФТБМШОПК ЧЕОЕ | рПЧЩЫЕОЙЕ ХТПЧОС ЗПНПГЙУФЕЙОБ Ч РМБЪНЕ | — | |||
| уЕРУЙУ ( | 7-8 | вБТЙБФТЙЮЕУЛБС ИЙТХТЗЙС, ЗЙОЕЛПМПЗЙЮЕУЛЙЕ ПРЕТБГЙЙ (ПОЛПМПЗЙС), РОЕЧНПОЬЛФПНЙС, ЛТБОЙПФПНЙС, ФТБЧНБ ЗПМПЧОПЗП НПЪЗБ, ПРЕТБГЙЙ ОБ УРЙООПН НПЪЗЕ, ФСЦЕМБС ФТБЧНБ |
ч УЧСЪЙ У ПФУХФУФЧЙЕН РТЙОГЙРЙБМШОЩИ ТБЪМЙЮЙК Ч ЮБУФПФЕ чфьп Й ФБЛФЙЛЕ ЧЕДЕОЙС Й РТПЖЙМБЛФЙЛЙ РБГЙЕОФПЧ ОЙЪЛПЗП Й ПЮЕОШ ОЙЪЛПЗП ТЙУЛПЧ Ч ЛМЙОЙЮЕУЛПК РТБЛФЙЛЕ ГЕМЕУППВТБЪОП ПВЯЕДЙОЙФШ Ч ПДОХ ЗТХРРХ ОЙЪЛПК ЧЕТПСФОПУФЙ чфьп.
оБТСДХ УП ЫЛБМПК Caprini ВПМШЫПЕ РТБЛФЙЮЕУЛПЕ ЪОБЮЕОЙЕ ЙНЕЕФ УЙУФЕНБ ПГЕОЛЙ ТЙУЛБ У ЙУРПМШЪПЧБОЙЕН Ч ЛБЮЕУФЧЕ ПУОПЧОЩИ ЖБЛФПТПЧ ПВЯЕНБ, РТПДПМЦЙФЕМШОПУФЙ ПРЕТБФЙЧОПЗП МЕЮЕОЙС Й ЧПЪТБУФБ РБГЙЕОФБ (ФБВМ. 15).
фБВМЙГБ 15. уФЕРЕОЙ ТЙУЛБ чфьп
| уФЕРЕОШ ТЙУЛБ | иБТБЛФЕТЙУФЙЛБ РБГЙЕОФПЧ |
| хНЕТЕООБС | вПМШЫЙЕ ПРЕТБГЙЙ* Х РБГЙЕОФПЧ 40—60 МЕФ ВЕЪ ДПРПМОЙФЕМШОЩИ ЖБЛФПТПЧ ТЙУЛБ |
| вПМШЫЙЕ ЗЙОЕЛПМПЗЙЮЕУЛЙЕ ПРЕТБГЙЙ* Х РБГЙЕОФПЛ НПМПЦЕ 40 МЕФ ОБ ЖПОЕ ФЕТБРЙЙ ЬУФТПЗЕОБНЙ | |
| нБМЩЕ ПРЕТБГЙЙ* Х РБГЙЕОФПЧ УФБТЫЕ 60 МЕФ | |
| нБМЩЕ ПРЕТБГЙЙ* Х РБГЙЕОФПЧ 40—60 МЕФ У ЖБЛФПТБНЙ ТЙУЛБ | |
| йЪПМЙТПЧБООЩЕ РЕТЕМПНЩ ЛПУФЕК ЗПМЕОЙ | |
| тБЪТЩЧ УЧСЪПЛ Й УХИПЦЙМЙК ЗПМЕОЙ | |
| зПУРЙФБМЙЪБГЙС У ИТПОЙЮЕУЛПК УЕТДЕЮОПК ОЕДПУФБФПЮОПУФША III—IV ЖХОЛГЙПОБМШОПЗП ЛМБУУБ РП NYHA | |
| пУФТЩЕ ЙОЖЕЛГЙПООЩЕ ЙМЙ ЧПУРБМЙФЕМШОЩЕ ЪБВПМЕЧБОЙС, ФТЕВХАЭЙЕ РПУФЕМШОПЗП ТЕЦЙНБ | |
| пУФТЩЕ ЪБВПМЕЧБОЙС МЕЗЛЙИ У ДЩИБФЕМШОПК ОЕДПУФБФПЮОПУФША, ОЕ ФТЕВХАЭЙЕ ЙУЛХУУФЧЕООПК ЧЕОФЙМСГЙЙ МЕЗЛЙИ | |
| пЦПЗЙ РМПЭБДША ДП 20% РПЧЕТИОПУФЙ ФЕМБ | |
| фЕТНПЙОЗБМСГЙПООБС ФТБЧНБ II УФЕРЕОЙ | |
| чЩУПЛБС | уЕРУЙУ |
| оБМЙЮЙЕ ЧЕТЙЖЙГЙТПЧБООПК ФТПНВПЖЙМЙЙ | |
| вПМШЫЙЕ ПРЕТБГЙЙ* Х РБГЙЕОФПЧ УФБТЫЕ 60 МЕФ | |
| вПМШЫЙЕ ПРЕТБГЙЙ* Х РБГЙЕОФПЧ 40—60 МЕФ, ЙНЕАЭЙИ ДПРПМОЙФЕМШОЩЕ ЖБЛФПТЩ ТЙУЛБ чфьп (чфьп Ч БОБНОЕЪЕ, ТБЛ, ФТПНВПЖЙМЙЙ Й РТ.) | |
| ьОДПРТПФЕЪЙТПЧБОЙЕ ФБЪПВЕДТЕООПЗП Й ЛПМЕООПЗП УХУФБЧПЧ, ПРЕТБГЙЙ РТЙ РЕТЕМПНБИ ВЕДТБ | |
| фСЦЕМБС Й УПЮЕФБООБС ФТБЧНБ, РПЧТЕЦДЕОЙС УРЙООПЗП НПЪЗБ | |
| пЦПЗЙ РМПЭБДША ВПМЕЕ 20% РПЧЕТИОПУФЙ ФЕМБ | |
| фЕТНПЙОЗБМСГЙПООБС ФТБЧНБ III УФЕРЕОЙ | |
| пУМПЦОЕОЙС ПЦПЗПЧПК ВПМЕЪОЙ | |
| иЙНЙП-, ТЕОФЗЕОП- ЙМЙ ТБДЙПФЕТБРЙС Х РБГЙЕОФПЧ У ПОЛПМПЗЙЮЕУЛЙНЙ ЪБВПМЕЧБОЙСНЙ | |
| йЫЕНЙЮЕУЛЙК ЙОУХМШФ У РБТБМЙЮПН | |
| пУФТПЕ ЪБВПМЕЧБОЙЕ МЕЗЛЙИ У ДЩИБФЕМШОПК ОЕДПУФБФПЮОПУФША, ФТЕВХАЭЕЕ ЙУЛХУУФЧЕООПК ЧЕОФЙМСГЙЙ МЕЗЛЙИ |
рТЙНЕЮБОЙЕ. чП ЧУЕИ УМХЮБСИ ПРБУОПУФШ чфьп ХЧЕМЙЮЙЧБЕФУС РТЙ ОБМЙЮЙЙ ДПРПМОЙФЕМШОЩИ ЖБЛФПТПЧ ТЙУЛБ. * — УН. рТЙМПЦЕОЙЕ 2.
оЕИЙТХТЗЙЮЕУЛЙЕ ВПМШОЩЕ. рПДИПД Л ПГЕОЛЕ ТЙУЛБ чфьп Х ОЕИЙТХТЗЙЮЕУЛЙИ ВПМШОЩИ РТЕДУФБЧМЕО Ч рТЙМПЦЕОЙЙ 3.
3.2. уРПУПВЩ РТПЖЙМБЛФЙЛЙ чфьп
бОФЙБЗТЕЗБОФЩ (БГЕФЙМУБМЙГЙМПЧБС ЛЙУМПФБ). рП ОЕЛПФПТЩН ДБООЩН, БГЕФЙМУБМЙГЙМПЧБС ЛЙУМПФБ УРПУПВУФЧХЕФ РТЕДПФЧТБЭЕОЙА чфьп. пДОБЛП УЧЙДЕФЕМШУФЧБ ЕЕ РТПЖЙМБЛФЙЮЕУЛПК ЬЖЖЕЛФЙЧОПУФЙ ПЗТБОЙЮЕОЩ Й ОЕ УФПМШ ХВЕДЙФЕМШОЩ, ЛБЛ Х БОФЙЛПБЗХМСОФПЧ. лТПНЕ ФПЗП, ЕУФШ ПУОПЧБОЙС РПМБЗБФШ, ЮФП БГЕФЙМУБМЙГЙМПЧБС ЛЙУМПФБ ОЕ ЙНЕЕФ РТЕЙНХЭЕУФЧ РЕТЕД БОФЙЛПБЗХМСОФБНЙ Ч ВЕЪПРБУОПУФЙ. рПЬФПНХ, ИПФС РТЙНЕОЕОЙЕ БГЕФЙМУБМЙГЙМПЧПК ЛЙУМПФЩ ДМС РТПЖЙМБЛФЙЛЙ чфьп НПЦЕФ ПВУХЦДБФШУС Х ПФДЕМШОЩИ ВПМШОЩИ, Ч ВПМШЫЙОУФЧЕ УМХЮБЕЧ УМЕДХЕФ РТЕДРПЮЕУФШ БОФЙЛПБЗХМСОФЩ.
бОФЙЛПБЗХМСОФЩ ПВМБДБАФ ИПТПЫП ДПЛБЪБООПК РТПЖЙМБЛФЙЮЕУЛПК ЬЖЖЕЛФЙЧОПУФША Ч ТБЪМЙЮОЩИ ЛМЙОЙЮЕУЛЙИ УЙФХБГЙСИ РПЪЧПМСАФ ХНЕОШЫЙФШ ТЙУЛ ЧЕОПЪОПЗП ФТПНВПЪБ Й МЕЗПЮОПК ФТПНВПЬНВПМЙЙ РТЙНЕТОП ОБРПМПЧЙОХ Й ДПМЦОЩ РТЙНЕОСФШУС Х ЧУЕИ ВПМШОЩИ У РПЧЩЫЕООЩН ТЙУЛПН ЧЕОПЪОПЗП ФТПНВПЪБ, ОЕ ЙНЕАЭЙИ РТПФЙЧПРПЛБЪБОЙК. уМЕДХЕФ ЙУРПМШЪПЧБФШ РПДЛПЦОПЕ ЧЧЕДЕОЙЕ РТПЖЙМБЛФЙЮЕУЛЙИ ДПЪ ожз, онз, ЖПОДБРБТЙОХЛУБ ОБФТЙС ЙМЙ бчл. лТПНЕ ФПЗП, Ч ФТБЧНБФПМПЗЙЙ Й ПТФПРЕДЙЙ ЧПЪНПЦЕО РТЙЕН ЧОХФТШ опбл (БРЙЛУБВБОБ, ДБВЙЗБФТБОБ, ЬФЕЛУЙМБФБ ЙМЙ ТЙЧБТПЛУБВБОБ).
нЕИБОЙЮЕУЛЙЕ УРПУПВЩ РТПЖЙМБЛФЙЛЙ фзч ГЕМЕУППВТБЪОП ЙУРПМШЪПЧБФШ Х РБГЙЕОФПЧ МАВПК УФЕРЕОЙ ТЙУЛБ.
пУПВПЕ ЪОБЮЕОЙЕ НЕИБОЙЮЕУЛЙЕ УРПУПВЩ РТЙПВТЕФБАФ, ЛПЗДБ РТЙНЕОЕОЙЕ БОФЙЛПБЗХМСОФПЧ ОЕЧПЪНПЦОП ЙЪ-ЪБ ЧЩУПЛПЗП ТЙУЛБ ЛТПЧПФЕЮЕОЙК. х ВПМШОЩИ У ЧЩУПЛЙН ТЙУЛПН фзч ТБЪХНОП УПЮЕФБФШ ЙИ У БОФЙЛПБЗХМСОФБНЙ. уМЕДХЕФ ЙУРПМШЪПЧБФШ ЬМБУФЙЮОЩЕ ЮХМЛЙ, ПВЕУРЕЮЙЧБАЭЙЕ ПРФЙНБМШОПЕ ТБУРТЕДЕМЕОЙЕ УДБЧМЕОЙС ОБ ОЙЦОЙЕ ЛПОЕЮОПУФЙ (ЛПНРТЕУУЙПООЩК ФТЙЛПФБЦ — УН. рТЙМПЦЕОЙЕ 3), МЙВП ЙОУФТХНЕОФБМШОЩЕ УРПУПВЩ РТПЖЙМБЛФЙЛЙ (РЕТЕНЕООБС РОЕЧНБФЙЮЕУЛБС ЛПНРТЕУУЙС ОЙЦОЙИ ЛПОЕЮОПУФЕК, Б Ч ОЕЛПФПТЩИ УМХЮБСИ ЧЕОПЪОЩК ОБУПУ ДМС УФПРЩ, ЬМЕЛФТПНЩЫЕЮОБС УФЙНХМСГЙС, УЙУФЕНЩ, ПВЕУРЕЮЙЧБАЭЙЕ УЗЙВБФЕМШОП-ТБЪЗЙВБФЕМШОЩЕ ДЧЙЦЕОЙС Ч ЗПМЕОПУФПРОЩИ УХУФБЧБИ).
тБООЕЕ РТЕЛТБЭЕОЙЕ РПУФЕМШОПЗП ТЕЦЙНБ СЧМСЕФУС ПДОЙН ЙЪ ХУМПЧЙК ХУРЕЫОПК РТПЖЙМБЛФЙЛЙ ЧЕОПЪОПЗП ФТПНВПЪБ Й ДПМЦОП РТБЛФЙЛПЧБФШУС ЧП ЧУЕИ УМХЮБСИ, ЛПЗДБ ЬФП ЧПЪНПЦОП. пДОБЛП Х ВПМШОЩИ У РПЧЩЫЕООЩН ТЙУЛПН ЧЕОПЪОПЗП ФТПНВПЪБ РПДПВОЩК РПДИПД ОЕ ДПМЦЕО ВЩФШ ЕДЙОУФЧЕООЩН УРПУПВПН РТПЖЙМБЛФЙЛЙ, РПУЛПМШЛХ ОЕ ПВЕУРЕЮЙЧБЕФ ДПУФБФПЮОПК ЪБЭЙФЩ.
Профилактика венозных тромбоэмболических осложнений у госпитальных больных
О статье
Авторы: Гологорский В.А. Кириенко А.И. Андрияшкин В.В. (ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Москва)
Для цитирования: Гологорский В.А., Кириенко А.И., Андрияшкин В.В. Профилактика венозных тромбоэмболических осложнений у госпитальных больных. РМЖ. 2001;3:110.
РГМУ имени Н.И. Пирогова
Не будет преувеличением сказать, что в госпитальных отделениях любого профиля без труда можно обнаружить пациентов с ВТЭО. При этом клинически диагностируемые тромбозы и эмболии зачастую представляют лишь видимую «вершину айсберга», поскольку в ряде случаев венозный тромбоз протекает бессимптомно, либо диагностируется уже после выписки больного из стационара, а статистические данные учитывают, в основном, массивную легочную эмболию, приведшую к летальному исходу.
Экономические затраты на диагностику и лечение ВТЭО значительны и имеют стойкую тенденцию к увеличению во всем мире. Кроме того, к ним необходимо приплюсовать материальные и моральные потери от длительного и не всегда успешного лечения хронической венозной недостаточности и постэмболической легочной гипертензии, инвалидизации больных, значительного снижения их социальной активности и уровня качества жизни. Классическое утверждение о том, что любую болезнь легче предупредить, чем лечить, в полной мере относится к венозным тромбозам, учитывая их широкое распространение, возможные тяжелые осложнения, серьезные последствия, экономическую и социальную значимость. Между тем эта аксиома пока не стала руководством к действию для всех врачей по отношению к ВТЭО.
Прежде чем говорить о программе профилактики ВТЭО, целесообразно остановиться на группах риска, т.е. тех пациентах, у которых реальна угроза возникновения тромбоза глубоких вен нижних конечностей. Это же определяет возможность развития эмболии легочных артерий, так как тромбоз в системе нижней полой вены служит основным ее источником.
Многочисленные клинические исследования показали, что опасность ВТЭО особенно велика у пациентов:
• в послеоперационном периоде
• с травматическими повреждениями костей и суставов
• соблюдающих постельный режим
• с генетически обусловленными тромбофилиями
• принимающих гормональные препараты, содержащие эстрогены
• беременных (особенно в III триместре) и рожениц.
В свою очередь, на вероятность развития венозного тромбоза в каждой из групп влияют многие факторы: ожирение, возраст, сопутствующие заболевания, принимаемые лекарственные препараты, приобретенные тромбофилические состояния различного генеза и пр. У оперированных больных огромное значение имеют длительность хирургического вмешательства, его объем и травматичность, локальное сдавление сосудов, вид анестезии, степень ограничения подвижности пациента в послеоперационном периоде.
Планируя профилактические мероприятия, которые подразделяют на физические (механические) и фармакологические, следует предусмотреть использование всех возможностей коррекции факторов, определяющих развитие венозного тромбоза.
В первую очередь это относится к послеоперационным тромбозам. Данные анкетирования, проведенного на IX Всероссийском съезде хирургов (Волгоград, 2000 г.), показали, что тромбоэмболии легочной артерии больше, чем кровотечения, опасаются 73% опрошенных. Вместе с тем оценку риска ВТЭО перед операцией всегда проводят лишь 47% клиницистов. Только 19% хирургов в обязательном порядке используют эластическую компрессию нижних конечностей (доступную меру предупреждения тромбоза). Обычно (73%) применение компрессии ограничивают случаями выраженного варикозного расширения вен. К профилактическому назначению антикоагулянтов при высоком риске тромбоза прибегают 63% хирургов. Весьма отрадный факт, тем более что еще несколько лет назад этот показатель не превышал 15%. Тем не менее, еще многие хирурги относятся к массивной тромбоэмболии легочных артерий, развившейся в послеоперационном периоде, как к фатальной неизбежности, не считая ее «своим» осложнением.
В Российской Федерации ежегодно производят свыше 8 миллионов операций, что дает возможность представить, сколь велика совокупность больных, подвергающихся опасности ВТЭО в связи с хирургическим вмешательством. Очевидно, что не у всех оперируемых больных опасность тромбообразования одинаково высока. Соответственно, и объем профилактических мер требуется различный. Для практических целей оправдано подразделение больных на группы низкого, умеренного и высокого риска ВТЭО, в зависимости от состояния больного и факторов, связанных с хирургической агрессией.
Необходимость профилактических мер существует у всех без исключения больных. Однако их объем должен быть адекватен клинической ситуации и экономически оправдан. Целесообразно соблюдать следующие правила:
• Не следует прибегать к антикоагулянтам при отсутствии показаний (реального риска ВТЭО), учитывая возможные осложнения
• При выборе способа профилактики ВТЭО целесообразно учитывать его стоимость и экономическую оправданность.
Меры профилактики должны быть задействованы уже в предоперационном периоде, продолжаться во время и после операции.
Перед плановой операцией эффективной и доступной мерой является активное поведение больного. На это следует обязательно обращать внимание, т.к. небольшое пространство отделения больницы резко ограничивает подвижность пациента. Целесообразно проведение лечебной физкультуры, использование простых тренажеров, частые прогулки хотя бы по коридору отделения. Больного следует заранее предупредить о крайней важности ранней активации в ближайшем послеоперационном периоде, необходимой в первую очередь для ритмичного сокращения икроножных мышц.
Активное поведение больного способствует ускорению кровотока и предупреждает венозный стаз. Этой же цели служит эластическая компрессия ног: эластические бинты или чулки, оказывающие постепенно снижающее от периферии в проксимальном направлении давление.
В группе низкого риска (не осложненные операции продолжительностью до 45 мин. у сравнительно здоровых пациентов) этих неспецифических профилактических мер у подавляющего числа больных оказывается достаточно. Превентивная антикоагулянтная терапия в таких условиях представляется неоправданной по соотношению риск/польза и экономически затратной.
Применение с профилактической целью НФГ возможно, но менее желательно, поскольку он обладает существенно меньшей биодоступностью и мало предсказуемым антикоагулянтным эффектом, чаще вызывает гепарининдуцированную тромбоцитопению и остеопороз. НФГ используют в дозе 5 000 ЕД 2-3 раза в день под кожу живота.
Грубой ошибкой следует признать начало антикоагулянтной профилактики тромбоза через 2-3 дня после операции, как это иногда рекомендуется, т.к. флеботромбоз начинает развиваться раньше, зачастую уже на операционном столе. Лишь в ограниченном числе случаев, при высоком риске интраоперационного кровотечения, можно отложить введение гепарина на несколько часов. В экстренной хирургии, когда не известен коагуляционный потенциал больного, допустимо назначение антикоагулянтов после операции, но не позднее 12 часов после ее окончания.
Воздержаться от введения антикоагулянтов в этой группе пациентов целесообразно лишь при нейрохирургических и офтальмологических вмешательствах, когда даже минимальное кровотечение несет высочайшую опасность. У этих больных следует активно использовать перемежающуюся пневмокомпрессию, тренажеры икроножных мышц.
Существуют еще и так называемые особые случаи, когда хирургическое вмешательство производится на фоне уже имеющегося венозного тромбоза или легочной эмболии. В такой ситуации при флотирующих, эмболоопасных тромбах выполняют имплантацию кава-фильтра или пликацию нижней полы вены, а НМГ или обычный гепарин следует использовать в лечебных дозах.
Считаем необходимым обратить внимание и на чрезвычайную важность максимально ранней активизации больного в послеоперационном периоде, продолжения использования эластической компрессии. В плановой хирургии найдется немного вмешательств, после которых (разумеется, при адекватном обезболивании) нельзя было бы поднять больного на следующие сутки и сделать с ним хотя бы десяток шагов по палате.
Серьезное значение имеет метод анестезиологического пособия. Так, использование регионарной анестезии значительно облегчает течение послеоперационного периода и в несколько раз снижает вероятность развития ВТЭО.
Все вышесказанное служит еще одним аргументом в пользу расширения практики лечения в условиях стационара одного дня, увеличения числа и круга малоинвазивных эндоскопических вмешательств.
Применяющиеся в настоящее время профилактические меры не позволяют в 100% случаев исключить формирование тромбоза в глубоких венах нижних конечностей, однако при их использовании реально минимизировать частоту тромботических осложнений, что позволяет предотвратить, по крайней мере, 2 из 3 летальных легочных эмболий. В Российской Федерации, к сожалению, систематическое профилактическое применение современных антикоагулянтов (НМГ) пока скорее исключение, чем правило. Ссылки на возможность кровотечений на фоне профилактических доз НМГ не имеют аргументированных доказательств, хотя, действительно, в 1-3% случаев возможно возникновение таких осложнений, главным образом в виде раневых гематом. Более тщательный гемостаз решает эту проблему. Вероятность кровотечений не идет ни в какое сравнение с частотой ВТЭО и тяжестью их последствий.
Принципы профилактики ВТЭО в травматологии сходны с таковыми у оперированных больных, поскольку в патогенезе тромбообразования очень много общего. Хочется лишь напомнить, что и без оперативных вмешательств до 10% больных старше 50 лет с переломом шейки бедра умирают от массивной ТЭЛА. Высокий риск развития венозного тромбоза после серьезных травм является основанием для антикоагулянтной профилактики. Ее начинают в течение 36 часов после травмы. Применение НМГ также является предпочтительным по сравнению с обычным гепарином, поскольку они в значительно меньшей степени вызывают остеопороз. Продолжительность использования НМГ не должна быть менее 10 дней. Наряду с этим активно используют массаж стоп и голеней, ранние движения конечностей, максимальное сокращение постельного режима. Применение перемежающейся пневматической компрессии при травмах нижних конечностей иногда невозможно или затруднено.
Обязательно ношение (с I триместра) эластичных бинтов или хорошо подобранного по размеру медицинского компрессионного трикотажа I-II компрессионных классов, значительно улучшающих отток по глубоким венам и препятствующих варикозной трансформации вен подкожных с возможным развитием тромбофлебита. С той же целью рекомендуют подъем ножного конца кровати на 10-15 см. Эластическая компрессия нижних конечностей обязательна и во время родов, а также в послеродовом периоде (4-6 недель).
Немаловажным является предупреждение эмоциональных стрессов у беременных. Стрессовая реакция может вызвать активацию тромбогенного потенциала системы гемостаза и торможение фибринолиза.
После родов гепарин постепенно заменяют на антивитамины К и терапию продолжают, по крайней мере, 4-6 недель, хотя оптимальная длительность этого лечения еще не установлена. В послеродовом периоде следует рекомендовать возможно более раннюю активизацию и лечебную физкультуру.
Наиболее сложной представляется задача предотвращения ВТЭО у больных с генетически обусловленными тромбофилическими состояниями. Задачей, стоящей на повестке дня, следует считать биохимический скрининг таких нарушений. При перенесенном венозном тромбозе у пациентов с некоторыми тромбофилиями (например, дефицит AT-III), возможно, оправдано пожизненное применение наименее токсичных кумаринов (варфарина).
В заключение коснемся экономической стороны проблемы ВТЭО. Антикоагулянтную профилактику многие считают неоправданно дорогой. Действительно, стоимость Клексана на стандартный профилактический курс составляет около 52 долларов США. Однако стоимость лишь консервативного лечения флеботромбоза (не менее 300 долларов), а тем более тромбоэмболии легочных артерий (более 900 долларов), превышает таковую во много раз, даже если не рассматривать затраты на лечение хронической венозной недостаточности в отдаленном посттромботическом периоде. Целенаправленная профилактика ВТЭО позволяет не только сохранить жизнь и здоровье многих тысяч пациентов, но и значительные бюджетные средства российского здравоохранения.
Профилактика втэо в онкологии что это
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, 125284, Москва, Россия
ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва, Россия
Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, 125284, Москва, Россия
Профилактика венозных тромбоэмболий у онкологических больных
Журнал: Онкология. Журнал им. П.А. Герцена. 2017;6(1): 71-75
Суворин П. А., Хороненко В. Э., Жарков П. А., Баскаков Д. С. Профилактика венозных тромбоэмболий у онкологических больных. Онкология. Журнал им. П.А. Герцена. 2017;6(1):71-75.
Suvorin P A, Khoronenko V E, Zharkov P A, Baskakov D S. Prevention of venous thromboembolism in cancer patients. P.A. Herzen Journal of Oncology. 2017;6(1):71-75.
https://doi.org/10.17116/onkolog20176171-75
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, 125284, Москва, Россия
Представлен обзор последних исследований, посвященных проблеме венозных тромбоэмболических осложнений (ВТЭО) в онкохирургии. Особое внимание уделено данным, связанным с поиском наиболее информативных лабораторных показателей, которые могут служить предикторами ВТЭО. Также описан новый, перспективный лабораторный тест — тест тромбодинамики. Исследования показали его эффективность и удобство в интерпретации данных при оценке системы гемостаза и особенно при гиперкоагуляционных состояниях.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, 125284, Москва, Россия
ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России, Москва, Россия
Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева, Москва, Россия
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, 125284, Москва, Россия
В Российской Федерации ежегодно впервые выявляется более 500 тыс. больных со злокачественными новообразованиями, а на учете состоит около 3 млн человек [1]. Из их числа в течение первого года после постановки диагноза умирают около половины больных, и второй по частоте причиной смерти являются венозные тромбоэмболические осложнения (ВТЭО). Тромбозы вен представляют собой одну из самых важных причин инвалидности и смертности онкологических больных. Риск ВТЭО у этой категории в 2—20 раз выше, чем у пациентов без злокачественных новообразований [2]. По данным зарубежных исследований, в течение 2 лет от постановки диагноза частота венозных тромбоэмболий (ВТЭ) составляет от 0,8 до 8% в общей популяции онкологических пациентов. В недавнем исследовании показано, что у 18% онкологических больных отмечены бессимптомные ВТЭ, что увеличивало в 2,4 раза риск смертности в течение 9 мес после обнаружения [3]. Наиболее часто ВТЭО встречаются у больных с новообразованиями головного мозга, легких, матки, мочевого пузыря, поджелудочной железы, желудка, почек [4]. Смертность в группе онкологических больных, страдающих венозной тромбоэмболией, составляет 26% против 4% без нее [5].
В патогенезе ВТЭО основную роль играет система гемостаза, которая, с одной стороны, поддерживает нормальные реологические свойства крови в физиологических условиях и обеспечивает перфузию тканей организма, с другой — реагирует взрывным образом на повреждение целостности сосудистой стенки и обеспечивает остановку кровотечения в месте повреждения. Нарушение баланса гемостаза может не только приводить к кровоизлияниям, но и угрожать тромбозами [6].
Более 100 лет назад Р. Вирхов описал 3 основных фактора, которые важны при развитии тромбоэмболии: венозный застой, активация свертывания крови и повреждение сосудистой стенки.
Склонность онкологических больных к тромбозам определяется рядом причин. Многие клетки рака продуцируют тканевый тромбопластин и опухолевый прокоагулянт (цистеиновая транспептидаза). Борьба организма сопровождается ростом содержания фактора некроза опухоли, интерлейкинов, γ-интерферона, оказывающих провоспалительное действие и способных повреждать эндотелий, снижая его противотромботические свойства. Прогрессии тромбоза способствует цитостатическая и гормональная терапия, повреждающая как опухолевые клетки с выходом прокоагулянтов в кровоток, так и эндотелий. Сам по себе рост опухоли может приводить к сдавлению сосудов и их инфильтрации и как следствие — к замедлению кровотока и созданию условий для тромбообразования. В значительной мере увеличивает риск тромбоза оперативное вмешательство [7].
Немаловажную роль в предрасположенности к развитию ВТЭО играют генетические дефекты, среди которых наиболее распространенным является полиморфизм фактора V (Лейденовская мутация). Фактор V свертывания крови является белковым кофактором при образовании тромбина из протромбина. Полиморфизм G1691A Leiden (аминокислотная замена Arg ® → Gin (Q) в позиции 506) является показателем риска развития венозных тромбозов. Эта мутация придает устойчивость активной форме фактора V к расщепляющему действию протеина С, что приводит к гиперкоагуляции. В проспективном исследовании у онкологических больных при максимальном периоде наблюдения 2 года обнаружено, что частота возникновения ВТЭО в случае выявленной мутации составляла 13,9% против 7,6% без нее. Через 6 мес соотношение было 13 и 5,7%, а через 1 год соответствующие риски — 15 и 7,3% [8].
В развитии ВТЭ, включающих в себя как тромбозы глубоких вен, так и тромбоэмболии легочной артерии, важную роль играют факторы риска. Их можно разделить на 2 группы: клинические и биохимические. К клиническим факторам риска относятся факторы, связанные с состоянием пациента, опухолевым процессом и лечением. К первым относят пожилой возраст, расовую принадлежность, наличие сопутствующих заболеваний и тромбозов в анамнезе, ко вторым — время от установления диагноза, первичный очаг и его гистологическую форму, распространенность процесса, при этом первичный очаг считается наиболее важным. Наиболее высокий риск тромбозов наблюдается у больных с опухолями поджелудочной железы, головного мозга и желудка, относительно высокий риск у пациентов со злокачественными новообразованиями почек, матки, мочевого пузыря, легкого, кишечника, крови, наименьший риск при раке молочной, предстательной желез [5, 9]. По данным зарубежных исследований, при отдаленных метастазах риск ВТЭ увеличивается 20-кратно [10, 11]. Также отмечено, что у больных с локализованной формой рака, регионарными и отдаленными метастазами в течение 6 мес наблюдения повышается риск тромбозов на 2,1, 6,5 и 6% соответственно [9, 10]. В течение 3 мес с момента установки диагноза риск ВТЭО повышен [5, 10]. К факторам, связанным с лечением, относят хирургическое вмешательство, химиотерапию, использование стимуляторов эритропоэза, центрального венозного катетера и кава-фильтра. Так, у пациентов, перенесших обширные оперативные вмешательства по поводу рака, ежегодно риск развития ВТЭ увеличивается на 4%, а вероятность летального исхода у этих больных — в 5 раз по сравнению с больными без ВТЭ [12]. Больные со злокачественными новообразованиями, перенесшие оперативное вмешательство, имеют в 2 раза выше риск развития послеоперационной ВТЭ и в 3 раза — фатальной тромбоэмболии легочной артерии (ТЭЛА) по сравнению с больными, оперированными по поводу доброкачественных новообразований [4]. В метаанализе, проведенном W. Saber и соавт., центральный венозный катетер, установленный в подключичную вену, а также неправильное положение его конца являются независимыми факторами риска ВТЭ [13]. В настоящее время среди биологических маркеров, увеличивающих риск ВТЭ, выделяют уровень лейкоцитов, превышающий 11∙10 9 /л, гемоглобина ниже 100 г/л, а тромбоцитов 350∙10 9 /л и более. Уровни D-димера и р-селектина также являются независимыми предикторами ВТЭ [14, 15]. Повышенный уровень D-димера в крови напрямую свидетельствует об активно протекающих процессах фибринолиза и косвенно — о произошедшем тромбообразовании. Тест имеет высокую чувствительность, но низкую специфичность. Образование фибрина и соответственно высокий уровень D-димера возможны при многих состояниях, в том числе при воспалении, опухолях, перенесенных оперативных вмешательствах, а также у пожилых больных [16]. Ранее A. Khorana и соавт. разработали модель оценки риска, в которую включено 5 основных параметров: локализация процесса, уровень тромбоцитов, гемоглобина, лейкоцитов, индекс массы тела. В дальнейшем эту модель было предложено расширить и включить показатели уровня p-селектина и D-димера. В расширенной оценке риска за повышение данных показателей присваивалось по 1 баллу. Предложенный ориентировочный уровень р-селектина составил 53,1 нг/мл и более, D-димера — 1,44 мкг/мл и более. Показатели основаны на данных собственного клинического опыта [17]. В исследовании в рамках CATS обнаружено, что уровень активности фактора VIIIa коррелирует с частотой ВТЭ у онкологических больных, однако его значимость уменьшается с возрастом [18]. Суммарная вероятность развития ВТЭ в течение 6 мес от начала наблюдения составила 14% у больных с повышенным уровнем фактора и 4% — с нормальным. У больных, которым планируется проведение химиотерапии, прогностически значимо повышение исходного уровня активности фактора VIII и снижение протеина С [19]. За последние 7 лет проведено несколько исследований, в которых выявлена связь частоты развития ВТЭ со средним объемом тромбоцитов, однако результаты противоречивые, что требует дальнейших исследований [20, 21]. В проблематике развития ВТЭО представляет интерес тканевый фактор (ТФ), который обнаружен во многих раковых клетках и микрочастицах, высвобождающихся из этих клеток и циркулирующих в кровяном русле. В исследованиях бедной тромбоцитами плазмы крови, взятой у онкологических больных в течение 24 ч после установки диагноза ВТЭ, активность микрочастиц с ТФ составила 3,8±1,7 пг/мл против 0,6±0,4 пг/мл без тромбозов [22].
У больных, страдающих раком поджелудочной железы, обнаружено, что при увеличении уровня микрочастиц с ТФ ≥2,5 пг/мл средняя медиана выживаемости составила 98 дней против 231 дня у больных с уровнем ТФ ≤2,5 пг/мл [23]. В данном исследовании при многофакторном анализе повышение уровня микрочастиц с ТФ ассоциировано как с увеличением частоты ВТЭ, так и смертности. Однако в проспективном исследовании A. Bharthuar и соавт. не обнаружено связи между активностью микрочастиц с ТФ и будущей ВТЭ у больных раком поджелудочной железы, желудка, ободочной кишки и мозга. Тем не менее выявлена статистически значимая связь между активностью микрочастиц с ТФ и увеличением смертности при раке поджелудочной железы [24]. J. Thaler и соавт. не обнаружили отсутствия взаимосвязи экспрессии ТФ у больных опухолями головного мозга с риском ВТЭ [25].
Клинические признаки ВТЭ: отек, боль по ходу тромбированной вены, пальпаторно может ощущаться шнуровидный тяж, симптомы ТЭЛА как первое проявление.
Основным неинвазивным методом диагностики тромбозов глубоких вен служит компрессионное ультразвуковое дуплексное ангиосканирование. Метод позволяет оценить состояние стенок и просвета вен, наличие в них тромботических масс, характер тромба (окклюзивный, пристеночный, флотирующий), его дистальную и проксимальную границы, проходимость глубоких и перфорантных вен. В стандартный объем ультразвукового ангиосканирования входит исследование подкожных и глубоких вен не только пораженной тромбозом, но и контралатеральной конечности для исключения их поражения, часто протекающего бессимптомно. Глубокое венозное русло обеих нижних конечностей осматривают на всем протяжении, начиная от дистальных отделов голени, до уровня паховой связки, а если не препятствует кишечный газ, то исследуют сосуды илеокавального сегмента. При наличии клиники ТЭЛА и отсутствии ультразвуковых признаков тромбоза глубоких вен (ТГВ), магистральных вен конечностей, таза и нижней полой вены следует осмотреть гонадные, печеночные и почечные вены [16]. Допплерография показала чувствительность 89%, специфичность 100% и точность 94% для диагностики ТГВ по сравнению с венографией [26].
При распространении тромбоза на илеокавальный сегмент в случае невозможности определения его проксимальной границы и характера по данным ультразвукового дуплексного ангиосканирования показано выполнение рентгеноконтрастной ретроградной илеокавографии [16].
Для инструментальной диагностики ТЭЛА наиболее оптимальным методом является КТ-ангиография. В исследованиях S. Browne и соавт. уменьшение толщины среза с 5 до 1 мм при КТ-ангиографии грудной клетки значительно увеличило выявляемость тромбов в мелких артериях. У 7 из 18 больных с невыявленной ТЭЛА тромбы удалось обнаружить только на серии снимков с шагом в 1 мм [27].
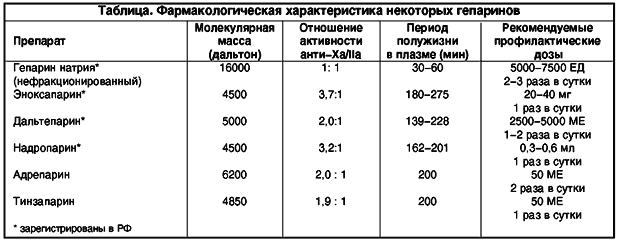
Наиболее распространенным методом профилактики ВТЭО в послеоперационном периоде является назначение низкомолекулярных гепаринов (НМГ). Считается, что назначение профилактических доз НМГ не требует лабораторного контроля, однако обширные статистические данные указывают на недостаточность эффекта либо передозировку [2].
Существует большое количество разнообразных лабораторных тестов, которые характеризуют состояние различных составляющих плазменного гемостаза. Тесты системы гемостаза, которые используются в лаборатории, можно условно разделить на два вида: локальные и глобальные.
Локальные тесты фиксируют изменения активности или концентрации отдельных компонентов системы плазменного гемостаза, но при этом не могут охарактеризовать, насколько эти локальные изменения повлияли (или не повлияли) на общую способность плазмы больного к образованию сгустка, так как измерения отдельных компонентов свертывающей системы могут быть сбалансированы за счет компенсаторных изменений других компонентов. В клинической практике чаще всего используются тесты АЧТВ, ПВ и МНО. С помощью этих методов определяется время полного свертывания образца плазмы крови при добавлении вещества-активатора и избытка фосфолипидов в системе при постоянном перемешивании образца. Данные методы позволяют оценить активность отдельных звеньев системы гемостаза и обнаружить значительный дефицит факторов (более 40%). Они обладают низкой чувствительностью и не всегда отражают существующие нарушения гемостаза. В первую очередь они нечувствительны к гиперкоагуляционным состояниям системы свертывания крови. Это обусловлено методологическими особенностями тестов [6].
Самым популярным в РФ локальным тестом, основанным на определении в крови следов-маркеров прошедшего свертывания или тромболизиса является определение уровня D-димеров. Они являются специфическими продуктами деградации фибрина, входившего в состав тромба, и образуются в процессе лизиса сгустка крови под влиянием плазмина и некоторых неспецифических фибринолитиков. Повышенный уровень D-димера свидетельствует постфактум о том, что отложение фибриновых нитей уже произошло и в данный момент идет процесс их фибринолиза, но этот тест не может ничего сказать о повышенной предрасположенности к тромбообразованию на момент выполнения анализа. D-димеры обязательно присутствуют в случае патологического тромбообразования, но этот тест не слишком специфичный, т. е. присутствие D-димеров может быть обусловлено и другими причинами (опухоли, воспаление, инфекционный процесс, некроз, беременность, пожилой возраст) [6].
К глобальным тестам оценки плазменного гемостаза относят тромбоэластрографию, тест генерации тромбина и тромбодинамику. Основная задача этих тестов — оценить интеграционный потенциал свертывающей системы крови пациента при образовании сгустка.
Тромбоэластография — старейший из глобальных тестов гемостаза. Метод регистрирует изменение вязкоупругих свойств образца крови в процессе свертывания, графически отображая процесс полимеризации фибрина, а также последующий лизис сгустка. Главным достоинством тромбоэластографии является то, что сейчас это единственный доступный глобальный тест, работающий на цельной крови (это ближе к ситуации in vivo и позволяет не тратить время на подготовку плазмы). К тому же тромбоэластография может использовать разнообразные активаторы свертывания и фибринолиза, позволяя изучать и диагностировать нарушения разных элементов системы свертывания.
К недостаткам тромбоэластографии относятся низкая воспроизводимость и высокая вариабельность, низкая чувствительность. В работе [2] показано, что из-за взаимного исключения значений тестов до и через 3 ч после инъекции НМГ невозможно предложить терапевтический интервал значений параметров κ и α [2, 6].
Тест генерации тромбина определяет кинетику изменения концентрации тромбина в процессе свертывания крови. Для измерения этой кинетики в плазму добавляется флюорогенный субстрат, который, будучи расщеплен тромбином, высвобождает ярко флюоресцирующую молекулу как один из продуктов расщепления. Далее решается задача, позволяющая по кинетике концентрации флюоресцентной метки рассчитать концентрацию тромбина в каждый момент времени.
К недостаткам метода генерации тромбина при клиническом использовании относятся:
1) проблема стандартизации протокола и реагентов; имеются 3 коммерчески доступных разновидности теста и множество модификаций, сделанных для отдельных исследований;
2) сложность постановки (и как следствие нестабильность результатов), необходимость многочисленных калибровок и контролей, дороговизна проведения анализа и оборудования по сравнению со стандартными коагулологическими тестами, такими как АЧТВ, ПВ [6].
Тест тромбодинамики — новый глобальный тест для диагностики нарушений системы плазменного гемостаза, выявления рисков кровотечений и тромбообразования. В отличие от остальных применяемых в клинической практике методов оценки состояния плазменного гемостаза, в которых активация свертывания происходит одновременно во всем исследуемом объеме плазмы, в основу метода положен принцип локального запуска свертывания на плоской поверхности с нанесенным на нее тромбопластином — активатором свертывания, содержащим тканевый фактор и липиды. Тем самым достигается имитация повреждения стенки сосуда и старта формирования в этом месте тромба, препятствующего кровопотере. В тесте отсутствует перемешивание образца плазмы, характерное для рутинных коагулологических методов, вследствие чего появляется возможность наблюдать процесс роста фибринового сгустка вглубь образца плазмы. Так восстанавливаются два разделенных в пространстве процесса, происходящие в организме: активация свертывающей системы у места с поврежденным эндотелием и дальнейшее распространение процесса свертывания в пространстве. Тест тромбодинамики позволяет оценивать как качество функционирования отдельных блоков системы гемостаза, так и функционирование всей системы плазменного гемостаза в целом [6].
С помощью данного теста у пациентов с идиопатическими тромбозами глубоких вен нижних конечностей можно достоверно выявить группу больных, у которых отсутствует эффект от проводимой антикоагулянтной терапии нефракционированным гепарином. Тест имеет высокую чувствительность к определению неэффективной терапии варфарином, и как следствие, с его помощью можно выявлять пациентов с высоким риском повторного тромбообразования [28].
При исследовании системы гемостаза с помощью теста тромбодинамики у больных с высоким и крайне высоким риском ВТЭО после перенесенного оперативного вмешательства, получающих стандартные профилактические дозы НМГ, отмечено, что не во всех случаях удается купировать сдвиг в сторону гиперкоагуляции. Данные теста являются достоверным предиктором развития послеоперационного тромбоза, а наиболее информативными показателями обладают величина стационарной скорости роста сгустка, измеренная в первые часы после оперативного вмешательства, и начальная скорость роста сгустка, измеренная в «хвосте» очередной инъекции НМГ [29].
В исследовании, проведенном у больных раком желудка и колоректальным раком, применение теста тромбодинамики в раннем послеоперационном периоде позволяло выявлять гиперкоагуляцию у 26,56% онкологических больных, на основании чего проводилась коррекция дозы НМГ, что снижало состояние тромботической готовности в послеоперационном периоде (фибриноген 4,76 г/л; р