Продукты реакции что это
Классификация химических реакций
Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
В ходе химической реакции разрушаются химические связи, и образуются новые.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
2. Реакции, протекающие с изменением состава
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
Реакция газообразного водорода с твердым йодом также эндотермическая:
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Также экзотермическими являются:
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Также эндотермическими являются:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практичсеки не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так: A + K = AK; AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом. К обратимым реакциям относятся большинство гомогенных реакций, этерификация; реакции гидролиза; гидрирование-дегидрирование, гидратация-дегидратация; получение аммиака из простых веществ, окисление сернистого газа, получение галогеноводородов (кроме фтороводорода) и сероводорода; синтез метанола; получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях. Примеры необратимых реакций: горение; реакции, идущие со взрывом; реакции, идущие с образованием газа, осадка или воды в растворах; растворение щелочных металлов в воде; и др.
Разница между реагентами и продуктами
Содержание:
Ключевые области покрыты
1. Что такое реагенты
— определение, свойства, типы реакций и их реагенты
2. Что такое продукты
— Определение, свойства, типы реакций и их продуктов
3. Каковы сходства между реагентами и продуктами
— Краткое описание общих черт
4. В чем разница между реагентами и продуктами
— Сравнение основных различий
Ключевые термины: кислотно-основные реакции, реакции горения, реакции разложения, эндотермические реакции, экзотермические реакции, реакции осаждения, продукты, реагенты, окислительно-восстановительные реакции, реакции синтеза
Какие реактивы
Реактивы могут быть бесцветными или красочными. В результате они могут привести к появлению либо бесцветных, либо красочных продуктов, в зависимости от типа и условий реакции. Реагенты химической реакции могут находиться в твердой фазе, жидкой фазе или газообразной фазе. В зависимости от типа реакции реагенты различаются.
Типы реакций и реагентов
Кислотно-основные реакции
Реагентами этих реакций являются кислоты и основания.
Окислительно-восстановительные реакции
Реагенты являются окислителями и восстановителями. Иногда буферные растворы также используются для поддержания pH реакционной смеси.
Реакции синтеза
Реагенты реакций синтеза представляют собой небольшие молекулы, чем их продукты.
Реакции разложения
В реакциях разложения реагенты представляют собой большие молекулы, чем продукты этой реакции.
Реакции сгорания
Реакции осадков
В большинстве случаев реагенты реакций осаждения представляют собой жидкости.
Экзотермические реакции
Реагенты этих химических реакций имеют более высокую потенциальную энергию, чем у продуктов.
Эндотермические реакции
Реагенты этих реакций имеют более низкую потенциальную энергию, чем продукты.
На скорость реакции также влияют реагенты. Скорость конкретной реакции будет зависеть от потенциальной энергии реагентов.
Рисунок 01: Реакционно-координатная диаграмма для экзотермической химической реакции
На изображении выше показана диаграмма реакции-координаты для конкретной химической реакции. В этой реакции реагенты имеют более высокую потенциальную энергию, чем продукты. Следовательно, в ходе этой реакции избыточная энергия выделяется в окружающую среду.
Что такое продукты
Изделия могут быть как бесцветными, так и красочными. Цвет продукта зависит от типов реагентов, участвующих в реакции. Количество продуктов, присутствующих в реакционной смеси, всегда увеличивается с развитием реакции.
Типы реакций и их продукты
Кислотно-основные реакции
Продуктами этих реакций всегда являются соль и вода.
Окислительно-восстановительные реакции
Продукты окислены и восстановлены формы реагентов. Часто вода предоставляется в качестве продукта.
Реакции синтеза
Продуктами реакций синтеза являются большие молекулы, чем реагенты.
Реакции разложения
В реакциях разложения продукты представляют собой небольшие молекулы, чем реагенты.
Реакции сгорания
Продуктами реакций сгорания часто являются углекислый газ и вода для полного сгорания (углеводородов) и окись углерода для неполного сгорания.
Реакции осадков
Продуктами реакций осаждения являются твердые осадки или суспензии.
Экзотермические реакции
Продукты этих химических реакций имеют более низкую потенциальную энергию, чем у реагентов.
Эндотермические реакции
Продукты этих реакций имеют более высокую потенциальную энергию, чем у реагентов.
Скорость реакции может быть определена количеством продукта, образовавшегося в определенный период времени. В большинстве случаев продукты представляют собой стабильные формы реагентов. Реактивы подвергаются химическим реакциям с целью получения стабильного состояния.
Рисунок 02: Реакция-координационная диаграмма для образования метилового спирта
На приведенной выше диаграмме реакционная смесь вначале состоит только из реагентов, а затем появляется промежуточный продукт, который является переходным состоянием реагентов, и затем образуется конечный продукт. Поскольку реагенты имеют более высокую потенциальную энергию, чем у продуктов в этой конкретной реакции, энергия выделяется в виде тепла. Но эта энергия не считается продуктом химической реакции, потому что это не вещество.
Сходство между реагентами и продуктами
Разница между реагентами и продуктами
Определение
потребление
Реактивы: Реактивы расходуются на протяжении всей реакции.
Товары: Продукты не потребляются в реакции.
концентрация
Реактивы: Количество реагентов, присутствующих в реакционной смеси, уменьшается либо быстро, либо медленно во время реакции.
Товары: Количество продуктов, присутствующих в реакционной смеси, увеличивается либо быстро, либо медленно во время реакции.
начало
Реактивы: В начале реакции в реакционной смеси присутствуют только реагенты.
Товары: В начале реакции продукты не присутствуют в реакционной смеси.
Конец
Реактивы: В конце реакции реагенты могут присутствовать или не присутствовать в реакционной смеси.
Товары: В конце реакции продукты присутствуют в реакционной смеси.
Заключение
Реактивы и продукты являются важными компонентами химической реакции. Реактивы реагируют друг с другом, в результате чего образуются основные продукты и побочные продукты. Однако реагирующие вещества реагируют только в соответствии со стехиометрией. Иногда количество определенного реагента может быть недостаточно для полной реакции с другим реагентом. В этом случае оба продукта и часть избыточного реагента будут присутствовать в конце реакции. Но здесь оставшийся реагент не рассматривается как продукт реакции, поскольку он не образуется в результате реакции. Поэтому очень важно понимать разницу между реагентами и продуктами.
Ссылка:
1. Хельменстин, к.т.н. Анна Мария. «Что такое продукт в химии? Определение и примеры. ”ThoughtCo. Н.п., н.д. Web.
Химические реакции
Химическая реакция — это процесс, во время которого из одних веществ получаются другие. В процессе химической реакции происходит разрыв одних и образование других химических связей, т.е. атомы одного вещества разрывают связь друг с другом и соединяются с атомами другого вещества, тем самым образуя абсолютно новое вещество.
Признаки химических реакции
ЗАПОМНИ! Вещества, вступающие в химическую реакцию, называются реагентами. Продукты реакции — это вещества, полученные в результате химической реакции. Скорость, с которой происходит изменение вещества, называется скоростью реакции.
Где происходят химические реакции?
Если ты думаешь, что единственное место, где могут происходить химические реакции, — научная лаборатория, ты глубоко заблуждаешься. На самом деле такие реакции ежеминутно происходят в любой точке нашей планеты, даже в человеке. К примеру, когда ты принимаешь пищу, твой организм превращает ее в энергию именно при помощи химических реакций. Горение дерева, покрытие металла ржавчиной, фотосинтез у растений — все это примеры химических реакций.
Скорость реакции
На скорость реакции могут оказывать влияние различные факторы: солнечный свет, тепло, давление или электричество существенно увеличивают ее.
Как начинаются реакции?
Тепло приходит и уходит
Экзотермические реакции протекают с выделением теплоты. В быту примером такой реакции является работа многоразовой солевой грелки. Грелка представляет собой емкость с перенасыщенным солевым раствором, внутри которой находится аппликатор. Когда мы перегибаем аппликатор, солевой раствор из жидкого состояния переходит в твердое. Процесс сопровождается выделением теплоты, и грелка нагревается. Эндотермические реакции протекают с поглощением теплоты. Один из примеров такой реакции — приготовление пищи. Чтобы сырой продукт превратился в пригодный для употребления, в нем должны произойти разные химические реакции, большинству из которых необходимо постоянное поступление тепла из внешней среды.
Примеры нехимических реакций
Во время таяния лед из твердого состояния переходит в жидкое. Казалось бы, изменение очевидно! Но это не химическая реакция, так как вещество осталось прежним, просто вода изменила свое состояние.
Образование смесей и растворов также не является химической реакцией, так как вещества, входящие в состав смесей или растворов, не превращаются в другие.
Большая часть химических исследований сосредоточена на синтезе и описании полезных продуктов, а также на обнаружении и удалении нежелательных продуктов. Химиков-синтетиков можно разделить на химиков-исследователей, которые разрабатывают новые химические вещества и пионеры новых методов их синтеза, а также на химиков-технологов, которые расширяют химическое производство и делают его более безопасным, экологически устойчивым и эффективным. Другие области включают химиков натуральных продуктов, которые выделяют продукты, созданные живыми организмами, а затем описывают и изучают эти продукты.
СОДЕРЖАНИЕ
Определение реакции
Если продукты имеют более высокую химическую энергию, чем реагенты, тогда реакция потребует энергии для осуществления и, следовательно, является эндергонической реакцией. Кроме того, если продукт менее стабилен, чем реагент, то предположение Леффлера придерживается мнения, что переходное состояние будет больше напоминать продукт, чем реагент. Иногда продукт будет достаточно значительно отличаться от реагента, чтобы его можно было легко очистить после реакции, например, когда продукт нерастворим и выпадает в осадок из раствора, в то время как реагенты остаются растворенными.
История
Большая часть синтетической химии связана с синтезом новых химикатов, что происходит при разработке и создании новых лекарств, а также открытии новых синтетических методов. Однако, начиная с начала 2000-х (десятилетия), химия процессов начала формироваться как отдельная область синтетической химии, сосредоточенная на расширении масштабов химического синтеза до промышленных уровней, а также на поиске способов сделать эти процессы более эффективными, безопасными и экологически ответственными.
Биохимия
Распущенность продуктов
Некоторые ферменты проявляют беспорядочную половую связь, когда они превращают один субстрат в несколько различных продуктов. Это происходит, когда реакция происходит через переходное состояние с высокой энергией, которое может быть разделено на множество различных химических продуктов.
Подавление продукта
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
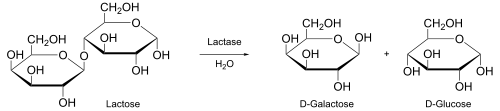
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.