Пробирка с цитратом натрия для чего
Статьи
Вакуумные пробирки и их компоненты
Исследование крови позволяет медикам получить точную информацию о текущем состоянии здоровья пациента. Сегодня, благодаря современному инструментарию, процедура взятия крови проходит быстро и практически безболезненно.
Вакуумные пробирки для забора крови упрощают технику взятия крови и делают результаты анализов максимально точными. Все пробирки снабжены крышечками разных цветов, в зависимости от вида исследования крови.
Лаборант ежедневно проводит забор биоматериалов для самых разных исследований. Пробирка с нужным наполнителем внутри и нужной крышкой снаружи подбирается в зависимости от вида анализа, для которого пациент сдает кровь.
Преимущества вакуумных пробирок
К основным преимуществам вакуумных пробирок относят:
комфорт и безопасность;
вакуумные пробирки не бьются;
пробирка стерильно защищена вакуумом, если герметичность пробирки нарушена, то забор крови не производится;
сокращение продолжительности процедуры забора крови;
возможность за короткое время набрать кровь в несколько пробирок без повторного введения иглы в вену;
точное соотношение реагента и объема крови;
простая и надежная цветовая маркировка пробирок, что исключает возможность ошибки;
не нужно переливать кровь в другие емкости;
удобство при центрифугировании и перевозке;
при работе с анализаторами не нужно открывать крышку пробирки;
Основные виды вакуумных пробирок для плазмотерапии
Натрий является компонентом межклеточной жидкости, поэтому попадание незначительного количества этого вещества в организм не приведет к развитию побочных эффектов. Пробирки с натрий-гепарином могут содержать разделительный гель, плотность которого выше, чем у плазмы, но ниже, чем у клеток крови.
Во время процедуры центрифугирования гель начинает двигаться вверх, образуя устойчивый барьер, который отделяет плазму от клеток крови. В результате плазму можно брать прямо из пробирки, а не переносить ее вручную в другой контейнер.
В пробирках с литий-гепарином используется микроэлемент литий, попадание которого в организм с гепаринизированной кровью может привести к развитию побочных эффектов.
Цитрат натрия при внутрикожном и подкожном введении обладает высокой клеточной агрессивностью.
Вакуумные пробирки с натрий-гепарином
Предназначены для проведения процедуры плазмотерапии. Изнутри на стенки таких пробирок наносят сухой натрий-гепарин и специальный гель-олефинолигомер, который выполняет функцию сепарационной мембраны. Натрий гепарин добавляют из расчета 12-30 МЕ вещества на 1 мл крови.
Гель делит инъекцию на сгусток крови и плазму в течение двух суток без дополнительного включения центрифуги.
К преимуществам данного типа пробирок относят:
возможность получения большего объема плазмы при том же объеме взятой крови;
минимальный риск возникновения тромбоцитоза и гемолиза;
благодаря наличию специального геля между клетками и плазмой образуется барьер, что исключает взбалтывание содержимого во время проведения центрифугирования.
Вакуумные пробирки с аммония гепарином
Аммоний гепарин, нанесенный на внутренние стенки пробирки, способствует активации антитромбинов, что препятствует процессу свертывания крови.
Вакуумные пробирки с литий-гепарином
Предназначены для плазмотерапии. На внутренние стенки пробирки наносят литий-гепарин, который при смешивании с кровью препятствует ее свертыванию. Такой эффект достигается за счет замораживания активности тромбина и замедления процесса превращения фибриногена в фибрин. К преимуществам литий-гепарина относят минимальный риск гемолиза эритроцитов.
Вакуумные пробирки с цитратом натрия
Цитрат натрия, концентрация которого может быть 3,2% либо 3,8%, нанесен на стенки пробирки. Он взаимодействует с кальцием плазмы крови и предотвращает ее свертывание.
Приобрести качественные вакуумные пробирки по доступным ценам Вы можете прямо сейчас в нашем интернет-магазине.
Пробирки с голубой крышкой
Калькулятор
заказов
Новости
График работы в дни праздников
Установлен график работы Клинических отделений в дни Новогодних каникул.
ВЫЕЗД на ДОМ!
С 1 декабря возобновляется выезд на дом в Пятигорске!
Процесс свертывания крови представляет собой последовательность сложных реакций, в которых результатом первых реакций (с участием активных ферментов) является активация следующих, первоначально неактивных энзимов. Последним активным ферментом в этой цепочке присутствует тромбин, который осуществляет превращение фибриногена в фибрин. Нити фибрина опутывают клетки крови и окончательно формируют кровяной сгусток. Крайне важную роль на этом этапе играют ионы Са2+. Антикоагуляционные свойства цитрата проявляются в формировании комплекса с ионами Са2+ и эффективном удалении их из крови.
Общее исследование свертывания крови определяется временем, необходимым для последовательной активации ферментов, участвующих в коагуляционном процессе. Проводится определение времени активации и количественное измерение различных составляющих коагуляционного каскада, для чего создаются так называемые «обходные пути» добавлением некоторых промежуточных продуктов свертывания.
Наиболее часто используются пробирки с 3,8% или 3,2% раствором цитрата натрия (0,129 моль/л), соотношение цитрата к количеству забираемой крови 1/9.
Для максимально качественного проведения коагулологических исследований рекомендуется соблюдение определенных правил:
Оптимальными условиями хранения пробирки с образцом крови является температура 20-24ºС и исследование коагуляционных свойств и факторов свертывания крови должно быть проведено в течение 2-х часов с момента взятия крови
Цветовая кодировка вакуумных пробирок VACUETTE
Цветовая кодировка вакуумных пробирок VACUETTE
В современном мире все больше внимания уделяется лабораторным исследованиям и качеству их проведения.
На что больше всего обращает внимания любой человек, увидевший пробирку? Яркий цвет колпачка! Это не просто дизайнерское решение, это удобство медсестер и лаборантов. Данные требования отражены в ГОСТ ISO 6710-2011 «Контейнеры для сбора образцов венозной крови одноразовые. Технические требования и методы испытаний» и ГОСТ Р 53079.4-2008 «Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа».
Итак, что же означают эти яркие колпачки. Каждая пробирка имеет определенный реагент или же не имеет его, что тоже кодируется определенным цветом. Рассмотрим подробнее, каждый цвет и реагент.
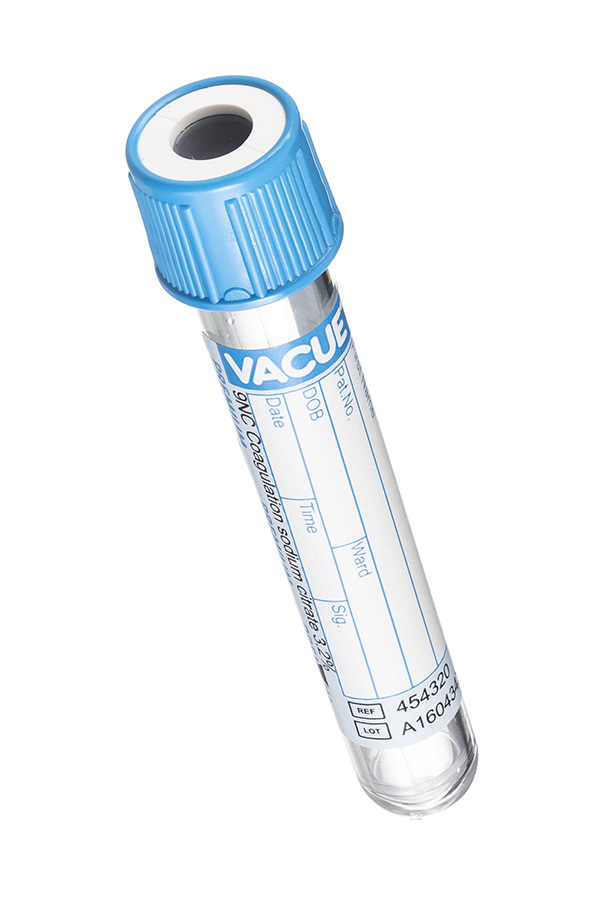
1. Пробирка с голубой крышкой (с цитратом натрия).
В данной пробирке имеется забуференный раствор натрия цитрата в возможных процентных соотношениях 3,2 и 2,8. Этот тип пробирок используется для исследования системы гемостаза (коагулограмма). В данный тип исследования входят такие показатели, как: АЧТВ, протромбин, фибриноген, тромбиновое время и другие.
Также пробирки с голубой крышкой могут содержать в себе реагент CTAD. Настоящий реагент используется для тех же исследований, но его применяют при исследовании пациентов, получающих антикоагулянтную терапию. В состав реагента входит забуференный цитрат натрия, теофиллин, аденозин и дипиридамол.
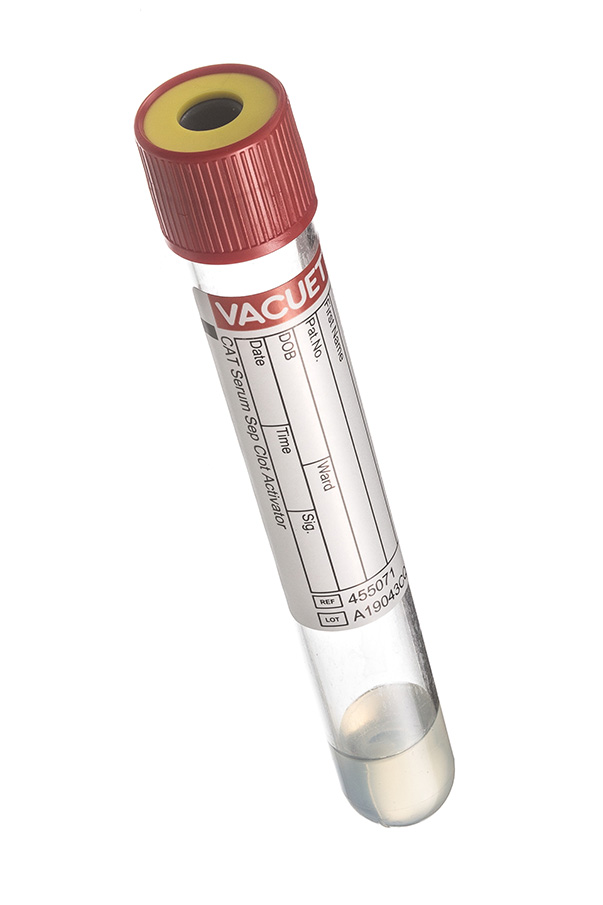
2. Пробирка с красной крышкой (с диоксидом кремния и разделительным гелем).
Данные пробирки используют для исследования сыворотки крови. Сыворотка крови, в отличие от плазмы, не содержит фибриногена, следовательно, чтобы получить пробу сыворотки, нужно активировать процесс свертывания пробы.
В пробирках с красной крышкой происходит активация данного процесса за счет диоксида кремния (SiО2) нанесенного на внутренние стенки в виде микрочастиц. Помимо реагента, в пробирках данного типа может содержаться разделительный гель. Он создает надежный барьер между сгустком и сывороткой, что важно во время хранения и транспортировки пробы. Пробирки с активатором свертывания используют для исследований в: биохимии, иммунологии, микробиологии, серологии и другие.
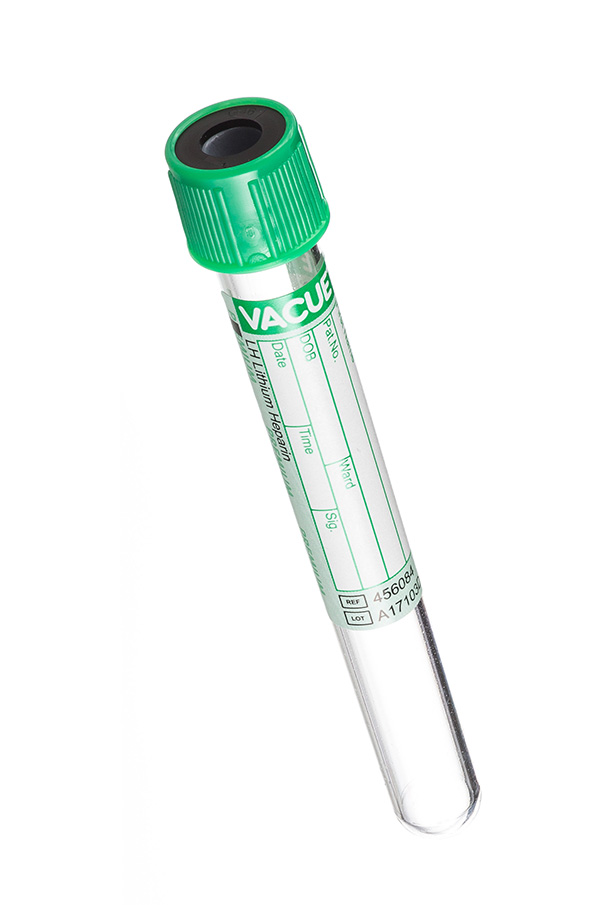
3. Пробирка с зеленой крышкой (с гепарином).
В отличие от пробирок с красной крышкой, служат для получения плазмы.
В них должен содержаться реагент, блокирующий процесс свертывания. В пробирках с зелеными крышками содержится антикоагулянт гепарин (натрий гепарин, литий гепарин, аммоний гепарин). В пробирках этого типа, также может содержаться гель для большей стабильности образца. Он создает надежный барьер между плазмой и форменными элементами во время транспортировки. Пробирки с антикоагулянтом могут использоваться для таких исследований как: электролитный состав крови, газовый состав крови, содержание алкоголя в крови.
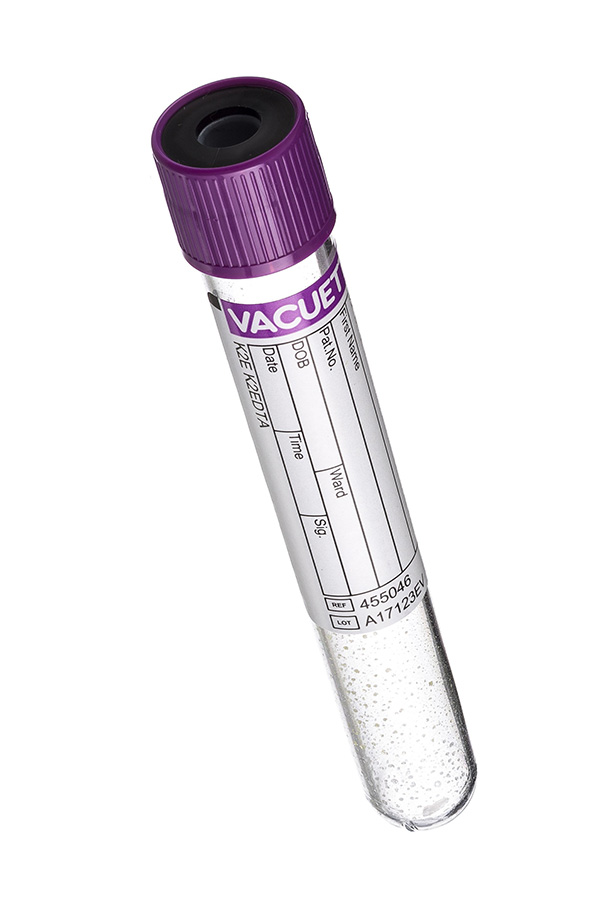
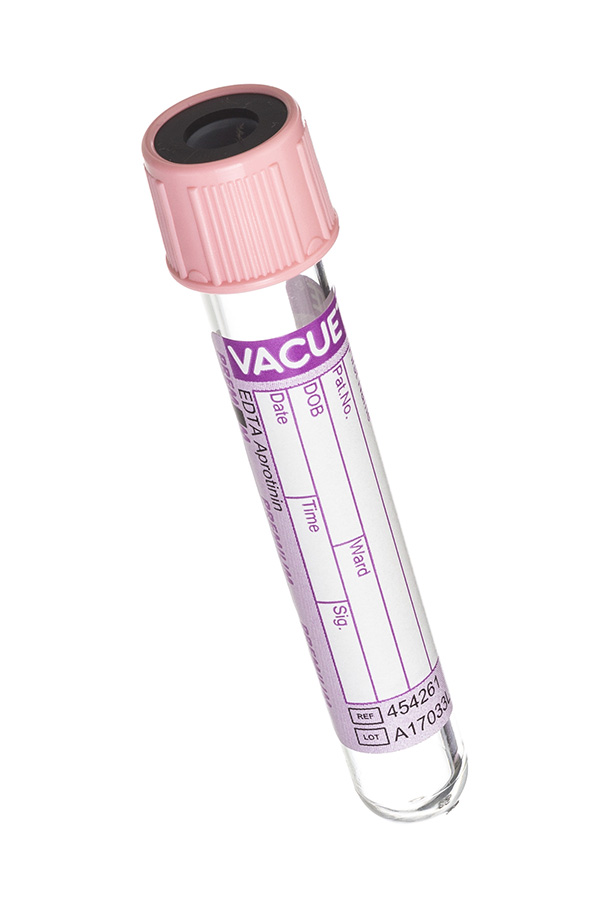
4. Пробирка с фиолетовой крышкой (ЭДТА).
Реагент, содержащийся в данных пробирках связывает ионы кальция и блокирует процесс свертывания. Реагент состоит из этилендиаминуксусной кислоты (ЭДТА). ЭДТА-к2 или ЭДТА-к3 нанесена на внутренние стенки пробирки. Эти пробирки переназначены для гематологических исследований (качественный и количественный состав крови). Для молекулярно-генетических исследований и определения вирусной нагрузки применяются пробирки с ЭДТА и разделительным гелем.
5. Пробирка с розовой крышкой (с апротинином и КЭДТА)
В данной пробирке содержится реагент КЭДТА и апротинин (устойчивый белок, выделенный из бычьих легких) – ингибитор тканевых и сывороточных протеолитических ферментов (трипсин, хемитрипсин, плазмин, калликреин). Этот реагент помогает стабилизировать нестабильные и проблемные аналиты (например, некоторые гормоны).
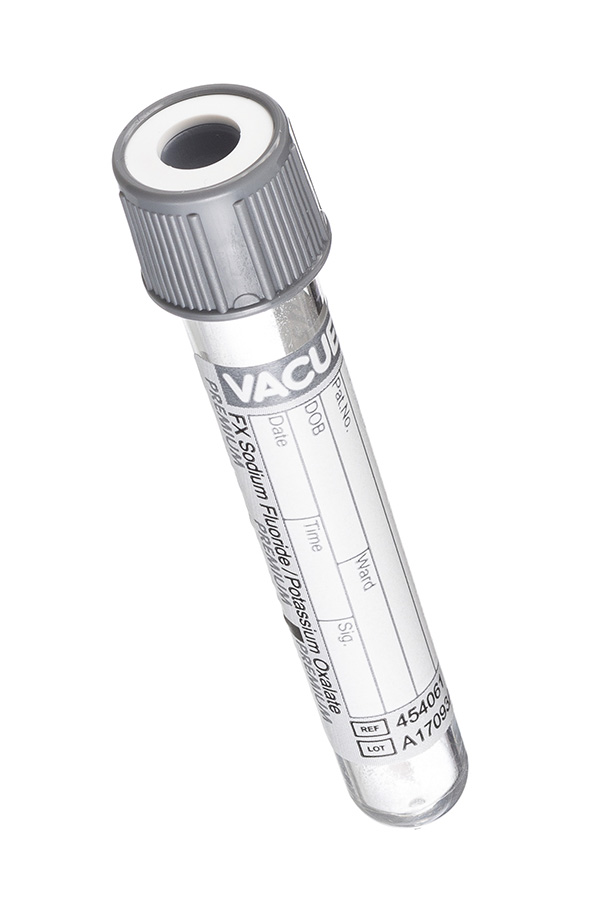
6. Пробирка с серой крышкой (с разными реагентами: лития гепарин и монойодацетат или натрия фторид и калия оксалат).
Специальные пробирки для исследования глюкозы с несколькими вариантами реагентов: монойодацетат и лития гепарин, натрия фторид и калия оксалат, натрия фторид и КзЭДТА. Благодаря тому, что реагент в своем составе содержит не только антикоагулянт, но и стабилизатор уровня глюкозы, проба может сохранять свою стабильность до 48 часов при комнатной температуре.
7. Пробирки с желтой крышкой (с лимонной кислотой, натрия цитратом, декстрозой).
8. Пробирки с черной крышкой (с цитратом натрия).
Используются для определения СОЭ и в составе реагента имеют 3,2% цитрат натрия.
Данный материал носит ознакомительный характер и не может использоваться в качестве обучающего.
Пробирка с цитратом натрия для чего
Вакуумная пробирка — основной инструмент для забора венозной крови. Она может быть наполнена реагентом, который позволит провести быстрый и точный анализ. В таком случае каждая пробирка имеет колпачок своего цвета. Цветное кодирование соответствует международному стандарту ISO 6710.
Вакуумные пробирки для получения сыворотки (биохимия, серология). Цвет крышечки – коричневый или красный
Сыворотка крови – жидкая часть крови лишенная форменных элементов и некоторых белков (фибрин и др.) в отличие от плазмы, в которой сохраняются все элементы жидкой части крови кроме форменных элементов.
Получение сыворотки крови является результатом двухступенчатого биохимического процесса: свертывания (коагуляции) крови и ретракции (уплотнения) сгустка. Для запуска коагуляционного каскада необходимо наличие внешнего активатора, каковым может служить кремния диоксид, поэтому процесс свертывания крови быстрее происходит в стеклянных пробирках, так как кремния диоксид является базовым материалом стекла или в пластиковых пробирках с активатором свертывания. Активатор свертывания (clot activator) выполнен в виде напыления на внутренней стенке пробирки.
После образования сгустка начинается этап его уплотнения и выделения сыворотки. На практике ретракция сгустка ускоряется центрифугированием пробирок с кровью.
Для получения максимально чистой сыворотки рекомендуется соблюдение трех условий:
1. После забора крови в пробирку в соответствии с инструкцией необходимо осторожно однократно перевернуть пробирку для более полного контакта крови с активатором свертывания;
2. Дождаться завершения процесса свертывания крови в течение 20-30 минут при комнатной температуре и вертикальном положении пробирки;
3. Центрифугировать пробирку со свернувшейся кровью не менее 10 минут с ускорением 1500 G (примерно 3000 об/мин) для максимального выдавливания сыворотки из сгустка. При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
После центрифугирования и полной ретракции сгустка сыворотка располагается над сгустком, но в контакте с ним. Сохраняется опасность загрязнения сыворотки составляющими сгустка при неосторожном обращении с пробиркой (встряхивание, опрокидывание и пр.). Для лучшего очищения сыворотки и более полного разграничения сыворотки и сгустка применяются специальные пробирки, содержащие биологически инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, который тяжелее сыворотки, но легче кровяного сгустка, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером. Стабильность такого барьера гарантирована в течение 5-7 дней при хранении пробирки с кровью при комнатной температуре.
Оптимальные сроки сохранности образца крови в данных пробирках составляет при комнатной температуре 6 часов, при хранении в холодильнике (+4ºС) – 24 часа. Повторное центрифугирование пробирок, особенно с гелем, не допускается.
Полученная сыворотка крови применяется для очень широкого спектра лабораторных биохимических, ИФА и иммунологических исследований:
белковый состав, ферменты, гормоны, онкомаркеры, ВИЧ-инфицирование, гепатиты и пр.
Вакуумные пробирки для получения цельной крови или плазмы
Не все анализы в клинике делаются из сыворотки крови. Для многих видов исследований необходима цельная кровь, содержащая форменные элементы, или плазма, освобожденная от клеток крови центрифугированием. С целью получения несвернувшейся крови разработаны пробирки с определенными добавками – антикоагулянтами. На практике используют два вида антикоагулянтов:
ингибиторы (вещества, вызывающие торможение) тромбина. Тромбин является ключевым игроком в коагуляционном каскаде. Он принимает участие в формировании ряда факторов свертывания крови и способствует трансформации фибриногена в фибрин. Добавление биохимических ингибиторов тромбина эффективно активирует антикоагуляционные свойства крови.
связывание (удаление) ионов Ca2+. При прочих равных условиях свертывание крови происходит при активном участии ионов Ca2+. Удаление их является эффективным механизмом сохранения крови в жидком состоянии.
Гепарин. Цвет крышечки – зеленый, светло-зеленый
Для более чистого разграничения плазмы крови и сгустка применяются специальные пробирки, содержащие кроме гепарина инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, который тяжелее плазмы, но легче форменных клеток крови, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером.
Фторид натрия/ЭДТА калия. Цвет крышечки – серый
Добавление фторида натрия и ЭДТА калия в пробирку позволяет предотвратить разрушение глюкозы крови (процесс, называемый гликолизом) и сохранить ее уровень во взятом образце крови.
Фторид натрия и оксалат калия выступают в качестве антикоагулянтов, связывая ионы Са2+ и, кроме того, фторид натрия стабилизирует уровень глюкозы.
Глюкоза разрушается до пирувата и лактата при последовательном осуществлении различных энзиматических реакций. Фторид натрия ингибирует некоторые ферментативные реакции, включая превращение фосфоглицерата в фосфоенолпируватацид, и предотвращает гликолиз.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин).
Пробирки с добавлением фторида натрия и оксалата калия используют для проведения определения уровня сахара (глюкозы) в крови. Соотношение компонентов 1/1, общее количество добавляемых реагентов – 4,5 мг/1 мл забираемой в пробирку крови.
Замечания: Фторид блокирует активность уреазы и некоторых других ферментов. Образцы крови из данных пробирок нельзя использовать для прямого определения энзимов. Фторид натрия и ЭДТА калия связывают ион Са2+, заменяя в крови 1 ион кальция на 2 иона натрия или калия. Следствием этого является повышение напряжения ионов в межклеточной жидкости и выкачивание воды из внутриклеточного пространства в межклеточное, сморщивание клеток крови с умеренным «выдавливанием» из эритроцитов гемоглобина. Поэтому видимый гемолиз свойственен образцам крови с данной добавкой.
Глюкоза превращается в лактат в результате комплекса реакций, включающего в себя различные этапы. Фторид ингибирует один их последних этапов разрушения глюкозы, начальные этапы с участием гексокиназы и фосфофруктокиназы блокируются менее эффективно, поэтому можно наблюдать снижение содержания глюкозы в образце крови на 6-7% от первоначального.
После первоначального незначительного снижения уровня глюкозы ее количество остается постоянным при хранении крови в пробирке в течение 8-10 часов при температуре до 25ºС и в течение 2-3 дней в холодильнике (+4ºС).
Этилендиаминтетраацетат (ЭДТА) является предпочтительным антикоагулянтом для гематологических исследований. ЭДТА и его щелочные соли способны создавать хелатные соединения с ионами кальция с образованием растворимых высокостабильных комплексов. Наиболее эффективная концентрация ЭДТА – 1,2 мг/мл крови. Во всем мире используют три варианта солей ЭДТА: ЭДТА-К3, ЭДТА-К2 и ЭДТА-Na2. Наиболее предпочтительной и рекомендуемой Международной Комиссией по Стандартизации в Гематологии является двукалиевая соль ЭДТА:
ЭДТА-К3 показывает меньшую способность поддержания крови в жидком состоянии, также ЭДТА-К3 влияет на подсчет лейкоцитов, занижая их количество.
различия между ЭДТА-К2 и ЭДТА-Na2 в клиническом плане незначительны и ими можно пренебречь, но ЭДТА-Na2 хуже растворим.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта;
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин). При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
Наиболее широко используются пробирки, содержащие 1,95 мг ЭДТА/1мл крови. Они нашли свое применение в таких областях лабораторной практики, как:
гематологические исследования – подсчет клеток крови, определение СОЭ и пр.
ПЦР-исследования (качественные и количественные методики).
Пробирки с образцами крови можно хранить до 6-10 часов при 4ºС, хранение свыше 24 часов не рекомендуется из-за снижения числа эритроцитов и лейкоцитов.
Цитрат натрия является антикоагулянтом для сбора венозной крови с це6лью проведения исследований коагуляционных свойств крови.
Процесс свертывания крови представляет собой последовательность сложных реакций, в которых результатом первых реакций (с участием активных ферментов) является активация следующих, первоначально неактивных энзимов. Последним активным ферментом в этой цепочке присутствует тромбин, который осуществляет превращение фибриногена в фибрин. Нити фибрина опутывают клетки крови и окончательно формируют кровяной сгусток. Крайне важную роль на этом этапе играют ионы Са2+. Антикоагуляционные свойства цитрата проявляются в формировании комплекса с ионами Са2+ и эффективном удалении их из крови.
Общее исследование свертывания крови определяется временем, необходимым для последовательной активации ферментов, участвующих в коагуляционном процессе. Проводится определение времени активации и количественное измерение различных составляющих коагуляционного каскада, для чего создаются так называемые «обходные пути» добавлением некоторых промежуточных продуктов свертывания.
Наиболее часто используются пробирки с 3,8% или 3,2% раствором цитрата натрия (0,129 моль/л), соотношение цитрата к количеству забираемой крови 1/9.
Для максимально качественного проведения коагулологических исследований рекомендуется соблюдение определенных правил:
нельзя использовать пробирку для взятия крови на коагуляционные тесты первой, сразу после венепункции, так как на результаты может повлиять выделяющийся при пункции тканевой тромбопластин;
венозный жгут во время взятия крови в пробирку должен быть снят;
немедленно после взятия крови пробирку аккуратно переворачивают 5-6 раз для лучшего перемешивания крови и антикоагулянта;
сразу после этого надо проверить количество взятой крови: ее верхняя граница должна быть на уровне голубой полоски на этикетке.
Оптимальными условиями хранения пробирки с образцом крови является температура 20-24ºС и исследование коагуляционных свойств и факторов свертывания крови должно быть проведено в течение 2-х часов с момента взятия крови
Методические рекомендации. Гематологические анализаторы. Интерпретация анализа крови
УТВЕРЖДАЮ
Заместитель Министра
здравоохранения и
социального развития
Российской Федерации
Р.А.ХАЛЬФИН
21 марта 2007 г. N 2050-РХ
ГЕМАТОЛОГИЧЕСКИЕ АНАЛИЗАТОРЫ. ИНТЕРПРЕТАЦИЯ АНАЛИЗА КРОВИ
В эру использования современных технологий автоматизированного анализа крови стало реальным предоставлять значительно больше клинической информации о состоянии кроветворной системы и реагировании ее на различные внешние и внутренние факторы. Анализ результатов исследования крови составляет неотъемлемое звено в диагностическом процессе и последующем мониторинге на фоне проводимой терапии.
Высокотехнологические гематологические анализаторы способны измерять более 32 параметров крови, осуществлять полный дифференцированный подсчет лейкоцитов по 5-ти основным популяциям: нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты, что делает возможным в случае отсутствия от референсных значений этих показателей не проводить ручной подсчет лейкоцитарной формулы.
Аналитические возможности гематологических анализаторов:
высокая производительность (до 100-120 проб в час)
небольшой объем крови для анализа (12-150 мкл)
анализ большого количества (десятки тысяч) клеток
высокая точность и воспроизводимость
оценка 18-30 и более параметров одновременно
графическое представление результатов исследований в виде гистограмм, скатерограмм.
Диагностические возможности гематологических анализаторов:
оценка состояния гемопоэза
диагностика и дифференциальная диагностика анемий
диагностика воспалительных заболеваний
оценка эффективности проводимой терапии
мониторинг за мобилизацией стволовых клеток из костного мозга.
Несмотря на все достоинства, даже самые современные гематологические анализаторы обладают некоторыми ограничениями, которые касаются точной морфологической оценки патологических клеток (например, при лейкозах), и не в состоянии полностью заменить световую микроскопию.
Преаналитический этап гематологических исследований
Контроль преаналитических факторов в гематологических исследованиях является ключевым для обеспечения качественных результатов тестов. Отклонения от стандартов при взятии пробы, транспортировке и хранении образца, интерферирующие вещества, а также факторы, связанные с пациентом, могут привести к неверным или неточным результатам анализов и, следовательно, к постановке ошибочного диагноза. До 70% лабораторных ошибок связаны именно с преаналитическим этапом исследования крови. За счет снижения числа ошибок на любом этапе преаналитической подготовки можно существенно улучшить качество гематологических анализов, снизить количество повторных проб, сократить расходы рабочего времени и средств на обследование пациентов.
Снижение до минимума возможных ошибок и обеспечение высокого качества гематологических исследований возможно за счет стандартизации преаналитического и аналитического этапов работы.
На точность и правильность результатов оказывает влияние техника взятия крови, используемые при этом инструменты (иглы, скарификаторы и др.), а также пробирки, в которые берется, а в последующем хранится и транспортируется кровь.
— Кровь следует брать натощак (после примерно 12 часов голодания, воздержания от приема алкоголя и курения), между 7 и 9 часами утра, при минимальной физической активности непосредственно перед взятием (в течение 20-30 мин.), в положении пациента лежа или сидя.
— Взятие материала следует проводить в резиновых перчатках, соблюдая правила асептики.
Венозная кровь. Венозная кровь считается лучшим материалом для клинического исследования крови. При известной стандартизации процессов взятия, хранения, транспортировки венозной крови удается добиться минимальной травматизации и активации клеток, примеси тканевой жидкости, при этом всегда имеется возможность повторить и/или расширить анализ, например, добавив исследование ретикулоцитов.
Достоверность и точность гематологических исследований, проводимых из венозной крови, во многом определяется техникой взятия крови.
Подготовка пациента к взятию крови из вены включает несколько этапов. Место венепункции нужно продезинфицировать марлевой салфеткой или специальной безворсовой салфеткой, смоченной 70 град. спиртом, и подождать до полного высыхания антисептика (30-60 секунд). Применение ватных тампонов и других волокнистых материалов подобного рода может привести к засорению волокнами счетной и гемоглобиновой камер, что влечет снижение точности и воспроизводимости измерения. Не рекомендуется использовать 96 град. спирт, так как он дубит кожу, поры кожи закрываются, и стерилизация может быть неполной.
Не рекомендуется вытирать и обдувать место прокола, пальпировать вену после обработки. Рука пациента должна покоиться на твердой поверхности, быть вытянута и наклонена немного вниз так, чтобы плечо и предплечье образовывали прямую линию. Необходимо следить, чтобы в момент взятия крови кулак пациента был разжат. Жгут следует накладывать не более чем на 1-2 минуты, тем самым обеспечивается минимальный стаз, при котором клетки крови не повреждаются. Игла должна быть достаточно большого диаметра и иметь короткий срез, чтобы не травмировать противоположную стенку вены во избежание тромбоза. После взятия крови необходимо приложить сухую стерильную салфетку к месту венепункции, а затем наложить давящую повязку на руку или бактерицидный пластырь.
— Кровь для гематологических исследований должна поступать
свободным током непосредственно в пробирку, содержащую
антикоагулянт К ЭДТА. Взятие крови шприцом без антикоагулянта с последующим переливанием в пробирку нежелательно из-за
формирования микросгустков и гемолиза. При взятии капиллярной
крови необходимо использовать специальные пробирки с ЭДТА для
капиллярной крови.
У некоторых пациентов может наблюдаться небольшая спонтанная агрегация тромбоцитов или реже так называемая ЭДТА-зависимая псевдотромбоцитопения (иммунного характера), причем эти явления прогрессируют по мере увеличения времени, прошедшего после взятия крови. У таких лиц точный подсчет числа эритроцитов может быть осуществлен при взятии крови с цитратом в качестве антикоагулянта.
Следует помнить, что применение в качестве антикоагулянтов гепарина или цитрата натрия сопровождается структурными изменениями клеток и поэтому не рекомендуется для использования как при автоматизированном, так и морфологическом исследовании крови.
Капиллярная кровь. Для гематологических исследований капиллярную кровь рекомендуется брать в следующих случаях:
— при ожогах, занимающих большую площадь поверхности тела пациента;
— при выраженном ожирении пациента;
— при установленной склонности к венозному тромбозу;
Применение ватных тампонов и других волокнистых материалов не рекомендовано, поскольку это приводит к засорению волокнами счетных и гемоглобиновой камер. В результате точность и воспроизводимость измерения падает.
Первую каплю крови, полученную после прокола кожи, следует удалить тампоном, поскольку эта капля содержит примесь тканевой жидкости. Капли крови должны свободно вытекать, нельзя давить на палец и массировать зону вокруг прокола, так как при этом в кровь попадает тканевая жидкость, что существенно искажает результаты исследования. После взятия крови к раневой поверхности прикладывается новый стерильный тампон, смоченный 70 град. спиртом. Тампон следует удерживать, пока не прекратится кровотечение.
При прикосновении края пробирки к месту пункции капли крови начинают стекать в нее под действием капиллярного эффекта. После завершения сбора крови пробирку следует плотно закрыть. Необходимым условием для обеспечения качественной пробы является ее обязательное немедленное перемешивание с антикоагулянтом осторожным переворачиванием пробирки до 10 раз. В случае последовательного взятия капиллярной крови в несколько микропробирок необходимо соблюдать определенный порядок их заполнения. Последовательность взятия крови такова: в первую очередь заполняются пробирки с ЭДТА, затем с другими реактивами и в последнюю очередь заполняются пробирки для исследования сыворотки крови.
Основные рекомендации при работе с капиллярной кровью:
— При взятии крови в пробирку с антикоагулянтом не допускается стекание крови по коже пальца, стенке пробирки и любой другой поверхности, так как мгновенно происходит контактная активация прогресса свертывания.
— Кровь самотеком из прокола должна попадать прямо в антикоагулянт, перемешиваясь с ним.
— Нельзя выдавливать кровь из пальца во избежание спонтанной агрегации тромбоцитов и попадания в пробу большого количества межтканевой жидкости (тканевого тромбопластина).
Следует отметить, что при взятии капиллярной крови возможен ряд особенностей, которые бывает весьма трудно стандартизировать:
Все это приводит к значительным разбросам в получаемых результатах и, как следствие, к необходимости повторных исследований для уточнения результата.
Доставка, хранение и подготовка проб к исследованию
Для обеспечения качественного результата исследований нужно четко контролировать время и условия хранения проб до выполнения анализа.
— Непосредственно после взятия крови исключается возможность спонтанной агрегации тромбоцитов, примерно 25 мин. необходимо для адаптации тромбоцитов к антикоагулянту. При анализе, проведенном позже чем через 6-8 часов после взятия образца, уменьшается достоверность результатов. Более продолжительное хранение крови не рекомендуется, т.к. изменяются некоторые характеристики клеток (сопротивляемость клеточной мембраны), снижается объем лейкоцитов, повышается объем эритроцитов, что в конечном итоге приводит к ошибочным результатам измерения и неправильной интерпретации результатов. Только концентрация гемоглобина и количество тромбоцитов остаются стабильными в течение суток хранения крови.
— Кровь нельзя замораживать. Капиллярную кровь с ЭДТА следует хранить при комнатной температуре и анализировать в течение 4 часов после взятия.
— Непосредственно перед исследованием кровь должна быть тщательно перемешана в течение нескольких минут для разведения антикоагулянта и равномерного распределения форменных элементов в плазме. Длительное постоянное перемешивание образцов на ротомиксе до момента их исследований не рекомендуется вследствие возможного травмирования и распада патологических клеток.
— Исследование крови на приборе проводится при комнатной температуре. Кровь, хранившуюся в холодильнике, необходимо вначале согреть до комнатной температуры, так как при низкой температуре увеличивается вязкость, а форменные элементы имеют тенденцию к склеиванию, что, в свою очередь, приводит к нарушению перемешивания и неполному лизису. Исследование холодной крови может быть причиной появления «сигналов тревоги» вследствие компрессии лейкоцитарной гистограммы.
— Приготовление мазков крови рекомендуется делать не позднее 1-2 часов после взятия крови.
При выполнении гематологических исследований на значительном удалении от места взятия крови неизбежно возникают проблемы, связанные с неблагоприятными условиями транспортировки. Тряска, вибрация, постоянное перемешивание, нарушения температурного режима, возможные проливы и загрязнения проб могут оказывать существенное влияние на качество анализов. Для устранения этих причин при перевозках пробирок с кровью рекомендуется использовать герметично закрытые пластиковые пробирки (BD Vacutainer (R) производства компании «Becton Dickinson», Deltalab, Sarstedt) и специальные транспортные изотермические контейнеры (фирма «Гем»).
Влияние преаналитических факторов, зависящих от пациента
На результаты гематологических исследований могут влиять факторы, связанные с индивидуальными особенностями и физиологическим состоянием организма пациента. Изменения клеточного состава периферической крови наблюдаются не только при различных заболеваниях, они также зависят от возраста, пола, диеты, курения и употребления алкоголя, менструального цикла, беременности, физической нагрузки, эмоционального состояния и психического стресса, циркадных и сезонных ритмов; климатических и метеорологических условий; положения пациента в момент взятия крови; приема фармакологических препаратов и др. Так, например, число эритроцитов и концентрация гемоглобина у новорожденных выше, чем у взрослых. С увеличением высоты над уровнем моря значительное повышение наблюдается для гематокрита и гемоглобина (до 8% на высоте 1400 м). Физические упражнения могут приводить к существенным изменениям числа лейкоцитов, обусловленным гормональными сдвигами. У больных при переходе из положения лежа в положение стоя показатели гемоглобина и число лейкоцитов могут увеличиваться на 6-8%, а показатели гематокрита и число эритроцитов возрастать на 15-18%. Этот эффект обусловлен переходом жидкости из сосудистого русла в ткани в результате повышения гидростатического давления. Выраженная диарея и рвота могут приводить к значительной дегидратации и гемоконцентрации. После регидратации наблюдается снижение гемоглобина и гематокрита, что может быть ошибочно принято за кровопотерю.
Для устранения или сведения к минимуму влияния этих факторов кровь для повторных анализов необходимо брать в тех же условиях, что при первом исследовании.
Автоматизированное исследование клеток крови
Автоматические счетчики крови оценивают размеры, структурные, цитохимические и другие характеристики клеток. Они анализируют около 10000 клеток в одном образце и имеют несколько различных каналов подсчета клеточных популяций и концентрации гемоглобина. На основании количества определяемых параметров и степени сложности их можно условно разделить на 3 основных класса:
В основе работы анализаторов I-го класса лежит кондуктометрический метод. Анализаторы II и III-го классов используют в своей работе комбинации разных методов.
Кондуктометрические гематологические анализаторы
Если в один и тот же момент в канале находятся две клетки, они регистрируются в виде одного импульса, что приведет к ошибке подсчета клеток. Во избежание этого, проба крови разводится до такой концентрации, при которой в канале датчика всегда будет не больше одной клетки.
Апертуро-импедансный метод позволяет определять большинство эритроцитарных и тромбоцитарных показателей, связанных с объемом клеток (НСТ, MCV, МСН, МСНС, MPV), а также является основой для дифференцировки лейкоцитов по трем параметрам.
Подсчет эритроцитов и тромбоцитов, расчет величины гематокрита, эритроцитарных и тромбоцитарных индексов
Устройство, которое разделяет импульсы по величине амплитуды, называется дискриминатор. В современных анализаторах применяются многоканальные дискриминаторы, позволяющие получить детальную информацию о размерах клеток в виде гистограмм, поскольку каждый канал соответствует определенному объему клеток.
Поскольку в норме концентрация эритроцитов в крови на 3 порядка превышает концентрацию лейкоцитов, то вклад лейкоцитов в общее количество подсчитываемых клеток пренебрежимо мал по сравнению с эритроцитами, поэтому в некоторых анализаторах за количество эритроцитов принимают общее подсчитанное количество клеток. Такое допущение справедливо, за исключением случаев явных лейкоцитозов.
Подсчет и дифференцировка лейкоцитов
Определение количества лейкоцитов возможно только после лизиса эритроцитов. Эта задача оказалась легко решаемой, так как свойства мембран эритроцитов и лейкоцитов существенно различаются. Эритроциты легко лизируются под воздействием многих поверхностно-активных веществ, при этом лейкоциты, хотя и претерпевают некоторые изменения, остаются целыми. Поэтому при подсчете лейкоцитов, прежде чем пропустить разведенную суспензию крови через апертуру датчика, к ней добавляют лизирующий раствор или гемолитик, эритроциты разрушаются до очень мелких фрагментов, которые при подсчете лейкоцитов генерируют электрические импульсы очень низкой амплитуды, не влияющие на результат анализа.
Разделение неизмененных лейкоцитов кондуктометрическим методом на основные субпопуляции невозможно в виду близости их объемов, однако можно подобрать такую композицию растворителя и гемолитика, что различные формы лейкоцитов претерпевают изменения размеров в разной степени и, благодаря этому, могут разделяться данным методом. Изменение объема клетки зависит от многих факторов, включающих величину и форму ядра, объем цитоплазмы, наличие внутриклеточных включений и т.д., поэтому размер трансформированных клеток не соответствует размерам клеток при визуальном просмотре их в окрашенном мазке крови (таблица 1)
| Соотношение размеров клеток в окрашенных мазках крови и в приборах после обработки их лизирующим реагентом | ||
| Тип клеток | Размер клеток при визуальном анализе мазков крови | Размер клеток после обработки лизатом |
| Лимфоциты | малый | малый |
| Базофилы | средний | средний, малый |
| Эозинофилы | средний | средний, большой |
| Моноциты | наибольший | средний |
| Нейтрофилы | средний | большой, средний |
| Патологические формы клеток | различный | различный |
| Дальнейшая идентификация патологических форм клеток проводится визуально | ||
— Область малых объемов (35-90 фл) формируется лимфоцитами, которые под действием гемолитика значительно уменьшаются в объеме.
— Гранулоциты (нейтрофилы, базофилы и эозинофилы), напротив, подвергаются небольшому сжатию и расположены в области больших объемов (120-400 фл).
— Между двумя пиками имеется зона так называемых «средних лейкоцитов» (90-120 фл), которая лучше всего коррелирует с моноцитами (по этой причине в некоторых анализаторах клетки в этой области указываются как моноциты). Однако, учитывая тот факт, что коэффициент корреляции с моноцитами R = 0,5-0,8 сравнительно невысок, более корректным является название параметра «средние лейкоциты» или «средние клетки» (MID). Практически в область средних клеток могут частично попадать базофилы, эозинофилы, различные патологические формы.
Высокотехнологические гематологические анализаторы
Высокотехнологические гематологические анализаторы способны осуществлять дифференцированный счет лейкоцитов по 5-ти (5Diff) основным популяциям, используя различные принципы дифференцирования клеток: нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты, оценивать наличие незрелых гранулоцитов, анализировать ретикулоциты и их субпопуляции, проводить оценку стволовых гемопоэтических клеток и субпопуляций лимфоцитов. Многочисленные функции современных гематологических анализаторов стали возможны, благодаря развитию новых технологий, которые отличаются у разных фирм-производителей.
— для оценки клеточной зернистости и дифференцировки эозинофилов используется оценка светорассеивания деполяризованного луча под углом в 90 град.
Сравнивая информацию, получаемую с Perox- и Baso-каналов, компьютер осуществляет дифференцировку лейкоцитов на 5 основных популяций, а также сигнализирует в виде флагов о присутствии в крови активированных лимфоцитов, незрелых гранулоцитов, бластов, эритробластов.
3. Детекция специфического флюоресцентного сигнала (SFL), которая регистрируется также как боковое светорассеивание под углом 90 град. и позволяет судить о содержании РНК/ДНК в клетках.
Кроме того, приборы оборудованы каналом для выделения незрелых гранулоцитов и атипичных лимфоцитов.
Таким образом, использование приборов с полным дифференцированным подсчетом лейкоцитов (5Diff) позволяет повысить точность дифференциального подсчета лейкоцитов, провести скрининг нормы и патологии, динамический контроль за лейкоцитарной формулой и резко сократить ручной подсчет лейкоцитарной формулы, оставляя примерно до 15-20% образцов крови для световой микроскопии.
В классическом гемиглобинцианидном методе (метод Драбкина) +2 +3 Fe гемоглобина окисляется до Fe метгемоглобина феррицианидом, затем метгемоглобин переводится в стабильный цианметгемоглобин цианидом. Оптическая плотность CNmetHb измеряется при 540 нм, при которой имеется максимум поглощения. Гемиглобинцианидный метод рекомендован Международным комитетом по стандартизации в гематологии Всемирной Организации Здравоохранения и используется в мировой практике более 30 лет.
В гематологических анализаторах к методам определения гемоглобина предъявляется ряд специфических требований. Во-первых, время реакции должно быть в десятки раз меньше для обеспечения высокой производительности анализаторов. Во-вторых, для оптимизации конструкции анализаторов гемоглобин должен измеряться в том же гемолизате, который используется для подсчета лейкоцитов, и, следовательно, компоненты, обеспечивающие гемоглобиновую реакцию, не должны негативно влиять на подсчет лейкоцитов.
Многие гематологические анализаторы измеряют концентрацию гемоглобина модифицированным гемиглобинцианидным методом. Высокая
скорость реакции достигается путем быстрого лизиса эритроцитов, +3 денатурирования и окисления гемоглобина до Fe с помощью
поверхностно-активных веществ. Последующая реакция с цианидом формирует устойчивую форму со спектром поглощения, похожим на
спектр гемиглобинцианида в методе Драбкина, и максимумом поглощения около 545 нм. Достоинством метода является его простота, высокая скорость реакции и стабильность конечного продукта. Применение циановых методов в гематологических автоанализаторах имеет два существенных недостатка, связанных с тем, что цианид из флаконов постепенно выпаривается в виде синильной кислоты. Во-первых, это может оказывать вредное воздействие на персонал при плохой вентиляции помещения. Во-вторых, это приводит к ухудшению реакции и изменению калибровки по гемоглобину через 2-3 месяца после подсоединения к прибору флакона с гемолитиком.
Учитывая недостатки модифицированных гемиглобинцианидных методов, в последние годы в большинстве новых моделей гематологических анализаторов используются бесциановые методы. Одной из первых бесциановый SLS (натрий лаурил сульфат)-метод использовала фирма Sysmex. Этот метод оказался не совместимым с определением лейкоцитов в одном канале, для его реализации используется дополнительный реагент и канал измерения.
В других современных бесциановых методах используются компоненты гемихромной реакции, которые совместимы с подсчетом лейкоцитов и их дифференциацией на три популяции. Высокая скорость реакции достигается путем быстрого лизиса эритроцитов, +3 денатурирования и окисления гемоглобина до Fe с помощью окислителей в присутствии поверхностно-активных веществ. При этом в качестве лигандов атомов железа гема используются отличные от цианида вещества.
Качество результатов исследования крови на гематологическом анализаторе определяется следующими факторами:
— точностью дозирования цельной или разведенной крови;
— точностью дозирования изотонического раствора при проведении процедуры разведения крови;
— точностью определения объема суспензии, пропущенного через датчики подсчета клеток;
— точностью самого подсчета клеток;
— точностью определения размеров клеток;
— корректностью математических методов обработки первичных результатов измерений.
Во избежание случаев несовместимости реагентов следует использовать изотонический раствор и гемолитик от одного изготовителя. При смене реагентов одного производителя на реагенты другого производителя необходимо проверить калибровку анализатора по контрольной крови, обращая особое внимание на Hb и MCV/HCT, и при необходимости нужно делать перекалибровку этих показателей. Калибровка других показателей, как правило, не меняется.
Периодически необходима калибровка по стандартным материалам, так как электронные и механические компоненты прибора, датчиков, насосов и т.д. со временем подвергаются старению и меняют свои технические параметры. Для осуществления калибровки необходимо пользоваться только качественными контрольными материалами!
Гематологические анализаторы очень чувствительны к длительным отключениям и перебоям в работе, что связано с подсыханием шлангов, проростом микрофлоры, кристаллизацией из растворов. При длительной остановке (на период отпуска, переезда или отсутствия реагентов) обязательным является заполнение шлангов консервирующими растворами с последующей многократной отмывкой от них.
Автоматизированные гематологические анализаторы, поставляемые в КДЛ в рамках Приоритетного национального проекта «Здоровье»
Для оснащения клинико-диагностических лабораторий поликлиник предпочтение отдано автоматизированным гематологическим анализаторам, работа которых основана на кондуктометрическом методе, который позволяет получить до 18 параметров крови с определением трех популяций лейкоцитов (лимфоциты, клетки средних размеров, гранулоциты).
При использовании такого анализатора определяют:
— RBC (количество эритроцитов)
— HGB (концентрация гемоглобина)
— MCV (средний объем эритроцита)
— МСН (среднее содержание гемоглобина в эритроците)
— МСНС (средняя концентрация гемоглобина в эритроците)
— RDW (ширина распределения эритроцитов по объему)
— PLT (количество тромбоцитов)
— MPV (средний объем тромбоцита)
— PDW (ширина распределения тромбоцитов по объему)
— WBC (количество лейкоцитов)
Гистограммы (распределение клеток по объему)
Автоматизированный гематологический анализатор MEK-6400J/K
В приборе существует пять режимов разведения: нормальный, режим низкого, высокого и очень высокого разведения, режим предварительного разведения.
В нормальном режиме разведения измеряется образец объемом 30 мкл.
Для режимов измерения крови с предварительным разведением можно указать объем исследуемой крови (10 или 20 мкл). Этот режим удобен при работе с малым объемом крови, особенно у детей и пожилых людей.
При наличии лейкоцитоза образец крови может быть измерен в режиме высокого или более высокого разведения. В режиме высокого разведения образец крови объемом 10 мкл разводится втрое больше обычной пропорции разведения. В режиме более высокого разведения 5 мкл образца крови разводится в пропорции, в шесть раз большей обычной пропорции разведения.
В случаях низкого содержания в крови лейкоцитов и тромбоцитов образец измеряется в режиме низкого разведения, при котором 55 мкл крови разводится в пропорции, вдвое меньшей обычной пропорции. Пересчет с высоким/низким разведением недоступен для образцов в режиме предварительного разведения.
Прибор снабжен системой закодированных флагов, которые появляются на экране при наличии отклонений в измерении или изменении гистограмм распределения клеток. Следует внимательно изучить названия флагов, т.к. они помогают определить возможные причины их появления. Помимо количественных характеристик клеток крови в анализаторе отображается распределение клеток по объему в виде гистограмм, анализ которых имеет диагностическое значение.
Уважаемые коллеги!
Все методические рекомендации, пособия и т.д. интеллектуальная собственность авторов, Ассоциации и являются архивными материалами разных лет!!