Признаки временной функциональной нестабильности миокарда что это такое
Что такое миокардит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Колесниченко Ирины Вячеславовны, кардиолога со стажем в 24 года.
Определение болезни. Причины заболевания
Миокардит — это острый или хронический воспалительный процесс в миокарде (мышечной ткани сердца), приводящий к его повреждению.
Признаки миокардита: одышка, боли в грудной клетке, отёки, нарушения ритмичной работы сердца.
К развитию миокардита могут приводить как инфекционные, так и неинфекционные причины.
Инфекционные причины миокардита
Неинфекционные причины
В группу риска развития миокардита попадают люди, злоупотребляющие алкоголем, наркотиками, болеющие сахарным диабетом, так как у них снижен иммунитет. Поскольку миокардит, как правило, является результатом инфекционных заболеваний, чаще вирусных, то профилактика состоит в предотвращении этих болезней.
Симптомы миокардита
Выраженность клинических проявлений миокардита варьирует от изменений, заметных только при обследовании инструментальными методами (электрокардиографией, трансторакальной эхокардиографией, магнито-резонансной томографией) и не сопровождающихся жалобами, до быстро развивающегося кардиогенного шока и внезапной смерти.
Кардиогенный шок — это резкое снижение сократительной способности миокарда, приводящее к нарушению кровоснабжения всех органов и тканей.
Клиническая картина при миокардите может сопровождаться болью в грудной клетке, как при инфаркте миокарда.
Временные изменения на ЭКГ, указывающие на вовлечение миокарда, часто встречаются при вирусных инфекциях. При этом в большинстве случаев симптомы заболевания отсутствуют.
Распространённые симптомы миокардита
Заподозрить миокардит следует в тех случаях, когда после перенесённой вирусной инфекции пациент не выздоравливает полностью:
Патогенез миокардита
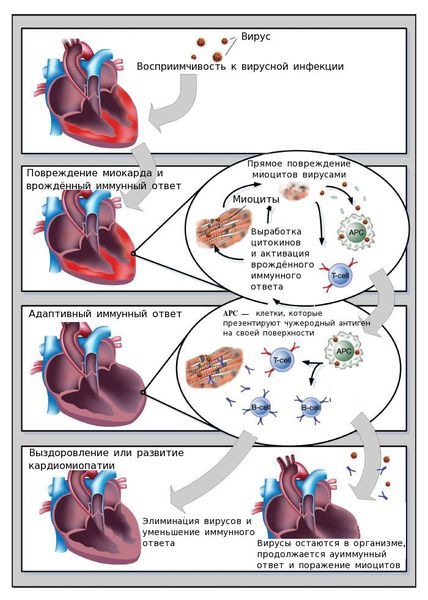
Ключевую роль в развитии активного миокардита играет вирусная инфекция.
Фазы развития миокардита:
В зависимости от особенностей защитных механизмов организма и характеристик возбудителя, возможно преобладание той или иной фазы развития заболевания.
Нормальная иммунная реактивность способствует устранению вируса и обеспечивает заживление повреждённого миокарда. Однако иммунные нарушения могут приводить дисбалансу: организму либо не удаётся устранить вирус, либо создаются благоприятные условия для длительного пребывания клеток иммунной системы в сердечной мышце. Клетки иммунной системы выделают белки-цитокины, которые разрушают кардиомиоциты.
В механизме развития вирусных миокардитов выделяют ключевые факторы: непосредственное повреждающее действие вирусов, которое приводит к появлению острых и хронических аутоиммунных реакций, и последующее ремоделирование сердца.
Нарушение кровообращения при вирусном миокардите проходит три фазы:
Первая фаза — гипердинамическая. Развивается в течение 1-3 суток после инфицирования. Во время этой фазы повышается сократительная способность миокарда, увеличивается объём крови, которое сердце прокачивает в минуту (минутный объём), так как повышается активность симпатического отдела вегетативной нервной системы. Также в этой фазе развивается диастолическая дисфункция сердечной мышцы — нарушение расслабления миокарда. Отмечается небольшое повреждение кардиомиоцитов в результате воздействия вирусов и медиаторов иммунной системы. Выраженных патологических изменений сердечных клеток ещё нет.
Вторая фаза — депрессивная. Отмечается между 4-ми и 7-ми сутками после инфицирования. Во время этой фазы прогрессирует снижение сократительной способности, минутного объёма сердца и нарушение расслабления миокарда. На 5-е сутки развивается дилятация (расширение) левого желудочка. На 7-е сутки может возникнуть кардиогенный шок и тяжёлые проявления венозного застоя. В этой фазе вирус продолжает повреждать кардиомиоциты, также наблюдается активное поражение кардиомиоцитов цитокинами. Развивается отёк, миокард пропитывается клетками воспаления, что приводит к нарастанию диастолической дисфункции левого желудочка (нарушению его расслабления).
Классификация и стадии развития миокардита
Согласно данным, полученным при прижизненной и посмертной биопсии миокарда, выделяют следующие формы миокардита:
Выраженность воспаления может быть слабой, умеренной и тяжёлой, что определяется степенью пропитывания миокарда клетками иммунной системы.
По распространённости воспаления выделяют ограниченную, сливающуюся и диффузную формы миокардита. При диффузных формах сравнительно рано увеличиваются размеры сердца, его функция также не снижается.
Единая классификация миокардитов пока отсутствует. Основываясь на морфологической картине заболевания, все миокардиты, согласно Далласским критериям (в модификации 1997 г.), можно разделить на:
Согласно этой классификации, выделяют следующие типы миокардитов:
Отдельно выделяют ещё два вида миокардита:
Осложнения миокардита
Нарушения ритма и проводимости. При миокардитах могут возникать нарушения ритма и проводимости (наджелудочковая и желудочковая тахикардия, фибрилляция предсердий, экстрасистолия, АВ-блокады и др.), некоторые из которых, например полная атриовентрикулярная блокада, опасны для жизни. Кроме лечения выявленной аритмии, нужно определить, вызвана ли она воспалением миокарда, недостатком кислорода, побочным действием препаратов или сочетанием этих факторов. Независимо от причины аритмии, зачастую для предотвращения дальнейшего ухудшения состояния больного необходимо лечебное вмешательство.
Кардиомиопатия и сердечная недостаточность. Если по данным эхокардиографии наблюдается расширение левого желудочка и других камер сердца со снижением его систолической функции, то это свидетельствует о развитии дилятационной кардиомиопатии (заболевания миокарда с растяжением полостей сердца) с сердечной недостаточностью. При рестриктивной кардиомиопатии (заболевание миокарда с ригидностью стенок желудочков) отмечаются симптомы сердечной недостаточности. При этом, по данным эхокардиографии:
Прогноз заболевания зависит от того, разовьётся ли при миокардите кардиомиопатия или сердце полностью восстановится.
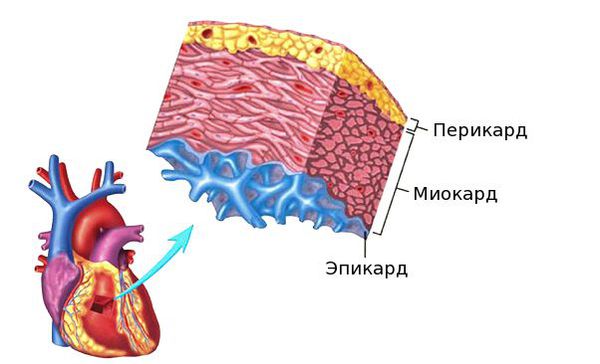
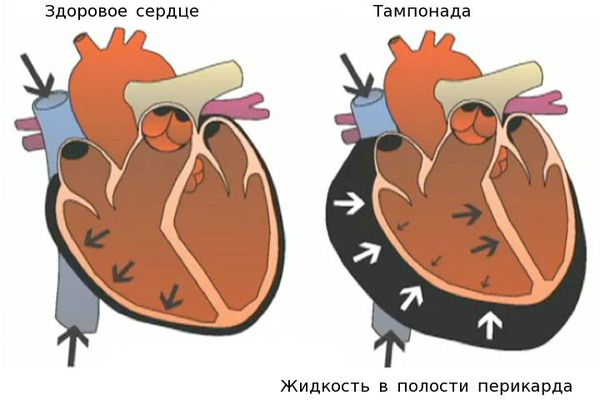
Гнойный перикардит и тампонада сердца — грозные осложнения миокардита. При дыхании возникают острые боли в грудной клетке. Сократительная функция сердца падает, так как оно зажато в тисках воспалённого перикарда, в полости которого может скопиться большое количество выпота. Требуется дренирование полости перикарда. Перикард — это тонкий, но плотный мешок, в котором находится сердце. Перикард отгораживает сердце от других органов грудной клетки.
Тромбоэмболические осложнения. При выраженном снижении функции миокарда увеличивается риск образования внутрисердечных тромбов. При этом возможно попадание тромбов в сосуды головного мозга или лёгких и их закупорка. Учитывая такой риск, для предотвращения тромбообразования применяют антикоагулянты, разжижающие кровь.
Диагностика миокардита
Диагностика миокардита, в первую очередь, основывается на оценке жалоб и симптомов, обнаруженных при объективном обследовании больного. Необходимо опросить пациента и установить связь с перенесённой инфекцией, действием токсинов или лекарственных препаратов. Также следует выявить у пациента заболевания, которые могут быть причиной миокардита: сахарный диабет, системную красную волчанку, воспалительные заболевания кишечника и др.
Пациентов могут беспокоить:
Однако жалоб при миокардите может и не быть. Тяжёлые миокардиты по клинической симптоматике часто напоминают инфаркт миокарда. При тяжёлом течении внезапно развивается обморочное состояние, вызванное нарушением кровообращения.
При объективном обследовании наблюдается повышение температуры выше 38 °С, расширение границ сердца и нарушения ритма. При тяжёлом течении миокардита и развитии сердечной недостаточности снижается артериальное давление вплоть до кардиогенного шока и возникают отёки на ногах.
Такие клинические признаки, как сыпь, повышение температуры тела более 38 ºС и эозинофилия (рост уровня эозинофилов в крови) в сочетании с недавно начатым приёмом лекарственных средств характерны для гиперчувствительного миокардита. Заболевание может приводить к внезапной смерти, развитию быстро прогрессирующей сердечной недостаточности или хроническому течению с развитием дилятационной кардиомиопатии.
При гибели миоцитов при миокардите в периферической крови повышаются специфические маркеры повреждения миокарда — тропонин Т и I.
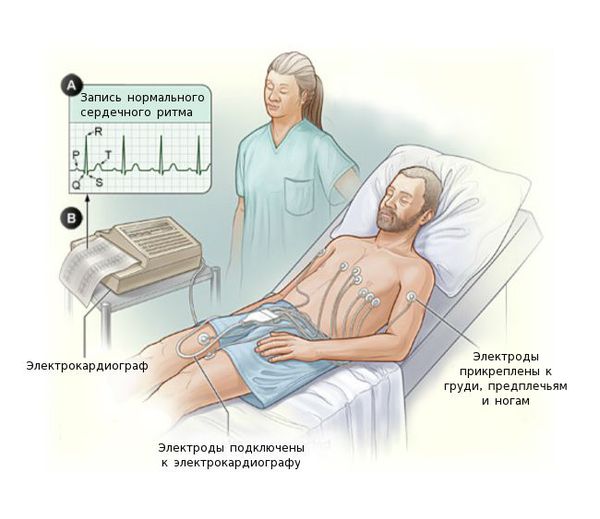
Электрокардиография (ЭКГ) поможет отличить миокардит от инфаркта. Также на ЭКГ выявляются различные нарушения ритма и проводимости сердца: желудочковая экстрасистолия, пароксизмальная желудочковая тахикардия, фибрилляция предсердий, АВ-блокада II-III степени вплоть до поперечной блокады.
К неинвазивным методам диагностики миокардита, основанным на визуализации сердца, относят:
Для начального обследования всех больных с предполагаемым миокардитом используется ЭХО-КГ. На обследовании выявляется:
ЭХО-КГ эффективна для оценки ответной реакции на лечение миокардита.
Радиоизотопная визуализация используется для оценки омертвения сердечной мышцы.
Для подтверждения диагноза миокардита «золотым стандартом» в настоящее время считается проведение эндомиокардиальной биопсии (ЭМБ) под МРТ.
Показания к ЭМБ:
Лечение миокардита
Лечение миокардитов зависит от причины воспаления в сердечной мышце. Терапевтические мероприятия направлены на уменьшение воспаления, коррекцию нарушений кровообращения и возникших осложнений.
Лечение бактериального и вирусного миокардитов включает:
При лечении некротизирующего эозинофильного, гигантоклеточного и гиперчувствительного миокардитов обязательно используется иммуносупрессивная терапия, направленная на подавление избыточной реакции иммунной системы. Раннее распознавание гиперчувствительного миокардита позволяет своевременно отменить лекарственные средства, которые стали его причиной, и применить высокие дозы глюкокортикостероидов.
Препараты, которые не следует применять при лечении моикардитов
При вирусных миокардитах необходимо отказаться от необоснованного применения нестероидных противовоспалительных средств (НПВС), так как они способствуют задержке жидкости, что может приводить к развитию сердечной недостаточности.
Прогноз. Профилактика
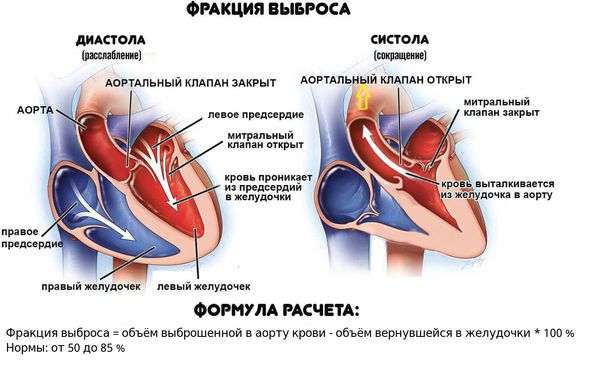
Если даже заболевание проявляется сердечной недостаточностью, у больных нередко отмечается лишь слабовыраженное нарушение функции желудочков сердца (фракция выброса левого желудочка от 40 до 50 %), а улучшение происходит в течение недель или месяцев.
У небольшого числа больных с выраженным нарушением функции левого желудочка заболевание проявляется кардиогенным шоком, при котором нужна механическая поддержка кровообращения. При этом может потребоваться либо достаточно кратковременная поддержка, либо более длительная, продолжающаяся до восстановления функции левого желудочка или трансплантации сердца.
Обморочные состояния, блокада ножек пучка Гиса или снижение фракции выброса левого желудочка менее 40 % можно считать прогностическими показателями смерти или трансплантации сердца. Выраженные симптомы сердечной недостаточности также являются факторами неблагоприятного прогноза.
При вирусных миокардитах в 40-60 % случаев возможно спонтанное восстановление функции миокарда, при этом прогноз благоприятен. Если функции сердечной мышцы не восстанавливаются, то прогноз хуже. В настоящее время отсутствуют надёжные методы, которые позволяли бы прогнозировать спонтанное восстановление функции миокарда. Однако уменьшение числа миоцитов вследствие апоптоза (программируемой гибели клеток) приводит к прогрессированию дисфункции миокарда, так как при этом ограничивается восстановление сердечной мышцы.
Профилактика миокардитов
Важно помнить, что лечение при миокардите назначает врач-кардиолог, самолечение опасно и недопустимо.
Признаки временной функциональной нестабильности миокарда что это такое
Нестабильная стенокардия (НС) остается актуальной проблемой клинической кардиологии из-за высокого риска развития инфаркта миокарда и внезапной сердечной смерти как в период госпитализации, так и при дальнейшем наблюдении за больными [4, 7]. В то же время, благодаря совершенствованию методов лечения обострений ишемической болезни сердца (ИБС), все большее влияние на прогноз и качество жизни пациентов с НС приобретают процессы ишемического ремоделирования миокарда и формирования хронической сердечной недостаточности (ХСН) [8].
Повреждение части кардиомиоцитов провоцирует процессы склерозирования, гипертрофию оставшихся миоцитов с изменением их взаиморасположения, изменение объемов и массы миокарда [6]. Эти процессы во многом связаны с наличием зон хронической ишемии (гибернации) и зон риска ишемии.
Прекращение или резкое уменьшение коронарного кровотока приводит и к значительной электрической нестабильности миокарда, проявляющейся в нарушениях ритма и проводимости. С другой стороны, в проведенных исследованиях [5, 10] отмечена провоцирующая роль многих аритмий в развитии и особенно прогрессировании сердечной недостаточности.
По мнению S. Goldstein и соавт. [9], «треугольник риска» внезапной смерти состоит из ишемии миокарда, электрической нестабильности и дисфункции левого желудочка.
Цель нашего исследования: изучение структурно-функциональных показателей левого желудочка, электрической нестабильности миокарда у пациентов с различными формами нестабильной стенокардии (по Браунвальду).
Материал и методы
Критериями включения больных в исследование были: поступление в блок интенсивной терапии с НС, возникшей в течение 48 ч в форме:
а) стенокардии покоя (боль, развившаяся в покое или при минимальном усилии, длившаяся больше 5 мин, но меньше 30 мин);
б) стенокардии напряжения (при нагрузке, которая раньше не вызывала стенокардии);
в) учащения приступов стенокардии при наличии подтверждения на ЭКГ (депрессия сегмента ST больше 0,5 мм, но меньше 1 мм, т.е. недостаточный для диагноза острого инфаркта миокарда).
В исследование не включались больные, у которых в момент развития приступа имелись инфаркт миокарда в анамнезе; обструктивные заболевания легких; наличие органических поражений клапанов сердца; наличие признаков идиопатической кардиомиопатии; сахарный диабет; постоянная форма фибрилляции предсердий; анемия с уровнем гемоглобина менее 120 г/л.
Все больные были разделены на группы согласно классификации Braunwald (2000 г.) и методом рандомизации разграничены на группу воздействия (с применением терапии периндоприлом, небивололом и симвастатином) и группу сравнения (традиционно лечившиеся в районных поликлиниках). Таким образом, нами были сформированы 4 группы:
Характеристика исследуемых групп представлена в табл. 1.
Таблица 1
Сравнительная клиническая характеристика больных
Средний возраст, годы
Длительность ИБС, годы
Согласно протоколу исследования, у пациентов всех 4-х групп оценивались структурно-функциональные показатели левого желудочка (методом эхокардиографии и допплер-эхокардиографии), наличие потенциально злокачественных аритмий и эпизодов достоверной безболевой ишемии миокарда (суточное мониторирование ЭКГ) в начале наблюдения и через 1 год.
Суточное мониторирование ЭКГ по Холтеру для регистрации нарушений ритма и ишемической депрессии сегмента ST выполнялось с использованием системы Shiller (Швейцария). К потенциально злокачественным аритмиям (ПЗА) относили желудочковую экстрасистолию высоких градаций по классификации Лауна: одиночные, если их количество превышало 30 в час, политопные, парные и ранние экстрасистолы типа «R на Т», а также эпизоды неустойчивой желудочковой тахикардии.
Трансторакальную эхокардиографию производили с использованием аппарата Siemens Sonoline G50 (Германия). Определялись основные структурно-функциональные показатели левого желудочка: конечно-диастолический объем (КДО), ударный объем (УО), фракция выброса (ФВ), масса миокарда левого желудочка (ММЛЖ), относительная толщина стенки левого желудочка (ОТСЛЖ), амплитуда пиков раннего и позднего диастолического наполнения (Е и А). Многие из этих показателей стандартизировались к антропометрическим данным (отношением к площади поверхности тела) пациента с выведением индекса.
Статистическая обработка данных осуществлялась с применением пакета прикладных программ «Statistica 6.0». Она включала расчет средних значений, стандартной ошибки. Парные групповые сравнения проводились непараметрическим методом Манна‒Уитни. При анализе зависимых выборок использовался критерий Уилкоксона. При всех расчетах различия считались статистически значимыми при р 1).
У пациентов со стенокардией покоя (группа сравнения) в динамике отмечалось статистически значимое нарастание индекса массы миокарда левого желудочка и миокардиального стресса, была тенденция к увеличению индексов КДО и КСО. По данным разных авторов [6, 7], эти изменения можно отнести к прогностически неблагоприятным. Одновременно с этим у пациентов 3-й группы (получавших периндоприл, небиволол и симвастатин) наблюдались противоположные изменения: достоверное снижение индекса ММЛЖ, индексов КДО и КСО левого желудочка, МС. Наряду с этим отмечалась положительная динамика в виде увеличения ФВ (р
Лечение гипертрофической кардиомиопатии
Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание миокарда, проявляющееся комплексом специфических морфо-функциональных изменений
Лечение гипертрофической кардиомиопатии
Гипертрофическая кардиомиопатия (ГКМП) – это генетически обусловленное заболевание миокарда, проявляющееся комплексом специфических морфо-функциональных изменений и постепенно прогрессирующим течением с высоким риском развития жизнеугрожающих аритмий и внезапной смерти.
Типичными являются морфологические изменения: аномалия архитектоники сократительных элементов миокарда (гипертрофия и дезориентация мышечных волокон), развитие фибротических изменений мышцы сердца, патология мелких интрамиокардиальных сосудов.
При ГКМП происходит массивная гипертрофия миокарда левого (и реже правого желудочка), чаще асимметричного характера за счет утолщения межжелудочковой перегородки, часто с развитием обструкции выходного тракта левого желудочка (ЛЖ) при отсутствии каких-либо явных причин.
Общепризнанной является представление о преимущественно наследственной природе ГКМП. В связи с этим, широкое распространение получил термин «семейная гипертрофическая кардиомиопатия». К настоящему времени установлено, что более половины всех случаев заболевания являются наследуемыми, при этом основной тип наследования – аутосомно-доминантный. Оставшиеся приходятся на так называемую спорадическую форму; в этом случае у пациента нет родственников, болеющих ГКМП или имеющих гипертрофию миокарда. Считается, что большинство, если не все случаи спорадической ГКМП, также имеют генетическую причину, т. е. вызваны случайными мутациями.
Гипертрофическая кардиомиопатия – это генетически гетерогенное заболевание, причиной которого являются более 200 описанных мутаций нескольких генов, кодирующих белки миофибриллярного аппарата. К настоящему времени известны 10 белковых компонентов сердечного саркомера, выполняющих контрактильную, структурную или регуляторную функции, дефекты которых наблюдаются при ГКМП. Причем в каждом гене множество мутаций могут становиться причиной заболевания (полигенное мультиаллельное заболевание).
Наличие той или иной ассоциированной с ГКМП мутации признается «золотым» стандартом диагностики заболевания. При этом описанные генетические дефекты характеризуются разной степенью пенетрантности, выраженностью морфологических и клинических проявлений. Тяжесть клинической картины зависит от присутствия и степени гипертрофии.
Таким образом, ГКМП характеризуется крайней гетерогенностью вызывающих ее причин, морфологических, гемодинамических и клинических проявлений, разнообразием вариантов течения и прогноза, что существенно затрудняет выбор адекватных и наиболее эффективных лечебных подходов по контролю и коррекции имеющихся нарушений.
Возможны три гемодинамических варианта обструктивной ГКМП:
Cимптомы болезни разнообразны и малоспецифичны, связаны с гемодинамическими нарушениями (диастолическая дисфункция, динамическая обструкция путей оттока, митральная регургитация), ишемией миокарда, патологией вегетативной регуляции кровообращения и нарушением электрофизиологических процессов в сердце. Диапазон клинических проявлений крайне велик: от бессимптомных до неуклонно прогрессирующих и трудно поддающихся медикаментозному лечению форм, сопровождающихся тяжелой симптоматикой.
Повышение диастолического давления в левом желудочке из-за диастолической дисфункции, динамическая обструкция выносящего тракта левого желудочка проявляются одышкой в покое и при физической нагрузке, утомляемости, слабости. Нарастание давления в малом круге кровообращения сопровождается развитием острой левожелудочковой недостаточности (чаще в ночные часы – сердечная астма, альвеолярный отек легких).
Падение фракции выброса при физической нагрузке или нарушениях сердечного ритма сопровождается ухудшением кровообращения головного мозга. Преходящая ишемия мозговых структур проявляется кратковременной потерей сознания (обморок) или предобморочными состояниями (внезапная слабость, головокружение, потемнение в глазах, шум и «заложенность» в ушах).
Методы исследования:
ЭХО-КГ – основной метод диагностики ГКМП. Критериями диагностики ГКМП на основании данных ЭХО-КГ являются:
Если в покое обструкции выносящего тракта левого желудочка нет, ее можно спровоцировать медикаментозными (ингаляция амилнитрита, введение изопреналина, добутамина) или функциональными пробами (проба Вальсальвы, физическая нагрузка), которые уменьшают преднагрузку или повышают сократимость левого желудочка.
Катетеризация сердца и коронарная ангиография проводятся для оценки коронарного русла перед миоэктомией или операцией на митральном клапане, а также чтобы выяснить причину ишемии миокарда. При этом к характерным признакам ГКМП относят:
Сцинтиграфия миокарда и позитронно-эмиссионная томография
При гипертрофической кардиомиопатии сцинтиграфия миокарда имеет некоторые особенности, однако в целом ее значение в диагностике ишемии такое же, как и обычно. Стойкие дефекты накопления указывают на рубцовые изменения после инфаркта миокарда, обычно они сопровождаются снижением функции левого желудочка и плохой переносимостью физической нагрузки. Обратимые дефекты накопления указывают на ишемию, вызванную снижением коронарного резерва при нормальных артериях или коронарным атеросклерозом. Обратимые дефекты часто никак не проявляются, однако, по-видимому, они повышают риск внезапной смерти, особенно у молодых больных с гипертрофической кардиомиопатией. При изотопной вентрикулографии можно выявить замедленное наполнение левого желудочка и удлинение периода изоволюмического расслабления.
Позитронно-эмиссионная томография – более чувствительный метод, кроме того, она позволяет учесть и устранить помехи, связанные с затуханием сигнала. Позитронно-эмиссионная томография с фтордезоксиглюкозой подтверждает наличие субэндокарлиальной ишемии, вызванной снижением коронарного резерва.
Современные подходы к лечению ГКМП
По современным представлениям, лечебная стратегия определяется в процессе разделения больных на категории в зависимости от описанных выше вариантов течения и прогноза.
Все лица с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, нуждаются в динамическом наблюдении, в ходе которого оцениваются характер и выраженность морфологических и гемодинамических нарушений. Особое значение имеет выявление факторов, определяющих неблагоприятный прогноз и повышенный риск внезапной смерти (в частности, скрытых, прогностически значимых аритмий).
Общие мероприятия
Ограничение значительных физических нагрузок и запрещение занятий спортом, способных вызывать усугубление гипертрофии миокарда, повышение внутрижелудочкового градиента давления и риска внезапной смерти.
Медикаментозное лечение
До настоящего времени окончательно не решен вопрос о необходимости проведения активной медикаментозной терапии у наиболее многочисленной группы больных с бессимптомной или малосимптомной формами ГКМП и низкой вероятностью внезапной смерти. Противники активной тактики обращают внимание на то, что при благоприятном течении заболевания продолжительность жизни и показатели смертности не отличаются от таковых в общей популяции. Некоторые же авторы указывают на то, что использование в этой группе пациентов β-адреноблокаторов и антагонистов кальция (верапамил) может приводить к сдерживанию гемодинамических нарушений и клинической симптоматики. При этом никто не оспаривает тот факт, что выжидательная тактика в случаях бессимптомного или малосимптомного течения ГКМП возможна лишь при отсутствии признаков внутрижелудочковой обструкции, обмороков и серьезных нарушений сердечного ритма, отягощенной наследственности и случаев ВС у близких родственников.
Следует признать, что лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, пока может быть в большей степени симптоматическим и паллиативным. Тем не менее к основным задачам лечебных мероприятий относятся не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания.
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: β-адреноблокаторы и блокаторы кальциевых каналов. Для лечения весьма распространенных при этом заболевании нарушений сердечного ритма используются также дизопирамид (антиаритмический препарат IA класса) и амиодарон.
Предпочтение отдается β-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают начиная с 20 мг 3-4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой в большинстве случаев 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, так как отсутствие эффекта терапии β-блокаторами, вероятно, связано с недостаточной дозировкой. При этом нельзя забывать о том, что повышение дозировок существенно увеличивает риск известных побочных эффектов.
Инвазивные методы лечения:
1. Чрезаортальная септальная миэктомия
2. Вальвулопластики или протезирования митрального клапана
В ряде случаев при наличии дополнительных показаний для уменьшения выраженности обструкции и митральной регургитации одномоментно выполняется операция вальвулопластики или протезирования митрального клапана низкопрофильным протезом. Улучшить отдаленные результаты миэктомии позволяет последующая длительная терапия верапамилом, обеспечивающая улучшение диастолической функции ЛЖ, что не достигается при хирургическом лечении.
3. Иссечения межжелудочковой перегородки
В настоящее время разработаны и успешно применяются отличные от классической миэктомии методики. В частности, в НЦССХ им. А. Н. Бакулева под руководством академика Л. А. Бокерия разработана оригинальная методика иссечения зоны гипертрофированной МЖП из конусной части правого желудочка. Этот способ хирургической коррекции обструктивной ГКМП является высокоэффективным и может стать методом выбора в случаях одновременной обструкции выходных отделов обоих желудочков, а также в случаях среднежелудочковой обструкции ЛЖ.
4. Транскатетерная септальная аблация
Другим альтернативным методом лечения рефракторной обструктивной ГКМП является транскатетерная алкогольная септальная аблация. Методика предполагает инфузию через баллонный катетер в перфорантную септальную ветвь 1–3 мл 95% спирта, вследствие чего возникает инфаркт гипертрофированного отдела МЖП, захватывающей от 3 до 10% массы миокарда ЛЖ (до 20% массы МЖП). Это приводит к значимому уменьшению выраженности обструкции выходного тракта и митральной недостаточности, объективной и субъективной симптоматике заболевания.
В Волынской больнице отработана методика выполнения транскатетерной септальной аблации при ГКМП. Доказан положительный результат данного вмешательства при относительно низком риске развития осложнений.