Привыкание к цефтриаксону чем заменить
Сравнительное изучение препаратов цефтриаксона
История создания цефалоспоринов берет свое начало с 1945 г., когда профессор бактериологии Cinsepni Brotzu выделил из культуры гриба Cephalosporium фильтрат, отличающийся по своим антибактериальным свойствам от пенициллина.
Показания:
1.Острая бактериальная пневмония
2.Деструктивная пневмония (неясного генеза), кровохарканье.
3.Хронический бронхит, фаза обострения.
5.Сепсис. Инфекционный эндокардит.
В процессе изучения цефтриаксона были определены следующие критерии использования антибиотика на больных с бронхолегочными заболеваниями, инфекционным эндокардитом (ИЭ), сепсисом, иерсиниозом и др. заболеваниями:
— оценка эффективности антибиотика;
— определение разовой (она же и суточная) дозы;
— оценка комбинированной терапии цефтриаксона с клиндамицином и амикацином;
— регистрация нежелательных явлений в процессе лечения пациентов.
Для решения поставленных задач использовались следующие методы:
— бактериоскопическое и бактериологическое исследование мокроты, крови, мочи и др. с идентификацией возбудителя и определение антибиотикограммы;
— биохимические показатели крови: билирубин, трансаминазы (ACT и АЛТ и гамма-ГТ), мочевина, креатинин крови, щелочная фосфатаза, общий белок и его фракции:
Микробиологическое исследование.
Клиническому применению цефтриаксона предшествовало определение возбудителей в биологическом материале. Идентификация микроорганизмов осуществлялась общепринятыми методами. Для определения чувствительности аэробов к цефтриаксону использовали диско-диффузионный метод (содержащий в диске 30 мкг/мл. цефтриаксона). Были изучены 170 культур, выделенных из мокроты, крови, гнойного отделяемого глаз, носа, уха, ран и зева больных, лечившихся в клинической больнице МПС РФ в течение февраля-апреля 1999 г. (см.таблицу 1,2). Антибиотикочувствительность микрофлоры мокроты, полученная от больных бронхолегочными заболеваниями приведена в таблице 1.
Таблица 1
Микрофлора мокроты от больных с бронхолегочными заболеваниями с определением антпбнограммы офрамакса, фирмы «Ranbaxy», Индия.
Возбудители
Число выделенных штаммов
Чувст.шт.
Количество штаммов
Слабо чувст.шт.
Резист.шт.
Streptococcus pneumoniae
S.aureus
Streptococcus viridans
Klebsiella pneumoniae
E.coli
Pseudomonas aeruginosae
Candida
Proteus
Итого:
Таблица 2.
Чувствительность клинических штаммов (гр+) и (гр-) бактерий к офрамаксу
(метод дисков – 30 мкг/мл), фирма «Ranbaxv», Индия.
Микроорганизмы
Число культур
Офрамакс
Чуств.шт.
Слабо чувст.шт.
Резист.шт
Моча.
Staphylococcus epidermidis
Enterococcus
Proteus
E.coli
Кровь.
Staphylococcus aureus
Гнойное отделяемое из глаз.
Staphylococcus aureus
Staphylococcus epidermidis
Гнойное отделяемое из носа.
Staphylococcus epidermidis
Из уха.
Staphylococcus aureus
Раневая инфекция.
Staphylococcus aureus
Enterococcus
Staphylococcus aureus
Staphylococcus viridans
Enterococcus
Итого:
В целом следует отметить, что как грам (+), так и грам (-) возбудители, выделенные из разного биоматериала были антибиотикочувствительны, что и составило 55,6%. Резистентность наблюдалась в 32 (40,5%) можно объяснить тем, что некоторые бактерии, в частности энтерококки приподно резистентны ко всем беталактамам [5].
выделенных из мокроты больных бронхолегочной инфекцией.
Микроорганизмы
Количество культур
Из них
Чуств.шт.
Слабо чувст.шт.
Резист.шт
Streptococcus pneumoniae
Staphylococcus aureus
E.coli
Kl. pneumoniae
P. aeruginosae
Proteus
p.Candida
Всего:
Итак, существенных преимуществ в антимикробном спектре мокроты больных, лечившихся роцефином и офрамаксом не выявлено (см.таблицу 1,3).
Изучение фармакокинетики офрамакса.
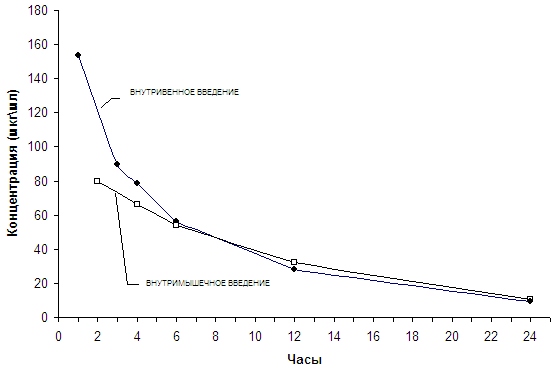
Фармакокинетику изучали на 20 терапевтических больных после однократного внутривенного и внутримышечного введения в дозе 1 г в сутки.
Однократное внутримышечное введение 1 г офрамакса выявило максимальную концентрацию через 2 часа – 80 мкг\мл, примерно половину от максимальной концентрации после внутривенного введения в той же дозе. Через 4, 6,12 и 24 часа определяли высокие концентрации, которые находились практически на одном уровне с наблюдаемыми после внутривенного применения препарата в те же сроки (таблица 4 и график).
Таблица 4.
Средние концентрации офрамакса в сыворотке крови больных после однократного внутривенного и внутримышечного введения в дозе 1 г.
Способ
введения
Часы
Концентрация в мкг\мл после введения через
График 1.
Средние концентрации офрамакса в сыворотке крови больных после однократного внутривенного и внутримышечного введения в дозе 1 г
Цефтриаксон не метаболизируется в организме больного. 50% парентерально вводимой дозы выводится с мочой в активной форме в течение 48 часов. Скорость выведения цефтриаксона значительно снижена благодаря высокой степени связывания препарата белками сыворотки крови (95%), 10% выделяется желчью.
Длительный период полувыведения (Т 1\2- 5,47 – 7,6 часа) независит от пути введения намного превышая этот показатель для других цефалоспоринов, что позволяет поддерживать в течение 24 часов высокие концентрации и вводить препарат 1 раз в сутки. Такие высокие, длительно сохраняющиеся концентрации вполне достаточны для подавления большинства грамотрицательных и грамположительных микроорганизмов.
Площади под фармакокинетической кривой (AUC) также существенно не различаются (1004-1010), что свидетельствует об одинаковой биодоступности препарата, как при внутримышечном, так и при внутривенном введении.
Так, при внутримышечном введении роцефина максимальная концентрация 92.3 мкг/мл достигается через 2 часа, а через 20-25 часов пределы колебания концентрации в сыворотке крови больных составляли 9-14 мкг/мл.
Фармакокинетическое изучение офрамакса в сыворотке крови выявило, что офрамакс не уступает по всем показателям роцефину, фирмы La Roche и характеризует его как эффективный антибиотик при бронхолегочной патологии и сепсисе.
Клиническая эффективность
Цефтриаксон (офрамакс) был применен на 20-ти больных с инфекцией различной локализацией (см.таблицу 5).
Инфекции дыхательных путей.
Таблица 5.
Клиническая эффективность офрамакса фирмы «Ranbaxy», Индия, в клинике внутренних болезней.
Диагноз
Количество
наблюдений
Клиническая переносимость и эффективность препарата
хорошая
удовл.
без эффекта
Острая пневмококковая пневмония
Деструктивная пневмония неясного генеза (кровохрюканье)
Обострение хронического бронхита (без выраженной обструкции)
Хронический деформирующий бронхит.
Синдром Картагенера
Острый гаймарит
Болезнь Эбштейна. Сепсис.
Перелом шейки бедра, пролежени, сепсис.
Энтероколит (V.enterocolitica)
Всего:
Гнойная инфекция кожи и мягких тканей.
Иерсиниоз (Versinia enterocolitica).
В литературе цефтриаксон характеризуется как антибиотик,обладающий хорошей переносимостью, хотя и он не избавлен от возможных побочных эффектов: повышение уровня ферментов и креатинина в крови, гемолитическая анемия, тромбоцитопения. аллергические кожные реакции, болезненность при внутримышечном введении. Ферментемию контролировали по аланинаминотрансферазе (ACT), аспартатаминотрансферазе (ACT), гаммаглютаминтрансферазе (ГГТ) и щелочной фосфатазе (ЩФ). На фоне лечения роцефином отмечено два случая повышения уровня АЛТ и по одному случаю ГГТ и ЩФ.
У двух человек на фоне лечения роцефином зарегистрирована легкая степень тромбоцитопении. Основная жалоба при введении роцефина и офрамакса, это болезненность в месте инъекции. Так, в одном случае при лечении офрамаксом наблюдали аллергическую реакцию (отек губ. жжение в ротоглотке и т.д.). Все явления быстро прошли на фоне антигистаминовой терапии.
Выводы:
5. Хорошие результаты получены при лечении офрамаксом энтероколита, вызнанного versinia enterocolitica.
6. Нежелательные реакции у роцефина (транзиторная гиперферментемия. тромбоцитопения и повышение щелочной фосфотазы) выражены значительнее, чем у офрамакса (аллергический компонент в одном случае).
Зав.кафедрой клинической фармакологии и терапии РМАПО МЗ РФ,
Профессор В.А. ОРЛОВ
Исполнители:
ст.научн.сотр..к.м.н В.И. СОКОЛОВА
ст.научн.сотр..к.м.н В.А. ШЕНДЕРОВИЧ
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.