Принцип модульной организации белковой молекулы что это
Структурная организация белков
Структурная организация белков
Белковые молекулы представляют собой продукт полимеризации 20-25 различных мономерных молекул (аминокислот), соединенных не хаотично, а в строгом соответствии с кодом белкового синтеза. Из 20 различных аминокислот (при условии, что каждая войдёт в цепь только один раз) можно построить 2,3•10 18 изомеров белковой молекулы.
?-Аминокислоты, входящие в состав белков
(?-аминоизокапроновая кислота)
LeucineЛей
Leu
L
(?-амино-?-тиопропионовая кислота)
CysteineЦис
Cys
C—СH2SHМЕТИОНИН*
(?-амино-?-метилтиомаслянная кислота)
MethionineМет
(?-аминоянтарная кислота)
AsparDicАсп
Asp
D—СН2СООНГЛУТАМИНОВАЯ КИСЛОТА
(?-амино-?-имидазолилпропионовая кислота)
HistidineГис
H
K—CH2-CH2-СН2-CH2-NH2АРГИНИН
(?-амино-?-гуанидиновалериановая кислота)
ARginineАрг
(амид аспарагиновой кислоты)
AsparagiNeАсн
Asn
NNH2 (CO)CH2 —ГЛУТАМИН
(амид глутаминовой кислоты)
Glutamine
Q-tamineГлн
(?-амино-?-гидроксипропионовая кислота)
SerineСер
Ser
S—CH2-OHТРЕОНИН*
(?-амино-?-оксимасляная кислота)
ThreonineТре
(?-амино-?-(3-индолил) пропионовая кислота)
Tryptophan
TWyptophanТрип
Trp
W
(?-амино-?-параоксифенилпропионовая кислота)
TYrosineТир
Y
Белки представляют собой сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом пептидными (R—СО—NH—R’) связями, возникающими при взаимодействии карбоксильных СООН и аминных NH2 групп аминокислот. На примере аланина и глицина образование пептидной связи (с выделением молекулы воды) можно представить следующим уравнением:
К дипептиду аналогичным способом могут присоединяться и другие аминокислоты с образованием три-, тетра-, пентапептида и т. д., вплоть до крупной молекулы полипептида (белка).
Получены следующие экспериментальные доказательства полипептидной теории строения белка.
Здесь следует указать на некоторые особенности строения полипептидной цепи. Во-первых, это касается своеобразия расположения атомов углерода и азота, находящихся примерно в одной плоскости, и атомов водорода и радикалов, направленных к этой плоскости под углом 109 o 28′. Во-вторых, это относится к своеобразию пептидной связи. Расстояние между атомами С и N в пептидной связи (равное 0,132 нм) является промежуточным между простой (одинарной) связью (т. е. связью между С—N=, равной 0,147 нм) и двойной связью (между =C=N—, равной 0,125 нм):
Это создает предпосылки для осуществления таутомерных (лактам-лактимных) превращений. Лактимная (енольная) форма дает некоторые преимущества полипептидной цепи, выражающиеся в повышении реакционной способности. Наконец, следует указать на своеобразие радикалов, которые являются полифункциональными и определяют и структуру (пространственную), и многообразие функций молекул белка.
Первичная структура белка
Под первичной структурой подразумевают порядок, последовательность расположения аминокислотных остатков в полипептидной цепи. Зная первичную структуру, можно точно написать структурную формулу белковой молекулы, если она представлена одной полипептидной цепью. Если в состав белка входит несколько полипептидных цепей, то задача определения первичной структуры несколько сложнее, так как необходимо предварительное разъединение этих цепей.
Стабильность первичной структуры обеспечивается в основном главновалентными пептидными связями; возможно участие и небольшого числа дисульфидных связей.
В настоящее время выяснение первичной структуры белков является вопросом времени и технического оснащения лабораторий. Полностью выяснена первичная структура многих природных белков. Первым из них был инсулин, содержащий 51 аминокислотный остаток (Сэнджер, 1953). Самым крупным белком с выясненной первичной структурой был иммуноглобулин, в четырех полипептидных цепях которого насчитывается 1300 аминокислотных остатков.
Вторичная структура белка
Таким образом, стабильность вторичной структуры в основном обеспечивается водородными связями (определенный вклад в это вносят и валентные связи — пептидные и дисульфидные).
Типичным примером таких белков является коллаген — фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных. В естественных условиях коллаген находится в форме длинных фибриллярных нитей, однако при нагревании эти нити превращаются в беспорядочные клубочки, получившие название желатины.
Третичная структура белка
(в) Третичная структура (г) Четвертичная структура
В стабилизации пространственной структуры белков, помимо валентных связей (пептидные и дисульфидные связи), основную роль играют так называемые нековалентные связи. К этим связям относятся: водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные силы Ван-дер-Ваальса, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия, вызванные вталкиванием гидрофобных радикалов внутрь молекулы белка молекулами воды (растворителя) и т. д.
Третичная структура белка, после завершения его синтеза в рибосомах, возникает автоматически и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры являются взаимодействия радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот как бы вталкиваются внутрь белковой молекулы, образуя там сухие зоны, в то время как полярные радикалы оказываются ориентированными в стороны воды. В какой-то момент возникает термодинамически наиболее выгодная конформация молекулы в целом и она стабилизируется. В такой форме белковая молекула характеризуется минимальной свободной энергией.
В свою очередь трехмерная структура белковой молекулы также содержит информацию, но уже совершенно нового типа, а именно функциональную. Все биологические свойства белков (каталитические, гормональные, антигенные и др.) связаны с сохранностью их третичной структуры, которую принято называть нативной конформацией. Любые воздействия (термические, физико-химические), приводящие к нарушению этой конформации молекулы (разрыв водородных и других нековалентных связей), сопровождаются частичной или полной потерей белком его биологических свойств.
Четвертичная структура белка
Под четвертичной структурой подразумевают симметричнопосторенные комплексы, стабилизированные за счет нековалентных взаимодействий. Такие называют олигомерами, а составные единицы комплексов (2-12 белков) – субъединицами или мономерами (рисунок (г)). Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных нековалентными связями (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров. Образовавшуюся молекулу принято называть мультимером. Мультимерные белки чаще всего построены из четного числа протомеров (от 2 до 4, реже от 6 до 8, 10, 12 и т. д.) с разными молекулярными массами — от нескольких тысяч до 100 000 дальтон.
Основными силами, стабилизирующими четвертичную структуру, являются нековалентные связи между контактными площадками протомеров, которые взаимодействуют друг с другом по типу комплементарности, т. е. универсальному принципу, свойственному живой природе.
Каждый индивидуальный белок характеризуется уникальной структурой, обеспечивающей уникальность его функций. Поэтому выяснение структуры разнообразных белков может служить ключом к познанию природы живых систем и, соответственно, сущности жизни.
One thought on “ Структурная организация белков ”
Структурные белки цитоскелета, как своего рода арматура, придают форму клеткам и многим органоидам и участвуют в изменении формы клеток. Большинство структурных белков являются филаментозными: например, мономеры актина и тубулина — это глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит цитоскелет, позволяющий клетке поддерживать форму
Принцип модульной организации белковой молекулы что это
§ 8. ПРОСТРАНСТВЕННАЯ ОРГАНИЗАЦИЯ БЕЛКОВОЙ МОЛЕКУЛЫ
Первичная структура
Под первичной структурой белка понимают количество и порядок чередования аминокислотных остатков, соединенных друг с другом пептидными связями, в полипептидной цепи.
Полипептидная цепь на одном конце содержит свободную, не участвующую в образовании пептидной связи, NH2-группу, этот участок обозначается как N–конец. На противоположной стороне располагается свободная, не участвующая в образовании пептидной связи, НООС-группа, это – С-конец. За начало цепи принимается N-конец, именно с него начинается нумерация аминокислотных остатков:
Аминокислотную последовательность инсулина установил Ф. Сэнгер (Кембриджский университет). Этот белок состоит из двух полипептидных цепей. Одна цепь состоит из 21 аминокислотного остатка, другая цепь – из 30. Цепи связаны двумя дисульфидными мостиками (рис.6).
Рис. 6. Первичная структура инсулина человека
На расшифровку этой структуры было затрачено 10 лет (1944 – 1954 гг.). В настоящее время первичная структура определена у многих белков, процесс ее определения автоматизирован и не представляет собой серьезную проблему для исследователей.
Информация о первичной структуре каждого белка закодирована в гене (участке молекулы ДНК) и реализуется в ходе транскрипции (переписывании информации на мРНК) и трансляции (синтеза полипептидной цепи). В связи с этим можно установить первичную структуру белка также по известной структуре соответствующего гена.
По первичной структуре гомологичных белков можно судить о таксономическом родстве видов. К гомологичным белкам относятся те белки, которые у разных видов выполняют одинаковые функции. Такие белки имеют сходные аминокислотные последовательности. Например, белок цитохром С у большинства видов имеет относительную молекулярную массу около 12500 и содержит около 100 аминокислотных остатков. Различия в первичной структуре цитохрома С двух видов пропорциональны филогенетическому различию между данными видами. Так цитохромы С лошади и дрожжей отличаются по 48 аминокислотным остаткам, курицы и утки – по двум, цитохромы же курицы и индейки идентичны.
Вторичная структура
Вторичная структура белка формируется вследствие образования водородных связей между пептидными группами. Различают два типа вторичной структуры: α-спираль и β-структура (или складчатый слой). В белках могут присутствовать также участки полипептидной цепи, не образующие вторичную структуру.
α-Спираль по форме напоминает пружину. При формировании α-спирали атом кислорода каждой пептидной группы образует водородную связь с атомом водорода четвертой по ходу цепи NH-группы:
Каждый виток спирали связан со следующим витком спирали несколькими водородными связями, что придает структуре значительную прочность. α-Спираль обладает следующими характеристиками: диаметр спирали 0,5 нм, шаг спирали – 0,54 нм, на один виток спирали приходится 3,6 аминокислотных остатка (рис. 7).
Рис. 7. Модель a-спирали, отражающая ее количественные характеристики
Боковые радикалы аминокислот направлены наружу от 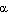
Рис. 8. Модель 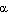
Из природных L-аминокислот может быть построена как правая, так и левая 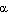
Некоторые аминокислотные остатки препятствуют образованию α-спирали. Например, если в цепи подряд расположено несколько положительно или отрицательно заряженных аминокислотных остатков, такой участок не примет α-спиральной структуры из-за взаимного отталкивания одноименно заряженных радикалов. Затрудняют образование 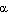
Рис. 9. Остаток пролина препятствует образованию 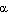
Поэтому остаток пролина, входящий в состав полипептидной цепи, не способен образовывать внутрицепочечную водородную связь. Кроме того, атом азота в пролине входит в состав жесткого кольца, что делает невозможным вращение вокруг связи N – C и образование спирали.
Кроме α-спирали описаны и другие типы спиралей. Однако они встречаются редко, в основном на коротких участках.
Образование водородных связей между пептидными группами соседних полипептидных фрагментов цепей приводит к формированию β-структуры, или складчатого слоя:
В отличие от α-спирали складчатый слой имеет зигзагообразную форму, похожую на гармошку (рис. 10).
Рис. 10. β-Структура белка
Различают параллельные и антипараллельные складчатые слои. Параллельные β-структуры образуются между участками полипептидной цепи, направления которых совпадают:
Антипаралельные β-структуры образуются между противоположно направленными участками полипептидной цепи:
β-Структуры могут формироваться более чем между двумя полипептидными цепями:
В составе одних белков вторичная структура может быть представлена только α-спиралью, в других – только β-структурами (параллельными, или антипараллельными, или и теми, и другими), в третьих наряду с α-спирализованными участками могут присутствовать и β-структуры.
Третичная структура
У многих белков вторичноорганизованные структуры (α-спирали, 
Третичная структура белков определяется их аминокислотной последовательностью. При ее формировании связи могут возникать между аминокислотами, расположенными в полипептидной цепи на значительном расстоянии. У растворимых белков полярные радикалы аминокислот, как правило, оказываются на поверхности белковых молекул и реже – внутри молекулы, гидрофобные радикалы оказываются компактно упакованными внутри глобулы, образуя гидрофобные области.
В настоящее время третичная структура многих белков установлена. Рассмотрим два примера.
Миоглобин – кислород-связывающий белок с относительной массой 16700. Его функция – запасание кислорода в мышцах. В его молекуле имеется одна полипептидная цепь, состоящая из 153 аминокислотных остатков, и гемогруппа, играющая важную роль в связывании кислорода.
Пространственная организация миоглобина установлена благодаря работам Джона Кендрью и его коллег (рис. 11). В молекуле этого белка присутствуют 8 α-спиральных участков, на их долю приходится 80 % всех аминокислотных остатков. Молекула миоглобина очень компактна, внутри нее может уместиться всего четыре молекулы воды, почти все полярные радикалы аминокислот расположены на внешней поверхности молекулы, большая часть гидрофобных радикалов расположена внутри молекулы, вблизи поверхности находится гем – небелковая группа, ответственная за связывание кислорода.
Рис.11. Третичная структура миоглобина
Рибонуклеаза – глобулярный белок. Она секретируется клетками поджелудочной железы, это – фермент, катализирующий расщепление РНК. В отличие от миоглобина, в молекуле рибонуклеазы имеется очень мало α-спиральных участков и достаточно большое число сегментов, находящихся в β-конформации. Прочность третичной структуре белка придают 4 дисульфидные связи.
Четвертичная структура
Многие белки состоят из нескольких, двух или более, белковых субъединиц, или молекул, обладающих определенной вторичной и третичной структурами, удерживаемых вместе при помощи водородных и ионных связей, гидрофобных взаимодействий, ван-дер-ваальсовых сил. Такая организация белковых молекул носит название четвертичной структуры, а сами белки называют олигомерными. Отдельная субъединица, или белковая молекула, в составе олигомерного белка называется протомером.
Число протомеров в олигомерных белках может варьировать в широких пределах. Например, креатинкиназа состоит из 2 протомеров, гемоглобин – из 4 протомеров, РНК-полимераза E.coli – фермент, ответственный за синтез РНК, – из 5 протомеров, пируватдегидрогеназный комплекс – из 72 протомеров. Если белок состоит из двух протомеров, его называют димером, четырех – тетрамером, шести – гексамером (рис. 12). Чаще в молекуле олигомерного белка содержится 2 или 4 протомера. В состав олигомерного белка могут входить одинаковые или различные протомеры. Если в состав белка входят два идентичных протомера, то это – гомодимер, если разные – гетеродимер.
Рис. 12. Олигомерные белки
Рассмотрим организацию молекулы гемоглобина. Основная функция гемоглобина заключается в транспорте кислорода из легких в ткани и углекислого газа в обратном направлении. Его молекула (рис. 13) состоит из четырех полипептидных цепей двух различных типов – двух α-цепей и двух β-цепей и гема. Гемоглобин является белком, родственным миоглобину. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны. Каждый протомер гемоглобина содержит, как и миоглобин, 8 α-спирализованных участков полипептидной цепи. При этом надо отметить, что в первичных структурах миоглобина и протомера гемоглобина идентичны только 24 аминокислотных остатка. Следовательно, белки, значительно отличающиеся по первичной структуре, могут иметь сходную пространственную организацию и выполнять сходные функции.
Всё для студентов медицинских вузов
Пример: пептид ангиотензин-2, повышающий давление
Особенности строения пептидной связи:Наличие плоской (компланарной) сопряженной системы в пептидном звене затрудняет вращение вокруг связи С-N

Мезомерия пептидной связи
Вторичная структура белков
В 1950 г. Лайнус Полинг предложил два вида пространственной структуры белков — альфа-спираль и бета-структуру. Эти понятия сохранились до настоящего времени как виды вторичной структуры белков. Кроме них сейчас различают ещё один, третий тип вторичной структуры — b-поворот. Вторичная структура белка — это локальная конформация полипептидной цепи, обусловленная вращением отдельных участков этой полипептидной цепи вокруг одинарных ковалентных связей.
Стабильность спирали поддерживают водородные связи между атомами пептидных группировок аминокислот, расположенных на соседних витках спирали. Все условия, ведущие к формированию спиральных структур, могут успешно реализоваться и при другой форме расположения полипептидной цепи. Эту альтернативную спирали форму назвали -структурой. Она формируется при укладке цепи в форме плоских шпилек. -структура также стабилизирована водородными связями. Из двух или более b-структурных участков полипептидной цепи формируется b-слой. В грубом приближении она плоская и напоминает лист. Однако из-за того, что плоскости пептидных групп в каждом b-структурном участке наклонены поочередно в разные стороны относительно направления этого участка, плоский b-слой приобретает складчатую форму.
b-поворот или b-изгиб — ещё один тип вторичной структуры, встречающийся во многих глобулярных белках в тех местах, где направление полипептидной цепи меняется на противоположное. Данная структура часто рассматривается как связующее звено между двумя уложенными антипараллельно b-участками в составе b-слоя. Она образуется в полипептидной цепи там, где встречается пролин. Дело в том, что эта аминокислота не может изгибаться, и там где она встречается в полипептидной цепи, a-спираль и b-структура обычно нарушаются. В этом месте образуется своеобразный излом — b-поворот. В b-повороте водородная связь замыкается через три аминокислотных остатка. Там, где встречается b-поворот, полипептидная цепь делает изгиб. b-повороты обычно находятся у поверхности белковой молекулы.
 |  |  |
Схематическое изображение b-структуры. а) параллельное, б) антипараллельное расположение b-структурных участков полипептидной цепи в b-слое
Увеличение числа известных белков привело ученых к необходимости более подробно исследовать пространственную структуру полипептидных цепей. Оказалось, что несколько участков цепи, организованных в пространстве в форме a-спирали или b-структуры, могут объединяться, формируя так называемую надвторичную структуру. В белке может быть несколько организованных таким образом участков. Всех их можно подразделить на четыре класса: a/a, b/b, a/b и a + b, в зависимости от взаимного расположения в цепи a-спиральных и b-структурных участков.
Полипептидная цепь изображается в виде ленты, при этом a-спиральные участки представлены спиралями, b-структурные — стрелками, а нерегулярные — светлыми петлями. Боковые цепи не показаны, хотя во всех белках пространство между атомами основной цепи заполнено атомами боковых цепей. a/a структура состоит в основном из a-спиралей, b-участки в ней практически отсутствуют. a-спирали упакованы таким образом, что неполярные боковые цепи оказываются спрятанными внутрь. В b/b типе имеется несколько b-цепей и нет (или почти нет) a-спиралей. В a/b варианте a- и b-участки чередуются вдоль цепи. Часто b-участки образуют параллельный b-слой, окруженный a-спиралями. В a + b-типе a- и b-участки обычно располагаются в разных сегментах полипептидной цепи.
 |
Варианты объединения a-спиральных и b-структурных участков (надвторичной структуры) в полипептидной цепи
В крупных белках при сворачивании полипептидной цепи часто образуются две или более пространственно разделенные области, называемые доменами. По своей
структуре каждый домен напоминает отдельный небольшой белок. Обычно в одном домене содержится от 40 до 300 остатков. Доменом называют участок белковой молекулы, образованный несколькими вторичными или надвторичными структурами, имеющий глобулярную форму. В разных белках они могут быть одинаково организованными участками и выполнять одинаковые функции. Домены часто обладают специфическими функциями, такими как связывание небольших молекул.
 | Обобщенное изображение кофермент-связывающего домена в составе различных дегидрогеназ. Этот домен состоит из двух одинаковых по структуре babab единиц (один — желтого и один — синего цвета). Каждая единица связывает НАД (никотинамидадениндинуклеотид) и образует в месте связывания складку. |
Использование понятия «домен» позволило выделить целые семейства белков, имеющих общего предшественника, что проливает свет на процессы совершенствования живого мира.
В ряде случаев четко определить функции тех или иных доменов не удается. Между доменами в пределах одной и той же полипептидной цепи устанавливаеются гидрофобные контакты. В этих зонах формируется каталитический центр, а образующие его группы размещены в обоих доменах.
На этом уровне структурной организации белка еще не принимались во внимание возможности взаимодействия радикалов аминокислот между собой и с растворителем (водой), в котором белок должен выполнять свои функции.
Третичная структура белков
Третичной структурой белков назвали расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют свою локальную конформацию, то есть сохраняют спиральные или b-структурные формы. Большая часть белков на уровне третичной структуры принимает глобулярную (шаровидную) форму. Это связано, в первую очередь, с тем, что многие неполярные группы радикалов аминокислот под влиянием полярного растворителя, воды, объединяются между собой в кластеры, исключающие воду. При этом они разрывают водородные связи между диполями воды, уменьшая энтропию, и сближаются на расстояния, доступные для электростатического взаимодействия между ними. Такое взаимодействие получило название «сил гидрофобного взаимодействия». Эти силы, требующие небольших усилий для разрыва, тем не менее приобретают важнейшее значение для стабилизации пространственной структуры белка. Аналогичным образом формируются липидные мицеллы. Поэтому при складывании полипептидной цепи гидрофобные радикалы оказываются внутри белковой молекулы, а гидрофильные — наружи, тем самым снижение энтропии становится минимальным.
Этапы пространственной укладки полипептидной цепи и приобретения ею третичной структуры
Важную роль в стабилизации третичной структуры белка играют водородные связи и ионное взаимодействие. Указанные силы успешно сочетают прочность структуры белка и ее довольно значительную подвижность, что чрезвычайно важно для выполнения функций. В ряде белков прочность структуры укрепляется дополнительно и ковалентными дисульфидными связями.
Связи, стабилизирующие третичную структуру белка. А. Ионная связь. Б. Водородная связь (три типа показаны). В. Гидрофобное взаимодействие (две формы — нижнее кластерного типа, а верхнее типа p-связи). Г. Дисульфидная связь.
В фибриллярных (нитевидных) белках третичная структура формируется или путем многослойной укладки плоских b-структур, или параллельной укладкой нескольких спиральных структур. В любом случае возникают ориентированные в длину волокнистые структуры. Такие волокна имеют высокую прочность. Примером такого белка может служить белок соединительной ткани — коллаген. Его молекула представляет своеобразную суперспираль, состоящую из 3-х спирально свернутых полипептидных цепей. Такие суперспирали, в свою очередь, укладываются в форме более толстых протофибрилл, объединяемых затем в коллагеновое волокно.
В заключение надо отметить, что для уникальному пространственному расположению атомов в молекуле белка (укладка полипептидной цепи в пространстве), которое «запрограммированно» самой аминокислотной последовательностью полипептидной цепи и поэтому образуется самопроизвольно, тем не менее нужны помощники. Эти помощники также являются белками и получили название «шапероны» (см.гл.10). Впервые они были открыты как «белки теплового шока» (hsp 60 и hsp 70). Их функция заключается в защите складывающейся полипептидной цепи от взаимодействия с другими многочисленными клеточными белками и, возможно, в ускорении этого процесса.
Четвертичная структура белков
Под четвертичной структурой понимают структуру белков, состоящих из нескольких полипептидных цепей. Каждая из этих цепей имеет свою завершенную пространственную структуру и называется субъединицей белка с четвертичной структурой. Белок при таком объединении нескольких цепей приобретает новую функцию.
Уровни структурной организации белковой молекулы
Связи, которые имеются между субъединицами, как правило, нековалентные (силы гидрофобного взаимодействия, ионные, водородные), хотя в ряде белков (например, белки плазмы крови) субъединицы соединены ковалентными дисульфидными мостиками. Создание белков с четвертичной структурной организацией позволило Природе расширить свои возможности в области качественного разнообразия белков при незначительном увеличении количества генетического материала. Например, фермент лактатдегидрогеназа (ЛДГ), состоящий из 4-х субъединиц, формируется из 2-х генетически детерминированных полипептидных цепей H и M. Их разные комбинации (HHHH,HHHM,HHMM,HMMM,MMMM) позволяют существовать в организме 5 ферментам ЛДГ, катализирующих одинаковую реакцию в разных органах и тканях: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4 и ЛДГ5. Такие белки с одинаковыми функциями, но отличающимися физико-химическими свойствами получили название изопротеинов (изоферментов).
Слабое взаимодействие между отдельными частями белкой молекулы дает ей некоторую свободу к изменениям пространственной структуры. Мы уже указывали, что расположение атомов или групп атомов молекулы органического вещества, обусловленное возможностями вращения их вокруг ковалентных связей, получило название конформации. Изменение конформации белковой молекулы лежит в основе ее биологической активности.
Каждая отдельно взятая полипептидная цепь, которая называется протомером, чаще всего не обладает биологической активностью. Эту способность белок приобретает при объединении с другими протомерами. Образовавшуюся при этом молекулу называют мультимером. Мультимерные белки чаще всего построены из чётного числа протомеров. Функционально активная часть мультимера называется субъединицей.
В частности молекула белка глобина состоит из 2a и 2b субъедениц, каждая из которых состоит из двух одинаковых полипептидных цепей соответственно. То есть молекула гемоглобина состоит из четырех полипептидных цепей, каждая из которых окружает группу гема.
При определённых условиях (в присутствии мочевины) или при сдвиге рН молекула гемоглобина обратимо диссоциируют на 2a и 2b полипептидных цепи. После удаления мочевины происходит автоматическая ассоциация исходной молекулы. Это возможно благодаря информации, заложенной в первичной структуре. То есть последовательность аминокислот содержит в себе информацию, которая реализуется на всех уровнях структурной организаци белка. Наиболее изученным мультемерным ферментом является ЛДГ, состоящий из 4-х субъединиц и может существовать в 5-ти формах (изоферменты).
ПЯТЫЙ УРОВЕНЬ организации представлен в виде ферментных комплексов, которые катализируют цепной и метаболический путь. Эти комплексы называются метаболонами, они чаще связаны с клеточными мембранами.
Стабильность четвертичной структуры обусловлена ковалентными связями между контактными площадками протомеров, которые взаимодействуют друг с другом по принципу комплементарности. Так, например, в гемоглобине каждая субъединица имеет 4 контактные поверхности для связывания с гемом, 3 – для связывания с другими протомерами.
В последние годы была сформулирована теория доменной структуры белка. Домен – это функциональный модуль, рабочая поверхность отдельного белка. То есть белок – это полифункциональный модуль, состоящий из нескольких доменов. Было установлено, что белки выполняющие одну и ту же функцию, но выделенные из разных веществ, имеют сходное строение. Домены друг относительно друга могут смещаться благодаря “ гибкости” белковой молекулы. Смещение происходит под действием температуры, факторов внешней среды, фосфорилирования, метилирования, и это отражается на свойствах и функциях белка.
Уникальная пространственная структура каждой белковой молекулы и ее возможности в определенных пределах изменять эту структуру придают белкам способность выполнять многочисленные специфические функции. Главный принцип, лежащий в основе этой специфичности, это принцип комплементарности или пространственной дополнительности между определенным участком белковой молекулы (активным участком) и молекулой или участком молекулы (лигандом), с которой реагирует этот белок. Активные участки белковых молекул образуются на поверхности в «карманах», «расщелинах». При этом если для функции необходимы гидрофобные радикалы аминокислот, то они, упрятанные от воды в глубине белковой молекулы, становятся доступными благодаря изменению её конформации. В таком случае говорят о кооперативном эффекте, который образно можно представить на модели «рука — перчатка».
Лигандами могут быть самые разные по химической природе вещества: белки, углеводы, липиды, неорганические вещества и т.д. Примерами такого специфического белок-лиганд взаимодействия являются взаимодействие между ферментом и субстратом, антителом и антигеном, рецептором и гормоном и т.д.
Учитывая важность конформационных изменений для выполнения белками их функций, становится понятным, что в регуляции их функциональной активности важная роль отводится факторам, влияющим на конформацию белка. Такими факторами могут быть изменения pH, температуры, которые в равной мере влияют на все белки и могут быть названы неспецифическими факторами регуляции. С другой стороны, это могут быть специфически взаимодействующие с белками вещества и тогда говорят о специфических факторах регуляции. Последние создают неограниченные возможности в специфической регуляции процессами жизнедеятельности.















