Причиной чего может явиться остановка сердца и прекращение дыхания
Внезапная остановка сердца и сердечно-легочная реанимация
Внезапная остановка сердца — это резкое прекращение сердцебиения, в результате чего останавливается кровообращение, начинается кислородное голодание органов (прежде всего мозга и легких).
Это состояние чаще всего возникает из-за нарушения электрической деятельности сердца. В момент остановки сердца, человек падает в обморок и перестает дышать.
Часто внезапную остановку сердца сравнивают с сердечным приступом, но это не верно. Приток крови к одному из отделов сердца заблокирован во время приступа. Но он также может спровоцировать электрический дисбаланс, который становится причиной остановки сердца.
Во время внезапной остановки сердца требуется экстренная помощь врачей, иначе человек умрет. При первых признаках нужно сразу же вызывать скорую. А базовая сердечно-легочная реанимация (вручную или с помощью дефибриллятора) до прибытия скорой повышает шансы на спасение.
Причины возникновения внезапной остановки сердца
Одна из причин — нарушения сердечного ритма, что называются аритмией. Они возникают в том случае, если электрическая система сердца работает с перебоями.
Главной задачей этой системы является контроль над ритмом и частотой сокращений мышцы сердца. Если в этой системе происходят нарушения, то сердце начинает биться слишком часто, слишком редко или неритмично. Обычно это неопасно и быстро проходит, но в некоторых случаях приводит к внезапной остановке сердца.
В 90% случаев сердце останавливается из-за фибрилляции желудочков: быстрые и неустойчивые электрические импульсы заставляют их сокращаться хаотично и неэффективно, вместо того чтобы равномерно перекачивать кровь.
Крайне редко бывает, что сердце останавливается у совершенно здорового человека. Но обычно это случается с людьми, которые имели заболевания сердца, но возможно, об этом не знали.
Внезапная остановка сердца чаще всего возникает у :
Кроме того, причиной остановки сердца становятся и внесердечные проблемы, например, травмы, нарушения дыхания ( в результате обструкции дыхательных путей, утопления, отравления дымом), передозировка лекарствами или наркотическими веществами.
Факторы риска
Из-за того, что внезапная остановка сердца связана с кардиологическими проблемами, факторы риска у них следующие:
Значительно повышают вероятность этого состояния:
Как распознать внезапную остановку сердца
Все признаки проявляются резко и неожиданно:
Изредка остановке сердца предшествует:
Первая помощь: базовая сердечно-легочная реанимация
Заметив у человека симптомы, похожие на внезапную остановку сердца, немедленно вызывайте скорую медицинскую помощь.
При внезапной остановке сердца, кровь перестает получать необходимое количество кислорода. Находясь в таком состоянии, на протяжении даже и нескольких минут можно умереть или получить необратимые повреждения мозга. Время играет здесь главную роль. Поэтому как только вызовите скорую, самостоятельно начинайте реанимацию. У вас есть шанс спасти человека, даже если вы никогда этого не делали.
Выполните следующие действия:
Если в вашем окружении есть люди, для которых высок риск остановки сердца, стоит научиться оказывать первую помощь и приобрести портативный дефибриллятор.
Причиной чего может явиться остановка сердца и прекращение дыхания
Специальные методы защиты дыхательных путей.
Специальные методы защиты дыхательных путей требуют специального оборудования и навыков. Они должны использоваться у пациента на фоне апное, которому проводятся меры первичной СЛР.
Ротовые и назофарингеальные воздуховоды просты в постановке при наличии минимального опыта. Наиболее распространенным и простым в постановке является орофарингеальный воздуховод Гведела. Орофарингеальный воздуховод имеет размеры, соответствующие расстоянию от угла рта до угла нижней челюсти. Назофарингеальный воздуховод перед введением должен быть хорошо смазан и равен диаметру мизинца пострадавшего. Не используйте назофарингеальный воздуховод, если имеется подозрение на перелом основания черепа.
Интубация трахеи – наилучший способ обеспечения проходимости и безопасности дыхательных путей. Однако манипуляция требует специальных навыков и оборудования. В случае неправильного выполнения многочисленные попытки интубации могут привести к развитию дальнейших осложнений и потере времени. Самыми надежными способами подтверждения правильного стояния трубки являются визуальный контроль в момент ее прохождения между голосовыми связками, аускультация легких и, при наличии, капнометрия в конце выдоха. Также доступны всевозможные типы пищеводных детекторов.
При подозрении на наличие риска регургитации и аспирации желудочным содержимым возможно применение давления на перстневидный хрящ до момента раздувания манжеты интубационной трубки. Однако это может создать трудности, особенно для неопытного оператора, если манипуляция выполняется не совсем корректно.
Другие орофарингеальные воздуховоды.
Будучи рутинно использовавшейся в анестезиологической практике Великобритании при неудачной интубации втечение десяти лет, ларингеальная маска (ЛМ) стала применяться при реанимации только в последние годы.
Техника введения легко осваивается, что обеспечивает простоту и эффективность вентиляции мешком и ЛМ. Однако в некоторых случаях возникают трудности при постановке ЛМ, она не обеспечивает адекватной вентиляции при уплотненных легких, а также не защищает на 100% от содержимого желудка. При реанимации также использовался двухпросветный Комбитьюб ( Combitube ® ), который устанавливается вслепую в пищевод и используется для раздувания легких через второй просвет. См. предыдущие выпуски “ UA ”, где имеется более детальное описание ЛМ и Комбитьюба.
Хирургические мероприятия по поддержанию проходимости ВДП необходимы при наличии опасной для жизни обструкции дыхательных путей, когда другие способы поддержания их проходимости были неудачны. Срочный доступ к ВДП возможен через маловаскуляризированную перстнещитовидную мембрану. Эта мембрана легко определяется путем идентификации срединного углубления между перстневидным хрящом и нижним краем щитовидного хряща.
Пункция перстнещитовидной мембраны Канюля 12 или 14 гейч с прикрепленным шприцем вводится через перстнещитовидную мембрану до появления воздуха в шприце при аспирации. Далее канюля проводится по игле в трахею. К павильону иглы прикрепляется источник кислорода с потоком 15 л/мин и пациент вентилируется одну секунду с фазой выдоха 4 секунды.
При отсутствии подачи кислорода может использоваться импровизированное оборудование, например:
Канюля соединяется с 10 мл шприцом без поршня. Интубационная трубка 8,0 вставляется в цилиндр шприца, затем раздувается манжета и предпринимается попытка вентиляции мехом.
Коннектор эндотрахеальной трубки номер 3,5 обычно подходит к канюле, что позволяет проводить вентиляцию.
При проведении вентиляции подобным способом невозможно достичь удаления СО2, что приводит к возникновению респираторного ацидоза. Должно осуществляться внимательное наблюдение для предотвращения баротравмы, так как спонтанная вентиляция через перстнещитовидную мембрану невозможна. Следует поддерживать адекватный путь для выдоха, так как канюля не обеспечивает удаления избытка дыхательной смеси.
Вентиляция через иглу может проводиться не более 10-20 минут и в дальнейшем должна быть проведена хирургическая крикотомия для обеспечения адекватной вентиляции. Интубационная или трахеостомическая трубка (размер 5,0-6,5) вводится через горизонтальный разрез в мембране, соединяется с мехом и таким образом обеспечивается высокоэффективная вентиляция и поддержание проходимости дыхательных путей.
Алгоритм действий поддержания проходимости верхних дыхательных путей и вентиляции легких.
Этот простой метод также требует времени для подготовки оборудования и имеет высокий процент осложнений, поэтому в операционной или комнате для оказания неотложной помощи необходимый инструмент всегда должен находиться наготове.
Дефибриляция.
При большинстве остановок сердца у взрослых имеет место фибриляция желудочков, которая может быть купирована электрической дефибриляцией. Вероятность удачной дефибриляции снижается со временем (примерно на 2-7% на каждую минуту остановки сердца), но меры первичной реанимации замедляют этот процесс, отодвигая развитие асистолии.
При дефибриляции осуществляется воздействие электрическим током на сердце, деполяризируя критическую массу миокарда и вызывая координированный период абсолютной рефрактерности – период, при котором потенциал действия не может быть вызван стимулом любой интенсивности. В случае успеха дефибриляция прерывает хаотическую электрическую активность сердца. При этом клетки пейсмейкера синоатриального узла имеют возможность снова обеспечивать синусовый ритм, так как они являются первыми клетками миокарда, способными деполяризоваться спонтанно.
Все дефибриляторы состоят из блока питания, переключателя уровня энергии, выпрямителя тока, конденсатора и набора электродов (рисунок 5). Современные устройства позволяют регистрировать ЭКГ с собственных пластинок или электродов, соединенных с дефибрилятором. Энергия разряда обозначается в Джоулях (Дж) и соответствует энергии, которая воздействовала через электроды на грудную клетку.
Во время разряда только незначительная часть энергии воздействует на сердце вследствие наличия различного уровня сопротивления (импеданса) грудной клетки. Величина требуемой энергии во время дефибриляции (порог дефибриляции) возрастает со временем после остановки сердца. Для реанимации взрослых используются эмпирически подобранные разряды в 200 Дж для первых двух разрядов и 360 Дж для последующих. Разряды постоянного тока должны наноситься при правильной постановке электродов и хорошем контакте с кожей. Полярность электродов не является решающим моментом, т.к. при их верной позиции «грудина» и «верхушка» на экране дефибрилятора проецируется правильная ориентация комплекса. Электрод, накладываемый на грудину, помещается на верхнюю часть правой половины грудной клетки под ключицей. Электрод, накладываемый на верхушку сердца, располагается немного латеральнее точки нормальной проекции верхушечного толчка (рисунок 6), но не на молочную железу у женщин. В случае неудачи могут применяться другие положения электродов, например, на верхушке и задней поверхности грудной клетки.
Рис. 5.
Рис. 6.
За последние годы появились полу- и автоматические дефибриляторы. При соединении с пациентом такие устройства способны самостоятельно оценивать сердечный ритм и производить необходимые разряды.
Некоторые из них также позволяют оценивать сопротивление грудной клетки для подбора необходимой силы тока разряда. Последние поколения дефибриляторов используют двух- и трехфазные формы волны энергии для достижения успешной дефибриляции при меньшей силе энергии.
В соответствии с типом используемого дефибрилятора важно, чтобы персонал был знаком с инструкцией по эксплуатации и регулярно проходил учебу по его использованию.
Остановка сердца: техника дефибриляции.
Для проведения дефибриляции необходимо убедиться в необходимости ее проведения по подтвержденному на ЭКГ ритму. Первые три разряда должны быть нанесены за первые 90 секунд СЛР. При отсутствии изменений ритма на ЭКГ необходимость контролировать пульс между разрядами отсутствует.
Медикаментозная терапия.
Алгоритм СЛР предполагает использование антиаритмических препаратов, соды, атропина и кардиостимуляции. Антиаритмические препараты перечислены ниже.
Атропин в дозе 3 мг вполне достаточен для полной блокады вагуса и должен использоваться однократно при асистолии. Он также показан при симптоматической брадикардии в дозе 0,5-1 мг.
Путь введения медикаментов.
Оптимальным является путь введения через катетеризированную центральную вену. Однако на практике зачастую используется периферический доступ, при котором следом за вводимыми препаратами для их доставки до центрального кровообращения должны вводиться 20-50 мл физиологического раствора.
Непредсказуемое введение препаратов и риск повреждения левой нисходящей коронарной артерии делает внутрисердечное введение нецелесообразным и небезопасным.
Алгоритм дальнейшего поддержания жизни.
Важным при проведении реанимации является диагностика и терапия ритма и причины, вызвавшей остановку сердца. Алгоритмы реанимации зависят от характера ритма, явившегося причиной остановки сердца – фибриляция желудочков (ФЖ)/желудочковая тахикардия (ЖТ) без пульса и асистолия/электрическая активность сердца без пульса (на рисунке = ЭМД).
Фибриляция желудочков или желудочковая тахикардия без пульса.
При диагностировании ФЖ или ЖТ как можно раньше должна проводиться дефибриляция тремя разрядами 200, 200 и 360 Дж. Если на ЭКГ отсутствует изменение ритма, не следует проверять наличие пульса, так как это откладывает следующую попытку дефибриляции. Пальпация магистральных артерий проводится, если для этого имеются данные ЭКГ или была попытка движения пациентом. При отсутствии эффекта от первых трех разрядов следует продолжить последовательность СЛР втечение одной минуты для обеспечения проходимости ВДП и постановки венозного доступа. После в/в введения адреналина (1 мг) необходимо заподозрить одну из причин ФЖ, поддающихся специфическому лечению – гипотермию или интоксикацию. ЭКГ рекомендуется оценивать после каждых 10 циклов СЛР. Персистирующая ФЖ требует проведения дополнительных трех разрядов мощностью 360 Дж. Дефибриляции отдается приоритет перед манипуляциями на дыхательных путях или постановкой в/в доступа. Рекомендуется использовать антиаритмические препараты только после проведения 9-12 разрядов на фоне введения адреналина каждые 2-3 минуты реанимации.
При отсутствии кардиомонитора, но наличии дефибрилятора реанимацию следует проводить по схеме фибриляции желудочков, как наиболее прогнозируемой.
Асистолия или электрическая активность без пульса.
Асистолия это полное отсутствие регистрируемой электрической активности сердца, имеет очень плохой прогноз. Электрическая активность без пульса (или электромеханическая диссоциация — ЭМД) имеет место при наличии на ЭКГ ритма, в норме ассоциирующегося с адекватным кровообращением, но без определяемого пульса на центральных артериях. В любом случае алгоритм СЛР с использованием дефибриляции не является адекватной мерой терапии данного типа остановки сердца.
При асистолии или ЭМД возможности терапии ограничены. Следует использовать правую часть алгоритма СЛР, представленного на схеме. Как можно раньше проводятся стандартные манипуляции для поддержания проходимости ВДП и обеспечения вентиляции, устанавливается в/в доступ, СЛР продолжается на фоне вводимых каждые три минуты доз адреналина. Атропин (3 мг) вводится однократно. Шансы положительного исхода повышаются, если имеется обратимая причина асистолии или ЭМД, поддающаяся лечению. Основные из них перечислены в алгоритме. Острая гиповолемия – наиболее хорошо поддающееся лечению состояние, приводящее к остановке кровообращения при кровопотере (> 50% объема крови). Такие пациенты требует срочного оперативного лечения и возмещения объема крови. При любом изменении ЭКГ с появлением ФЖ следует незамедлительно перейти к другому алгоритму СЛР.
Прекращение реанимации.
Решение о прекращении реанимации принимается бригадой, проводящей реанимацию. Часто принятие решения — дело наиболее опытного присутствующего доктора. Пациенты с асистолией или ЭМД без выясненной причины трагедии, без положительной реакции на меры первичной реанимации и адреналин имеют очень плохой прогноз и по нашему опыту реанимация у них должна завершаться через 10-15 минут. Лечение должно продолжаться, пока на ЭКГ регистрируется фибриляция желудочков. Однако вероятность успешной реанимации снижается после 12 дефибриляций.
Успешная реанимации является редкой по прошествии 15-20 минут с момента остановки кровообращения.Наиболее перспективный прогноз имеется у зарегистрированной остановки вследствие фибриляции желудочков, при рано начатых мерах первичной реанимации и дефибриляции. Исследования, проведенные в госпиталях в 1990-х показывают, что частота успешных реанимаций составляет до 50%, тогда как отношение выживаемости/выписки из стационара всего 20% в той же популяционной группе.
Реанимация пациентов с тяжелой патологией или в терминальном состоянии обычно безуспешна. Во многих госпиталях подобные пациенты после обсуждения с родственниками и/или самим пациентом, а также с медицинским персоналом, участвующим в его лечении, определяются как «не подлежащие реанимации». Законодательная основа и алгоритмы этого процесса различаются в разных странах. Пациенты, остановка кровообращения у которых развилась в отсутствие свидетелей и, соответственно, СЛР и дефибриляция у них проводится с задержкой, имеют мрачный прогноз и в большинстве случаев погибают.
Терапия остановки сердца без дефибрилятора.
Очевидно, что при отсутствии возможности проведения дефибриляции, терапия остановки менее успешна, однако лечение причины, приведшей к ней, обеспечивает большие шансы на выживание пациента. До установления причины остановки сердца (например, гиповолемии) и ее терапии должна быть начата СЛР и вводиться адреналин.
Другая антиаритмическая терапия.
Тогда как дефибриляция остается основной мерой терапии, может также использоваться широкий спектр антиаритмических препаратов. Их применение возможно при наличии персистирующей, угрожающей жизни аритмии для снижения порога чувствительности к успешной дефибриляции или как мера профилактики дальнейших нарушений ритма.
Каждый препарат обладает специфическими показаниями, но большинство из них имеют отрицательный инотропный эффект – очевидный негативный эффект при реанимации. Наиболее часто используемыми из них являются бретилий, амиодарон и сульфат магния. Их эффективность не подтверждена клиническими исследованиями.
Лидокаин. Обладает антиаритмическими свойствами вследствие вызываемой им блокады натриевых каналов и стабилизации клеточной мембраны. Подавляется синусный автоматизм и проводимость в левом желудочке. Имеется также незначительное действие на атриовентрикулярный узел. Миокардиодепрессивное и проаритмическое действия минимальны.
Лидокаин применяется для лечения желудочковой тахикардии. Способность лидокаина увеличивать шансы успешной дефибриляции при персистирующей фибриляции желудочков неоднозначна, однако препарат применяется, если неоднократная дефибриляция безуспешна. Лидокаин может использоваться при гемодинамически стабильной желудочковой тахикардии.
Доза лидокаина при рефрактерной фибриляции желудочков – 100 мг в/в, а при гемодинамически стабильной желудочковой тахикардии – 1 мг/кг в/в – доза, которая при необходимости вводится однократно повторно. В дальнейшем начинается постоянная инфузия лидокаина 4мг/мин втечение получаса, 2 мг/мин втечение 2 часов, а затем 1 мг/мин.
Амиодарон вызывает блокаду калиевых каналов с незначительным замедлением натрий-зависимой деполяризации, удлинением потенциала действия и некоторой блокадой бета-адренорецепторов. Это объясняет антиаритмическое действие и снижение порога чувствительности к дефибриляции при минимальном влиянии на сократимость миокарда.
Амиодарон используется рутинно и является препаратом второй линии для лечения тахиаритмий, возникающих при остановке сердца. Его предпочтительно медленно вводить в центральную вену. Обычно применяется нагрузочная доза 300 мг в/в с последующей постоянной инфузией 900 мг в 1000 мл 5% глюкоза втечение 24 часов. При необходимости первая доза 300 мг может вводиться втечение 5-15 минут с последующими 300 мг за 1 час.
Бретилия тозилат стабилизирует продолжительность потенциала действия во всем миокарде. Это повышает резистентность к желудочковой тахикардии и снижает порог чувствительности к дефибриляции. Однако действие его наступает медленно (15-20 мин), а также имеется тенденция к возникновению непродуктивной электрической активности и более выраженной гипотензии после восстановления ритма.
Сульфат магния является важным фактором для стабилизации кардиомиоцитов. Пониженная его внутриклеточная концентрация стимулирует возбуждение кардиомиоцита, однако, при его нормальной концентрации болюсное введение сульфата магния подавляет эктопические очаги в миокарде желудочков. Исследований по использованию сульфата магния при остановке сердца не проводилось, однако он может применяться в дозе 10 мл 50% р-ра при остановке, развившейся на фоне гипокалиемии.
Кальций имеет специфические показания для неотложной помощи при гиперкалиемии или при таком редком состоянии, как передозировка блокаторов Са 2+ каналов (например, верапамила). Несмотря на важную роль кальция в механизме возникновения потенциала действия, а также сокращения миокарда, его введение по различным причинам может быть неэффективным, а иногда и опасным, так как его высокая внутриклеточная концентрация обладает разрушающим действием на поврежденные миокардиоциты и нейроны. Однако при концентрации калия в крови более 6 ммоль/л следует ввести 10 мл 10% хлорида кальция.
В практике, вследствие незначительного действия отдельных препаратов на сократимость миокарда применяется широкий спектр антиаритмических средств, однако их сочетанное применение может обладать опасным кумулятивным эффектом даже при условии восстановления эффективного ритма.
Нарушения ритма, в случае успешной реанимации, остаются вероятным ее последствием. В настоящей статье рассмотрена терапия брадиаритмий, а также тахикардий с узким и широким комплексом.
Причиной чего может явиться остановка сердца и прекращение дыхания
12.1. Асфиксия. Определение. Виды
Асфиксия (asphyxia; греческое а- отрицание + phyxis пульс) – это патологическое состояние нарастающего удушья, характеризующееся резким недостатком кислорода и избытком углекислоты в организме.
Асфиксия достаточно часто осложняет различные формы патологии инфекционной и неинфекционной природы. В связи с тем фактом, что запасы кислорода в организме незначительны (2-2,5 литра), этого объема достаточно только для обеспечения жизни человека в течение нескольких минут. В то же время, как известно, за 1 минуту потребляется 6-8 литров воздуха.
В зависимости от причин возникновения и механизмов развития различают внутриутробную, первичную и вторичную асфиксии. К внутриутробным и первичным относятся асфиксии плода и новорожденного. Вторичные асфиксии включают в себя следующие разновидности: механическую асфиксию, асфиксию от недостатка кислорода во вдыхаемом воздухе, асфиксию в результате поражения нервной системы, асфиксию, развивающуюся при длительных спастических состояниях, асфиксию рефлекторной природы, а также вторичную асфиксию новорожденного.
Механическая асфиксия наиболее часто встречается в клинической практике и составляет 28-30% всей насильственной смерти. Ежегодно в России регистрируется 40 000-60 000 случаев смерти от механической асфиксии из них 60% приходится на долю странгуляционной асфиксии и 25% составляет обтурационная асфиксия.
Механическая асфиксия – это вызванное механическими причинами нарушение внешнего дыхания, приводящее к затруднению или полному прекращению поступления в организм кислорода и накоплению в нем углекислоты.
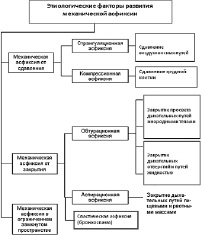
В зависимости от этиологического фактора выделяют следующие виды механической асфиксии (рис. 14):
Рис.14. Инициирующие факторы развития механической асфиксии
Странгуляционная асфиксия, возникает при сдавлении органов дыхания на шее. На фоне нарушения дыхания развивается повышенное внутричерепное давление из-за прекращения оттока крови по сдавленным яремным венам. Хотя сонные артерии также сдавлены, приток крови к головному мозгу осуществляется по позвоночным артериям, идущим через поперечные отростки позвонков. Поэтому цианоз, синюшность лица очень выражены. Следует учитывать, что в ряде случаев сдавления органов дыхания на шее активируются ваго-вагальные рефлексы возникает раздражение верхнее-гортанного и языкоглоточного нервов, а также симпатического ствола, что приводит к рефлекторной остановке сердца и дыхания.
Компрессионная асфиксия, возникающая от сдавления груди и живота. Сильное сдавление легких сопровождается резким ограничением дыхания. Одновременно сдавливается верхняя полая вена, осуществляющая отток крови от головы, шеи, верхних конечностей. Происходит резкое повышение давления и застой крови в венах головы и шеи. При этом возможны разрывы капилляров и мелких вен кожи, что обусловливает появление многочисленных точечных кровоизлияний. Лицо пострадавшего одутловатое, кожа лица и верхних отделов груди багровая, темно-фиолетовая, в тяжелых случаях почти черная (экхимотическая маска). Эта окраска имеет относительно четкую границу в верхней части туловища. В местах плотного прилегания одежды на шее и надключичных областях остаются полосы нормально окрашенной кожи. На коже груди и живота отмечаются полосовидные кровоизлияния в виде рельефа одежды, а также частицы материала, которым было сдавлено туловище.
Обтурационная (аспирационная) асфиксия, возникающая при попадании твердых или жидких веществ в дыхательные пути и их закупоривании. Закрытие просвета дыхательных путей имеет свои особенности, зависящие от свойств, размеров и положения инородного тела. Чаще всего твердые предметы закрывают просвет гортани, голосовую щель. При полном закрытии просвета выявляются признаки типичного развития асфиксии. Если размеры предмета небольшие, то нет полного перекрытия просвета дыхательных путей. При этом развивается быстрый отек слизистой гортани, являющийся вторичной причиной закрытия дыхательных путей. В ряде случаев небольшие предметы, раздражая слизистую гортани и трахеи, могут вызвать отек слизистой, рефлекторный спазм голосовой щели или рефлекторную остановку сердца. В последнем случае асфиксия не успевает полностью развиться, что будет констатироваться отсутствием ряда типичных признаков асфиксии. Таким образом, обнаружение инородного предмета в дыхательных путях является ведущим доказательством причины смерти.
Асфиксия в замкнутом и полузамкнутом пространстве. Этот тот вид механической асфиксии развивается в пространствах с полным или частичным отсутствием вентиляции, где происходит постепенное накопление углекислого газа и уменьшение кислорода. Патогенез данного состояния характеризуется сочетанием гиперкапнии, гипоксии, гипоксемии. Биологическая активность углекислого газа выше, чем кислорода. Повышение концентрации углекислоты до 3–5 % вызывает раздражение слизистых оболочек дыхательных путей и резкое учащение дыхания. Дальнейшее повышение концентрации углекислого газа до 8– 10 % приводит к развитию типичной асфиксии, без развития специфических морфологических изменений.
Независимо от особенностей патогенных факторов, инициирующих механическую асфиксию, различают следующие периоды ее развития.
Предасфиктический – длится до 1 мин, характеризуется наличием тахи- и гиперпноэ, гиперкапнии. В случаях, если препятствие не устранено, развивается следующий период.
Асфиктический – условно делится на несколько стадий, которые могут длиться от 1 до 3–5 мин:
1) стадия инспираторной одышки – характеризуется усиленными, следующими друг за другом вдыхательными движениями, активацией рефлекса Геринга-Брейера за счет возбуждения МАР рецепторов альвеол. В результате легкие сильно расширяются, возможны разрывы легочной ткани. Одновременно усиливается приток крови к легким, переполнение их кровью, образование кровоизлияний. Далее переполняется кровью правый желудочек и правое предсердие сердца, и развивается системная венозная гиперемия. Внешние проявления – синюшность кожи лица, мышечная слабость. Сознание сохраняется только в начале стадии;
2) стадия экспираторной одышки – усиленный выдох при участии рефлекса Геринга-Брейера происходит подавление активности бульбарных инспираторных нейронов и активация экспираторных нейронов, наблюдается уменьшение объема грудной клетки, возбуждение мускулатуры, непроизвольная дефекация, мочеиспускание, семяизвержение, повышение артериального давления, возникновение кровоизлияний. При двигательной активности возможно образование повреждений об окружающие предметы;
3) кратковременная остановка дыхания (обратимое апноэ на фазе экспирации) – отмечается падение артериального и венозного давления, расслабление мускулатуры;
4) терминальная стадия свидетельствует о гибели нейронов дыхательного центра, характеризуется терминальным дыханием Куссмауля, апнейстическим или гаспинг-дыханием.
5) стойкая остановка дыхания наступает вследствие паралича дыхательного центра.
Общая продолжительность асфиксии (от ее начала до наступления смерти) также может колебаться в довольно широких пределах. При внезапном полном прекращении легочной вентиляции длительность асфиксии составляет не более 5—7 минут. В случаях постепенно развивающейся асфиксии (например, при дыхании в замкнутом пространстве или при неврологических заболеваниях) продолжительность асфиксии может быть значительно большей.
Имеются существенные возрастные различия чувствительности к асфиксии. Чем моложе животное, тем оно легче переносит асфиксию. Так, крысенок в возрасте 12 — 15 часов живет без доступа воздуха до 30 минут, шестидневный — около 15 минут, двадцатидневный — около 2 минут; взрослый человек — 3—6 минут, тогда как новорожденный — 10—15 минут.
Клиническая картина асфиксии зависит от степени гипоксии и гиперкапнии. Выделяют легкую, средней тяжести и тяжелую формы.
Асфиксия от недостатка кислорода во вдыхаемом воздухе может наблюдаться при высотной болезни, в специфических производственных условиях, связанных с пребыванием в замкнутых системах с принудительной подачей газовой смеси в тех случаях, когда нарушается подача кислорода и поглощение углекислого газа; асфиксия возникает при пребывании в изолированном замкнутом пространстве, когда происходит постепенное падение содержания кислорода в воздухе и прогрессирующее нарастание концентрации углекислого газа. Характерные для асфиксии расстройства жизнедеятельности развиваются в таких случаях вначале на фоне нормальной или даже увеличенной легочной вентиляции. В дальнейшем деятельность дыхательного центра нарушается, объем вентиляции падает, и асфиксия приобретает обычное течение.
Асфиксия в результате поражения нервной системы обусловлена расстройствами вентиляции при параличах дыхательной мускулатуры. Последние, как известно, могут быть центральными или периферическими, возникать при поражении двигательной зоны КГМ, пирамидных трактов, при параличах дыхательной мускулатуры возникающих в результате нарушений проводимости нервно-мышечных синапсов (отравление курареподобными средствами, действие бактериальных токсинов, отравляющих веществ), множественных невритов, распространенного поражения мотонейронов спинного мозга в шейных и грудных сегментах при травмах, полиомиелите и других инфекционных и неинфекционных заболеваниях.
Одной из частых причин асфиксии являются грубые расстройства деятельности дыхательного центра, возникающие в результате его органических поражений различного характера, а также при интоксикациях, передозировке снотворных и наркотических средств и при гипоксии бульбарных структур, сопровождающейся энергетическим истощением нейронов дыхательного центра и ослаблением или полным прекращением их функции.
Асфиксия как следствие длительных спастических состояний, например при столбняке, отравлении стрихнином и другими ядами, вызывающими, судороги.
Рефлексогенная асфиксия. Наблюдается при раздражении рецепторов трахеи и бронхов различными газо- и парообразными химическими соединениями, дымом, частицами пыли, патологическим процессом (воспаление, опухоль), локализованным в легочной ткани или дыхательных путях. Возникающие при этом рефлекторные влияния на дыхательный центр дезорганизуют акт дыхания.
Асфиксия возникает и в тех случаях, когда дыхательные экскурсии вызывают стойкое болевое ощущение (при переломах ребер, патологических процессах в плевральной полости, межреберной невралгии).
12.2. Асфиксия плода и новорожденного является одной из наиболее распространённых патологий в родах является, которая может быть: внутриутробной (возникает во внутриутробный период); первичной (возникает в момент рождения, у 5-7% новорожденных ); вторичной (развивается в первые сутки жизни младенца).
В основе внутриутробной формы асфиксии лежит кислородное голодание плода. Причинами ее могут быть: нарушения маточно-плацентарного кровообращения (токсикоз беременных, патология плаценты), заболевания матери, сопровождающиеся кислородным голоданием (сердечно-сосудистая и легочная патология, острая кровопотеря, шок), сдавление пуповины, длительный безводный период, затяжные и патологические роды. В результате наступившего кислородного голодания в крови плода накапливается избыточное количество углекислоты. Это приводит к возбуждению дыхательного центра, появлению преждевременных дыхательных движений, аспирации плодом околоплодной жидкости с последующей закупоркой дыхательных путей.
При длительном кислородном голодании в организме плода возникают глубокие метаболические, структурные и функциональные нарушения органов и систем: развивается ацидоз, появляются тяжелые расстройства кровообращения, кровоизлияния в мозг, легкие и другие органы. Первоначальное возбуждение дыхательного центра сменяется его параличом. В центральной нервной системе наступают необратимые изменения.
Нарушение сердечной деятельности плода проявляется в виде тахикардии или брадикардии, аритмии, глухости тонов. Поведение плода становится беспокойным, происходит расслабление сфинктера заднего прохода и околоплодные воды окрашиваются меконием. По мере нарастания асфиксии тоны сердца становятся редкими и глухими. Движения плода замедляются и затем полностью прекращаются. Исходом внутриутробной асфиксии может быть гибель плода до родов, во время родов или рождение ребенка в состоянии асфиксии.
Факторами риска развития первичной асфиксии являются внутриутробная гипоксия (острая или хроническая); внутричерепная родовая травма ребенка; иммунологическая несовместимость матери и плода; полная или частичная закупорка дыхательных путей ребенка околоплодными водами или слизью; экстрагенитальные заболевания матери во время беременности; патологическое течение беременности;аномалии родовой деятельности (патологически узкий таз матери, неправильное врезание головки плода, в некоторых случаях обвитие пуповиной).
Среди причин вторичной асфиксии выделяют: врожденную пневмонию у ребенка; нарушение мозгового кровообращения; попадание в дыхательные пути рвотных масс; нарушение работы центральной нервной системы малыша.