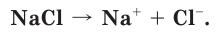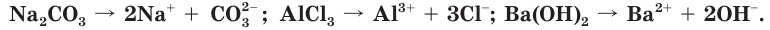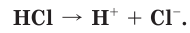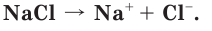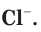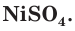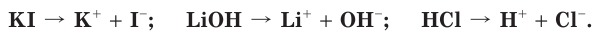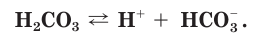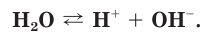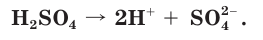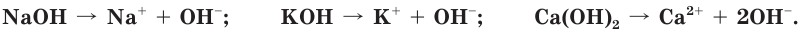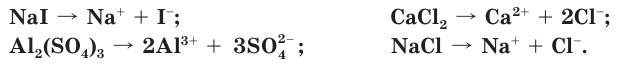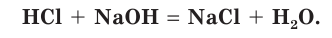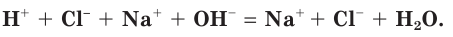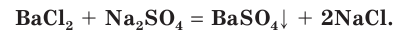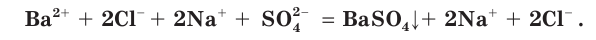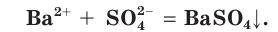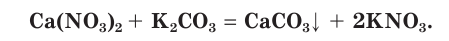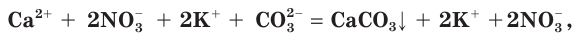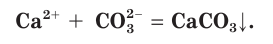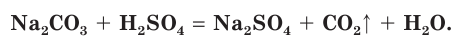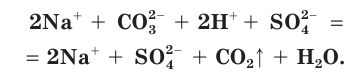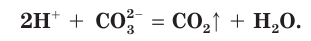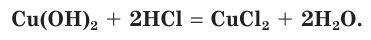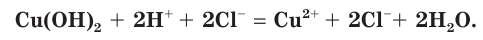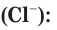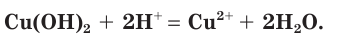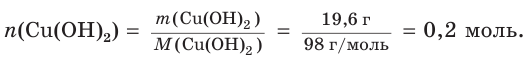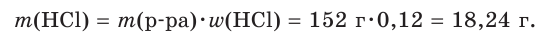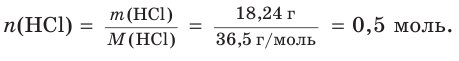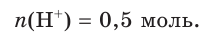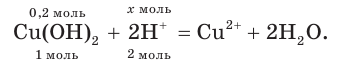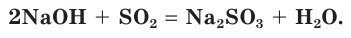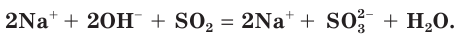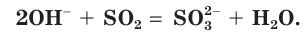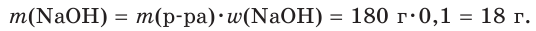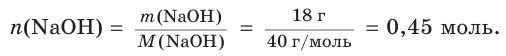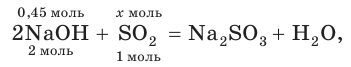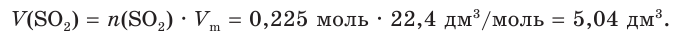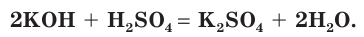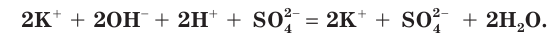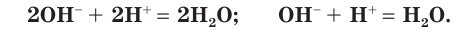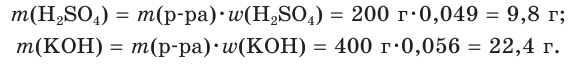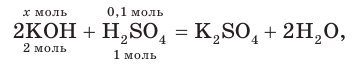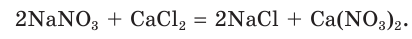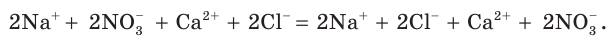Причина того что растворы электролитов проводят электрический ток
Причина того что растворы электролитов проводят электрический ток
Данный урок посвящен изучению темы «Электролитическая диссоциация». В процессе изучения этой темы Вы поймете суть некоторых удивительных фактов: почему растворы кислот, солей и щелочей проводят электрический ток; почему температура кипения раствора электролита выше по сравнению с раствором неэлектролита.
I. Понятие электролитическая диссоциация
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
Рис. 1. Схема распада на ионы хлорида натрия
Пронаблюдайте за следующим экспериментом: “Изучение электрической проводимости веществ”
II. Сущность процесса электролитической диссоциации. Теория ЭД
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современные положения теории электролитической диссоциации
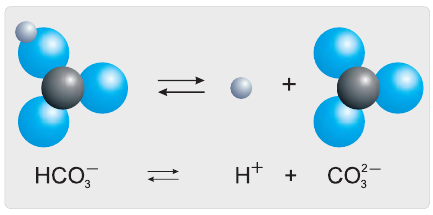
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
2. В растворах и расплавах электролиты проводят электрический ток.
Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток
Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток
Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания
Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью
В растворах и расплавах образуются ионы
В растворах и расплавах не образуются ионы
III. Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1. Молекула воды полярна и представляет собой диполь
Растворение в воде веществ с ионной химической связью
(на примере хлорида натрия – поваренной соли)
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде (рис. 2) состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na + и Сl – из кристалла в раствор происходит образование гидратов этих ионов.
Рис. 2. Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na + ; б – гидратация (окружение молекулами воды) ионов Na + и Сl –
Растворение в воде веществ с ковалентной сильнополярной химической связью
(на примере соляной кислоты)
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными (рис.3).
Рис. 3. Диссоциация молекул HCl на ионы в водном растворе
Основные положения:
Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении.
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов, обладающие положительным ( катионы ) или отрицательным ( анионы ) зарядом.
Ионы отличаются от атомов как по строению, так и по свойствам
Пример 1. Сравним свойства молекулярного водорода (состоит из двух нейтральных атомов водорода) со свойствами иона.
Пример 2. Сравним свойства атомарного и молекулярного хлора со свойствами иона.
+17Cl 0 1s 2 2s 2 2p 6 3s 2 3p 5
Атомы хлора имеют незавершённый внешний уровень, поэтому они химически очень активны, принимают электроны и восстанавливаются.
Именно поэтому газообразный хлор ядовит, при вдыхании его наступает отравление организма.
Ионы хлора имеют завершённый внешний уровень, поэтому они химически неактивны, находятся в устойчивом электронном состоянии.
Ионы хлора входят в состав поваренной соли, употребление в пищу которой не вызывает отравления организма.
1. Ионы отличаются от атомов и молекул по строению и свойствам;
2. Общий и характерный признак ионов – наличие электрических зарядов;
3. Растворы и расплавы электролитов проводят электрический ток из-за наличия в них ионов.
IV. Тренажеры
ЦОРы
Памятка (электролиты и неэлектролиты)
Электролитическая диссоциация
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.

Вещества, которые проводят электрический ток назвали электролитами, вещества, непроводящие ток – неэлектролиты. Электролиты делятся на сильные и слабые. Сильные хорошо проводят ток, лампочка горит ярко, слабые – плохо проводят ток, лампочка горит тускло, например, в растворе уксусной кислоты (см. рисунок).
В чем же причина электропроводности? Почему одни вещества проводят электрический ток, а другие нет?
Электрический ток – это направленно движение заряженных частиц под действием разности потенциалов. Электрический ток в металлах осуществляется за счет электронов, именно электроны являются носителями заряда. А в растворах и расплавах заряд переносят ионы. Вещества, которые распадаются на ионы в растворе или расплаве и проводят электрический ток называются электролитами.
Запомнить! Электролиты – вещества, которые проводят электрический ток в растворах. Электролиты в растворах распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам. Это и есть причина электрического тока в растворах.
Химическая связь в электролитах — ионная или ковалентная сильнополярная (соли, кислоты, основания).
Неэлектролиты – вещества, которые не проводят электрический ток в растворах. Связь в таких веществах — ковалентная неполярная и слабополярная. При растворении они образуют не ионы, а молекулы, которые не способны переносить электрический ток, например, органические вещества (сахароза, бензин, спирт).
Теория электролитической диссоциации была сформулирована Сванте Аррениусом в 1887 году, но актуальна и по сей день. Основные положения этой теории:
Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации.
В зависимости от значения степени диссоциации, электролиты можно разделить на сильные, средние и слабые.
Сильные электролиты имеют степень диссоциации α > 30%, средние от 3 – 30%, а слабые – меньше 3%.
К сильным относят все раств. соли, все щелочи и некоторые кислоты. В растворе эти соединения практически полностью распадаются на ионы.
При написании уравнений диссоциации помните, что суммарный заряд катионов и анионов должен быть равен нулю.
Эти реакции распада на ионы протекают необратимо (только в одну сторону), ионы обратно не соединяются в кристаллическую решетку, препятствуют молекулы воды, окружающие эти ионы (гидратные оболочки).
К электролиам средней силы относят гидроксид магния, сернистую и фосфорную кислоты.
К слабым электролитам, которые лишь частично распадаются на ионы, α Опубликовано admin в 15:59
Содержание:
Электролиты и неэлектролиты:
Еще в начале XIX в. ученые сделали важное наблюдение: электрический ток могут проводить не только металлы, но и растворы многих веществ, например уксусной кислоты, поваренной соли и др.
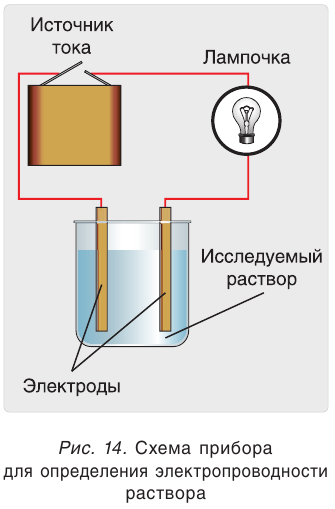
Электропроводность раствора можно установить с помощью прибора, изображенного на рисунке 14. Два электрода помещают в раствор и соединяют с источником тока. Если раствор проводит электрический ток, то цепь замыкается, о чем свидетельствуют показание вольтметра или загоревшаяся лампочка.
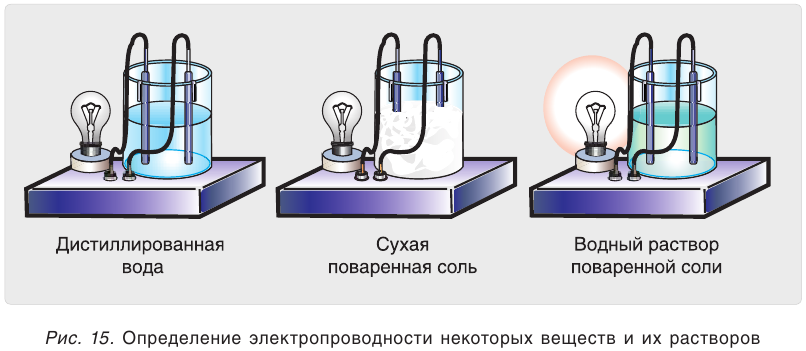
При погружении электродов в дистиллированную воду лампочка не загорается. Чистая вода не проводит электрический ток (рис. 15). Не проводит ток и сухая поваренная соль NaCl, если в нее погрузить электроды. Водный раствор этой же соли проводит электрический ток. Можно сделать вывод, что в растворе имеются носители электрического тока — заряженные частицы (ионы). Точно так же ведут себя в растворах и другие соли, а также щёлочи и кислоты. Безводные
кислоты — очень плохие проводники электрического тока, но водные растворы многих кислот являются хорошими проводниками. Электропроводными являются также расплавы ионных соединений — солей и щелочей.
Исследуем электропроводность растворов и таких веществ, как сахароза, глюкоза, спирт. Мы видим, что лампочка в приборе не загорается. Следовательно, водные растворы этих веществ не проводят электрический ток. Это объясняется тем, что такие вещества состоят из молекул, которые переходят в раствор, не распадаясь на ионы.
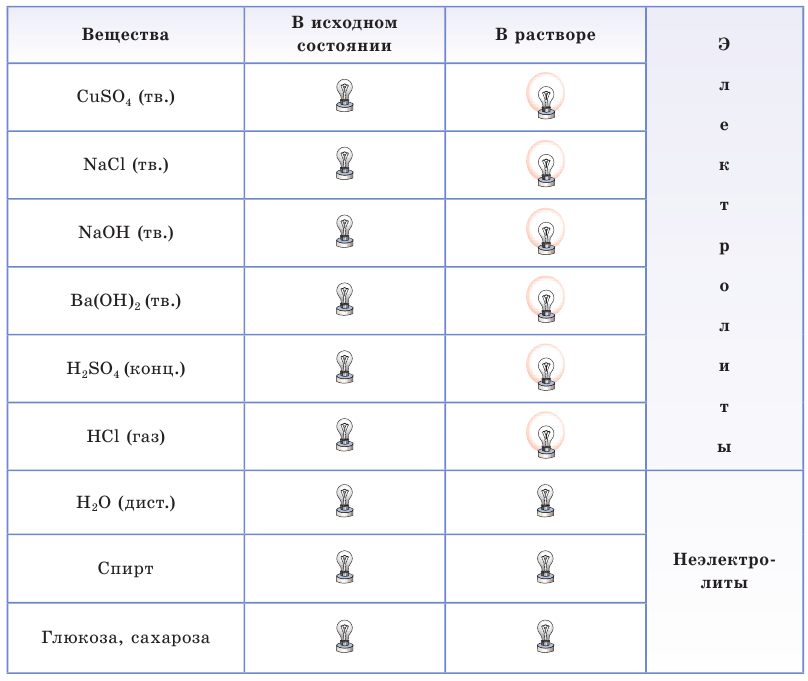
Результаты испытаний электропроводности веществ в исходном (твердом, жидком или газообразном) состоянии и их водных растворов отражены в таблице 10.
Таблица10. Электропроводность некоторых веществ и их растворов
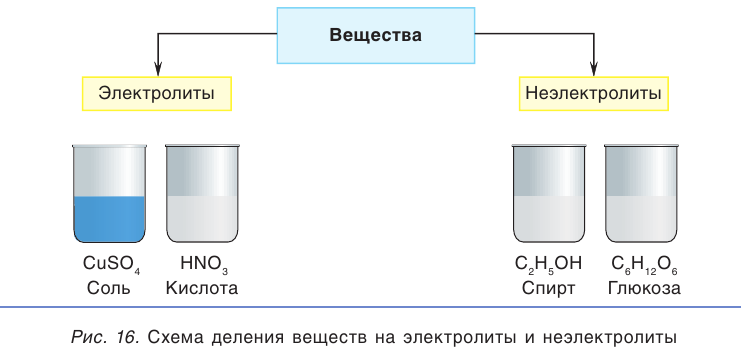
Известный английский физик Майкл Фарадей предложил разделить все вещества в зависимости от их способности проводить ток в растворенном или расплавленном состоянии на электролиты и неэлектролиты (рис. 16). Термин «электролит» происходит от греческого слова литос — растворенный (разложенный).
Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами.
К электролитам относятся соединения с ионным типом связи. Это соли 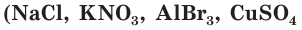

Электролитами являются и многие кислоты — вещества, образованные молекулами с ковалентными полярными связями 

Вещества, водные растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Неэлектролитами является большинство органических веществ, таких как сахароза, спирт, глицерин, простые вещества неметаллов и др. Они существуют в виде неполярных или малополярных молекул, которые при растворении в воде распределяются между ее молекулами.
По способности проводить электрический ток в растворах и расплавах вещества делятся на электролиты и неэлектролиты.
Электролиты — это вещества, водные растворы или расплавы которых проводят электрический ток.
Электролитами являются ионные соединения (основания, соли) и большинство кислот.
Электролитическая диссоциация веществ
Почему растворы и расплавы электролитов проводят электрический ток? Для ответа на этот вопрос шведский ученый Сванте Аррениус в 1887 г. детально изучил поведение веществ в водных растворах и выдвинул теорию, которая получила название теории электролитической диссоциации. Термин «диссоциация» происходит от латинского слова dissociatio — разъединение, распад.
Теория электролитической диссоциации
Электрический ток — это направленное движение заряженных частиц. Какие же частицы являются носителями электрического тока в растворах? В результате многочисленных экспериментов Аррениус установил, что растворы электролитов содержат больше частиц, чем их было в исходном веществе. Например, если в воде растворить хлороводород химическим количеством 1 моль, в растворе суммарное число частиц будет 2 моль, а 1 моль хлорида алюминия образует 4 моль частиц. Учитывая, что кристаллы хлорида алюминия имеют ионное строение, мы можем утверждать, что ионы алюминия и хлорид-ионы в воде переходят в раствор. Объяснения этих наблюдений явились основой теории электролитической диссоциации. Согласно этой теории, при растворении в воде или при расплавлении электролиты распадаются (диссоциируют) на ионы — положительно и отрицательно заряженные частицы.
Электролитическая диссоциация — это распад электролитов на ионы в водных растворах или расплавах.
При диссоциации электролитов образуются как простые ионы, состоящие из одного атома 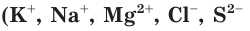
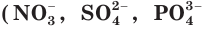
Обратите внимание:
При обозначении заряда иона справа вверху от его формулы сначала записывают цифру, а потом знак + или –. При обозначении же степени окисления атома, как вы уже знаете, над символом элемента сначала записывается знак + или –, а потом — число.
Для обозначения заряженных частиц Аррениус использовал термин «ион», предложенный ранее М. Фарадеем. Слово «ион» в переводе с греческого означает «движущийся, идущий, странствующий». В растворах ионы непрерывно перемещаются («странствуют») в различных направлениях.
Главной причиной электролитической диссоциации в водных растворах является взаимодействие электролитов с молекулами воды. Такое взаимодействие называется гидратацией.
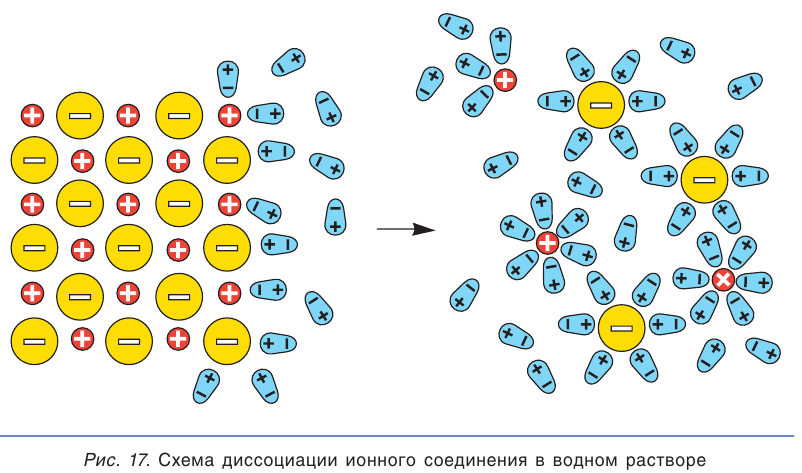
При погружении кристалла ионного соединения в воду полярные молекулы воды (диполи) притягиваются к ионам, находящимся на поверхности кристалла: отрицательными полюсами — к положительно заряженным ионам, а положительными полюсами — к отрицательно заряженным. Под действием молекул воды ионы отрываются от кристалла и переходят в раствор. При этом каждый отдельный ион оказывается окруженным диполями воды (рис. 17). Такие ионы называются гидратированными ионами.
Процесс электролитической диссоциации изображают химическим уравнением, в котором вместо знака равенства пишут либо одну, либо две противоположно направленные стрелки 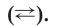
При составлении уравнений электролитической диссоциации руководствуются следующими правилами. В левой части уравнения записывают формулу вещества-электролита, а в правой — формулы ионов, на которые распадается электролит. Их число указывают с помощью коэффициентов:
Обратите внимание: сложные ионы, например 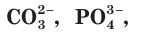
В молекулах с ковалентной связью ионов нет. Если в веществе ковалентная связь является малополярной, то при его растворении в воде разрываются только слабые связи между молекулами, а сами молекулы вещества остаются целыми, т. е. не распадаются на ионы и равномерно распределяются по всему объему раствора. Но что происходит при растворении в воде веществ с сильно полярной ковалентной связью, например газа хлороводорода HCl?
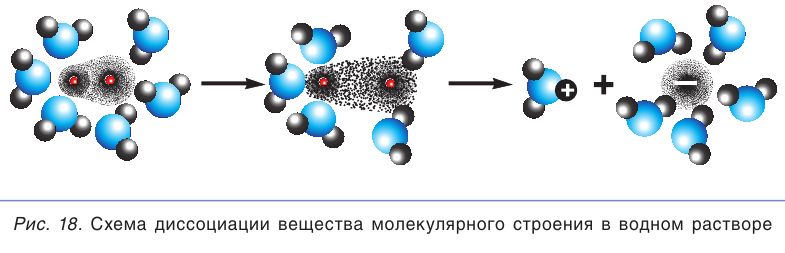
Когда полярная молекула хлороводорода попадает в воду, к той ее части, где сосредоточен положительный заряд, молекулы воды притягиваются своими отрицательными полюсами. К той части молекулы HCl, которая заряжена отрицательно, молекулы воды притягиваются положительными полюсами. В результате под действием диполей воды ковалентная полярная связь в молекуле хлороводорода разрывается с образованием гидратированных ионов водорода и хлора, которые переходят в раствор (рис. 18):
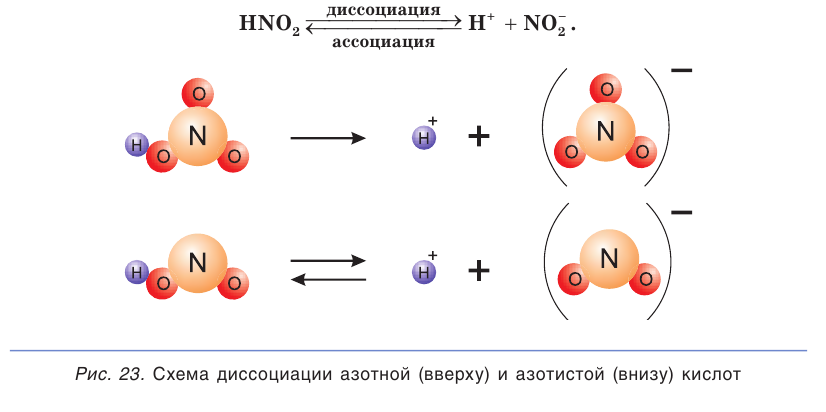
Диссоциация молекул других кислот (иодоводородной, азотной, серной и др.) протекает в водных растворах сходным образом.
Если атомы в молекулах растворяемых веществ связаны ковалентной малополярной или неполярной связью, то эти вещества в водных растворах не распадаются на ионы. Поэтому такие вещества являются неэлектролитами.
Следовательно, электролитами могут быть только вещества с ионной и ковалентной полярной связью.
Ионы в растворах электролитов
Ионы, образующиеся в процессе диссоциации электролитов в водных растворах, отличаются по своим свойствам от соответствующих нейтральных атомов и молекул.
Как вы уже знаете, при растворении поваренной соли в воде, содержащиеся в ее кристаллах ионы натрия и хлора переходят в раствор:
Сравним свойства атома и иона натрия. Общим, одинаковым в этих частицах является заряд ядра, равный 11+. Отличаются же они строением электронных оболочек, а следовательно, и свойствами (табл. 11).
Таблица 11. Отличия атомов натрия от ионов
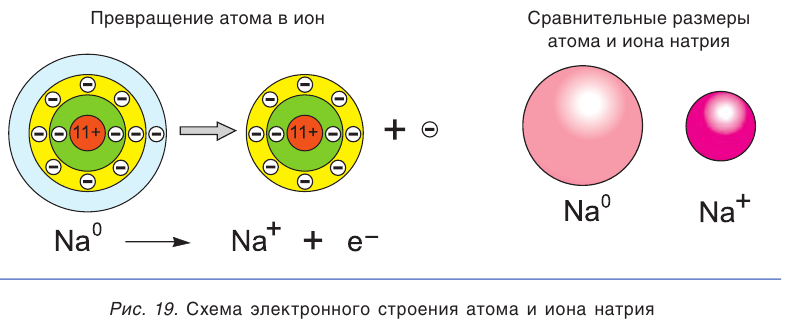
Высокая химическая активность натрия обусловлена тем, что у его атома на внешнем электронном слое находится всего один электрон. При взаимодействии с другими атомами атом натрия отдает этот электрон и превращается в гораздо более устойчивую частицу — ион Na + (рис. 19). Так, атомы натрия взаимодействуют с водой, вытесняя из нее водород, а при растворении поваренной соли в воде водород не выделяется.
Таблица 12. Отличия атомов хлора от ионов
Химическая активность атома хлора связана с нехваткой одного электрона на внешнем электронном слое для его завершения (рис. 20). Этот электрон атом хлора присоединяет при взаимодействии с атомами металлов, превращаясь при этом в устойчивый ион хлора
Атомы хлора Cl могут соединяться друг с другом ковалентной неполярной связью, образуя молекулу 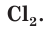
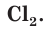
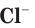
Аналогичным образом различаются свойства атомов водорода H, молекулярного водорода 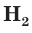

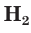
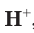
Таким образом, различия в свойствах атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц.
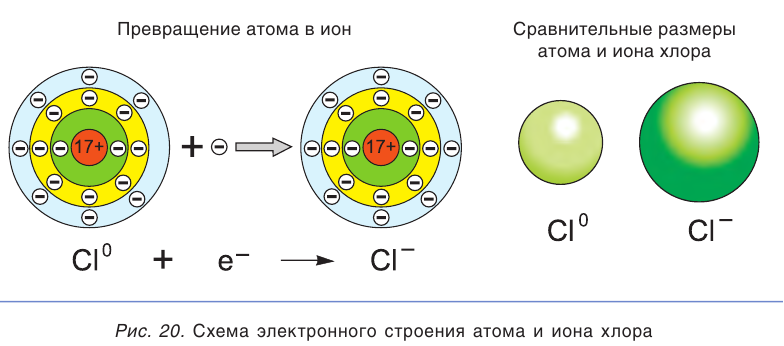
В растворе ионы находятся в хаотическом движении. Но если опустить в раствор электролита электроды и подать на них электрическое напряжение, то ионы приобретают направленное движение: положительно заряженные ионы перемещаются к катоду (отрицательно заряженному электроду), а отрицательно заряженные ионы — к аноду (положительно заряженному электроду) (рис. 21). Поэтому положительно заряженные ионы получили название катионы, а отрицательно заряженные — анионы. Следы движения окрашенных ионов (например, 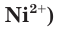
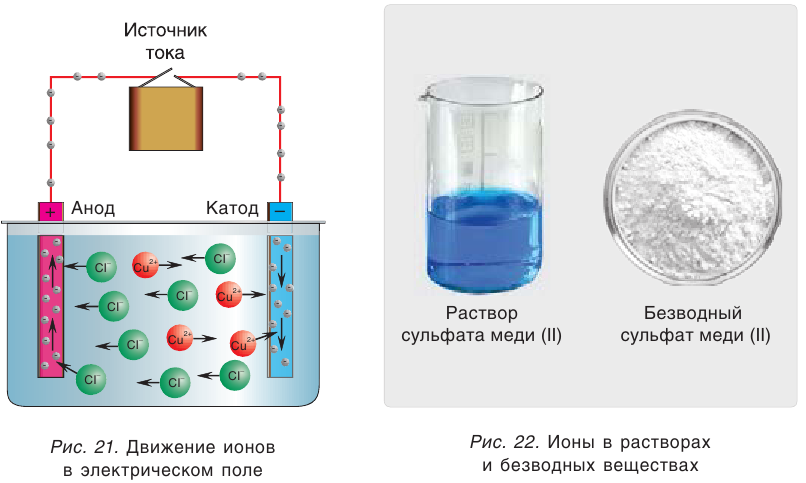
Свойства ионов в растворах во многом отличаются и от свойств этих же ионов в безводных веществах. Так, например, катионы меди 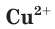
В состав большинства минеральных вод, которые продаются в наших магазинах, входят катионы натрия, кальция, магния, хлорид-анионы, сульфат-анионы, гидрокарбонат-анионы.
Сильные и слабые электролиты
Все ли электролиты диссоциируют одинаково? Каждое вещество обладает определенными свойствами и, возможно, процесс диссоциации разных веществ протекает в различной степени. Действительно, если сравнить электропроводность растворов хлороводородной и угольной кислот, то оказывается, что при их одинаковой молярной концентрации раствор хлороводорода обладает большей электропроводностью. Следовательно, в растворе хлороводородной кислоты больше заряженных частиц (ионов), т. е. молекулы НСl диссоциируют лучше.
В зависимости от способности к диссоциации все электролиты условно делят на две группы — сильные и слабые. К сильным электролитам относятся вещества, которые при растворении практически полностью диссоциируют на ионы. Это почти все соли, щёлочи 
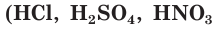
При растворении ионного соединения его кристаллическая структура разрушается под действием молекул воды, в результате чего в растворе образуются гидратированные ионы (см. рис. 17). Поэтому все растворимые ионные соединения в растворах находятся в виде ионов.
Вещества молекулярного строения с ковалентной полярной связью также способны распадаться на ионы в водных растворах (см. рис. 18). Полярные молекулы воды усиливают полярность молекулы электролита, превращая ее практически в ионную структуру с последующим распадом на ионы. Диссоциация полярных молекул может быть полной или частичной в зависимости от степени полярности связей в молекуле.
К слабым электролитам относятся вещества, при растворении диссоциирующие на ионы в незначительной степени. Это, например, такие кислоты как 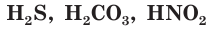
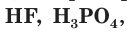

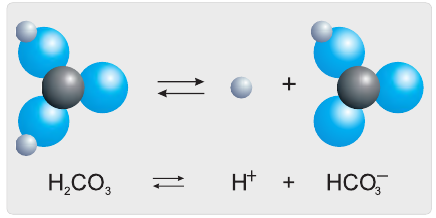
Разберем более подробно процесс диссоциации слабой двухосновной угольной кислоты 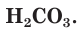
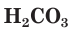
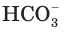
Анионы 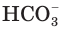

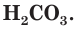
На второй ступени гидрокарбонат-ионы обратимо диссоциируют с образованием катионов водорода и карбонат-анионов (рис. 25):
Как правило, на второй ступени диссоциация происходит гораздо слабее.
Кроме слабых кислот, к слабым электролитам относятся также малорастворимые основания, например 
Чистая вода является очень слабым электролитом и незначительно диссоциирует на ионы водорода и гидроксид-ионы:
Содержание ионов 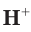

С количественными характеристиками способности веществ к диссоциации вы познакомитесь при дальнейшем изучении химии.
Электролитическая диссоциация кислот, оснований и солей
Вы уже знаете, что химические вещества делятся на классы — оксиды, кислоты, основания, соли. Как ведут себя в водных растворах вещества этих классов?
Вспомните отношение оксидов к воде. Основные оксиды активных металлов взаимодействуют с водой с образованием щелочей. Кислотные оксиды в результате растворения в воде образуют кислоты. Таким образом, основные и кислотные оксиды не являются электролитами и при контакте с водой не распадаются на ионы, а реагируют с ней. Электролитами являются кислоты, щёлочи и соли.
Водные растворы кислот имеют некоторые общие свойства. Для них характерны кислый вкус, способность окрашивать лакмус в красный цвет, взаимодействовать с некоторыми металлами с выделением водорода, а также с основными оксидами и основаниями. Точно также некоторые общие свойства имеют водные растворы всех щелочей: они мыльные на ощупь, окрашивают лакмус в синий цвет, способны реагировать с кислотными оксидами, кислотами. Водные растворы солей одной и той же кислоты или солей одного и того же металла также имеют общность свойств. Основная причина общности свойств растворов таких электролитов определяется однотипностью процессов их диссоциации.
Диссоциация кислот
Кислоты диссоциируют в водных растворах на ионы водорода H + и анион кислотного остатка, например:
Как вы уже знаете, молекулы кислот могут содержать разное количество атомов водорода. Число атомов водорода в молекуле кислоты, способное замещаться атомами металла с образованием соли, определяет основность кислоты. Так, например, 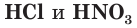
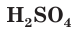
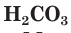
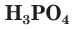
Многоосновные сильные кислоты диссоциируют ступенчато. Однако, поскольку при этом атомы водорода, превращаясь в ионы, уходят в раствор практически одновременно, диссоциацию таких кислот записывают одним уравнением:
Диссоциация многоосновных слабых кислот протекает сложнее, чем сильных. Например, слабые двухосновные кислоты частично диссоциируют только по первой ступени: 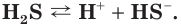

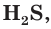
Таким образом, в растворах всех кислот содержатся ионы водорода 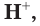
У газа хлороводорода HCl, так же как и у безводной серной кислоты, кислотные свойства отсутствуют. Эти свойства проявляются только в водных растворах указанных веществ, так как в процессе их диссоциации образуются ионы водорода, которые и определяют кислотный характер растворов. Следовательно, можно дать такое определение кислот.
Кислоты — это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Первое определение кислот в химии было предложено Р. Бойлем (1627—1691). Кислотами он называл вещества, которые реагировали с содой с выделением газа и окрашивали фиолетовые цветки фиалки в красный цвет. Позже он исследовал отвары, спиртовые вытяжки, соки других растений и установил, что щёлочи также меняют их окраску.
Диссоциация оснований
Растворимые в воде основания называются щелочами. В результате диссоциации щелочей образуются катионы металлов и гидроксид-ионы:
Мыльность растворов, способность окрашивать индикаторы, их едкое действие — результат присутствия в водном растворе гидроксид-ионов 
Основания — это электролиты, при диссоциации которых в водных растворах в качестве анионов образуются только гидроксид-ионы.
Вместе с тем и кислоты, и основания обладают индивидуальными свойствами, зависящими от природы аниона или катиона соответственно. Некоторые свойства серной кислоты и ее солей (например, образование осадка с раствором хлорида бария) обусловлены свойствами ее аниона 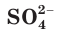
Диссоциация солей
Соли — это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков:
Свойства растворов солей также обусловлены свойствами всех ионов, которые образуются в процессе диссоциации.
Раствор, в котором находятся одинаковые количества ионов 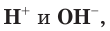


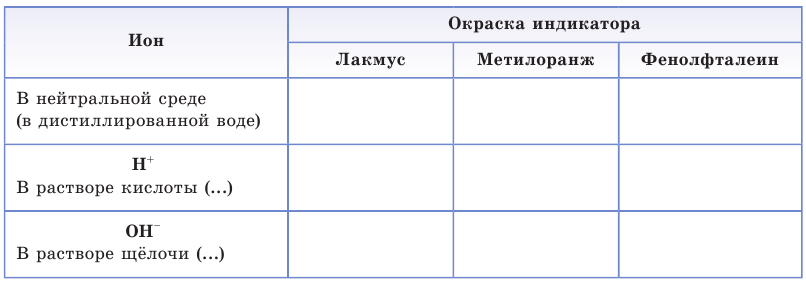
Таблица 13. Характеристика среды растворов
Определить среду раствора — это значит обнаружить в нем ионы 
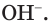
Лабораторный опыт 1
Обнаружение катионов водорода и гидроксид-анионов в растворах
Обнаружение ионов, обеспечивающих кислую или щелочную среду в растворах, имеет большое значение в лабораторной практике, медицине, промышленности и в быту.
1. Обратите внимание на окраску лакмуса, метилоранжа и фенолфталеина в нейтральной среде — водном растворе или на полоске универсальной индикаторной бумаги. Занесите результаты ваших наблюдений в таблицу.
2. Налейте в две пробирки раствор серной кислоты (или хлороводородной кислоты) и добавьте в одну пробирку 1—2 капли лакмуса (или метилоранжа), а во вторую 2—3 капли фенолфталеина. Обратите внимание на изменение окраски индикатора.
3. В пробирку с раствором гидроксида натрия добавьте 2—3 капли фенолфталеина. Появление малиновой окраски свидетельствует о наличии в растворе гидроксид-ионов.
Повторите опыт по обнаружению гидроксид-ионов в растворе щёлочи при помощи лакмуса или метилоранжа. Результаты опытов оформите в виде таблицы:
Как вы думаете, в какой цвет окрасится капля лакмуса, если ее поместить на срез лимона?
Растворы кислот, щелочей, ряда солей опасны для человека. Растворы многих кислот, попадая на кожу, в глаза, могут вызвать ожоги. Чем сильнее кислота, тем тяжелее ожог. Также опасны и вызывают химические ожоги щёлочи, содержащие гидроксид-ионы. Это свойство отражено в устаревших названиях щелочей, например «едкий натр» (NaOH), «едкое кали» (KOH) (рис. 28). Ионы, входящие в состав солей, также не безопасны для человека. Например, к сильным ядам относятся соли, содержащие катионы свинца, ртути и др.
Реакции ионного обмена
Познакомившись с диссоциацией солей, кислот и щелочей, мы узнали, что сильные электролиты существуют в растворах только в виде ионов. Следовательно, все реакции, которые происходят между электролитами в растворах, являются реакциями между ионами и называются ионными реакциями.
Ионными реакциями называются реакции, протекающие в водных растворах с участием ионов электролитов.
Многие реакции, протекающие в растворах, относятся к реакциям обмена. Напомним, что к этому типу относятся реакции между сложными веществами, в результате которых эти вещества обмениваются своими составными частями. Такими составными частями веществ в электролитах являются ионы.
Реакции ионного обмена в растворах электролитов протекают только в том случае, если в результате взаимодействия между ионами образуются малодиссоциирующие (вода или другие слабые электролиты), нерастворимые (осадки) и газообразные вещества.
Реакция ионного обмена, сопровождающаяся образованием слабого электролита (воды)
Вы уже знаете, что реакция между кислотой и основанием называется реакцией нейтрализации. В результате такого процесса образуются соль и вода:
Уравнение реакции, записанное в такой форме, обычно называют молекулярным (или уравнением в молекулярной форме). Молекулярным уравнением может изображаться любая реакция.
За ходом нейтрализации удобно следить с помощью индикатора, изменение окраски которого свидетельствует об окончании реакции между кислотой и щёлочью.
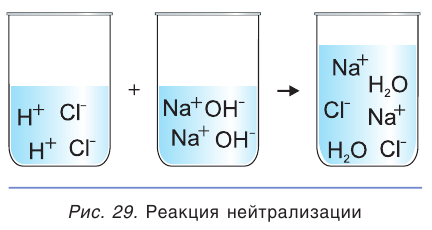
Три из четырех участников рассматриваемой реакции (HCl, NaOH и NaCl) являются сильными электролитами, т. е. находятся в растворе в виде ионов (рис. 29). Вода — слабый электролит, практически не диссоциирующий на ионы. Поэтому ионное уравнение данной реакции можно записать следующим образом:
Такая запись процесса называется полным ионным уравнением. В ионном уравнении все сильные электролиты записываются в виде формул их ионов. Твердые, плохо растворимые, газообразные вещества и слабые электролиты (включая воду) записываются в виде их молекулярных формул.
Если в правой и левой частях полного ионного уравнения исключить (сократить) одинаковые по химическому составу и числу ионы 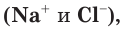
В левой части уравнения такого вида обычно сначала записывается катион, а потом — анион. Уравнение показывает, что реакция нейтрализации сводится к взаимодействию ионов водорода с гидроксид-ионами с образованием малодиссоциирующего вещества, каким является вода.
Составьте самостоятельно все три формы уравнений реакции нейтрализации между азотной кислотой и гидроксидом калия. Вы видите, что любая реакция между сильной кислотой и щёлочью сводится к взаимодействию ионов водорода с гидроксид-ионами. Поэтому одно и то же сокращенное ионное уравнение может описывать несколько реакций ионного обмена с участием различных веществ, и ему будут соответствовать несколько уравнений в молекулярном виде.
Реакции ионного обмена, сопровождающиеся образованием осадков
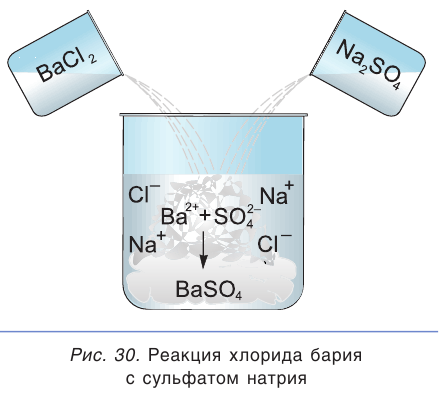
Взаимодействие между водными растворами сульфата натрия 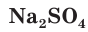
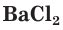
Полное ионное уравнение такой реакции имеет вид:
Если в этом уравнении исключить одинаковые ионы в правой и левой частях (это означает, что такие ионы не участвуют в процессе!), то получим уравнение в сокращенном ионном виде:
Это уравнение показывает, что при взаимодействии раствора сульфата натрия с раствором хлорида бария происходит связывание ионов бария 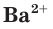
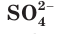
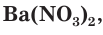
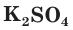
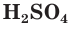
При составлении уравнений реакций обмена с образованием осадка необходимо пользоваться таблицей растворимости (см. форзац II), в которой указана растворимость электролитов в воде.
Например, необходимо определить, будет ли выпадать осадок при смешивании растворов нитрата кальция 
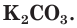
Для определения растворимости карбоната кальция 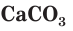
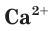
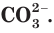
Аналогичным образом определяем, что нитрат калия 
а в сокращенном ионном виде:
(Прочерк в таблице растворимости означает, что вещество не существует или разлагается водой.)
Реакции ионного обмена, сопровождающиеся выделением газов
Связывание ионов приводит и к образованию газообразного продукта, выделяющегося из раствора.
Например, если к раствору соды 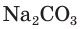
В полной ионной форме это уравнение записывается следующим образом:
Сокращенное ионное уравнение реакции в этом случае такое:
Таким образом, реакции ионного обмена в растворах электролитов протекают полностью («до конца»), если соблюдается одно из следующих условий:
С точки зрения теории электролитической диссоциации это означает, что в реакции образуются вещества, полученные в результате связывания ионов в осадок, газ или малодиссоциирующее вещество.
Многие реакции между растворами электролитов являются реакциями между ионами, т. е. ионными реакциями.
Реакции ионного обмена происходят только в том случае, если в результате образуются малорастворимые, газообразные или малодиссоциирующие вещества.
Уравнения реакций, отражающие взаимодействие между ионами в растворе, называются ионными уравнениями — полными или сокращенными.
Расчеты по уравнениям химических реакций, протекающих в растворах электролитов
Как вы уже знаете, реакции с участием электролитов осуществляются за счет взаимодействия ионов, содержащихся в их растворах. В таких реакциях могут участвовать также слабодиссоциирующие и малорастворимые вещества и неэлектролиты, например оксиды. При написании ионных уравнений реакций формулы таких веществ записываются в молекулярном виде. Последовательность действий рассмотрим на конкретных примерах.
Пример №1
Взаимодействие гидроксида меди(II) с соляной кислотой.
а) Записываем молекулярное уравнение реакции:
б) Составляем полное ионное уравнение. Для этого определяем, какие вещества являются сильными электролитами 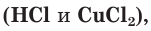
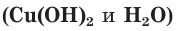
Обратите внимание, что коэффициенты, стоящие перед формулами веществ в молекулярном уравнении, учитываются и в полном ионном уравнении.
в) Записываем сокращенное ионное уравнение. Для этого из левой и правой частей полного ионного уравнения удаляем (вычеркиваем) ионы, не участвующие в химической реакции
Анализируем сокращенное ионное уравнение и делаем вывод, что данная реакция протекает за счет взаимодействия ионов водорода с осадком гидроксида меди(II) с образованием ионов меди(II) и воды.
На основе уравнений реакций, протекающих в растворах электролитов, можно проводить различные количественные расчеты.
Пример №2
Хватит ли ионов водорода, содержащихся в растворе хлороводородной кислоты массой 152 г с массовой долей НCl, равной 12 %, для полного растворения осадка гидроксида меди(II) массой 19,6 г?
1. Определим химическое количество гидроксида меди (II):
2. Рассчитаем массу хлороводородной кислоты в растворе:
3. Найдем химическое количество HCl и, соответственно, химическое количество ионов водорода в растворе:
Поскольку из 1 моль НCl в результате диссоциации образуется 1 моль ионов водорода, следовательно, из 0,5 моль НCl образуется 0,5 моль ионов водорода, т. е.
4. По сокращенному ионному уравнению составим пропорцию и определим, какое химическое количество ионов понадобится для реакции с 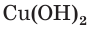
Отсюда получим, что х = 0,4 моль ионов водорода — столько потребуется для реакции. Поскольку в растворе имеется 0,5 моль ионов 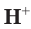
Пример №3
Взаимодействие раствора гидроксида натрия с газообразным оксидом серы(IV) SO2.
а) Записываем молекулярное уравнение реакции:
б) Составляем полное ионное уравнение реакции. Для этого определяем, какие вещества являются сильными электролитами 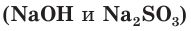
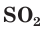
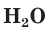
в) Записываем сокращенное ионное уравнение:
Из анализа сокращенного ионного уравнения делаем вывод, что данная реакция протекает за счет взаимодействия гидроксид-ионов 
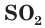
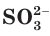
Пример №4
1. Рассчитаем массу гидроксида натрия в растворе:
2. Определим химическое количество гидроксида натрия в растворе:
Соответственно, химическое количество гидроксид-ионов в растворе также равно 0,45 моль. Поскольку из 1 моль NaOH в результате диссоциации образуется 1 моль гидроксид-ионов, 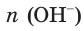
3. По молекулярному (или сокращенному ионному) уравнению составим пропорцию и вычислим, какое химическое количество 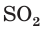
отсюда х = 0,225 моль SO2.
4. Найдем объем оксида серы (IV):
В результате реакций ионного обмена между кислотами и основаниями в растворах образуются соли и вода. При полной нейтрализации кислота и щёлочь расходуются полностью с образованием нейтрального раствора. Если же кислота берется в недостатке по отношению к щёлочи (или наоборот), происходит неполная нейтрализация.
Пример №5
Взаимодействие раствора гидроксида калия с раствором серной кислоты.
а) Составляем молекулярное уравнение реакции:
б) Записываем полное ионное уравнение реакции. Поскольку в данной реакции сильными электролитами являются 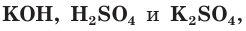
в) Записываем сокращенное ионное уравнение:
Пример №6
К раствору массой 200 г с массовой долей серной кислоты, равной 4,9 %, прибавили раствор массой 400 г с массовой долей гидроксида калия, равной 0,056. Какова окраска индикатора лакмуса в растворе после реакции?
1. Рассчитаем массы веществ в исходных растворах:
2. Определим химические количества веществ:
3. На основании молекулярного уравнения реакции определим химическое количество гидроксида калия, необходимого для полной нейтрализации серной кислоты в растворе:
откуда получим: х = 0,2 моль KOH.
4. Поскольку найденное химическое количество KOH (0,2 моль) меньше содержащегося в исходном растворе (0,4 моль), щёлочь была взята в избытке, и среда полученного раствора щелочная. В таком растворе лакмус окрашивается в синий цвет.
В некоторых случаях при смешивании растворов двух сильных электролитов химические реакции не происходят. Смешаем, например, растворы нитрата натрия и хлорида кальция. Составим молекулярное уравнение предполагаемой реакции обмена:
Определим, какие ионы находятся в полученном растворе, записав полное ионное уравнение:
Очевидно, что в данном случае ионы друг с другом не связываются и никаких изменений в растворе не происходит. Следовательно, реакция просто не идет, а в растворе содержатся ионы четырех видов.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.