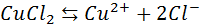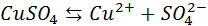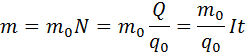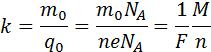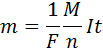Причина того что растворы электролитов проводят электрический ток является
Электролитическая диссоциация
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.

Вещества, которые проводят электрический ток назвали электролитами, вещества, непроводящие ток – неэлектролиты. Электролиты делятся на сильные и слабые. Сильные хорошо проводят ток, лампочка горит ярко, слабые – плохо проводят ток, лампочка горит тускло, например, в растворе уксусной кислоты (см. рисунок).
В чем же причина электропроводности? Почему одни вещества проводят электрический ток, а другие нет?
Электрический ток – это направленно движение заряженных частиц под действием разности потенциалов. Электрический ток в металлах осуществляется за счет электронов, именно электроны являются носителями заряда. А в растворах и расплавах заряд переносят ионы. Вещества, которые распадаются на ионы в растворе или расплаве и проводят электрический ток называются электролитами.
Запомнить! Электролиты – вещества, которые проводят электрический ток в растворах. Электролиты в растворах распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам. Это и есть причина электрического тока в растворах.
Химическая связь в электролитах — ионная или ковалентная сильнополярная (соли, кислоты, основания).
Неэлектролиты – вещества, которые не проводят электрический ток в растворах. Связь в таких веществах — ковалентная неполярная и слабополярная. При растворении они образуют не ионы, а молекулы, которые не способны переносить электрический ток, например, органические вещества (сахароза, бензин, спирт).
Теория электролитической диссоциации была сформулирована Сванте Аррениусом в 1887 году, но актуальна и по сей день. Основные положения этой теории:
Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации.
В зависимости от значения степени диссоциации, электролиты можно разделить на сильные, средние и слабые.
Сильные электролиты имеют степень диссоциации α > 30%, средние от 3 – 30%, а слабые – меньше 3%.
К сильным относят все раств. соли, все щелочи и некоторые кислоты. В растворе эти соединения практически полностью распадаются на ионы.
При написании уравнений диссоциации помните, что суммарный заряд катионов и анионов должен быть равен нулю.
Эти реакции распада на ионы протекают необратимо (только в одну сторону), ионы обратно не соединяются в кристаллическую решетку, препятствуют молекулы воды, окружающие эти ионы (гидратные оболочки).
К электролиам средней силы относят гидроксид магния, сернистую и фосфорную кислоты.
К слабым электролитам, которые лишь частично распадаются на ионы, α Опубликовано admin в 15:59
Причина того что растворы электролитов проводят электрический ток является
I. Повторение и дополнение пройденного материала урока
Растворы всех веществ можно разделить на две группы: проводят электрический ток или не проводят.
С особенностями растворения веществ можно познакомиться экспериментально, исследуя электропроводность растворов этих веществ с помощью прибора, изображённого на рисунке
это вещества, водные растворы или расплавы которых проводят электрический ток
это вещества, водные растворы или расплавы которых не проводят электрический ток
Вещества с ионной химической связью или ковалентной полярной химической связью
Вещества с ковалентной неполярной химической связью:
В растворах и расплавах образуются ионы
В растворах и расплавах нет ионов
Рассмотрим процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Молекула воды полярна и представляет собой диполь
Растворение в воде веществ с ионной химической связью (на примере хлорида натрия – поваренной соли)
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде (рис. 2) состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na + и Сl – из кристалла в раствор происходит образование гидратов этих ионов.
Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na + ; б – гидратация (окружение молекулами воды) ионов Na + и Сl –
Растворение в воде веществ с полярной ко валентной химической связью (на примере соляной кислоты)
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. (рис.3).
Диссоциация молекул HCl на ионы в водном растворе
Ионы отличаются от атомов как по строению, так и по свойствам
Пример 1. Сравним свойства молекулярного водорода (состоит из двух нейтральных атомов водорода) со свойствами иона.
Пример 2. Сравним свойства атомарного и молекулярного хлора со свойствами иона.
Атомы хлора имеют незавершённый внешний уровень, поэтому они химически очень активны, принимают электроны и восстанавливаются.
Именно поэтому газообразный хлор ядовит, при вдыхании его наступает отравление организма.
Ионы хлора имеют завершённый внешний уровень, поэтому они химически неактивны, находятся в устойчивом электронном состоянии.
Ионы хлора входят в состав поваренной соли, употребление в пищу которой не вызывает отравления организма.
1. Ионы отличаются от атомов и молекул по строению и свойствам;
2. Общий и характерный признак ионов – наличие электрических зарядов;
3. Растворы и расплавы электролитов проводят электрический ток из-за наличия в них ионов.
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно(анионы) заряженные частицы.
2. В растворах и расплавах электролиты проводят электрический ток.
Причина того что растворы электролитов проводят электрический ток является
Данный урок посвящен изучению темы «Электролитическая диссоциация». В процессе изучения этой темы Вы поймете суть некоторых удивительных фактов: почему растворы кислот, солей и щелочей проводят электрический ток; почему температура кипения раствора электролита выше по сравнению с раствором неэлектролита.
I. Понятие электролитическая диссоциация
Это и есть причина электрического тока в растворах. Данный процесс получил название электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионы являются толькопереносчиками зарядов в растворе и существуют в нем независимо от того, проходит черезраствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Процесс распада вещества на свободные ионы при его растворении или расплавлении называют электролитической диссоциацией.
Рис. 1. Схема распада на ионы хлорида натрия
Пронаблюдайте за следующим экспериментом: “Изучение электрической проводимости веществ”
II. Сущность процесса электролитической диссоциации. Теория ЭД
Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современные положения теории электролитической диссоциации
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
2. В растворах и расплавах электролиты проводят электрический ток.
Электролиты – это вещества, водные растворы или расплавы которых проводят электрический ток
Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток
Вещества с ионной химической связью или ковалентной сильнополярной химической связью – кислоты, соли, основания
Вещества с ковалентной неполярной химической связью или ковалентной слабополярной химической связью
В растворах и расплавах образуются ионы
В растворах и расплавах не образуются ионы
III. Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1. Молекула воды полярна и представляет собой диполь
Растворение в воде веществ с ионной химической связью
(на примере хлорида натрия – поваренной соли)
Механизм электролитической диссоциации NaCl при растворении поваренной соли в воде (рис. 2) состоит в последовательном отщеплении ионов натрия и хлора полярными молекулами воды. Вслед за переходом ионов Na + и Сl – из кристалла в раствор происходит образование гидратов этих ионов.
Рис. 2. Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na + ; б – гидратация (окружение молекулами воды) ионов Na + и Сl –
Растворение в воде веществ с ковалентной сильнополярной химической связью
(на примере соляной кислоты)
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными (рис.3).
Рис. 3. Диссоциация молекул HCl на ионы в водном растворе
Основные положения:
Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении.
Электролиты – это вещества, которые при растворении в воде или в расплавленном состоянии распадаются на ионы.
Ионы – это атомы или группы атомов, обладающие положительным ( катионы ) или отрицательным ( анионы ) зарядом.
Ионы отличаются от атомов как по строению, так и по свойствам
Пример 1. Сравним свойства молекулярного водорода (состоит из двух нейтральных атомов водорода) со свойствами иона.
Пример 2. Сравним свойства атомарного и молекулярного хлора со свойствами иона.
+17Cl 0 1s 2 2s 2 2p 6 3s 2 3p 5
Атомы хлора имеют незавершённый внешний уровень, поэтому они химически очень активны, принимают электроны и восстанавливаются.
Именно поэтому газообразный хлор ядовит, при вдыхании его наступает отравление организма.
Ионы хлора имеют завершённый внешний уровень, поэтому они химически неактивны, находятся в устойчивом электронном состоянии.
Ионы хлора входят в состав поваренной соли, употребление в пищу которой не вызывает отравления организма.
1. Ионы отличаются от атомов и молекул по строению и свойствам;
2. Общий и характерный признак ионов – наличие электрических зарядов;
3. Растворы и расплавы электролитов проводят электрический ток из-за наличия в них ионов.
IV. Тренажеры
ЦОРы
Памятка (электролиты и неэлектролиты)
Электрический ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
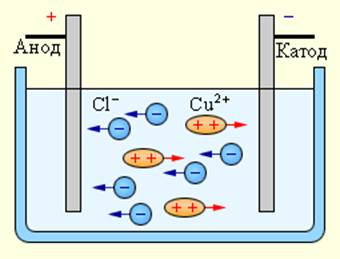
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис 1.15.1).
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион 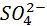
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
Электролиз водного раствора хлорида меди
Закон электролиза был экспериментально установлен английским физиком Майклом Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
Здесь m0 и q0 – масса и заряд одного иона, 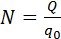
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
Явление электролиза широко применяется в современном промышленном производстве.
Урок №7. Сущность процесса электролитической диссоциации
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются.
С особенностями растворения веществ можно познакомиться экспериментально, исследуя электропроводность растворов этих веществ с помощью прибора, изображённого на рисунке 1.
Рис. 1. Прибор для испытания растворов на электрическую проводимость
Рис. 2 . Направленное движение ионов в водных растворах и расплавах электролитов
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К + и анион А — в общем виде записывается так:
КА ↔ K + + A —
Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н 2 О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 3). Поэтому молекула воды представляет собой диполь.