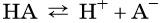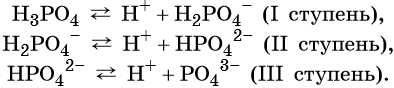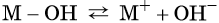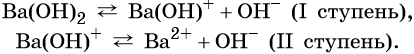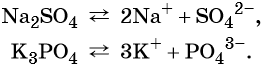При диссоциации щелочей что образуется
Урок №8. Диссоциация кислот, оснований и солей
Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
Многоосновные кислоты диссоциируют ступенчато:
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень) – ортофосфат ион
Диссоциация оснований
Примеры уравнений диссоциации щелочей:
Многокислотные основания диссоциируют ступенчато:
Диссоциация амфотерных оснований (амфолитов)
Диссоциацию амфотерного гидроксида цинка Zn(ОН) 2 можно выразить уравнением:
Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH + 4 ) и анионы кислотных остатков.
Диссоциация средних солей
Na 3 PO 4 →3Na + + PO 3- 4
Кислые и основные соли диссоциируют ступенчато.
Диссоциация кислых солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
Диссоциация основных солей
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
NaCl = Na + + Cl –
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
При диссоциации щелочей что образуется
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
I. Электролитическая диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H + )
1. Электролитическая диссоциация одноосновных кислот
Кислоты состоят не из ионов, а из молекул.
Возникает вопрос – как же тогда кислота диссоциирует, т. е как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в растворах кислот именно при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде, но для этого запишем строение молекул хлороводорода и воды.
В уравнении реакции электролитической диссоциации не всегда учитывают образование катиона гидроксония – обычно говорят, что образуется катион водорода.
Тогда уравнение диссоциации хлороводорода выглядит так:
HCl⇄H + + Cl —
2. Электролитическя диссоциация многоосновных кислот
Многоосновные кислоты диссоциируют ступенчато.
Рассмотри процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две стадии.
I–я стадия диссоциации
На первой стадии отрывается один катион водорода и образуется гидросульфат-анион.
II — я стадия диссоциации
Существуют кислоты, которые даже на первой стадии диссоциируют не полностью – такие кислоты являются слабыми. Например, угольная кислота Н2СО3.
НРО 2- 4 ↔ Н + + PО4 З- (третья ступень) – ортофосфат ион
II. Электролитическая диссоциация оснований
Диссоциация амфотерных оснований (амфолитов)
Щёлочи – это основания, растворимые в воде
Это основания щелочных и щелочноземельных металлов :
LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также NН4ОН
Примеры уравнений диссоциации щелочей
Многокислотные основания диссоциируют ступенчато:
Примеры уравнений диссоциации амфолитов
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением:
Нерастворимые в воде основания практически не подвергаются электролитической диссоциации, так как в воде они практически нерастворимы, а при нагревании – разлагаются, так что расплав их получить не удается.
III. Электролитическая диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH + 4) и анионы кислотных остатков.
Например, диссоциация средних солей :
Кислые же и основные соли диссоциируют ступенчато:
Диссоциация кислых солей
Диссоциация основных солей
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода.
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
IV. Тренажеры
Интерактивное задание LearningApps.org по теме: “Химические свойства растворов кислот»
V. Памятки
Памятка – Определение солей
VI. Задания для закрепления
Задание №1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
Задание №2. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: Ca(OH)2, Na2CO3, Na3PO4, HNO3, KOH, Ba(OH)2, H2SO3, Ca(NO3)2, Ca3(PO4)2, H2S, NaOH, HBr
Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних)
Катионами называют положительно заряженные ионы.
Анионами называют отрицательно заряженные ионы.
В общем виде диссоциацию кислот представляют так:
где A – — кислотный остаток.
Многоосновные кислоты диссоциируют ступенчато, например:
В общем виде диссоциацию основания можно представить так:
где M + — некий катион.
Число гидроксильных групп, которые образуются при диссоциации основания, называют его кислотностью. Например, NaOH — однокислотное основание, Ba(OH)2 — двухкислотное и т. д.
Многокислотные основания диссоциируют ступенчато, например:
Большинство оснований в воде растворимо мало. Растворимые в воде основания называют щелочами.
Прочность связи М—ОН возрастает с увеличением заряда иона металла и увеличением его радиуса. Поэтому сила оснований, образуемых элементами в пределах одного и того же периода, уменьшается с возрастанием порядкового номера. Если один и тот же элемент образует несколько оснований, то степень диссоциации уменьшается с увеличением степени окисления металла. Поэтому, например, у Fe(OH)2 степень основной диссоциации больше, чем у Fe(OH)3.
Электролиты, при диссоциации которых одновременно могут образовываться катионы водорода и гидроксид-ионы, называют амфотерными. К ним относят воду, гидроксиды цинка, хрома и некоторые другие вещества. Их полный перечень приведён в уроке 6, а их свойства рассмотрены в уроке 16.
Солями называют электролиты, при диссоциации которых образуются катионы металлов (а также катион аммония NH4 + ) и анионы кислотных остатков.
Химические свойства солей будут описаны в уроке 18.
Тренировочные задания
1. К электролитам средней силы относится
2. К сильным электролитам относится
3. Сульфат-ион в значительном количестве образуется при диссоциации в водном растворе вещества, формула которого
4. При разбавлении раствора электролита степень диссоциации
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
5. Степень диссоциации при нагревании раствора слабого электролита
1) остается неизменной
2) понижается
3) повышается
4) с начала повышается, потом понижается
6. Только сильные электролиты перечислены в ряду:
7. Водные растворы глюкозы и сульфата калия соответственно являются:
1) с ильным и слабым электролитом
2) неэлектролитом и сильным электролитом
3) слабым и сильным электролитом
4) слабым электролитом и неэлектролитом
8. Степень диссоциации электролитов средней силы
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
9. Степень диссоциации сильных электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
10. Степень диссоциации слабых электролитов
1) больше 0,6
2) больше 0,3
3) лежит в пределах 0,03—0,3
4) менее 0,03
11. Электролитами являются оба вещества:
1) фосфорная кислота и глюкоза
2) хлорид натрия и сульфат натрия
3) фруктоза и хлорид калия
4) ацетон и сульфат натрия
12. В водном растворе фосфорной кислоты H3PO4 наименьшая концентрация частиц
13. Электролиты расположены в порядке увеличения степени диссоциации в ряду
14. Электролиты расположены в порядке уменьшения степени диссоциации в ряду
15. Практически необратимо диссоциирует в водном растворе
1) уксусная кислота
2) бромоводородная кислота
3) фосфорная кислота
4) гидроксид кальция
16. Электролитом, более сильным по сравнению с азотистой кислотой, будет
1) уксусная кислота
2) сернистая кислота
3) фосфорная кислота
4) гидроксид натрия
17. Ступенчатая диссоциация характерна для
1) фосфорной кислоты
2) соляной кислоты
3) гидроксида натрия
4) нитрата натрия
18. Только слабые электролиты представлены в ряду
1) сульфат натрия и азотная кислота
2) уксусная кислота, сероводородная кислота
3) сульфат натрия, глюкоза
4) хлорид натрия, ацетон
19. Каждое из двух веществ является сильным электролитом
1) нитрат кальция, фосфат натрия
2) азотная кислота, азотистая кислота
3) гидроксид бария, сернистая кислота
4) уксусная кислота, фосфат калия
20. Оба вещества являются электролитами средней силы
1) гидроксид натрия, хлорид калия
2) фосфорная кислота, азотистая кислота
3) хлорид натрия, уксусная кислота
4) глюкоза, ацетат калия