При болезни паркинсона что нужно делать чтобы человек не слегся
Болезнь Паркинсона: как с ней справляться
Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов Каковы основные диагностические критерии болезни Паркинсона? Когда пациента необходимо
 |
| Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов |
Каковы основные диагностические критерии болезни Паркинсона?
Когда пациента необходимо отправить к специалисту?
С каких препаратов начать лекарственную терапию?
Каким образом устранить побочное действие специфической терапии?
Причины паркинсонизма до сих пор неизвестны, а лечение остается симптоматическим, несмотря на то, что прошло уже четверть века с тех пор, как леводопа прочно внедрилась в жизнь больных паркинсонизмом.
Но не будем слишком пессимистичны — современные методы лечения продлевают жизнь таким больным и делают ее более или менее нормальной [1]. Один человек из тысячи страдает болезнью Паркинсона. Диагноз ставится на основании клинического синдрома, включающего гипокинезию, ригидность, тремор и нарушенные рефлексы позы. Уровень допамина снижается почти на 80% к моменту появления клинических признаков, поэтому неудивительно, что невозможно точно указать время появления первых симптомов.
Далеко не всегда просто отличить идиопатическую болезнь Паркинсона от других состояний, включая такое часто встречающееся, как эссенциальный тремор, и менее распространенные заболевания, которым присущи иные неврологические симптомы — супрануклеарный паралич, автономные нарушения или мозжечковые симптомы [2].
Патолого-анатомические исследования показывают, что каждый пятый диагноз в данной группе заболеваний ошибочен. Перед тем как поставить диагноз, важно убедиться в наличии по крайней мере двух из четырех основных клинических признаков, помня при этом, что у большинства пациентов симптоматика асимметрична. В сомнительных случаях помогает пробное лечение леводопой или допаминовыми агонистами [3].
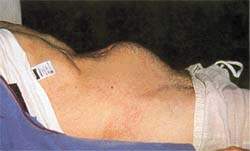 |
| Рисунок 2. Задержка мочи часто сопровождает болезнь Паркинсона |
Основной проблемой в контролировании болезни Паркинсона на сегодняшний день остается поздняя недостаточность допаминергической терапии, проявляющаяся в исчезновении или колебаниях реакции на препарат или в развитии дискинезий и прочих побочных эффектов у 75% пациентов после пяти лет лечения [4].
Расширение спектра препаратов и вновь возросший интерес к хирургическому лечению объясняется стремлением избежать или уменьшить проблемы длительного лечения.
Врач общей практики, подозревающий у пациента болезнь Паркинсона, должен решить, к кому его направить — к невропатологу, гериатру или другим специалистам. Особенно это важно в хронических прогрессирующих случаях у молодых людей, нуждающихся в длительном лечении.
Пациенту крайне необходимо рассказать о его болезни, прогнозе и сути применяемого лечения. Как и при астме, диабете и другом хроническом заболевании, врач и пациент должны действовать сообща, при активном участии последнего в принятии решений, касающихся лечения.
Как правило, с такими пациентами легко договориться, но по мере прогрессирования заболевания их приходится уговаривать принимать различные препараты несколько раз в день.
Контроль за заболеванием не сводится лишь к лекарственной терапии, напротив, психотерапия, трудотерапия, обучение навыкам речи и психологические методы существенно улучшают состояние пациентов [5]. Регулярная физиотерапия, назначаемая до допаминергических препаратов, замедляет прогрессирование заболевания [6], поэтому сразу после установления диагноза нужно советовать пациентам физические упражнения, соблюдение диеты, трудотерапию.
Весьма часто такие методы используются на более поздних стадиях заболевания, когда ничто другое уже не помогает, в то время как их нужно использовать для предупреждения развития болезни. Общество больных болезнью Паркинсона выпускает информационные сборники для персонала больниц и специальный обучающий материал для пациентов.
В ряде центров специально обученные сиделки помогают больным и тем, кто за ними ухаживает. Несмотря на отсутствие конкретных научных данных, многие пациенты признают эффект музыкотерапии, обучения, йоги и прочих дополнительных методов лечения.
Количество доступных препаратов и их новых форм в последние десять лет значительно увеличилось и обещает еще большее увеличение в ближайшем будущем. В табл. 1 приведены основные группы препаратов.
Таблица 1. Лекарственные препараты, применяемые для лечения паркинсонизма
антихолинергические препараты
Антихолинергические средства применялись еще в прошлом веке. Они до сих пор помогают справиться с тремором и, в меньшей степени, с ригидностью, практически не влияя на гипокинезию. Выбор среди них невелик. Все они имеют побочные эффекты: сухость во рту, нарушение аккомодации, запор и задержка мочи. У пожилых пациентов они склонны вызывать спутанность сознания и прочие психиатрические нарушения.
Следует отметить, что все антипаркинсонические средства способны вызывать подобные проблемы и любое нарушение ментальной функции требует пересмотра целесообразности применения и адекватности доз препарата. Леводопа, в настоящее время назначаемая вместе с ингибитором периферической декарбоксилазы (ИНД), остается пока самым эффективным лекарственным средством. В начале курса лечения могут возникать тошнота, рвота, поэтому пациенты предпочитают принимать их вместе с пищей или с противорвотными лекарствами — домперидоном и метоклопрамидом.
Необходимо учитывать, что большое потребление белка может мешать всасыванию леводопы.
Кроме психологических расстройств необходимо отметить и другие побочные эффекты — дискинезии или непроизвольные движения. Они бывают различными: движения языка и губ, гримасы, болезненные напряжения мышц, хореоатетоз, двигательное беспокойство. Снижение дозы препарата, как правило, уменьшает и дискинезию, однако пациенты часто предпочитают последнюю невозможности передвигаться вообще.
Другой элемент нарушений, возникающих при длительном лечении, — колебания реакции на препарат. Вначале это проявляется феноменом «выключения» — продолжительность действия леводопы-ИПД все время уменьшается. В тяжелых случаях человек внезапно переключается от движения, обычно с дискинезиями, к полной неподвижности.
 |
| Рисунок 3. Нарушение постуральных рефлексов — одна из составляющих клинического синдрома |
Для преодоления подобных проблем были разработаны формы с дозированным высвобождением препарата, позволяющие избежать колебаний концентраций лекарства в крови, и порошковые формы, обеспечивающие быстрое нарастание уровня лекарства в крови.
Агонисты допамина действуют на различные участки дофаминового рецептора. Соответственно разнится и их действие. Применяемые в одиночку, агонисты допамина менее эффективны, чем леводопа, но и реже приводят к колебаниям и дискинезиям [4]. Желудочно-кишечные побочные эффекты и воздействие на психику у них такие же. Апоморфин отличается от прочих упомянутых средств тем, что вводится путем инъекции.
По данным исследования, проведенного в Соединенных Штатах, селигин отсрочивает необходимость назначения леводопы, имеет нейропротекторные свойства и способен замедлять развитие болезни [7]. С тех пор, однако, было доказано, что селегилин сам по себе обладает умеренным допаминергическим эффектом, а также амфетаминоподобным и антидепрессантным воздействием; его защитные свойства в настоящее время находятся под сомнением [8].
Механизм действие селегилина — блокада моноаминоксидазы В, одного из основных ферментов допаминового метаболизма. Бытует мнение, что он потенциирует действие леводопы.
Ингибиторы катехол-о-метилтрансферазы (КОМТ) просто замедляют метаболизм допамина. По крайней мере два таких препарата уже готовятся к массовому производству [9, 10].
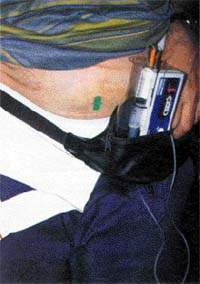 |
| Рисунок 4. Инъекции апоморфина применяют в трудно поддающихся лечению случаях |
Допаминергический эффект антивирусного препарата амантадина замечен еще много лет назад, но он менее эффективен, чем леводопы. Точный механизм его действия неизвестен, но все же его пытаются применять в случаях, резистентных к терапии леводопой; кроме того, его назначение совместно с леводопой позволяет уменьшить дозу последней.
Бесспорно, при назначении лекарственных препаратов следует учитывать возраст пациента, степень нарушений и индивидуальные особенности, однако невропатологи, как и другие специалисты, единого подхода к последовательности применения препаратов пока не разработали. Некоторые считают, что откладывать применение леводопы не имеет смысла, и начинают со стандартных схем ее использования.
Еще один подход заключается в использовании сначала пролонгированных форм, применении только дофаминового агониста или в сочетании с низкими дозами леводопы; или же назначают на какое-то время один селегилин, а затем присоединяют леводопу.
Какой бы схеме вы ни следовали, целесообразно начинать с низких доз, осторожно и постепенно подбирая необходимую дневную дозу. По возможности нужно избегать резких изменений в схеме приема или быстрого увеличения дозы.
При развитии феномена «выключения» нередко, хотя и на непродолжительное время, может оказаться полезным разделение дневной дозы препарата на несколько более мелких приемов. Можно попробовать присоединить к леводопе селегилин и/или агонист допамина, а также использовать вместо леводопы (или чаще дополнительно к ней) лекарственные формы пролонгированного действия. Биодоступность подобных форм меньше, чем у обычных препаратов, и их доза обычно несколько больше. У отдельных пациентов хороший результат дает прием препарата до, а не после еды или сокращение потребления белка.
В случаях с ярко выраженным феноменом включения-выключения используют те же приемы, в сочетании с индивидуальным подбором наиболее эффективной схемы лечения.
| Не рекомендуется устраивать длительные перерывы между приемами препаратов |
При отсутствии успеха от перорального приема препарата можно использовать такие новые методы, как подкожное введение апоморфина. Правда, для этого требуется обученный персонал, лучше всего — специальная сиделка для больных паркинсонизмом.
Другой подход — нейрохирургия. Проводят стереотоксическую паллидотомию или стимуляцию таламуса при феномене включения-выключения, а также при упорном треморе [11]. Имеющиеся на сегодняшний день данные обнадеживают. Они свидетельствуют об уменьшении дискинезии и удлинении периода включения. Однако, как и трансплантацию фетальных тканей, подобные хирургические методы пока следует считать экспериментальными, требующими дальнейшего изучения и оценки.
Кроме дискинезий и тремора, у многих пациентов при прогрессировании заболевания развиваются когнитивные и психические расстройства. При этом необходимо снижать дозу препарата.
Небольшие перерывы в приеме лекарств, отмена допаминергических препаратов на короткое время — такие «каникулы» (один-два дня каждую неделю) позволяют снизить психотоксичность [10]. Отмена препаратов на длительный срок не рекомендуется, поскольку может повлечь серьезные или даже необратимые нарушения способности двигаться.
Болезнь Паркинсона сопровождается нарушениями сна, депрессией, задержкой мочи, запорами, болями, расстройствами автономной нервной системы и сексуальными отклонениями. Все это поддается лекарственной коррекции. Просто надо дать возможность пациенту подробно описать все, что его беспокоит. Ограниченное время консультации вместе с тяжелыми проблемами общения, от которых страдают многие пациенты, могут быть преодолены посредством заранее подготовленного самим пациентом или сиделкой описания его состояния.
1. Clarke C. E. Mortality from Parkinson’s disease in England and Wales 1921-89. J. Neurol. Neurosurg Psychiatry 1993; 56:690-3.
2. Quinn N. Parkinsonism — recognition and differential diagnosis. BMJ 1995; 310:447-52.
3. Hughes A. J., Lees A. J., Stern G. M. Challenge test to predict the dopaminergic response in untreated Parkinson’s disease. Neurology 1991; 41:1723-5.
4. Marsden C. D. Parkinson’s disease. J. Neurol. Neurosurg Psychiat 1994; 57:672-81.
5. Patti F., Reggio A., Nicoletti F. et al. Effects of rehabilitation therapy on Parkinsonians’ disability and functional independence. J. Neurol. Rehab 1996; 10:223-231.
6. Doshay L. J. Method and value of physiotherapy in Parkinson’s disease. N. Eng. J. Med. 1962; 266:878-80.
7. Parkinson Study Group. Effects of tocopherol and deprenyl on the progression of disability in early Parkinson’s disease. N. Eng. J. Med. 1993; 328:176-83.
8. Jankovic J., Shoulson I., Weiner W. J. Early-stage Parkinson’s disease: to treat or not to treat. Neurology 1994; 44(suppl1):S4-S7.
9. Pouttinen H. M., Rinne U. K. A double-blind pharmocokinetic and clinical dose-response study of entacapone as an adjuvant to levadopa therapy in advanced Parkinson’s disease. Clin. Neuropharmac 1996; 19:283-96.
10. Stocchi F., Nordera G., Marsden C. D. Strategies for treating patients with advanced Parkinson’s disease with disastrous fluctuations and dyskinesias. Clin. Neuropharmac 1997; 20:95-115.
11. Obeso J. A., Guridi J., Delong M. Surgery for Parkinson’s disease. J. Neurol. Neurosurg. Psychiat 1997; 62:2-8.
Неотложные состояния при болезни Паркинсона
Болезнь Паркинсона (БП) – хроническое прогрессирующее заболевание головного мозга, преимущественно связанное с дегенерацией дофаминергических нейронов черной субстанции с накоплением в них белка α-синуклеина и образованием особых внутриклеточных включений (телец Леви), которое проявляется сочетанием гипокинезии с ригидностью, тремором покоя и постуральной неустойчивостью, а также широким спектром немоторных проявлений (психических, вегетативных, сенсорных и др.) [1, 2].
Хроническое медленно прогрессирующее течение процесса при этом заболевании может меняться с развитием острой декомпенсации БП – внезапного нарастания симптомов паркинсонизма, сопровождающегося
существенным ограничением функциональных возможностей пациента и сохраняющегося более 24 часов, несмотря на продолжение или возобновление привычной для пациента противопаркинсонической терапии [3]. Данное расстройство развивается у 0,3-1% больных БП ежегодно, а в 10% случаев приводит к летальному исходу.
— акинетический криз (АК);
— акинетико-гипертермический (злокачественный) синдром (АГС);
— злокачественный нейролептический синдром (ЗНС);
— тяжелые инвалидизирующие дискинезии с гипертермией;
— психоз;
— серотониновый синдром (СС).
Неотложные состояния при БП, в зависимости от состояния и степени вовлеченности дофаминергической системы, условно можно разделить на две группы:
1. Неотложные состояния, возникающие в результате дофаминергического дисбаланса:
А – развивающиеся в период «OFF» или гипофункции дофаминергической системы: синдром паркинсонизм – гиперпирексия или акинетический криз;
Б – развивающиеся в период «ON» или избыточной активности дофаминергической системы: психоз, тяжелая дискинезия с гиперпирексией и т.п.;
2. Неотложные состояния, не связанные напрямую с состоянием дофаминергической системы (серотониновый синдром, электролитные нарушения и т.п.)
Акинетический криз и акинетико-гипертермический (злокачественный) синдром
Акинетический криз – резкое нарастание гипокинезии и ригидности с развитием обездвиженности, спутанности сознания, анартрии, нарушения глотания и вегетативными расстройствами (тахикардия, артериальная
гипотензия, недержание мочи, потоотделение). Для акинетико-гипертермического синдрома характерны симптомы акинетического криза, а также гипертермия (гиперпирексия), вызванная дисфункцией гипоталамуса.
К основным причинам развития АК и АГС относятся:
— изменение дофаминергической терапии;
— блокада дофаминергических рецепторов;
— интеркуррентные состояния;
— нарушение работы системы глубокой электростимуляции (при наличии таковой у пациента).
Точная частота развития АК и АГС не известна. Наиболее цитируемой работой, в которой обсуждается частота встречаемости данных расстройств, является статья M.Serrano-Duenas [4]. Согласно его данным, у 3,6% (11 пациентов из 305) регулярно наблюдаемых им пациентов с БП в течение 9 лет развилось данное расстройство. Среди всех осмотренных за 9 лет пациентов с БП данный процент составил 0,04%. Во всех случаях причиной развития АГС являлась самостоятельная отмена препаратов леводопы без согласования с лечащим врачом. С другой стороны, в исследовании ELLDOPA [5], в которое были включены пациенты с ранней стадией заболевания, в результате двухнедельной отмены леводопы ни у одного из 361 пациента не развился АГС. Данный факт указывает на значение выраженности дегенерации нигростриатного пути, отражающего стадию заболевания в развитииакинетического криза.
Патофизиология акинетического криза окончательно не ясна, однако очевидно, что в основе его развития лежит не только отмена препарата. Особенностью АК является низкая эффективность возобновленной терапии
леводопой, при этом срок начала ответа может достигать 11 дней. Таким образом, во время акинетического криза, по-видимому, развивается временная блокировка ответа на привычную для пациента терапию. В 2014 г. была опубликована работа [6], в которой при помощи SPECT с лигандом [123I] FP-CIT, проведенной до, в период и после акинетического криза, было показано, что в острый период происходит значимое снижение накопления лиганда в пресинаптических терминалях стриатума и его дальнейшее медленное восстановление.
Впервые АГС был описан в 80-е годы ХХ в. у пациентов во время прекращения дофаминергической терапии в рамках проведения «лекарственных каникул». В настоящее время, в связи с пониманием всей опасности «лекарственных каникул», наиболее частой причиной развития АК и АГС называют изменение схемы ранее назначенной терапии (резкое снижение дозы, непропорциональная замена дофаминергического препарата). Прием препаратов, блокирующих дофаминовые рецепторы, таких как типичные нейролептики, метоклопромид, циннаризин, резерпин и др., также может приводить к развитию декомпенсации БП. Более того, существуют сообщения о развитии АК на фоне приема препаратов из группы атипичных нейролептиков. Нельзя забывать и о возможности влияния интеркуррентных заболеваний на течение БП. АГС может развиваться у пациентов с патологией желудочно-кишечного тракта в связи со снижением всасывания дофаминергических препаратов и развития состояния, эквивалентного отмене терапии. К таким состояниям относятся опухоли, резекция кишечника, тяжелые гастроэнтериты, непроходимость. Некоторые сопутствующие заболевания, несмотря на отсутствие прямого влияния на всасывание препаратов, также способны приводить к АК/АГС (инфекции, дегидратация, электролитные расстройства). Основными электролитными расстройствами, способными привести к развитию острой декомпенсации, являются гипо- и даже гипернатриемия, а неадекватная коррекция данных состояний способна вызвать понтинный или экстрапонтинный миелинолиз, усугубив течение АГС. Описаны случаи развития декомпенсации, связанные с менструальным циклом – вероятно за счет отрицательного влияния высокого уровня прогестерона на дофаминергическую систему. В связи с активным внедрением глубокой электростимуляции головного мозга, нельзя забывать о возможности развития декомпенсации у пациентов, перенесших данное оперативное лечение. Акинетический криз может развиться в случае прекращения стимуляции, некорректного программирования стимулятора, разрядки батареи, и даже непреднамеренного отключения стимуляции самим пациентом. При этом описаны случаи развития АГС в результате снижения дозы дофаминергической терапии даже на фоне эффективной глубокой электростимуляции.
Акинетический криз и акинетико-гипертермический синдром – неотложные состояния, требующие срочной госпитализации пациента в отделение интенсивной терапии. При развитии данной патологии в кратчайшие сроки должна быть проведена диагностика возможных интеркуррентных заболеваний (в первую очередь инфекционных), проведен комплекс лабораторных обследований (в первую очередь для исключения водно-электролитного и кислотно-щелочного расстройства). Акинетический криз требует тесного взаимодействия реаниматолога и невролога.
Клиническая картина АГС характеризуется следующими симптомами:
— сроки развития от 18 часов до 7 суток (с момента изменения/прекращения дофаминергической терапии или развития состояния, которое могло спровоцировать декомпенсацию);
— выраженная ригидность/акинезия;
— вегетативные расстройства (тахикардия, тахипноэ, лабильность АД, нарушение мочеиспускания, цианоз, потоотделение);
— через 72-96 часов (в некоторых случаях одновременно с дебютом акинезии) развивается гипертермия (до 41 °С);
— нарушение сознания (от возбуждения до оглушения и комы);
— возможно развитие генерализованных тонико-клонических судорог, миоклоний;
— изменение лабораторных показателей: лейкоцитоз, повышение уровня креатинкиназы (260-50000 Ед/л);
Основными осложнениями АК и АГС являются:
— тромбоз глубоких вен;
— эмболия легочной артерии;
— аспирационная пневмония;
— почечная недостаточность.
Мероприятия, проведение которых необходимо при поступлении больного с акинетическим кризом:
— интубация, проведение ИВЛ (при выраженной дыхательной недостаточности);
— постановка назогастрального зонда, мочевого катетера;
— антибиотикотерапия (в случае выявления инфекционного процесса);
— назначение антипиретиков;
— адекватная инфузионная терапия (коррекция электролитных расстройств);
— гемодиализ (при выявлении почечной недостаточности);
— гепаринотерапия, компрессионный трикотаж (профилактика тромбоза глубоких вен голеней и эмболии легочной артерии);
— позиционирование в кровати (профилактика пролежней).
Основой терапии акинетического криза является восстановление приема дофаминергической терапии в случае ее отмены. Особенности ответа на возобновленную терапию требуют учета следующих аспектов:
— раннее возобновление дофаминергической терапии;
— увеличение исходной дозы дофаминергических препаратов;
— продолжение терапии вне зависимости от наличия ответа (должный ответ может развиться лишь спустя 11 суток);
— невозможность ограничения терапии акинетического криза только дофаминергическими препаратами.
Важным дополнением к терапии является введение раствора амантадина сульфата как препарата, способного снизить активность глутаматной системы, возможно лежащей в основе АГС. Следует придерживаться следующей схемы назначения препарата:
— 500 мл раствора (200 мг амантадина сульфата) 2-3 раза в день в течение 10-14 дней;
— после завершения курса инфузионной терапии обязателен перевод на пероральную форму в таблетках (300-600 мг/сут).
Также в качестве дополнительной терапии рассматриваются апоморфин, дантролен и метилпреднизолон. К сожалению, первые два препарата не зарегистрированы в нашей стране. Метилпреднизолон назначается в дозе 1000 мг/сут в течение 3-5 дней. Терапия метилпреднизолоном существенно улучшает исходы и сокращает сроки акинетического криза. Окончательный механизм действия метилпреднизолона при акинетическом кризе не ясен. В экспериментальной модели на крысах было показано наличие глюкокортикоидных рецепторов на дофаминергических нейронах в вентральной области покрышки, за счет стимуляции которых возможно и развивается эффект метилпреднизолона. Имеется сообщение о применении ротиготина в виде трансдермальной терапевтической системы при акинетическом кризе [7].
Злокачественный нейролептический синдром Злокачественный нейролептический синдром – это ятрогенная, потенциально фатальная патология, которая может развиться на фоне приема любых препаратов, блокирующих дофаминергическую передачу. Чаще всего данный синдром развивается в ответ на прием типичных нейролептиков, однако описаны случаи развития ЗНС и при терапии атипичными нейролептиками. Патогенез ЗНС связан с блокадой дофаминергических структур в базальных ганглиях и гипоталамусе, иммунологическими нарушениями и повышением проницаемости гематоэнцефалического барьера, которые приводят к нейросенсибилизации организма с последующим аутоиммунным поражением ЦНС и висцеральных органов. В патогенезе ЗНС важную роль играет симпатоадреналовая и серотониновая гиперактивность.
Частота встречаемости ЗНС составляет 0,1–1% среди больных, получающих нейролептики. В данную группу попадают и пациенты с БП, течение которой осложнилось психотическими расстройствами. Чаще всего ЗНС развивается в первые дни после начала приема препарата, либо резкого увеличения его дозы. ЗНС может проявиться в любом возрасте, но чаще наблюдается у молодых мужчин. Факторами риска при ЗНС являются интеркуррентная инфекция, физическое истощение, нарушения водно-электролитного баланса (в первую очередь дегидратация), также, как и при АГС.
Клиническая картина ЗНС во многом схожа с АГС: характерно быстрое прогрессирование симптоматики с пиком в течение 72 часов, длительностью 7-14 дней. В случае ЗНС возможно купирование симптоматики без дополнительной терапии.
В 1985 г. Levenson J.L. впервые предложил критерии диагностики данной патологии [8], позже, в 1994 г., новые критерии были предложены в рамках DSM-IV:
Для ЗНС характерны изменения лабораторных показателей:
— повышение креатинкиназы (>90%);
— полиморфонуклеарный лейкоцитоз (75%);
Levenson J.L., 1985
DSM-IV, 1994