Прандиальный инсулин что это
Инсулинотерапия при сахарном диабете 2 типа
Инсулин — гормон, который вырабатывают b-клетки поджелудочной железы. При помощи инсулина глюкоза поступает в мышечную, печеночную и жировую ткань, где используется либо в виде источника энергии, либо запасается в виде гликогена.
При сахарном диабете 2-го типа β-клетки вырабатывают инсулин хуже, чем у здорового человека, и инсулин плохо воспринимается собственными тканями организма
При сахарном диабете 2-го типа β-клетки вырабатывают инсулин, но, во-первых, он плохо воспринимается собственными тканями организма, а во-вторых, β-клетки пациента с сахарным диабетом 2-го типа вырабатывают инсулин хуже, чем у здорового человека, причем со временем выработка инсулина ухудшается.
Исторически основными методами лечения сахарного диабета 2-го типа всегда были диетотерапия и сахароснижающие таблетки. В настоящее время диетотерапия уже не является самостоятельным способом лечения, однако изменению образа жизни (здоровое питание в сочетании с физической активностью) уделяется все большее внимание. Кроме этого, кардинально изменились подходы к применению инсулина у пациентов с сахарным диабетом 2-го типа.
У здорового человека инсулин вырабатывается постоянно со скоростью приблизительно 1 Ед в час. Эта секреция называется фоновой (базальной): ее роль состоит в поддержании нормального уровня глюкозы в крови в периоды между приемами пищи и в ночное время.
В ответ на поступление пищи скорость секреции инсулина резко возрастает. Эта секреция инсулина называется прандиальной (болюсной): ее роль состоит в поддержании нормального уровня глюкозы после приемов пищи.
По происхождению препараты инсулина можно разделить на 2 группы.
Генно-инженерные человеческие инсулины:
Профиль действия препаратов инсулина определяется 3 важными параметрами:
Применение двухфазного инсулина аспарта в лечении больных сахарным диабетом 2 типа
Сахарный диабет (СД) 2 типа является одним из наиболее распространенных хронических заболеваний и носит характер неинфекционной эпидемии. В настоящее время около 200 млн человек в мире страдают этим недугом. Количество
Сахарный диабет (СД) 2 типа является одним из наиболее распространенных хронических заболеваний и носит характер неинфекционной эпидемии. В настоящее время около 200 млн человек в мире страдают этим недугом. Количество болеющих СД ежегодно увеличивается на 5–7% и каждые 15 лет удваивается. СД характеризуется ранней инвалидизацией и высокой смертностью больных вследствие поздних сосудистых осложнений. Это обстоятельство ставит данное заболевание в ряд социально значимых. Среди пациентов с этой патологией больные СД 2 типа составляют более 90%.
В основе патофизиологических нарушений при СД 2 типа лежат два основных дефекта — инсулинорезистентность и дисфункция β-клеток поджелудочной железы (нарушение секреции инсулина и относительный дефицит инсулина). Эти два нарушения очень тесно взаимосвязаны и сначала приводят к повышению уровня глюкозы в крови после еды (постпрандиальная гликемия — ППГ), а в дальнейшем и к гипергликемии натощак. Кроме того, уменьшается чувствительность периферических тканей к инсулину.
Международная диабетическая федерация (IDF) разработала рекомендации, регламентирующие терапевтические цели при СД 2 типа (табл.), исходя из которых можно ставить индивидуальные задачи по улучшению компенсации заболевания.
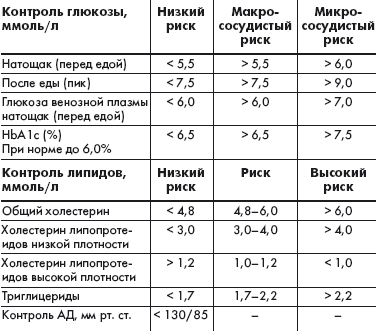 |
| Таблица. Терапевтические цели при сахарном диабете 2 типа |
Строгий контроль гликемии имеет первостепенное значение для снижения риска возникновения микро- и макрососудистых осложнений при СД 2 типа. Тем не менее, как показывают результаты Британского проспективного исследования сахарного диабета (UKPDS), по мере прогрессирования СД 2 типа становится все труднее поддерживать оптимальный уровень глюкозы крови натощак (ГКН) и гликированного гемоглобина (HbA1c) с помощью только гипокалорийной диеты, физических нагрузок. В этом случае назначаются пероральные сахароснижающие препараты (ПССП). Главная цель в лечении СД 2 типа — поддержание максимально приближенного к норме уровня сахара крови (гликемии).
В настоящее время в лечении СД 2 типа используются следующие группы ПССП.
Препараты, усиливающие секрецию инсулина поджелудочной железой. К этой группе ПССП относятся производные сульфонилмочевины (ПСМ) — глибенкламид (Манинил), гликлазид (Диабетон МВ), глимепирид (Амарил, Глемаз), гликвидон (Глюренорм) и прандиальные регуляторы гликемии (глиниды) — репаглинид (НовоНорм®). У каждого из перечисленных препаратов есть свои особенности, касающиеся в основном продолжительности действия. За счет усиления стимуляции инсулина поджелудочной железой эти препараты снижают уровень глюкозы в крови.
Препараты, улучшающие чувствительность к инсулину. Эта группа препаратов включает бигуаниды и инсулиновые сенситайзеры (тиазолидиндионы). Основным представителем группы бигуанидов является метформин (Глюкофаж, Сиофор, Багомет, Метфогамма). Метформин снижает продукцию глюкозы печенью за счет торможения глюконеогенеза, усиливает усвоение глюкозы периферическими тканями без стимуляции секреции инсулина поджелудочной железой. Метформин является препаратом выбора в лечении пациентов с СД 2 типа и избыточной массой тела. Препарат успешно применяется в комбинации с другими ПССП и инсулином.
Подгруппа инсулиновых сенситайзеров (тиазолидиндионов) представлена пиоглитазоном (Актос) и росиглитазоном (Авандия).
Препараты, уменьшающие всасывание углеводов в кишечнике. К этой группе относится акарбоза (Глюкобай), являющаяся ингибитором α-глюкозидаз. Акарбоза препятствует подъему уровня глюкозы в крови после еды за счет торможения всасывания углеводов, поступающих с пищей, в тонком кишечнике.
Комбинированные препараты. Они состоят из нескольких компонентов, к ним относятся, например, Глибомет (глибенкламид + метформин), Авандамет (росиглитазон + метформин).
Однако эффективное действие многих ПССП проявляется только при сохранении остаточной секреции β-клеток. Прогрессирующее снижение функции β-клеток и инсулинорезистентность, характерные для СД 2 типа, препятствуют достижению желаемого эффекта даже при комбинированной терапии несколькими ПССП. В этом случае наилучшим из имеющихся в арсенале вариантов лечения является инсулинотерапия. Один из выводов исследования UKPDS гласит: «Мы не начинаем инсулинотерапию так рано и так агрессивно, как это необходимо» [2].
Поддержание уровня гликированного гемоглобина в пределах рекомендованных целевых значений ( Рисунок 1. Суточные профили гликемии в 1-й и 2-й группах пациентов исходно и через 3,5 мес на фоне терапии препаратом НовоМикс 30
В исследовании ACTION (Achieving Control Through Insulin plus Oral agents) сравнивалась интенсификация терапии ПССП с инсулинотерапией в режиме двух инъекций [32]. Исследование продолжалось 24 нед. В него были включены пациенты с СД 2 типа, которым не удалось достичь целевых значений HbA1c на фоне терапии ПССП.
К завершению исследования 76% пациентов смогли достичь показателя HbA1c 7,5%. Длительность исследования составляла 6 мес. Исходно пациенты получали либо только метформин (2500 мг/сут), или только глимепирид (8 мг/сут), или комбинацию указанных препаратов (2500 мг/сут + 8 мг/сут).
В ходе исследования пациенты продолжали получать прежнюю терапию ПССП с добавлением препарата НовоМикс® 30 (n = 38). 8 пациентов были переведены на терапию плацебо + НовоМикс® 30 с отменой ПССП. Исходно масса тела и уровень HbA1c достоверно не отличались между группами.
Через 6 мес у пациентов всех групп отмечалось значительное снижение HbA1c, включая пациентов, получавших НовоМикс® 30 + плацебо. Цели контроля (HbA1c 32 кг/м2) плюс инсулин НовоРапид® прандиально. Дозы подбирались индивидуально в соотношении 3 : 2 : 1 (в завтрак, обед и ужин соответственно). ПССП отменялись в обеих группах терапии.
Оба режима терапии инсулиновыми аналогами обеспечили возможность безопасного достижения целевого уровня HbA1c 7,0%: 50% в группе терапии инсулином НовоМикс® 30 и 60% в группе терапии инсулинами Левемир® и НовоРапид® у пациентов СД 2 типа. Пациенты, ранее не получавшие инсулинотерапии, достигли равного гликемического контроля на фоне терапии двухфазным аналогом и базис-болюсной терапии.
Среднее значение ГКН также оказалось одинаковым: 8,05 ммоль/л на фоне терапии инсулином НовоМикс® 30 и 8,27 ммоль/л на фоне базис-болюсной терапии инсулинами Левемир® и НовоРапид® (р = 0,345). Частота гипогликемий была низкой и сравнимой для обоих режимов терапии инсулиновыми аналогами.
Целью рандомизированного, открытого, с параллельными группами исследования EuroMix [24] являлось сравнение эффективности безопасности двух режимов терапии инсулиновыми аналогами у 255 пациентов с СД 2 типа: инсулин НовоМикс® 30 в режиме двух инъекций в комбинации с метформином (n = 128) и инсулин Лантус в режиме одной инъекции в комбинации с глимепиридом 1 раз в сутки (n = 127). Первичным параметром исследования была разница в динамике снижения HbA1c между группами через 26 нед терапии.
 |
| Рисунок 2. Динамика прандиального прироста гликемии исходно и через 3,5 мес на фоне терапии препаратом НовоМикс 30 |
Исследование показало, что старт инсулинотерапии с использования двухфазного аналога НовоМикс® 30 в двухкратном режиме в комбинации с метформином обеспечивает более выраженное снижение уровня HbA1c и среднего прандиального прироста гликемии у больных СД 2 типа в сравнении с терапией аналогом инсулина Лантус® в режиме одной инъекции в сочетании с глимепиридом.
Нами было проведено исследование в 10 административных округах Москвы с целью изучения эффективности препарата НовоМикс® 30 в условиях повседневной клинической практики в течение 3,5 мес у 3 000 больных СД 2 типа с неудовлетворительным уровнем гликемии на фоне предшествующей терапии.
Для окончательного анализа методом случайной выборки было отобрано 309 анкет (каждая 10-я анкета). Длительность СД 2 типа составляла 11,5 ± 1,5 лет. До перевода на НовоМикс® 30 пациенты получали монотерапию ПССП или комбинированную терапию ПССП с инсулином. Уровень HbA1c в общей группе пациентов исходно составил 9,3 ± 1,5%. В ходе исследования пациенты были разделены на две группы: в 1-й группе больные получали НовоМикс® 30 в двух инъекциях в комбинации с ПССП, во 2-й — НовоМикс® 30 в трех инъекциях без ПССП.
 |
| Рисунок 3. Динамика прандиального прироста гликемии исходно и через 3,5 мес на фоне терапии препаратом НовоМикс® 30 |
1-я группа насчитывала 250 пациентов (195 женщин/55 мужчин), средняя длительность заболевания — 11,5 ± 6,2 года, исходный уровень HbA1c 9,3 ± 1,8%, ГКН 9,9 ± 2,3 ммоль/л, ППГ 11,7 ± 2,7 ммоль/л. Эта группа получала НовоМикс® 30 в двух инъекциях перед завтраком и перед ужином в комбинации с ПССП, представленными препаратами сульфонилмочевины и метформина в максимальных дозах.
Во 2-ю группу были включены 59 пациентов (44 женщины/15 мужчин), со средней длительностью заболевания 11,7 ± 7,8 года, исходными уровнями HbA1c 9,4 ± 1,8%, ГКН 9,5 ± 2,5 ммоль/л, ППГ 11,3 ± 2,6 ммоль/л. Эта группа пациентов получала НовоМикс® 30 в режиме трех инъекций перед основными приемами пищи.
Данные анализа показали, что в ходе наблюдения в обеих группах достоверно улучшились показатели суточного гликемического профиля (8 точек), определявшиеся в процессе самоконтроля (р Рисунок 4. Динамика HbA1c исходно и через 3,5 мес на фоне терапии препаратом НовоМикс® 30
К концу исследования в обеих группах пациентов уровень HbA1c снизился до 7,5 ± 0,8% (рис. 4).
Таким образом, данные по применению двухфазного аналога инсулина НовоМикс® 30 в практике лечения больных СД 2 типа позволяют сделать следующие выводы.
Литература
М. Б. Анциферов, доктор медицинских наук, профессор
Л. Г. Дорофеева
Эндокринологический диспансер Департамента здравоохранения г. Москвы
Введение современных инсулинов в терапию СД2: совместимость с неинсулиновыми препаратами, преимущества и безопасность.
Инсулинотерапия – эффективный метод лечения сахарного диабета. Аналог инсулина сверхдлительного действия и комбинация инсулинов сверхдлительного и ультракороткого действия позволяют подобрать оптимальную схему лечения и минимизировать риск гипогликемии.
В России, как и во всем мире, отмечается рост заболеваемости сахарным диабетом 2 типа (СД2), который приобрел черты неинфекционной эпидемии. Более того, этот рост сопровождается низкой долей пациентов с диагностированным заболеванием и пациентов, достигших и поддерживающих целевые уровни гликемического контроля на фоне терапии [1, 2].
В соответствии с «Алгоритмами специализированной медицинской помощи больным сахарным диабетом» [3], при недостижении целевого уровня гликированного гемоглобина (HbA1c) в течение 6 месяцев лечение пациентов СД2 должно интенсифицироваться, либо путем добавления второго и/или третьего неинсулиновых сахароснижающих препаратов (НИССП), чтобы воздействовать на разные патологические механизмы диабета, либо назначением инсулинотерапии.
Инсулин, по мнению экспертов Консенсуса, является самым мощным сахароснижающим препаратом. Своевременное начало инсулинотерапии обеспечивает оптимальный контроль гликемии и, соответственно, улучшает прогноз СД2, замедляя развитие в организме необратимых изменений, в том числе сердечно-сосудистых. По мере прогрессирования диабета заболеванием труднее управлять, и инсулин, действие которого не зависит от остаточной секреторной активности бета-клеток, имеет дополнительные преимущества [4–6].
Старт инсулинотерапии: риски и сложности
Инсулинотерапия при СД2 назначается при отсутствии достижения индивидуальных целей гликемического контроля на фоне комбинированной терапии другими сахароснижающими препаратами и требует своевременной и адекватной оптимизации и интенсификации до достижения этих целей. Тем не менее, в реальной клинической практике, даже при условии следования клиническим рекомендациям, у большинства пациентов СД2 не удается достичь целевых уровней HbA1c [7]. Одной из причин неудач является развитие гипогликемических состояний на фоне инсулинотерапии. Гипогликемии, а также страх перед их развитием и увеличением веса при инсулинотерапии,значительно снижают качество жизни больных СД2 [8–11], поэтому, как пациенты с СД2, так и врачи часто откладывают начало лечения инсулином или его оптимизацию и интенсификацию, несмотря на уже имеющиеся осложнения [12–14].
Для преодоления существующих барьеров необходимо объяснять пациентам, что инсулинотерапия с течением времени может понадобиться большинству пациентов с СД2, и субоптимальный гликемический контроль на фоне максимально переносимых доз НИССП является поводом к смене терапии. Инсулинотерапия – эффективный метод управления диабетом, а современные инсулины позволяют подобрать оптимальную схему с учётом индивидуальных особенностей пациента и образа его жизни [15]. Особенно важным представляется и способность инсулинов нового поколения минимизировать риск гипогликемических состояний – наиболее опасного из побочных эффектов инсулинотерапии.
Сочетание инсулинов с различными группами неинсулиновых препаратов
При назначении инсулина на фоне продолжения использования НИССП имеющиеся руководства однозначной рекомендации не предлагают, что связано с разнообразием доз, частоты и комбинаций применения [15]. Необходимо, однако, помнить о нерациональных комбинациях препаратов, сочетание которых противопоказано или не приносит дополнительного эффекта.
Так, общими принципами введения инсулинотерапии в комбинации с НИССП являются:
продолжение приема метформина;
отмена глитазонов в связи с их нежелательным влиянием на массу тела (за исключением подтвержденных случаев выраженной инсулинорезистентности);
отмена препаратов сульфонилмочевины и глинидов при использовании базис-болюсного режима инсулинотерапии или применении прандиального инсулина;
отмена иДПП-4, арГПП-1 при использовании инсулина короткого (ультракороткого) действия [4, 15].
При необходимости дальнейшей интенсификации лечения,возможно присоединение других сахароснижающих препаратов, но очередность назначения не регламентируется и определяется индивидуально. При назначении любой комбинации сахароснижающих препаратов, следует помнить о рациональности сочетания данных препаратов [3].
Рис. 1. Рациональные комбинации сахароснижающих препаратов
.jpg) |
Примечание:
+ рациональная комбинация; НР нерациональная комбинация;
1) за исключением подтвержденных случаев выраженной инсулинорезистентности;
2) у отдельных препаратов не внесена в инструкцию;
3) включая аналоги инсулина.
Современные инсулины и их комбинация с НИССП: преимущества и клинические доказательства
Базальные инсулины
Основным недостатком применения инсулинов в клинической практике, как было упомянуто, является достаточно высокий риск гипогликемических состояний, которые не только негативно влияют на самочувствие и работоспособность пациентов с СД, но и повышают вероятность тяжелых сердечно-сосудистых исходов и внезапной смерти [16].
Со времен появления первых аналогов инсулина постоянно велись поиски препаратов, максимально соответствующих эндогенному профилю человеческого инсулина. Однако, несмотря на замедление скорости абсорбции и улучшенные фармакокинетические параметры, появившиеся традиционные аналоги базального инсулина (инсулин гларгин 100 ЕД/мл и инсулин детемир) не имели оптимального беспикового кинетического профиля. Aналог инсулина сверхдлительного (более 42 часов) действия деглудек обладает не меньшей эффективностью в отношении улучшения гликемического контроля, но значительно реже вызывает развитие гипогликемии, особенно ночной, чем существовавшие ранее аналоги базального инсулина. При этом, очень длительный период действия инсулина деглудек создает возможность более гибкого дозирования базального инсулина в течение суток без ущерба для его эффективности или безопасности, что делает терапию более предсказуемой и более удобной для пациента [17].
Инсулин деглудек может применяться как в качестве монотерапии, так и в комбинации с НИССП или с прандиальным инсулином (в базис-плюс или базис-болюсном режиме). Препарат вводится подкожно 1 раз в день (минимальный интервал между инъекциями должен быть не менее 8 часов, но не более 40 часов) [18]. Как и при использовании других препаратов инсулина, доза должна подбираться индивидуально в каждом конкретном случае, на основании потребностей пациента. В комбинации с НИССП у пациентов с СД2, ранее не получавших инсулин, рекомендуемая начальная доза не отличается от рекомендуемых стартовых доз других базальных аналогов инсулина и составляет 10 ЕД один раз в день [19].
Результаты клинических исследований инсулина деглудек убедительно доказали, что базальный инсулин сверхдлительного действия может значительно улучшать гликемический контроль при более низком риске развития гипогликемий, особенно ночных, в сравнении с традиционно применяемыми аналогами инсулина [20]. При использовании пациентами с СД2 только базального инсулина в комбинации с пероральными сахароснижающими препаратами (НИССП), как деглудек, так и гларгин 100 ЕД/мл очень редко становились причиной развития тяжелых гипогликемических состояний (не более чем у 2% пациентов) [18, 21, 22]. Более того, по завершении титрации доз инсулинов частота тяжелых гипогликемий была значительно ниже на терапии инсулином деглудек, чем инсулином гларгин 100 ЕД/мл [21].
Тяжелые ночные гипогликемии при клинических исследованиях инсулина деглудек также были редкими и регистрировались не более, чем у 3–4% пациентов [18, 20, 21]. Во всех исследованиях 3-й фазы инсулина деглудек частота ночных подтвержденных гипогликемий была ниже, а в 5 из 8 исследований с инсулином гларгин 100 ЕД/мл значимо ниже на терапии инсулином деглудек, чем препаратом сравнения, независимо от режима инсулинотерапии, времени введения, типа СД и длительности инсулинотерапии [23]. Примечательно, что частота всех подтвержденных и ночных подтвержденных гипогликемий при СД2, зарегистрированных в ходе исследований 3-й фазы инсулина деглудек, была на 17% и 32% ниже на фоне терапии инсулином деглудек, чем на инсулине гларгин 100ЕД/мл, а у инсулин-наивных пациентов этот показатель был на 17% и 36% меньше, соответственно. Последующий анализ показал, что риск тяжелых гипогликемий у пациентов с СД2 при лечении инсулином деглудек в базальном режиме на 86% меньше, чем при использовании инсулина гларгин 100 ЕД/мл [23].
С клинической точки зрения, данные представленного мета-анализа показывают, что у пациентов с СД2, ранее не получавших инсулин, старт инсулинотерапии с базального инсулина деглудек, вне зависимости от назначаемого режима (базальный инсулин±НИССП или базис-болюсная терапия) будет сопряжен со значительно более низким риском гипогликемии [19].
Опубликованные результаты двухлетней терапии с использованием инсулина деглудек подтверждают длительную эффективность в достижении устойчивого гликемического контроля, хорошую переносимость и долгосрочную сердечно-сосудистую безопасность сверхдлительного базального аналога инсулина деглудек [24, 25].
Кроме того, в исследованиях было продемонстрирована и способность инсулина деглудек, как в базальном (в частности, в комбинации с НИССП), так и в базис-болюсном режиме улучшать ассоциированное со здоровьем качество жизни [26, 27]. У инсулин-наивных пациентов с СД2, получавших в ходе клинических исследований инсулин деглудек в базальном режиме, существенное улучшение выявлено в отношении оценки таких показателей, как физическая боль и жизнеспособность [21, 28]. Инсулин деглудек был зарегистрирован в России в 2013 г., в том же году включен в клинические рекомендации «Алгоритмы специализированной медицинской помощи больным сахарным диабетом» (7 вып.), и также присутствует в двух последующих пересмотрах [3, 29, 30]. С декабря 2014 г. инсулин деглудек также включен в перечень ЖНВЛП, что существенно расширило возможности его применения для лечения диабета в клинической практике.
Комбинированные инсулины и НИССП: возможности применения и клинические доказательства
В зависимости от индивидуальных показателей и гликемических целей пациента, старт инсулинотерапии на фоне применения НИССП возможен и сразу с комбинации сверхдлинного и ультракороткого инсулина, конечно, при соответствующей коррекции НИССП. Одновременное применение комбинации базального и болюсного инсулина обладает всеми преимуществами интенсивной базис-болюсной инсулинотерапии и при этом позволяет существенным образом упростить схему лечения, по сравнению с режимом многократных инъекций базального и прандиального инсулина [31].
Инсулин деглудек/инсулин аспарт (Райзодег ® ФлексТач ® ) – первый растворимый комбинированный препарат инсулина, содержащий 70% инсулина сверхдлительного действия деглудек и 30% аналога инсулина ультракороткого действия аспарт в одной инъекции [32]. Уникальная молекулярная структура инсулина деглудек позволяет ему не взаимодействовать в растворе в присутствии цинка и фенола с инсулином аспарт. При подкожном введении инсулин деглудек образует в подкожно-жировой клетчатке депо мультигексамерных цепочек, которые медленно с постоянной скоростью диссоциируют с образованием мономеров, обеспечивающих стабильное длительное действие базального инсулина. Гексамеры инсулина аспарт диссоциируют в подкожной клетчатке с образованием быстро всасывающихся в кровоток мономеров, обеспечивающих физиологические эффекты эндогенного инсулина во время еды [30].
Клинические преимущества комбинации инсулина деглудек/инсулина аспарт при СД2 были не раз доказаны, как в отношении монотерапии, так и для сочетания с НИССП. Так, имеются данные о преимуществах профилей эффективности гликемического контроля и сердечно-сосудистой безопасности комбинации инсулина деглудек/аспарт при применении 2 раза в день в сочетании с метформином у пациентов с СД2, ранее не получавших инсулин и не достигших контроля на фоне применения НИССП (HbA1c 7–11 %) по сравнению с широко применяющимися при лечении СД2 инсулинами гларгин 100 ЕД/мл и двухфазным инсулином аспарт 30 (ДИАсп 30) [32, 33]. Инсулин деглудек/инсулин аспарт обеспечивал эквивалентный контроль гликемии при использовании сопоставимых доз инсулина и значительно более низкой частоте подтвержденных гипогликемий, чем ДИАсп 30 (частота всех и ночных эпизодов на 54% и 75% ниже соответственно) [34].
Эффективность и безопасность комбинации инсулина деглудек/аспарт были широко изучены в программе клинических исследований BOOST™, включившей международные многоцентровые рандомизированные контролируемые исследования 3a фазы длительностью 26–52 недели с участием более 2500 пациентов с СД1 и СД2, а также в исследованиях 3b фазы, где он сравнивался с традиционно используемыми режимами старта и интенсификации инсулинотерапии. Все представленные исследования выполнены в дизайне «лечение до цели» с достижением одинаковой эффективности с препаратом сравнения, поэтому имеют ограниченное значение в отношении оценки эффективности лечения, но позволили выявить различия параметров безопасности при достижении эквивалентного гликемического контроля [28].
Результаты 26-недельного исследования у пациентов с СД2, ранее не получавших терапию инсулином и не достигших целей контроля на предшествующей терапии НИССП, показали, что старт с комбинации инсулина деглудек/инсулина аспарт способствует достижению успешного контроля и имеет преимущества в отношении улучшения глюкозы плазмы натощак по сравнению с ДИАсп 30 [35]. В целом во всех исследованиях около 50% пациентов на инсулине деглудек/инсулине аспарт достигли целей гликемического контроля (HbA1c меньше 7,0%), а снижение глюкозы плазмы натощак в конце исследуемого периода было более значимым (клинически и статистически), чем при использовании ДИАсп30, инсулина гларгин 100 ЕД/мл). Средняя разница между группами сравнения достигала 1,0 ммоль/л и более [34–38].
Данные клинических исследований инсулина деглудек/инсулина аспарт у пациентов с СД2 показали, что новый комбинированный препарат инсулина может значительно улучшать гликемический контроль при более низком риске развития гипогликемий, особенно ночных, как в сравнении с существующими в клинической практике предварительно смешанными двухфазными инсулинами (НовоМикс ® 30 ФлексПен ® ), так и базальными аналогами инсулина (гларгин 100 ЕД/мл) [34–38]. У инсулин-наивных пациентов с СД2 терапия комбинированным препаратом инсулина ассоциировалась с клинически и статистически значимой более низкой частотой подтвержденных и ночных подтвержденных гипогликемий (на 54% и 75% соответственно) по сравнению с ДИАсп 30 [35].
Таким образом, клинические исследования и практический опыт применения комбинированного инсулина подтвердили его высокую эффективность в отношении контроля гипогликемических эпизодов и сердечно-сосудистую безопасность у пациентов с СД2. Применение новой комбинации инсулинов в качестве старта инсулинотерапии у пациентов, получающих НИССП, показало преимущества перед большим спектром других препаратов, как в отношении нормализации гликемического профиля, так и в отношении удобства применения.
Заключение
Инсулин – самый мощный сахароснижающий препарат, действие которого не зависит от остаточной функции β-клеток и ограничено лишь риском развития гипогликемий. При неэффективности НИССП назначение инсулинов становится неизбежным, и инсулины нового поколения – аналог человеческого инсулина сверхдлительного действия деглудек и его фиксированная комбинация с аналогом ультракороткого действия аспарт дают возможность назначать инсулинотерапию с минимизацией данных рисков. Клинические исследования подтвердили способность инсулина сверхдлительного действия и комбинации аналогов инсулина сверхдлительного действия и ультракороткого действия сокращать число гипогликемических эпизодов и успешно достигать гликемических целей.
