постхолецистэктомический синдром мкб 10 код у взрослых
Постхолецистэктомический синдром (K91.5)
Алфавитные указатели МКБ-10
Внешние причины травм — термины в этом разделе представляют собой не медицинские диагнозы, а описание обстоятельств, при которых произошло событие (Класс XX. Внешние причины заболеваемости и смертности. Коды рубрик V01-Y98).
Лекарственные средства и химические вещества — таблица лекарственных средств и химических веществ, вызвавших отравление или другие неблагоприятные реакции.
В России Международная классификация болезней 10-го пересмотра (МКБ-10) принята как единый нормативный документ для учета заболеваемости, причин обращений населения в медицинские учреждения всех ведомств, причин смерти.
МКБ-10 внедрена в практику здравоохранения на всей территории РФ в 1999 году приказом Минздрава России от 27.05.97 г. №170
Выход в свет нового пересмотра (МКБ-11) планируется ВОЗ в 2022 году.
Сокращения и условные обозначения в Международой классификации болезней 10-го пересмотра
БДУ — без дополнительных уточнений.
НКДР — не классифицированный(ая)(ое) в других рубриках.
† — код основной болезни. Главный код в системе двойного кодирования, содержит информацию основной генерализованной болезни.
* — факультативный код. Дополнительный код в системе двойного кодирования, содержит информацию о проявлении основной генерализованной болезни в отдельном органе или области тела.
Постхолецистэктомический синдром: диагностика и лечение
Желчнокаменная болезнь (ЖКБ) чрезвычайно распространена в цивилизованных странах, в том числе и в России. Особенно высока заболеваемость среди женщин в возрасте 35–40 лет и старше. ЖКБ характеризуется образованием желчных
Желчнокаменная болезнь (ЖКБ) чрезвычайно распространена в цивилизованных странах, в том числе и в России. Особенно высока заболеваемость среди женщин в возрасте 35–40 лет и старше. ЖКБ характеризуется образованием желчных камней в билиарной системе, главным образом в желчном пузыре, и осложнениями, возникающими в связи с прогрессированием патологического процесса.
Основным методом лечения данного заболевания является холецистэктомия. У 25% перенесших холецистэктомию больных или сохраняются, или через некоторое время появляются абдоминальные боли и диспепсические расстройства, требующие лечения. Адекватная терапия больных зависит от правильного понимания патогенеза клинических симптомов, развивающихся после холецистэктомии. Особенности их формирования связаны, с одной стороны, с нарушениями в обмене холестерина, присущими желчнокаменной болезни, с другой — тем обстоятельством, что патологический процесс протекает в новых анатомо-физиологических условиях, т. е. при отсутствии желчного пузыря.
Известно, что удаление желчного пузыря по поводу калькулезного холецистита не избавляет больных от обменных нарушений, в том числе от печеночно-клеточной дисхолии, которая сохраняется и после операции. У большинства больных после холецистэктомии определяется литогенная желчь с низким холатохолестериновым коэффициентом. Выпадение физиологической роли желчного пузыря, а именно концентрация желчи в межпищеварительный период и выброс ее в двенадцатиперстную кишку во время еды, сопровождается нарушением пассажа желчи в кишечник и расстройством пищеварения. Изменение химического состава желчи и хаотическое ее поступление в двенадцатиперстную кишку нарушают переваривание и всасывание жира и других веществ липидной природы, уменьшают бактерицидность дуоденального содержимого, что приводит к микробному обсеменению двенадцатиперстной кишки, ослаблению роста и функционирования нормальной кишечной микрофлоры, расстройству печеночно-кишечной циркуляции и снижению общего пула желчных кислот. Под влиянием микрофлоры желчные кислоты подвергаются преждевременной деконъюгации, что сопровождается повреждением слизистой оболочки двенадцатиперстной, тонкой и толстой кишки с развитием дуоденита, рефлюкс-гастрита, энтерита и колита. Дуоденит сопровождается дуоденальной дискинезией и, в первую очередь, дуоденальной гипертензией с развитием дуодено-гастральных рефлюксов и забросом содержимого в общий желчный проток и проток поджелудочной железы.
В результате формируются дискинезии сфинктера печеночно-поджелудочной ампулы, желчного и панкреатического протоков (сфинктера Одди), а деконъюгированные желчные кислоты обусловливают развитие диареи. Таким образом, у больных с удаленным желчным пузырем имеющиеся клинические проявления могут быть связаны с изменением химического состава желчи, нарушенным пассажем ее в двенадцатиперстную кишку, дискинезией сфинктера Одди, а также с избыточным бактериальным ростом в кишечнике, синдромами мальдигестии и мальабсорбции, дуоденитом и другими патологическими нарушениями в системе пищеварения. Кроме того, у ряда больных могут сохраняться или развиваться вновь органические препятствия для оттока желчи, связанные с проведенной холецистэктомией. Патологические состояния, которые наблюдаются у больных после холецистэктомии, можно разделить на 3 группы.
В настоящее время термином «постхолецистэктомический синдром» принято обозначать только дисфункцию сфинктера Одди, обусловленную нарушением его сократительной функции и препятствующую нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку при отсутствии органических препятствий. При этом предлагается, вместо принятых ранее определений «постхолецистэктомический синдром», «билиарная дискинезия» и др., использовать термин «дисфункция сфинктера Одди».
Клинические проявления дисфункции сфинктера Одди зависят, в первую очередь, от вовлечения в процесс той или иной его структуры. При изолированной дисфункции сфинктера холедоха развиваются билиарные, при преимущественном вовлечении в процесс сфинктера панкреатического протока — панкреатические, а при патологии общего сфинктера — сочетанные билиарно-панкреатические боли. Для дисфункции сфинктера Одди характерны рецидивирующие приступы сильных или умеренных болей продолжительностью 20 и более минут, повторяющиеся в течение 3 и более месяцев. При билиарном типе боль локализуется в эпигастрии или правом подреберье с иррадиацией в спину и правую лопатку, при панкреатическом типе — в левом подреберье с иррадиацией в спину уменьшающаяся при наклоне вперед, при сочетанном типе — имеет опоясывающий характер. Боль может сочетаться со следующими признаками: а) начало после приема пищи; б) появление в ночные часы; в) тошнота и/или рвота.
Однако оценка только клинических симптомов недостаточна для исключения органической патологии билиарной системы. С этой целью используются ряд скрининговых и уточняющих методов (табл.).
Неинвазивные методы, позволяющие предположить дисфункцию сфинктера Одди, включают определение в крови уровня билирубина, щелочной фосфатазы, аминотрансфераз, амилазы и липазы. Лабораторные исследования необходимо проводить во время или не позднее 6 ч после окончания болевого приступа, а также в динамике. Транзиторное повышение в 2 и более раз уровня печеночных или панкреатических ферментов в период не менее чем при 2 последовательных приступах болей является важным в подтверждении дисфункции сфинктера Одди.
Аналогичное значение имеет провокационный морфино-простигминовый тест, когда парентеральное введение препаратов провоцирует развитие болевого приступа, чаще смешанного билиарно-панкреатического типа в сочетании с повышением в крови уровня аминотрансфераз, щелочной фосфатазы, панкреатических ферментов. Однако диагностическая ценность данного теста ограничена его низкой чувствительностью и специфичностью.
При УЗИ важное значение придается расширению холедоха и главного панкреатического протока, которое свидетельствует о нарушении тока желчи и панкреатического секрета на уровне сфинктера Одди. В то же время у 3-4% больных, перенесших холецистэктомию и не имеющих симптомов, отмечается расширение общего желчного протока. Определенное значение имеет ультразвуковое исследование диаметра общего желчного протока с использованием жирных завтраков, стимулирующих выработку эндогенного холецистокинина и увеличивающих холерез. После пробного завтрака измерение диаметра холедоха проводится каждые 15 мин в течение 1 ч. Увеличение его диаметра на 2 мм и более по сравнению с исходным позволяет предположить наличие неполной обтурации холедоха как в результате дисфункции сфинктера Одди, так и из-за органической патологии билиарной системы.
Для оценки состояния панкреатических протоков используется проба с введением секретина в дозе 1 мг/кг. В норме после стимуляции панкреатической секреции секретином при УЗИ отмечается расширение панкреатического протока в течение 30 мин с последующим его уменьшением до исходного уровня. Если проток остается расширенным более 30 мин, это свидетельствует о нарушении его проходимости.
При билисцинтиграфии о наличии дисфункции сфинктера Одди свидетельствует увеличение времени транзита радиофармпрепарата от ворот печени до двенадцатиперстной кишки, при этом оно пропорционально уровню базального давления сфинктера Одди. В то же время при расширенном холедохе данное исследование малоинформативно для оценки функции сфинктера Одди.
К инвазивным методам оценки функции сфинктера Одди относится непрямой способ — эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ). Косвенными признаками повышения тонуса сфинктера Одди являются диаметр холедоха более 12 мм, задержка контраста в холедохе свыше 45 мин. О дисфункции сфинктера главного панкреатического протока свидетельствуют расширение последнего до более чем 5 мм и замедление эвакуации контраста из его просвета. Однако аналогичные изменения могут наблюдаться и при наличии органической патологии.
Наиболее точным методом, подтверждающим дисфункцию сфинктера Одди, является манометрия. При этом возможно канюлирование раздельно холедоха и вирсунгова протока с проведением манометрии их сфинктеров, что позволяет выделить преимущественно билиарный или панкреатический тип расстройств, а также установить этиологию рецидивирующих панкреатитов у больных, перенесших холецистэктомию и папиллотомию. Признаками дисфункции сфинктера Одди при манометрическом исследовании являются:
Манометрия сфинктера Одди показана далеко не всем больным. Выбор данного исследования основывается на оценке тяжести клинических проявлений и эффективности консервативной терапии.
Таким образом, предположить, что речь идет о дисфункции сфинктера Одди можно в следующих ситуациях:
Примерные формулировки диагнозов у больных, перенесших холецистэктомию:
Диагноз: желчнокаменная болезнь, холецистэктомия в 1994 г. (для случаев, при которых отсутствуют клинические симптомы).
Диагноз: дисфункция сфинктера Одди билиарного типа. Желчнокаменная болезнь, холецистэктомия в 1999 г.
Диагноз: хронический рецидивирующий (обструктивный) панкреатит с внешнесекреторной и инкреторной недостаточностью в фазе обострения.
Сопутствующее заболевание: желчнокаменная болезнь, холецистэктомия в 1994 г.
Диагноз: синдром раздраженного кишечника с преобладанием запоров в фазе обострения.
Сопутствующий диагноз: желчнокаменная болезнь, холецистэктомия в 1994 г.
Ведение больных, перенесших холецистэктомию. Цель лечения: восстановить нормальное поступление желчи и панкреатического секрета из билиарных и панкреатических протоков в двенадцатиперстную кишку. Задачи лечения: нормализовать химический состав желчи; восстановить проходимость сфинктера Одди; восстановить нормальный состав кишечной микрофлоры; нормализовать процессы пищеварения и моторику тонкой кишки для профилактики дуоденальной гипертензии.
Для профилактики образования желчных сладжей или камней во внепеченочной билиарной системе рекомендуется:
Медикаментозное лечение дисфункции сфинктера Одди направлено на снятие спазма гладкой мускулатуры последнего. С этой целью используется ряд препаратов, обладающих спазмолитическим эффектом. Нитраты: нитроглицерин используется с целью быстрого купирования болей, нитросорбит — для курсового лечения. Механизм действия нитратов сводится к образованию в гладких мышцах свободных радикалов оксида азота (NO), которые активируют гуамилатциклазу и увеличивают содержание цГМФ, что приводит к их расслаблению. Однако выраженные кардиоваскулярные эффекты, побочные действия и развитие толерантности делают их малоприемлемыми для длительной терапии дисфункции сфинктера Одди.
Антихолинергические средства блокируют мускариновые рецепторы на постсинаптических мембранах органов-мишеней. В результате происходит блокада кальциевых каналов, прекращается вход ионов кальция в цитоплазму гладкомышечных клеток и, как следствие, достигается снятие мышечного спазма. В качестве спазмолитиков используются как неселективные (препараты красавки, метацин, платифиллин, бускопан и др.), так и селективные М-холиноблокаторы (гастроцепин и др.). Однако при приеме препаратов данной группы может наблюдаться достаточно широкий спектр побочных эффектов: сухость во рту, задержка мочеиспускания, нарушения зрения, повышение внутриглазного давления, тахикардия, запоры, сонливость. Сочетание довольно низкой эффективности с широким спектром побочных действий ограничивает применение препаратов этой группы при дисфункции сфинктера Одди.
Блокаторы медленных кальциевых каналов — фенилалкиламины (верапамил, галлопамил), 1,4-дигидроперидины (нифедипин, амлодипин) и бензотиазепины (дилтиазем и др.) закрывают кальциевые («медленные») каналы клеточных мембран, препятствуют входу ионов кальция в цитоплазму клеток гладкой мускулатуры и вызывают ее релаксацию. Препараты обладают многочисленными кардиоваскулярными эффектами, в первую очередь вазодилатирующими, в связи с чем не нашли широкого применения при лечении дисфункции сфинктера Одди. Имеются лишь единичные публикации по использованию нифедипина при дисфункции сфинктера Одди, и целесообразность их применения требует дальнейшего изучения.
Миотропные спазмолитики, механизм действия которых сводится к ингибированию фосфодиэстеразы, или к активации аденилатциклазы, или к блокаде аденозиновых рецепторов, что приводит к снижению тонуса и двигательной активности гладкой мускулатуры. Представителями данной группы препаратов являются дротаверин (но-шпа, но-шпа форте), бенциклан (галидор), дицикловерин (триган-Д), альверин (метеоспазмил) и др.
Основными недостатками препаратов всех вышеуказанных групп являются:
В отличие от них, гимекромон (одестон) обладает избирательным спазмолитическим действием на сфинктер Одди и сфинктер желчного пузыря. Кроме того, препарат не повышает давление в желчных путях, не оказывает влияния на секреторную функцию пищеварительных желез и процессы кишечной абсорбции.
В восстановлении нормального оттока желчи при отсутствии желчного пузыря, наряду с проходимостью сфинктера Одди, большое значение имеет уровень давления в двенадцатиперстной кишке. Если он превышает секреторное давление желчи и панкреатического сока, они будут депонироваться в билиарных и панкреатических протоках с соответствующими последствиями.
В связи с этим разрешение дуоденальной гипертензии считается непременным условием ведения больных с дисфункцией сфинктера Одди. При выборе тактики лечения следует учитывать, что основным патогенетическим механизмом развития дуоденальной гипертензии является избыточное содержание жидкости и газа в просвете двенадцатиперстной кишки в результате бродильно-гнилостных процессов, обусловленных микробной контаминацией.
Для деконтаминации двенадцатиперстной кишки проводятся 1-2 семидневных курса антибактериальной терапии со сменой препарата при очередном курсовом лечении. Препаратами выбора являются: доксициклин 0,1 г 2 раза в день, тетрациклин 0,25 г 4 раза в день, бисептол 960 мг 2 раза в день, фуразолидон 0,1 г 3 раза в день, эрсефурил 0,2 г 4 раза в день, ципрофлоксацин 250 мг 2 раза в день, метронидазол 0,25 г 4 раза в день, интетрикс 1 капсула 4 раза в сутки, реже — левомицетин 0,25 г 4 раза в день.
Подбор лекарственных средств проводится, как правило, эмпирически. При выраженных симптомах диспепсии назначаются сразу 2 препарата, один из которых должен действовать преимущественно на анаэробную микрофлору (например, метронидазол). Одновременно с приемом кишечных антисептиков в ряде случаев назначаются пребиотики: при наличии поносов — хилак форте 60 капель 3 раза в день в течение 1 нед, затем по 30 капель 3 раза в день в течение 2 нед; в случаях преобладания запоров — лактулоза по 1-2 столовые ложки 1 раз в день до нормализации стула.
После окончания антибактериальной терапии показаны пробиотики (препараты, содержащие нормальные штаммы кишечной флоры). Одним из известных представителей группы пробиотиков является бифиформ, содержащий в одной капсуле, покрытой энтерорастворимой оболочкой, энтерококки 107, бифидумбактерии 107 и питательную среду, способствующую их росту в тонкой и толстой кишке. Назначается препарат по 1 капсуле 2 раза в день в течение 2 нед. В комплексе с антибактериальными средствами необходимо назначать алюминийсодержащие буферные антациды (алюгастрин, алюмаг, маалокс, фосфалюгель, смекта и др.). Любой из препаратов принимается по 1 дозе через 1 ч после завтрака, обеда и ужина и перед сном (не сочетаются с хилаком форте). Продолжительность лечения составляет 5–7 дней. Целесообразность использования данных препаратов обусловлена следующими их способностями:
Наличие у большинства больных относительной ферментной недостаточности в результате разрушения пищеварительных ферментов дуоденальной и тонкокишечной микрофлорой, снижения интрадуоденального уровня рН, а также нарушения процесса смешивания их с пищевым химусом является обоснованием назначения ферментных препаратов. При склонности к поносам назначаются препараты панкреатина: мезим форте, креон, ликреаза, панцитрат и другие по 1 дозе 2-3 раза в день в начале еды; при склонности к запорам — комбинированные средства, содержащие панкреатин, желчные кислоты, гемицеллюлозу: фестал, энзистал, дигестал по 1 драже 2-3 раза в день в конце приема еды. Продолжительность лечения индивидуальна и, как правило, не превышает 10 дней.
Приведем ориентировочные схемы ведения больных с дисфункцией сфинктера Одди.
Диагноз: дисфункция сфинктера Одди билиарного типа. Желчнокаменная болезнь, холецистэктомия в 1996 г.
Диагноз: дисфункция сфинктера Одди билиарного типа. Желчнокаменная болезнь, холецистэктомия в 1989 г. Сопутствующие заболевания: хронический катаральный, преимущественно дистальный дуоденит. Синдром избыточного бактериального роста в тонкой кишке.
Таким образом, своевременная и правильная оценка клинической симптоматики, развивающейся у больных после операции холецистэктомии, дает возможность подобрать адекватную терапию и в результате существенно улучшить качество жизни пациентов с заболеваниями гепатобилиарной системы.
По вопросам литературы обращайтесь в редакцию.
П. Я. Григорьев, доктор медицинских наук, профессор, Э. П. Яковенко, доктор медицинских наук, профессор
Н. А. Агафонова, кандидат медицинских наук, А. С. Прянишникова, кандидат медицинских наук
И. П. Солуянова, кандидат медицинских наук, З. В. Бекузарова, А. В. Яковенко, кандидат медицинских наук
РГМУ, Москва
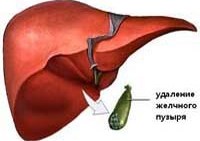
Постхолецистэктомический синдром
Постхолецистэктомический синдром – специфический симптомокомплекс, обусловленный перенесенной холецистэктомией и связанными с этим изменениями функционирования желчевыделительной системы. К проявлениям постхолецистэктомического синдрома относятся рецидивирующие болевые приступы, диспепсические расстройства, диарея и стеаторея, гиповитаминоз, снижение массы тела. Для выявления причин синдрома проводится УЗИ и МСКТ брюшной полости, фиброгастродуоденоскопия, РХПГ. Лечение постхолецистэктомического синдрома может быть консервативным (щадящая диета, прием спазмолитиков и ферментов) и хирургическим (дренирование желчных протоков, эндоскопическая сфинктеропластика и др.).
МКБ-10
Общие сведения
Постхолецистэктомический синдром – это комплекс клинических симптомов, развивающийся вследствие оперативного удаления желчного пузыря. В группу пациентов с постхолецистэктомическим синдромом не входят больные, у которых проведена холецистэктомия с погрешностями, остались камни в желчных протоках, развился послеоперационный панкреатит, сопровождающийся сдавлением общего желчного протока, холангит.
Постхолецистэктомический синдром встречается в среднем у 10-15% пациентов (при этом в разных группах этот показатель доходит до 30%). У мужчин он развивается практически в два раза реже, чем у женщин. Постхолецистэктомический синдром может развиться сразу после проведения оперативного удаления желчного пузыря, а может проявиться спустя длительное время (несколько месяцев, лет).
Причины
Основным патогенетическим фактором развития постхолецистэктомического синдрома является нарушение в билиарной системе – патологическая циркуляция желчи. После удаления желчного пузыря, являющегося резервуаром для вырабатываемой печенью желчи и участвующего в своевременном достаточном ее выделении в двенадцатиперстную кишку, привычный ток желчи изменяется. В некоторых случаях нормальное снабжение кишечника желчью не удается обеспечить. Окончательный механизм этих нарушений еще недостаточно изучен.
Факторами, способствующими развитию постхолецистэктомического синдрома, могут быть имеющие место дискинезии желчевыводящих путей, спазм сфинктера Одди (мышечного образования в месте впадения общего желчного протока в двенадцатиперстную кишку), оставшийся после операции пузырный проток значительной длины. Иногда причинами возникновения этого синдрома может быть выраженная послеоперационная боль и скопление жидкости в области произведенной операции. Только в 5% случаев причину развития постхолецистэктомического синдрома выявить не удается.
Симптомы постхолецистэктомического синдрома
Данный симптомокомплекс может проявляться сохранением клинических проявлений, имевших место до операции, в той или иной степени выраженности (чаще всего менее выраженных, но иногда отмечают и усиление дооперационной клиники). Иногда после холецистэктомии возникают новые симптомы.
Основной симптом – болевой. Боль может быть как режущей, так и тупой, различной степени интенсивности. Встречается приблизительно в 70% случаев. Вторым по распространенности является диспепсический синдром – тошнота (иногда рвота), вздутие и урчание в животе, отрыжка с горьким привкусом, изжога, диарея, стеаторея. Секреторные нарушения приводят к нарушению всасывания пищи в 12-перстной кишке и развитию синдрома мальабсорбции. Следствием этих процессов служат гиповитаминоз, снижение массы тела, общая слабость, ангулярный стоматит.
Также может подниматься температура тела, возникать желтуха (иногда проявляется только субиктеричностью склер). Постхолецистэктомический синдром может принимать различные клинические формы, проявляясь ложными и истинными рецидивами камнеобразования холедоха, стриктурами общего желчного протока, стенозирующим папиллитом, спаечным процессом в подпеченочном пространстве, холепанкреатитом, билиарными гастродуоденальными язвами.
Диагностика
В ряде случаев диагностирование развивающегося постхолецистэктомического синдрома бывает затруднено сглаженной, слабо выраженной клинической картиной. Для получения полноценной медицинской помощи пациенту в послеоперационном периоде и в дальнейшей жизни без желчного пузыря необходимо внимательно относиться к сигналам своего организма и однозначно сообщать об имеющихся жалобах своему врачу. Необходимо помнить, что постхолецистэктомический синдром – это состояние, требующее выявления причин его возникновения и соответствующей этиологической терапии.
Для выявления состояний, приведших к развитию постхолецистэктомического синдрома, назначают лабораторные исследования крови, чтобы обнаружить возможный воспалительный процесс, а также инструментальные методики, направленные на диагностирование патологий органов и систем, как непосредственно оказывающих влияние на работу билиарной системы, так и опосредованно действующих на общее состояние организма.
Спиральная компьютерная томография (МСКТ) и магнитно-резонансная томография (МРТ печени) максимально точно визуализирует состояние органов и сосудов брюшной полости, также информативной методикой является УЗИ брюшной полости. Эти методы могут выявить присутствие конкрементов в желчных протоках, послеоперационное воспаление желчных путей, поджелудочной железы.
При рентгенографии легких исключают заболевания легких и средостения (которые могут быть причиной болевого синдрома), рентген желудка с контрастным веществом может помочь выявить наличие язв и непроходимости в желудочно-кишечном тракте, рефлюкса.
Для исключения происхождения симптомов в результате иных заболеваний пищеварительного тракта, производят эндоскопическое исследование желудка (гастроскопия) и двенадцатиперстной кишки (фиброгастродуоденоскопия). Нарушения в циркуляции желчи выявляют с помощью радионуклеидного исследования – сцинтиграфии. При этом в организм вводится специфический маркер, который скапливается в желчи.
Одним из самых информативных методов, позволяющих изучить состояние протоков билиарной системы является РХПГ (эндоскопическая ретроградная панкреатохолангиография). В ходе этого исследования выявляются нарушения тока желчи, отмечают состояние желчных путей, протоков, ампулы Фатерова сосочка, выявляют мелкие конкременты, отмечают скорость выделения желчи. Также можно произвести манометрию сфинктера Одди и общего желчного протока.
Во время проведения РХПГ возможно осуществить некоторые лечебные мероприятия: удалить имеющиеся в протоках камни, расширить просвет желчных путей в местах сужений, произвести сфинктеротомию при стойком спазме. Однако стоит помнить, что в некоторых случаях эндоскопия желчных протоков способствует возникновению панкреатита. Для исключения патологии сердца используют ЭКГ.
Лечение постхолецистэктомического синдрома
Методы лечения постхолецистэктомического синдрома напрямую зависят от причин его развития. В том случае, если данный синдром является следствием какой-либо патологии органов пищеварения, лечение осуществляют согласно рекомендациям по терапии данной патологии.
Лечение, как правило, включает в себя щадящую диету: соблюдение режима питания – еда небольшими порциями 5-7 раз в день, пониженное суточное содержание жиров (не более 60 грамм), исключение жареных, кислых продуктов, острой и пряной пищи, продуктов, обладающих желчегонной активностью, раздражающих слизистые оболочки элементов, алкоголя. При выраженном болевом синдроме для его купирования применяют дротаверин, мебеверин. Лекарственные средства назначаются гастроэнтерологом в соответствии с принципами медикаментозного лечения основной патологии.
Хирургические методы лечения направлены на дренирование и восстановление проходимости желчных протоков. Как правило, проводится эндоскопическая сфинктеропластика. При неэффективности производят диагностическую операцию для детального изучения брюшной полости на предмет вероятных причин развития синдрома.
Профилактика и прогноз
В качестве профилактики постхолецистэктомического синдрома можно отметить меры по своевременному выявлению различных сопутствующих заболеваний, могущих послужить причиной развития нарушений циркуляции желчи: полное и тщательное комплексное обследование печени, поджелудочной железы, желчевыводящих путей, пищеварительного тракта, сосудистой системы брюшной полости при подготовке к операции.
Прогноз излечения от постхолецистэктомического синдрома связан с излечением от основного заболевания, послужившего причиной развития симптомокомплекса.