После уколов гепарина в живот появились уплотнения чем лечить
После уколов гепарина в живот появились уплотнения чем лечить
Гепарин является классическим антикоагулянтом прямого действия, который находит широкое применения в клинике для сохранения текучести крови и профилактики тромбозов. Вводится он для указанных целей парентерально, а чаще всего подкожно. При этом в местах инъекций нередко развиваются кровоподтеки. Несмотря на то, что кровоподтеки считаются убедительным доказательством повреждений и травм в судебной медицине, постинъекционные кровоподтеки до сих пор не считаются свидетельством повреждений [1, 2, 6, 9, 10]. Более того, постинъекционные кровоподтеки до такой степени стали привычными последствиями инъекций, что в настоящее время в Росси и в других странах мира регистрация этих кровоподтеков не проводится [3, 4, 7, 8]. Не проводится контроль динамики их развития, хотя иногда эти кровоподтеки могут иметь гигантские размеры и даже начинают пугать пациентов и окружающих своим видом [8]. Для того, чтобы избежать лишних волнений, медицинские работники вводят гепарин в части тела, прикрытые одеждой.
Тем не менее, постинъекционные кровоподтеки (синяки), возникающие в местах инъекций гепарина, продолжают волновать пациентов. Нет вразумительного объяснения механизму их развития, нет признания наличия данной проблемы и нет официально признанной группы средств, отбеливающих кожу в области кровоподтеков [6]. В частности, до сих пор не понятно, к чему относить постинъекционные кровоподтеки, возникающие в местах инъекций гепарина: к норме или к осложнениям. Кроме этого, не описаны клинические варианты и динамика постинъекционных кровоподтеков в местах инъекций гепарина. До сих пор игнорируется предложение А.Л. Уракова и Н.А. Ураковой считать кровоподтек самостоятельным вариантом постинъекционной болезни кожи [3, 6, 8, 10].
Цель исследования: демонстрация динамики постинъекционных кровоподтеков кожи в местах подкожных инъекций гепарина на примере одного клинического случая.
Материалы и методы исследования
Проведено наблюдение за динамикой цвета кожи в местах инъекций гепарина и за динамикой постинъекционных кровоподтеков в коже у 15 пациентов, находящихся на стационарном лечении в кардиологическом отделении ГАУЗ РТ «Больница скорой медицинской помощи» города Набережные Челны. В качестве гепарина применяли препарат, «Гепарин раствор для внутривенного и подкожного введения 5000 МЕ/мл» РУП (БЕЛМЕДПРЕПАРАТ) (рис. 1).
Рис. 1. Внешний вид упаковки гепарина использованного для инъекций
Раствор гепарина вводили под кожу передней стенки живота пациентов по назначению лечащего врача ежедневно 4 раза в день посредством стандартного шприца и иглы, предназначенного для подкожных инъекций. Динамика цвета и состояния кожи живота фиксировалась посредством ежедневного фотографирования с помощью профессионального фотоаппарата при естественном освещении.
Результаты исследования отображены в виде серии цветных фотографий, наглядно отображающих динамику развития кровоподтеков в местах инъекций у пациентки Г.
Результаты исследования и их обсуждения
Эволюция размеров и форм синяков, возникших на месте подкожных инъекций гепарина, показана в виде серии цветных фотографий передней стенки живота у одного пациента (рис. 2).
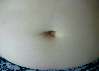
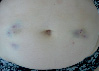
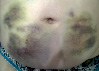
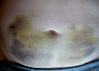
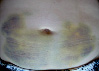

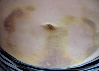
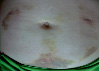
Рис. 2. Динамика внешнего вида передней стенки живота пациентки Г. (возраст 50 лет) до и после курса ежедневных подкожных инъекций гепарина в дозе 5000 МЕ: а – до инъекций, б – второй день введения гепарина, в – шестой день введения гепарина, г – первый день после прекращения инъекций гепарина, д – второй день после прекращения инъекций гепарина, е – третий день после прекращения инъекций гепарина, ж – восьмой день после прекращения инъекций гепарина, з – двенадцатый день после прекращения инъекций гепарина
Следует указать, что субъективно пациентка ощущала тепло в области кровоподтеков, однако жалоб на неблагополучие в области синяков не предъявляла. В частности, она не жаловалась на симптомы воспаления в области кровоподтеков. Проведенное исследование состояния кожи в области кровоподтеков не выявило существенного ее изменения. Поэтому лечение синяков не проводилось. У данной пациентки кровоподтеки исчезли бесследно через 3 недели.
Было проведено изучение содержания медицинских документов. Установлено, что ни в одной карте стационарного больного ни у одного пациента из 15 человек, вошедших группу исследования, не было ни одного указания на наличие у них постинъекционных кровоподтеков, их динамики и исхода.
Тем не менее, приведенные фотографии неопровержимо доказывают наличие кровоподтеков в местах подкожных инъекций гепарина, а также свидетельствуют о благоприятном их исходе.
В связи с этим предлагается производить ежедневное фотографирование кожи в местах инъекций гепарина с целью подготовки материалов для объективного рассмотрения причин и последствий постинъекционных осложнений при возможной судебно-медицинской экспертизе.
Чем лечить шишки от уколов на ягодицах
По-научному «шишки» от уколов называют постинъекционными инфильтратами ягодиц. «Они представляют собой уплотнения, которые возникают спустя некоторое время после внутримышечной инъекции, — рассказывает заведующая отделением амбулаторной хирургии одной из медицинских клиник Москвы. — Они являются патологической ответной реакцией организма на введение лекарства, вне зависимости от его типа».
«Шишки» на ягодицах после укола бывают нескольких видов. «Первый вариант — это инфильтрат, то есть местная реакция, которая характеризуется ответом тканей в месте инъекции — отеком, — объясняет врач-хирург, аспирант ФУВ кафедры хирургии, отделения хирургической эндокринологии ГБУЗ МО МОНИКИ им. М. Ф. Владимирского. — Второй вариант — гематома. Она появляется от кровоизлияния поврежденного сосуда после инъекции, к сожалению, заранее спрогнозировать это невозможно».
Третий вариант (и самый опасный) — это абсцесс. «Абсцессы — очень болезненные образования с гнойным содержимым и яркой клинической картиной, лечат их только хирургическим путем», — добавляет доктор.
По сути, «шишки» — это местная реакция организма на прокол и введение лекарства внутримышечно. Если их не лечить, инфильтраты могут стать абсцессами, что представляет серьезную угрозу для здоровья. «В большинстве случаев у относительно здоровых людей они проходят в течении недели, но бывают и исключения», — замечает врач.
Почему возникают шишки от уколов на ягодицах?
К образованию припухлостей после инъекций может привести несколько факторов.
Чтобы шишки от уколов не появлялись, эксперты советуют делать инъекции, соблюдая определенные правила. «Важно использовать иглы подходящей длины и диаметра, выбор зависит от возраста пациента, места введения, объема жидкости, количества мышечной и жировой ткани и вязкости раствора, — говорит Булат Юнусов. — Нужно строго соблюдать правила асептики и антисептики. Выполнять инъекции предпочтительно лежа на кушетке или кровати».
Как лечить шишки на ягодицах
В независимости от того, по какой причине у вас возникли болезненные уплотнения после уколов, лечить их все равно нужно. «Заниматься самолечением, особенно при „свежих“ инфильтратах, точно не стоит, так как любой инфильтрат может как рассосаться, так и нагноиться. Сразу объясню, что такое „свежий“ инфильтрат. Это уплотнение, которое вы обнаружили сразу после инъекции или он не старше 14 дней. Если инфильтрату 1-2 месяца и более, то вероятность его нагноения достаточно мала, но и вероятность его полного рассасывания также стремится к нулю», — замечает специалист.
Если дело не дошло до абсцесса, то можно обойтись довольно простыми средствами — использованием гелей, мазей и компрессов. «Какое конкретно лекарственное средство необходимо вам, кратность и длительность его применения, определяет врач на очном приеме после осмотра и проведения необходимых методов обследования (УЗИ мягких тканей)», — говорит доктор.
В домашних условиях гематомы и инфильтраты можно лечить безопасными средствами. «Допустимо умеренное массирование места инъекции, выполнение приседаний и применение холодных компрессов на место отека в первые 1-2 дня после его появления», — напоминает Булат Юнусов.
«Шишки после уколов можно лечить йодной сеточкой, но лучше пойти на прием к врачу-хирургу, чтобы он назначил физиотерапию», — рекомендует врач-терапевт.
Физиотерапию назначают как дополнение к основному лечению, что позволяет сократить его сроки. Среди наиболее эффективных методов отмечают:
Шишки после уколов на ягодицах: когда бить тревогу
Если инъекция сделана правильно и у вас нет аллергии на препарат, скорее всего, отека на ягодицах не будет. «Человек может испытывать легкий дискомфорт после укола, который проходит в течение нескольких минут — после интенсивной ходьбы, приседаний», — предупреждает Булат Юнусов.
Но, если после инъекций у вас возникли некоторые из следующих симптомов, следует обратиться к врачу:
Не откладывайте визит к врачу, поскольку это может иметь серьезные последствия для здоровья.
Причины геморрагических осложнений у пациентов стационара, получающих лечебные дозы антикоагулянтов
Широкое применение антикоагулянтов (АК) нередко сопровождается нежелательными явлениями, среди которых чаще всего встречаются геморрагические осложнения.
Оценить частоту и структуру кровотечений, связанных с использованием АК в многопрофильном стационаре, и разработать план мероприятий, направленных на снижение риска развития данных осложнений.
Материалы и методы
Ретроспективно проанализированы электронные истории болезни пациентов, госпитализированных в многопрофильный стационар с 01.01.2015 по 15.03.2018 и перенесших геморрагические осложнения (в том числе при поступлении в стационар) на фоне приема «лечебных»» доз АК, назначенных по следующим показаниям: фибрилляция предсердий, тромбоз глубоких вен, тромбоэмболия легочной артерии, механический протез сердечного клапана. Оценивали частоту, локализацию, тяжесть и предотвратимость кровотечений, а также их основные и дополнительные причины по методу Root Cause Analysis (RCA, анализ основных причин).
На протяжении 38 месяцев АК в «лечебных» дозах получали 2093 пациента. У 43 (2,1%) из них были зарегистрированы геморрагические осложнения. Частота назначения варфарина, низкомолекулярных гепаринов (НМГ) и прямых оральных антикоагулянтов (ПОАК) составила 28%, 32% и 46%, соответственно. Частота кровотечений при лечении разными АК достоверно не различалась и составила 2,8% при приеме варфарина, 1,6% – ПОАК и 2,2% – НМГ. Чаще всего встречались желудочно-кишечные кровотечения (33%) и гематурия (21%). Факторы пациента признаны основной причиной кровотечений в 83,7% случаев, факторы персонала – в 14,0%, организационные факторы – в 2,3%. С ошибками использования ЛС были связаны 16% кровотечений. Сопутствующие заболевания пациента были самой частой причиной кровотечений (63%). Потенциально предотвратимыми были 35% кровотечений.
По итогам RCA был составлен план устранения потенциально предотвратимых факторов кровотечений, связанных с пациентом, персоналом и организацией лечебно-диагностического процесса.
Широкое применение антикоагулянтов (АК) нередко приводит к нежелательным явлениям (НЯ), требующим обращения за медицинской помощью. Общее число обращений по поводу НЯ, развивающихся на фоне приема антикоагулянтных препаратов, в 2,4 раза превышает таковое при применении опиоидов [1]. По данным Института безопасной лекарственной практики (Institute for Safe Medication Practice), в 2016 году в США зарегистрировано 22 тыс сообщений о развитии НЯ при приеме АК, что составило примерно 10% от всех обращений за медицинской помощью пациентов, принимающих АК [2]. В США в 2013-2014 гг. антикоагулянты были самой частой причиной обращения за неотложной помощью по поводу НЯ; примерно в половине случаев (48,8%) пациенты нуждались в госпитализации [1]. Доля лекарственных нежелательных реакций среди всех осложнений, связанных с оказанием медицинской помощи в стационаре, составляет 39,6% [3]. Число НЯ в стационаре на 1000 выписанных пациентов, получавших нефракционированный гепарин (НФГ), составило 6,0, низкомолекулярные гепарины (НМГ) или прямые оральные АК (ПОАК) – 7,6, варфарин – 3,7 [3].
Основную долю НЯ, связанных с АК, составляют кровотечения (около 80%) различной локализации [1], которые возникают у 8-19% пациентов, длительно получающих препараты этой группы 6. У пациентов, принимавших АК для профилактики тромбоэмболических осложнений при фибрилляции предсердий, чаще развивались желудочно-кишечные кровотечения (8495 из 17218 случаев), а также внутримозговые кровоизлияния (1809 из 17218 случаев) [7].
Профилактика НЯ, связанных с приемом АК, в том числе кровотечений, способствует снижению расходов на медицинскую помощь. Например, внедрение программы «Saving Lives and Saving Money: Hospital-Acquired Conditions», разработанной Agency for Healthcare Research and Quality, привело к снижению частоты НЯ в стационарах США в 2010-2014 гг. и позволило съэкономить более 1 млрд долларов [3]. Затраты на лечение последствий НЯ, связанных с приемом АК, в США оцениваются в 40 640$ в расчете на одно событие (учитывая стоимость медикаментов и трудозатрат медперсонала) [8].
Эффективным инструментом анализа и управления риском возникновения НЯ является анализ основных причин (root cause analysis – RCA) [9]. Объединенная комиссия по аккредитации медицинских учреждений США (Joint Commission AHO) в 1997 году впервые использовала метод RCA для анализа ошибок локализации операционного поля (неверная сторона операции). Однако ряд исследователей указывают на низкую эффективность RCA при отсутствии активных действий по устранению выявленных причин события [10]. В настоящее время комплекс «анализ + действие» (RCA2) предполагает не только выявление причин НЯ, но и составление и реализацию плана мероприятий по их устранению [11].
Целью исследования была оценка частоты и структуры кровотечений, связанных с использованием АК в многопрофильном стационаре, с последующей разработкой плана мероприятий, направленных на снижение риска развития данных осложнений.
Материал и методы
В ретроспективное исследование включали пациентов, госпитализированных в Многопрофильный медицинский центр Банка России (Москва) с 01.01.2015 по 15.03.2018 и перенесших геморрагические осложнения на фоне применения «лечебных» доз АК, в том числе, при поступлении в стационар. Показания к применению АК в «лечебных» дозах включают в себя следующие: профилактика тромбоэмболий у пациентов с ФП и механическим клапаном сердца, лечение тромбоза глубоких вен, сопровождающегося или не сопровождающегося тромбоэмболией легочной артерии, лечение нестабильной стенокардии и инфаркта миокарда без зубца Q, лечение острого инфаркта миокарда с подъемом сегмента ST, профилактика тромбообразования в системе экстракорпорального кровообращения во время гемодиализа.
Критерии включения в исследование: развитие кровотечения на фоне применения «лечебных» доз АК; наличие в клиническом диагнозе заболевания (МКБ-10) следующих состояний: фибрилляция и трепетание предсердий (I48), протез сердечного клапана (Z95.2), флебит и тромбофлебит бедренной вены (I80.1), флебит и тромбофлебит других глубоких сосудов нижних конечностей (I80.2), флебит и тромбофлебит бедренной вены, других сосудов нижних конечностей в сочетании с легочной эмболией (I26).
Критерии невключения в исследование: анемия без документального подтверждения состоявшегося кровотечения; возникновение кровотечения на фоне применения «профилактических» доз АК; наличие в клиническом диагнозе заболевания (МКБ-10) следующих состояний: постфлебитический синдром (I87.0) (без указания даты тромбоза), флебит и тромбофлебит поверхностных сосудов нижних конечностей (I80.0), венозные тромбозы (I81-I82), легочная эмболия (I26) при отсутствии флебита и тромбофлебита бедренной вены, других сосудов нижних конечностей.
Тяжесть кровотечения оценивалась по классификациям GUSTO и TIMI [12].
Геморрагические осложнения были проанализированы с помощью методологии RCA по аналогии с формой выявления основной причины возникновения кровотечения при применении варфарина (Michigan Anticoagulation Quality Improvement Initiative) [13]. Итогом анализа RCA стало выявление основных причин возникновения кровотечений при применении «лечебных» доз АК (одна причина у каждого пациента). Основной причиной кровотечения эксперт называл фактор, который, предположительно, играл ключевую роль в развитии события (не зависит от прочих факторов, является «корневым» фактором при ответе на вопрос «почему возникло кровотечение?»). В описание результатов не вошли группы причин, не выявленных при анализе. Изза большого количества возможных факторов развития кровотечений определяли также дополнительные причины (несколько у одного пациента). У разных пациентов одни и те же причины развития кровотечений могли быть как основными, так и дополнительными. Такие группы причин, как «протоколы/процедуры организации», «управление информацией», «тех. и мат. обеспечение», относились к факторам организации, группа причин «коммуникация» не рассматривалась из-за ретроспективного анализа.
Среди основных/дополнительных причин развития кровотечений выявляли ошибки использования лекарственных средств (ЛС), для анализа которых использовали «Класси фи кацию ошибок, связанных с ЛС», разработанную Фон дом фармацевтической помощи Европы (Pharmaceutical Care Network Europe Foundation) [14].
Группы причин, в отношении которых можно применить профилактические меры, считались «потенциально предотвратимыми», остальные причины по умолчанию являлись «непредотвратимыми».
Статистическая обработка данных проведена непараметрическими методами с помощью прикладной программы «IBM SPSS Statistics v22». Для сравнения количественных показателей использовали U-тест Манна-Уитни, качественных – критерий X 2 Фишера. При ненормальном распределении применяли непараметрические методы описательной̆ статистики: медиана, интерквартильный размах (interquartile range – IQR). Различия считали достоверными при p
Результаты
Эпидемиология назначения «лечебных» доз АК. Из медицинской информационной системы ИНТЕРИН ретроспективно были отобраны случаи назначения пациентам «лечебных» доз» АК – 2093 (9%) из 23046 пациентов за 38,5 месяцев. Из 2093 электронных историй болезни с помощью поиска по ключевым словам «кровотечение», «-рагия», «геморраг-«, «гемма-» (в графе «клинический диагноз») были отобраны 64 случая кровотечений на фоне приема «лечебных» доз АК, из которых 43 соответствовали критериям включения и невключения в исследование. Показаниями к назначению АК в «лечебных» дозах (n=2093) были фибрилляция предсердий (71%), венозные тромбоэмболические осложнения (18%), острый коронарный синдром (8%), прочие тромбозы (2%) и механический протез клапана (1%).
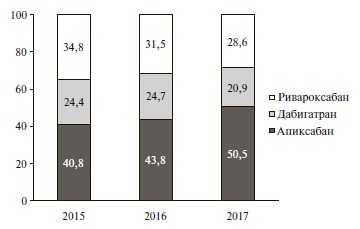
Структура назначений различных АК в 2015-2017 гг. представлена в табл. 1. Чаще всего назначали ПОАК, причем частота их назначения постепенно увеличи валась со временем (примерно на 9% в 2017 г. по сравнению с 2015 г.). Среди ПОАК наиболее распространенным препаратом был апиксабан (рис. 1).
| 2015 | 2016 | 2017 | Всего за 38 мес | |
|---|---|---|---|---|
| Примечание: разница между 2015 и 2016 гг. и между 2016 и 2017 гг. недостоверна | ||||
| Все АК, n (% от пролеченных за год) | 634 (8,8) | 629 (9,0) | 684 (9,3) | 2093(100) |
| АК, n (% от АК за год) | ||||
| Варфарин, | 153 (24,1) | 142 (22,6) | 137 (20,0) | 460 (21,9) |
| НМГ | 202 (31,9) | 195 (31,0) | 218 (31,9) | 670 (32,0) |
| ПОАК | 279 (44,0) | 292 (46,4) | 329 (48,1) | 963 (46,0) |
Характеристика пациентов и антикоагулянтной терапии. Общая характеристика включенных в исследование пациентов представлена в табл. 2. Самыми частыми сопутствующими заболеваниями были артериальная гипертония (95,0%) и сахарный диабет (39,5%). У 30 (90,5%) пациентов терапию АК назначали на неопределенно длительный срок. Девять (21,0%) пациентов ранее получали нестероидные противовоспалительные препараты регулярно в течение месяца и более, 10 (23,0%) – антиагреганты. Двадцать (46,5%) из 43 случаев кровотечений были выявлены при поступлении в стационар (в 19 случаях они послужили причиной госпитализации). У 30 пациентов текущая госпитализация была повторной: 17 (56,7%) из них госпитализировались в течение последних 6 месяцев, 8 (26,7%) – 6-12 месяцев назад и 5 (15,6%) – 1-5 лет назад. Хирур ги ческое вмешательство в течение последнего месяца было выполнено 23 (53,5%) пациентам; у 17 (74%) из них источник кровотечения находился в области послеоперационной раны.
| Показатели | Значения |
|---|---|
| Примечание: *метастазы, текущая химио- или лучевая терапия, отсутствие ремиссии в последние 6 мес | |
| Всего пациентов | 43 |
| Женщины, n (%) | 15 (35,0) |
| Возраст, медиана (IQR) | 73 (11,0) |
| Механический протез клапана, n (%) | 2 (4,5) |
| Фибрилляция предсердий, n (%) | 30 (70,0) |
| Тромбоз глубоких вен, n (%) | 11 (25,5) |
| Кровотечение в анамнезе, n (%) | 14 (32,5) |
| Индекс коморбидности Charlson, медиана (IQR) | 11,5 (6,0) |
| Сахарный диабет, n (%) | 17 (39,5) |
| Инсульт в анамнезе, n (%) | 10 (23,0) |
| Артериальная гипертония, n (%) | 41 (95,0) |
| Активная опухоль,* n (%) | 9 (21,0) |
Все пациенты на момент развития кровотечения получали АК в «лечебных» дозах: НМГ – 15 (34,9%), варфарин – 13 (30,2%) и ПОАК – 15 (34,9%), в том числе ривароксабан – 7, апиксабан – 5 и дабигатран – 3. Стандартные дозы АК принимали 18 (42,8%) пациентов, сниженные – 15 (34,9%) и повышенные – 10 (23,3%).
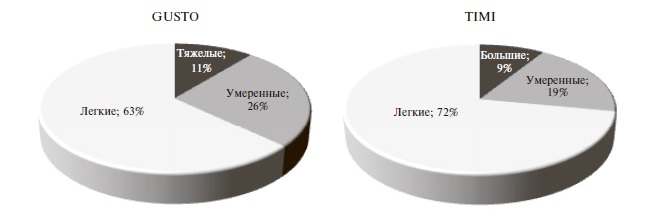
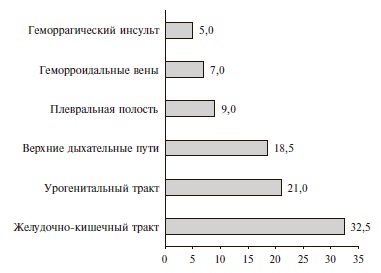
Частота и характеристика кровотечений. В целом частота кровотечений при применении «лечебных» доз АК составила 2,1%, или 18,5 случаев на 10 000 выписанных пациентов. Частота кровотечений на фоне приема варфарина, НМГ и ПОАК достоверно не отличалась: 2,8%, 2,2% и 1,6%, соответственно. Большинство кровотечений были легкими (63% – по классификации GUSTO и 72% – по классификации TIMI) (рис. 2). В 35 (81,5%) случаях после кровотечения терапия АК была приостановлена, а 14 (32,5%) пациентам потребовалось переливание крови. Структура кровотечений по локализации представлена на рис. 3.
Анализ основных и дополнительных причин развития кровотечений. Основные и дополнительные причины развития кровотечений распределяли на 3 категории – факторы пациента, персонала и факторы организации (системные факторы, связанные с организацией клинических процессов). Всего было выделено 169 причин, включая 43 основных и 126 дополнительных (рис. 4).
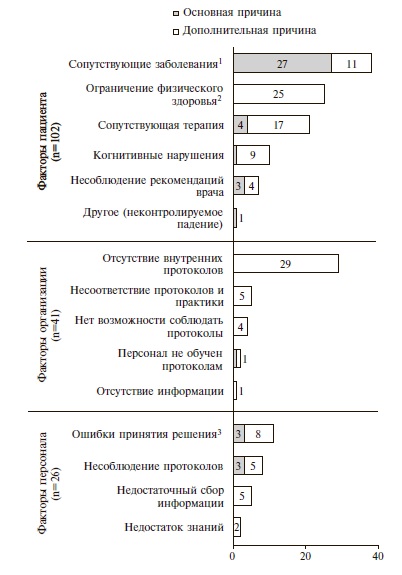
Факторы, связанные с пациентом, были признаны основной причиной кровотечений в 83,7% случаев (36 событий), факторы персонала – в 14,0% (6 событий) и факторы организации – в 2,3% (1 событие). Доля «потенциально предотвратимых» основных причин составила 35,0% (15 событий): факторы, связанные с пациентом, – 7, факторы персонала – 6, факторы организации – 1.
Среди дополнительных причин кровотечений при использовании «лечебных» доз АК факторы, связанные с пациентом, имелись в 52,5% случаев (66 событий), факторы организации – в 31,5% (40 событий), факторы персонала – в 16,0% (20 событий). Доля «потенциально предотвратимых» дополнительных причин составила 71,4% (90 событий): факторы, связанные с пациентом, – 30, факторы персонала – 20, факторы организации – 40. Среднее количество дополнительных причин возникновения кровотечений на одного пациента – 2,9.
Ошибки, связанные с использованием ЛС. Основной причиной 7 (16,3%) из 43 кровотечений были ошибки использования ЛС: отсутствие систематического пересмотра антикоагулянтной терапии при лабильном уровне МНО во время приема варфарина (2 случая), некорректный режим дозирования ривароксабана (повышение дозы) у пациентов с тромбозом глубоких вен (1), отсутствие коррекции дозы НМГ по массе тела пациента (1), превышение длительности лечения АК у пациента со спровоцированным тромбозом дистальных глубоких вен (1), неоправданное назначение антиагреганта на фоне терапии АК (1), неверная периоперационная тактика ведения пациента, принимающего варфарин (1).
Ошибки использования ЛС составили 20,6% от дополнительных причин, относящихся к факторам персонала и пациента (26 из 126): систематическое отсутствие пересмотра антикоагулянтной терапии при лабильном уровне МНО во время приема варфарина (4 случая), повышение/снижение дозы АК из-за отсутствия периодического пересмотра риска кровотечения пациента (7), несоблюдение пациентом рекомендаций врача (4), неоправданное назначение антиагрегантов при лечении АК (3), отсутствие пересмотра длительности терапии у пациентов с тромбозом глубоких вен в анамнезе, с существующим постфлебитическим синдромом (3), отсутствие расчета дозы НМГ в зависимости от массы тела пациента (3).
Профилактика кровотечений при лечении АК. По итогам анализа составлен план мероприятий по устранению потенциально предотвратимых причин кровотечений у пациентов, получающих «лечебные дозы» АК.
Обсуждение
Частота кровотечений у пациентов, принимающих «лечебные» дозы АК, в настоящем исследовании составила 18,5 на 10 000 выписанных пациентов. По данным Американского агентства по качеству и исследованиям в здравоохранении, частота кровотечений при приеме АК у пациентов в возрасте старше 65 лет в стационарах США в 2011 г. равнялась 16,4 на 10 000 выписанных пациентов [15]. Разница в частоте кровотечений может быть обусловлена высоким средним возрастом пациентов в нашем исследовании (73±11 лет), а также увеличением частоты назначения АК по сравнению с таковой в 2011 г. Таким образом, геморрагические осложнения были отмечены у 2% пациентов, которые в стационаре получали «лечебные» дозы АК. Для сравнения, кровотечения развиваются у 8-19% пациентов, длительно получающих терапию АК, в том числе амбулаторно [46]. Можно предполагать, что большая часть кровотечений при приеме АК возникает на амбулаторном этапе.
В нашем исследовании кровотечения развивались у пожилых пациентов с сопутствующими заболеваниями, которым АК назначали на неопределенно длительный срок (90,5%), преимущественно по поводу ФП (70%). Чаще всего у пациентов с ФП возникали желудочнокишечные кровотечения – в 37% случаев. В исследовании R. Hart и соавт. частота кровотечений этой локализации у пациентов с ФП составила 49% [7]. Высокая частота повторных госпитализаций (70%), кровотечений в анамнезе (32,5%), активных онкологических заболеваний (21%) свидетельствует о тяжести состояния пациентов, явившейся самой частой основной причиной возникновения кровотечений при приеме «лечебных доз» АК (63% всех основных причин). Факторы пациента были основной причиной 83,7%
кровотечений. Сходные данные приводят C. Graves и соавт. [16]. Доля тяжелых кровотечений составила 11,5% по классификации GUSTO и 9,5% по классификации TIMI. В аналогичном исследовании Gregory и соавт. доля тяжелых кровотечений по критериям GUSTO достигла 32% [8].
В нашем исследовании кровотечения развивались у 2,8% пациентов, получавших варфарин. В работе Daniels и соавт. частота кровотечений на фоне приема варфарина у пациентов терапевтического и хирургического профиля составила 1,5% и 13,5%, соответственно [17]. При лечении ПОАК мы зарегистрировали кровотечения у 1,6% пациентов. В Германии (German Claims Database) частота кровотечений у амбулаторных и стационарных пациентов с ФП, принимающих ПОАК, была выше (8%), что может свидетельствовать о более высоком риске кровотечений на амбулаторном этапе лечения [18]. Частота кровотечений у пациентов, которым назначали «лечебные» дозы НМГ, составила 2,2%. Следует отметить, что препараты этой группы получали около двух третей пациентов с внутрибольничными геморрагическими осложнениями (не при поступлении). Это может быть связано с назначением НМГ пациентам с высоким риском кровотечения или их применением в периоперационном периоде (около половины пациентов перенесли оперативное вмешательства в течение месяца до развития кровотечения). В 74% (17 из 23 пациентов) случаев источник кровотечения находился в области послеоперационной раны, что могло быть связано с несовершенством «хирургического» гемостаза (помимо высокого риска кровотечения пациента).
Низкая приверженность (несоблюдение рекомендаций врача, когнитивные нарушения) пациентов ассоциировалась с сокращением времени нахождения МНО в терапевтическом диапазоне при приеме варфарина. Тяжесть состояния пациентов в 27 случаях (63%) была ключевым фактором развития кровотечений, при этом 23 из 27 пациентов находились в периоперационном периоде.
У каждого пятого пациента среди основных и дополнительных причин кровотечений при применении «лечебных» доз АК были отмечены ошибки использования ЛС, в том числе связанные с выбором препарата (например, продолжение приема антагониста витамина К у пациентов, у которых МНО систематически находилось за пределами целевого диапазона), режима дозирования или длительности лечения АК, необоснованным назначением антиагрегантов на фоне приема АК. Отсутствие собственных внутренних протоколов терапии АК в ММЦ до конца 2017 г. могло быть причиной высокой частоты «факторов организации» (29%) среди дополнительных причин возникновения кровотечений.
Ограничения работы
Данное исследование проводилось ретроспективно путем анализа электронных историй болезни, поэтомуинформация о ряде факторов, способствующих возникновению кровотечений (например, ограничение передачи информации), отсутствовала. Ограничение выборки, в частности исключение из анализа «профилактических» доз» АК, могло повлиять на итоговую структуру результатов. Основные и дополнительные причины возникновения кровотечений определялись ретроспективно и носят вероятностный характер.
Заключение
Геморрагические осложнения развивались примерно у 2% стационарных пациентов, получавших «лечебные» дозы АК. Частота кровотечений была ниже всего при лечении ПОАК, хотя риск их развития достоверно не отличался при применении различных АК, в том числе НМГ и варфарина. Самыми частыми основными причинами развития кровотечений на фоне «лечебных доз» АК были факторы пациента (83,8%). Высокая доля «потенциально предотвратимых» событий (35,0%), а также большое количество «потенциально предотвратимых» дополнительных причин кровотечений (71,4%) у пациентов, получающих «лечебные» дозы АК, свидетельствует о необходимости разработки профилактических мер. Анализ структуры назначений АК и причин развития кровотечений по методу RCA позволяет составить целенаправленный план устранения «потенциально предотвратимых» нежелательных лекарственных реакций.


