Покровно ямочный эпителий с пролиферацией что это значит
Современная стратегия ведения пациента с предраковыми заболеваниями желудка

Представлен обзор, обобщающий существующие международные рекомендации по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка. Показано, что пациенты с хроническим атрофическим гастритом или кишечной метаплазией имеют повы
The review summarize existing international recommendations for managing patients with atrophic gastritis, intestinal metaplasia and gastric dysplasia. It is shown that patients with chronic anthropic gastritis or intestinal metaplasia have an increased risk of stomach adenocarcinoma development. Helicobacter pylori eradication tends to relieve indications of chronic nonatrophic gastritis and can lead to partial regression of atrophic gastritis, and reduces the risk of stomach cancer development.
Несмотря на успехи в области диагностики и лечения, рак желудка остается серьезной проблемой в мировом масштабе, занимая шестое место по уровню заболеваемости и второе — в структуре смертности от онкологических заболеваний [1–2]. Самые высокие показатели отмечаются в странах Восточной и Центральной Азии, Латинской Америке, самые низкие — в Северной Америке. В Восточной Азии заболеваемость раком желудка составляет 32,1 на 100 000 у мужчин, 13,2 — у женщин, в Южной Корее — 57,8 и 23,5 на 100 000, в Японии 40,7 и 16,0 на 100 000 для мужчин и женщин соответственно [1–2]. Наименьшая заболеваемость наблюдается в Северной Америке и большинстве районов Африки. Так, в Соединенных Штатах Америки (5,5 на 100 000 у мужчин; 2,8 — у женщин) [1]. Россия относится к странам с умеренным риском рака желудка, наряду с Португалией, Сингапуром, Эстонией. По итогам 2018 г., согласно российской статистике, в структуре общей заболеваемости удельный вес опухолей желудка достигал 20,4 на 100 000 населения у мужчин и 8,8 — у женщин [3]. Улучшение эпидемиологической ситуации по раку желудка наблюдается, как правило, в странах, где разработаны профилактические мероприятия, высокий уровень осведомленности населения и длительное время существуют национальные программы скрининга и ведения пациентов с предраковыми заболеваниями [4].
Цель представленного обзора — обобщение существующих международных рекомендаций по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка.
В 2012 г. Европейским обществом гастроинтестинальной эндоскопии (ESGE), Европейской группой по изучению Helicobacter и микробиоты (EHMSG), Европейским обществом патологов (ESP) и Португальским обществом гастроинтестинальной эндоскопии (SPED) были разработаны первые международные рекомендации по лечению предраковых состояний и изменений желудка (MAPS I). В 2019 г. опубликована обновленная версия рекомендаций под названием MAPS II [4]. Данные рекомендации были представлены на рассмотрение в разных странах.
Различные формы рака имеют свои специфические характеристики, знание которых позволит оптимизировать диагностику рака желудка на ранних стадиях. Подавляющее большинство раков желудка — аденокарциномы (АК, около 90%), которые происходят из желез слизистой оболочки желудка. Аденокарциномы желудка (АКЖ) подразделяют на кардиальные и некардиальные. Выделяют два основных гистологических типа некардиальных АКЖ: диффузные и кишечные. Кардиальной формой рака желудка является некардиальная аденокарцинома кишечного типа (90% АКЖ). Последняя имеет строение опухоли, сходное с картиной рака кишки. Для них характерны отчетливые железистые структуры, состоящие из высокодифференцированного цилиндрического эпителия с развитой щеточной каемкой. Диффузный тип опухоли представлен слабо организованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки) и характеризуется диффузным инфильтративным ростом. Возможен смешанный тип — в опухоли присутствуют участки кишечного и диффузного типа [5]. Дифференцированный тип чаще встречается у пожилых мужчин и развивается медленно, тогда как диффузный тип чаще встречается у женщин более молодого возраста и имеет худший прогноз [5].
Обзор представленных рекомендаций не распространяется на наследственный/семейный диффузный рак желудка, для которого разработаны специальные рекомендации [6].
Аденокарцинома желудка кишечного типа представляет собой окончательный исход последовательности «воспаление — атрофия — метаплазия — дисплазия — карцинома», известной как каскад Корреа [7–11].
Рекомендация 1 (MAPS II). Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития аденокарциномы желудка (высокий уровень доказательности) [4].
Хронический атрофический гастрит и кишечную метаплазию (КМ) рассматривают как предраковые состояния, поскольку они сами по себе связаны с риском развития рака желудка и на их фоне возможно развитие дисплазии и аденокарциномы [7–11].
Рекомендация 2 (MAPS II). Гистологически подтвержденная кишечная метаплазия — наиболее надежный маркер атрофии слизистой оболочки желудка (высокий уровень доказательности) [4].
Рекомендация 3 (MAPS II). Необходимо выявлять пациентов с гастритом на поздних стадиях, т. е. с атрофией и (или) кишечной метаплазией, слизистой оболочки как антрального отдела желудка, так и тела желудка, поскольку считается, что они подвержены более высокому риску развития аденокарциномы желудка (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 4 (MAPS II). Дисплазию тяжелой степени и инвазивную карциному следует рассматривать как исходы, которые необходимо предотвратить при лечении пациентов с хроническим атрофическим гастритом или кишечной метаплазией (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 5 (MAPS II). У пациентов с эндоскопически определяемыми патологическими изменениями, указывающими на дисплазию легкой или тяжелой степени или карциному, следует определить стадию заболевания и начать лечение (высокий уровень доказательности, сильная рекомендация).
Рекомендация 6 (MAPS II). Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии (высокий уровень доказательности).
Рекомендация 7 (MAPS II). При наличии возможности и после надлежащего обучения для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 8 (MAPS II). Для надлежащего определения стадии предраковых состояний желудка первая диагностическая эндоскопия верхнего отдела желудочно-кишечного тракта должна включать взятие биопсийных образцов из желудка для определения наличия инфекции Helicobacter pylori и выявления атрофического гастрита на поздних стадиях (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 9 (MAPS II). Следует выполнить биопсию как минимум на двух топографических участках (по малой и большой кривизне, как в антральном отделе желудка, так и в теле желудка). Следует дополнительно выполнить биопсию видимых предполагаемых неопластических поражений (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 10 (MAPS II). Для выявления пациентов с гастритом на поздних стадиях можно использовать системы гистопатологического определения стадии заболевания (например, оперативную систему оценки гастрита (OLGA) и оперативную систему оценки гастрита, основанную на кишечной метаплазии (OLGIM)). Стадии III и IV могут указывать на пациентов, подверженных более высокому риску развития рака желудка [12].
Следует рассмотреть возможность выполнения дополнительной биопсии из угла желудка (умеренный уровень доказательности, слабая рекомендация). Данный подход позволяет обеспечить максимальную степень выявления пациентов с предраковыми состояниями, в особенности в случаях, когда применение хромоэндоскопии для прицельной биопсии невозможно [4].
В случае выявления патологического изменения и результатов эндоскопической оценки, указывающих на наличие дисплазии, рекомендуется проводить резекцию патологического участка без дополнительной биопсии [4].
При наличии возможности для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений. Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии. Если при такой эндоскопии высокого разрешения не выявлены патологические изменения, рекомендуется выполнить биопсию для определения стадии гастрита (если ее не выполняли ранее) и эндоскопическое наблюдение в течение от 6 месяцев (при дисплазии тяжелой степени) до 12 месяцев (при дисплазии легкой степени) [4].
Дисплазия желудка представляет собой предпоследнюю стадию последовательности желудочного канцерогенеза. Ее определяют как гистологически подтвержденные неопластические изменения эпителия без признаков тканевой инвазии, что указывает на непосредственное неопластическое предраковое изменение [13]. Всемирная организация здравоохранения подтвердила классификацию дисплазии/интраэпителиальной неоплазии [14]:
Диагноз «неопределенная дисплазия/неоплазия» не следует изначально рассматривать как безобидный, несмотря на то, что у большинства пациентов прогноз будет благоприятным. В действительности в одном из исследований было установлено, что 26,8% резецированных поражений, классифицированных как неопределенная дисплазия/неоплазия по результатам биопсии перед резекцией, фактически представляли собой неопластические поражения (5,0% — аденома и 21,8% — ранний рак желудка) [15].
Следует помнить, что даже дисплазия легкой степени может представлять собой злокачественное новообразование [16].
В случае видимых патологических изменений одной эндоскопической биопсии недостаточно для диагностики злокачественного новообразования, при наличии любого эндоскопически определяемого патологического изменения с любыми неопластическими изменениями необходимо производить его эндоскопическую резекцию[4].
Рекомендуется проверка гистологических препаратов и немедленная (в кратчайшие возможные сроки) повторная оценка с применением эндоскопии высокого разрешения и хромоэндоскопии [4].
При отсутствии эндоскопически определяемых патологических изменений у пациентов с дисплазией рекомендуется выполнять немедленную повторную оценку с применением эндоскопии высокого разрешения и хромоэндоскопии (виртуальной или с применением красителя) [4].
Пациентам с неопределенной дисплазией, дисплазией, как и с карциномой, диагностированными на основании результатов неприцельной биопсии, необходимо дообследование и лечение только в клиниках, специализирующихся на диагностике и эндоскопическом лечении рака желудка [4].
Неинвазивные методы диагностики предраковых изменений слизистой оболочки желудка
Низкий уровень пепсиногена I в сыворотке крови и (или) низкое соотношение пепсиногена I/II позволяет выявлять пациентов с атрофическим гастритом на поздних стадиях. У таких пациентов рекомендуется выполнять эндоскопию, в особенности при отрицательном результате серологического теста на H. pylori. В качестве предельных значений указывается уровень пепсиногена I
* ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва
** ФГБОУ ВО ОмГМУ МЗ РФ, Омск
*** МЦ ЦБ РФ, Москва
**** ФГБОУ ВО СибГМУ Минздрава России, Томск
# ФГБОУ ВО КубГМУ Минздрава России, Краснодар
## ГБУЗ ГБ № 3 г. Сочи Минздрава КК, Сочи
### ИГМАПО — филиал ФГОУ ДПО РМАНПО Минздрава России, Иркутск
#### ФГБОУ ВО КрасГМУ им. проф. В. Ф. Войно-Ясенецкого Минздрава России, Красноярск
@ ФГБОУ ВО УрГМУ Минздрава России, Екатеринбург
@@ ФГБОУ ВО Южно-Уральский ГМУ Минздрава России, Челябинск
Современная стратегия по ведению пациента с предраковыми заболеваниями желудка/ Л. Б. Лазебник, Е. А. Лялюкова, Г. В. Белова, И. В. Долгалёв, Н. В. Корочанская, В. К. Косёнок, А. С. Лялюкова, Е. В. Онучина, М. М. Петрова, Л. В. Прохорова, А. С. Сарсенбаева
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 60-64
Теги: хронический атрофический гастрит, кишечная метаплазия, аденокарцинома желудка
Покровно ямочный эпителий с пролиферацией что это значит
Изучение заболеваний желудочно-кишечного тракта, в частности желудка и двенадцатиперстной кишки, является основой узкого направления медицины – гастроэнтерологии. Причин возникновения заболеваний желудка множество: неправильное питание, стрессы, нарушение режима труда и отдыха, воздействие вредных веществ, активность бактерий Helicobacter pylori и т.д. [1–3]. Желудок – важный орган, отвечающий за общее состояние организма, из-за желудочных состояний страдают все системы. Поэтому важно знать причины болезней желудка, основные его заболевания. Если рассматривать заболевания желудка с ракурса онкологии, то предвестниками данной патологии могут стать часто встречающиеся в повседневной практике гастроэнтерологов язвенная болезнь желудка, острый и хронический гастрит, дуоденогастральный рефлюкс, полипы, а также эрозия желудка. В ходе мониторинга пациентов стационарного и амбулаторного лечения данная группа заболеваний желудочно-кишечного тракта занимает лидирующее положение среди расстройств, которые в совокупности различных факторов окружающей среды, а также индивидуальных особенностей чаще других приводят к канцерогенной активности. Любое предраковое заболевание развивается поэтапно с нарастанием и углублением отрицательных изменений, происходящих в желудке. На некоторых стадиях любой процесс полностью обратим, то есть болезнь излечима. По мере углубления деструкции возможность обратимости снижается, наступает стойкая хронизация процесса, а болезнь становится неизлечимой. Переходу в предрак или рак способствуют наиболее глубокие стадии, когда болезнь развивается внутри клеток. Гастрит – это одно из наиболее распространенных желудочно-кишечных заболеваний воспалительного или воспалительно-дистрофического характера, поражающих слизистую оболочку желудка [4]. В связи со множеством разновидностей этой болезни термин «гастрит» является собирательным и служит для обозначения различных по происхождению воспалительных и дистрофических изменений в слизистой этого органа. Гастриты классифицируют по нескольким показателям – по типу, локализации воспалительного процесса, этиологическому фактору, эндоскопической картине, морфологическим изменениям слизистой оболочки желудка. Все эти показатели очень важны для диагностики и выбора способа лечения заболевания. Особого внимания заслуживает атрофический гастрит – длительно текущая форма хронического заболевания, при которой происходят деструктивные изменения в слизистой оболочке желудка. В результате патологического процесса ее площадь и количество функционирующих клеток резко уменьшаются. Многие специалисты считают [5–7], что этот подвид хронического гастрита является предраковым состоянием, как следствие угроза развития злокачественного процесса очень велика. При атрофическом гастрите запускается механизм перерождения нормальных клеток желудка; главные и добавочные клетки, принимающие участие в выработке пепсиногена и хлороводородной кислоты – основных составляющих желудочного сока, перестают функционировать в оптимальном режиме. Вместо него добавочные клетки желудка в большем объеме начинают продуцировать мукополисахариды – слизь. В результате резко снижается кислотность желудочного сока. То, что клетки меняют свою специализацию и перестают выполнять основную функцию, свидетельствует о том, что в организме есть сбой в системе гормональных, иммунных, ферментных и прочих регуляторов физиологических процессов. Язвенная болезнь желудка является одной из основных причин заболеваемости и смертности среди более семи миллионов ежегодно диагностируемых патологий желудочно-кишечного тракта [8]. Диагностика язвенной болезни желудка и двенадцатиперстной кишки предполагает наличие таких симптомов, как потеря веса, перенасыщенность, боли в эпигастральной области, чувство переполнения, вздутие живота, тошнота. К сожалению, наличие данных симптомов также вписывается в клиническую картину гастроэзофагеальной рефлюксной болезни, диспепсии и гастрита, в связи с чем диагностирование язвенной болезни желудка затруднено. Бессимптомное протекание данной патологии часто не позволяет провести диагностику на ранних стадиях развития болезни, заболевание остается незамеченным вплоть до клинических проявлений, а именно кровотечений желудочно-кишечного тракта [9]. Слизистая оболочка желудка выстлана одним слоем эпителиальных клеток, который поддерживается тонкими элементами рыхлой соединительной ткани, покрытой тонким слоем гладких мышечных волокон. У многих людей желудочный эпителий, помимо собственных кислых и ферментативных выделений желудка, подвергается воздействию Helicobacter pylori. Маленькие грамотрицательные палочки Helicobacter pylori обладают уникальной приспособленностью к колонизации желудка человека [10]. Наличие данных микроаэрофильных микроорганизмов приводит к возникновению ряда субклинических и клинических показателей, которые зависят от свойств заражающего штамма, хозяина и окружающей среды [11]. Ряду пациентов с язвенной болезнью желудка или развивающейся лимфомой желудка, которые ранее подвергались лечению с использованием нестероидных противовоспалительных препаратов, показана эрадикационная терапия. Но нельзя игнорировать тот факт, что данная терапия может ухудшить гастроэзофагеальную рефлюксную болезнь и увеличить риск развития рака пищевода [12]. Желудочные полипы представляют собой аномально растущую массу клеток, которые образуются на слизистой оболочке желудка. Наличие данной патологии является редкостью, и чаще всего заболевание протекает бессимптомно [13]. Большие полипы вызывают кровотечение, анемию, боль в животе или редко могут приводить к обструкции из-за своей локализации. Только определенные типы полипов способны обладать канцерогенной активностью и увеличивать риск развития онкологии в будущем, и в зависимости от этого выбирается дальнейшая стратегия лечения, которая может включать как хирургическое удаление полипа, так и мониторинг его изменений, и консервативное лечение [14].
Оценка морфологической структуры клеток возможна с помощью цитологического исследования, которое широко применяют в клинической практике как исключительно чувствительный, точный, эффективный метод диагностики злокачественных опухолей и ряда неопухолевых поражений всех органов пищеварительной трубки у больных с симптомами заболевания органов ЖКТ, а также при скрининге в группах высокого риска по развитию рака этих органов [15]. Микроскопически злокачественные клетки выстилают желудочные железы и крипты и представляют собой эпителиальные клетки, прорывающиеся через базальную мембрану и вторгающиеся в подслизистую оболочку и мышечный слой. Отдельные клетки теряют свою дифференцированность по отношению к соседним клеткам и представлены многочисленными митотическими фигурами [16]. Для предупреждения развития онкологических заболеваний важно раннее выявление таких состояний, а также их качественное обследование. Внедрение и максимальное использование современной эндоскопической техники значительно расширило возможности цитологической диагностики органов ЖКТ и, более того, открыло перспективы применения метода, поскольку цитологический материал пригоден для проведения имеющих неоценимое дифференциально-диагностическое значение иммуноморфологических, молекулярно-биологических и генетических исследований [17, 18].
Провести сравнительный анализ и выявить характерные морфологические цитологические признаки при различных доопухолевых заболеваниях желудка.
Материал и методы исследования
Результаты исследования и их обсуждение
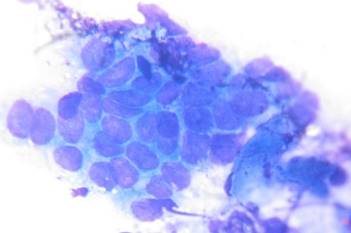
Рис. 1. Клетки покровно-ямочного эпителия с признаками гиперплазии
В случаях кишечной метаплазии в мазках-отпечатках обнаруживались высокие клетки цилиндрической, призматической или бокаловидной формы (рис. 2).
Рис. 2. Клетки покровно-ямочного эпителия с признаками кишечной метаплазии по тонкокишечному типу
Наблюдаются ядра больших и средних размеров, их расположение в клетках эксцентричное, окрашены интенсивно. Цитоплазма характеризуется базофильной окраской, у ядра и апикальной части почти прозрачная, широкая в апикальной части и узкая, более вытянутая в базальной. В исследуемых тканях имеются скопления лимфоидных элементов, а также плазматические клетки и сегментоядерные нейтрофилы. Эндоскопическая картина заживающей язвы характеризуется уменьшенной гиперемией слизистой оболочки, отсутствием некротических тканей и гнойных масс. Исчезает глубина язвы, воспаленные края язвы сглаживаются, формируется «красный рубец» – гиперемированная ткань слизистой оболочки, которая впоследствии после втяжения стенок формирует соединительнотканный «белый рубец» [23, 24]. Микроскопическое строение слизистой оболочки зависит от периода развития язвы. В цитологических мазках определяли десквамированные клетки эпителия, лейкоциты и эритроциты, фибробласты, гистиоциты, плазматические клетки и лимфоциты. Непосредственно по краю хронической язвы слизистая оболочка желудка подвергается значительному утолщению за счет интенсивной пролиферации ямочного эпителия. В цитологических препаратах можно найти все упомянутые выше клеточные элементы. В материале, полученном с краев хронической язвы, обычно обнаруживали полиморфные, различной степени зрелости клетки покровно-ямочного эпителия. Преобладание незрелых крупных клеток с большими ядрами и базофильной цитоплазмой может свидетельствовать об интенсивной пролиферации эпителия. В период обострения язвы в большом количестве встречаются дегенеративно измененные эпителиальные клетки без четких границ с укрупненными ядрами. Рисунок хроматина в них разреженный, в виде грубых волокон. В связи с большим клеточным распадом и явлениями цитолиза в материале, особенно полученном со дна язвы, можно видеть много «голых» ядер. В этих препаратах преобладали сегментоядерные лейкоциты и в значительном количестве встречаются элементы грануляционной ткани. В период рубцевания язвы в мазки попадают очень полиморфные клетки гистиоцитарного типа, которые бывает трудно отличить от атипических эпителиальных клеток [25]. В ходе эндоскопического исследования полипов оценивались количество, форма, размеры, поверхность, цвет, консистенция, воспалительные процессы и локализация новообразований. Цитологические препараты характеризовались большим количеством пластов и скоплений покровно-ямочного эпителия. При аденоматозных полипах встречаются также и железистоподобные структуры. По сравнению с цитологическими описаниями гастритов при этих заболеваниях отмечалось преимущество незрелых клеток, ядра светлые, укрупнены, рисунок хроматина нежно-сетчатый. Клетки эпителия желез и лимфоидные элементы определяются в небольшом количестве. В случаях грануляционных полипов с обильными воспалительными инфильтратами в их строме в цитологические препараты могут попадать в значительном количестве нейтрофильные лейкоциты.
В ходе проведенных исследований выявлены изменения в составе и морфологии клеток слизистой оболочки желудка, которые наблюдаются при гастрите, полипозе и язве, не являются строго специфическими. При всех этих заболеваниях может определяться различная степень пролиферации покровно-ямочного эпителия: в одних наблюдениях отмечается только незначительный полиморфизм эпителиальных клеток, в других – явно преобладают молодые элементы с некоторыми признаками атипии. Для установления диагноза необходимо применять дополнительные методы исследования, так как на основании только цитологических данных не представляется возможным диагностировать эти процессы.
Предраковые заболевания желудка
Облигатный предрак — заболевания, на почве которых всегда или в большинстве случаев, если их не лечить, возникает рак. К таким заболеваниям относят каллезную язву желудка, ригидный антральный гастрит, полипы, полипоз желудка.
факультативный предрак — хронические заболевания желудка, при которых рак развивается относительно редко, но чаще, чем У здоровых людей. Это хронический атрофический гастрит, болезнь оперированного желудка, пернициозная анемия, болезнь Менетрие и др.
Национальный раковый конгресс в Японии трактует ряд заболеваний, на фоне которых может возникнуть рак желудка, как фоновые, объединяя в одну группу облигатный и факультативный предрак.
По данным Национального ракового конгресса, рак желудка может развиться на фоне хронического атрофического гастрита в 0-13% случаев, пернициозной анемии — в 0,5-12,3%, хронической язвы желудка — в 1-2%, гиперпластического полипа — в 1-2%, плоской аденомы — в 6-21%, папилловирусной аденомы — в 20-75%, болезни Менетрие — в 5-10%, резекции желудка в анамнезе — в 0,4-7,8% случаев.
С морфологической точки зрения мультицентрически расположенные участки пролиферации атипического эпителия называются дисплазией.
Дисплазия — это нарушение структуры ткани, характеризующееся патологической пролиферацией и атипией эпителия. В слизистой оболочке желудка дисплазия может быть трех степеней (легкая, умеренная и тяжелая).
При дисплазии I и II степени изменения слабо выражены и носят обратимый характер. Изменения же, относящиеся к дисплазии III степени, постоянны и могут рассматриваться как рак in situ. У 40-45% людей в возрасте старше 60 лет в слизистой оболочке желудка происходит перестройка эпителия по кишечному типу — кишечная метаплазия (тонкокишечная, толстокишечная). Толстокишечная метаплазия трактуется как предраковое состояние.
Хронический гастрит — самое распространенное заболевание среди патологии желудочно-кишечного тракта, которое составляет 35% всех болезней органов пищеварения и 85% болезней желудка.
Хронический гастрит — заболевание полиэтиологическое. Существует много причин, вызывающих его, однако в соответствии с этиопатогенезом их можно объединить в три основные группы:
•I группа — инфекционные (экзогенные), связанные с желудочным хеликобактером (гастрит В — бактериальный);
•II группа — эндогенные аутоиммунные, обусловленные образованием антител к обкладочным клеткам желез желудка (гастрит А — аутоиммунный) — атрофический гастрит;
•III группа — экзоэндогенные, связанные с частичными термическими раздражениями, медикаментозными воздействиями выражаются гастродуоденальным рефлюксом (гастрит С — реактивный или химический).
На фоне хронического атрофического гастрита в 0-13% случаев возникает рак желудка.
Клиника. В клинической картине хронического гастрита нет типичных характерных признаков, на основании которых можно было бы распознать те или иные его формы.
Основные жалобы: нарушение аппетита, неприятные ощущения в эпигастральной области, связанные с приемом пищи отрыжка, изжога, тошнота, иногда рвота.
Синдромы желудочной и кишечной диспепсии могут быть в самых различных сочетаниях (чувство переполнения желудка пищей, метеоризм, урчание в животе, тенезмы, запоры, сменяющиеся поносами).
Диагностика. Рентгенологический метод исследования в диагностике хронического гастрита играет относительную роль. Он больше пригоден для выявления язвенного, полипозного и опухолевого поражения желудка. Исключение составляет ригидный антральный гастрит. Решающее значение в распознавании различных форм хронического гастрита принадлежит гастрофиброскопии и гастробиопсии. Диагноз: кишечная метаплазия, дисплазия разной степени выраженности, инфекция, вызванная Helicobacter pylori (HP), — только цитологический и гистологический.
Лечение. К терапевтическим мероприятиям при хроническом гастрите неинфекционной этиологии относятся: устранение основных факторов, способствующих развитию заболевания или поддерживающих его, диетотерапия, седативные средства в период обострений, средства, улучшающие микроциркуляцию и трофику слизистой оболочки, витаминотерапия, санаторно-курортное лечение.
Особого отношения требует инфекционный гастрит, вызванный микроорганизмами Helicobacter pylori. На сегодняшний день учеными мира доказано, что 30-50% населения земного шара — носители HP-инфекции (больной человек или бактерионоситель). HP-бактерии обычно размножаются под слоем слизи над слизистой оболочкой привратника, прикрепляются к апикальной части клеток эпителия, выделяют энзимы — цитотоксины и уреазу, и в эпителии развиваются отек, гиперемия, нарушение трофики, дегенерация клеток слизистой оболочки. Процессы воспаления и атрофии тесно связаны между собой и имеют инфекционно-иммунное происхождение.
В последние 10 лет многих исследователей интересуют проблемы хеликобактериоза и рака желудка. На сегодняшний день доказано, что Helicobacter pylori вырабатывается множество патогенных ферментов и токсинов, некоторые из них могут быть вовлечены в канцерогенез.
•Показана взаимосвязь между наличием HP-инфекции и кишечной метаплазией, разновидность которой — неполная кишечная метаплазия — считается предраковым состоянием.
•Установлено, что HP с помощью энзима экстрацеллюлярной уреазы расщепляет мочевину с образованием аммиака, активизирует процессы перекисного окисления липидов, повышает концентрацию свободных радикалов — производных кислорода, что стимулирует процессы канцерогенеза.
•В экспериментах in vitro показана способность HP стимулировать рост культуры опухолевых клеток.
Рак желудка в большинстве случаев сопровождается инфицированием слизистой оболочки HP; при этом НР-инфекция имеет большую распространенность, чем при язвенной болезни, приобретает характер тотального обсеменения всех отделов желудка, в том числе и самой опухоли.
Хеликобактерный гастрит (гастрит В) требует особого лечения. Чтобы уничтожить эти бактерии, необходимо обязательное применение трех препаратов, обладающих антибактериальной активностью: амоксициллина или ампициллина, производного нитронидазола (метронидазола) и производного нитрофурина (фуразолидона). Базисный препарат — де-нол (соль лимонной кислоты с висмутом).
Язва желудка. Малигнизация рецидивирующих и каллезных язв желудка отмечается у 2-10% больных.
Клиника. В отличие от хронического гастрита хроническая язва желудка имеет довольно четкую клиническую картину.
Наиболее постоянный симптом язвенной болезни — боль, связанная с приемом пищи. Боли могут быть ранними, возникающими либо сразу после приема пищи, либо через 0,5-1 ч, и поздними, наступающими через 2-3 ч после приема пищи и позднее. Иногда боли возникают ночью и проходят после приема пищи (молока).
Для язвенной болезни желудка характерна также сезонность — обострения в осенне-зимние и весенние месяцы, ремиссии в летний период.
Важным симптомом заболевания является изжога; у большей половины больных бывает рвота, тошнота. В рвотных массах — кислая жидкость с примесью пищи. При рубцовых стенозах привратника рвота становится более частой, при этом рвотные массы обильны, с остатками пищи, съеденной накануне. Нередко отмечаются нарушения функции кишечника — запоры часто сменяются поносами.
Диагностика. В распознавании язвенной болезни желудка, кроме клинической семиотики, определенную роль играет исследование желудочного сока. У большинства больных имеет место повышение секреции и кислотообразования. Лишь при длительном течении заболевания, особенно при каллезных язвах, кислотность желудочного сока понижается. Важно также исследование кала на скрытую кровь.
При рентгенологическом исследовании желудка главным симптомом является ниша. Большая ниша с окружающим валом и конвергенцией складок слизистой оболочки указывает обычно на каллезный характер язвы. Отличить доброкачественную язву желудка от злокачественной помогает эндоскопическое, цитологическое исследование, а также множественная биопсия с разных участков язвы.
Лечение. Острые и рецидивирующие язвы в стадии обострения лечатся, как правило, консервативным путем. Обычно для заживления язвы требуется от 4 до 8 нед, а при больших или застарелых язвах — и более длительный промежуток времени. Эндоскопический или рентгеноскопический контроль проводится через 8 нед и до полного заживления. Если полное заживление не наступает, проводится повторная биопсия.
При осложнениях язвы (пенетрация, перфорация, рубцовый стеноз, повторяющиеся кровотечения), отсутствии эффекта от консервативной терапии, частом рецидивировании неосложненной пептической язвы, лишающем больного трудоспособности, подозрении на злокачественную язву желудка показано хирургическое лечение.
Полипы и полипоз желудка. Полипы бывают гиперпластическими и аденоматозными.
Гиперпластические изменения встречаются в 80-90% случаев всех полипозных образований в желудке и относятся к опухолеподобным поражениям. В 10-20% случаев возникают аденоматозные полипы — доброкачественные эпителиальные опухоли. Обычно они имеют вид выступающих в просвет желудка округлых образований, расположенных на тонкой ножке или широком основании.
К числу предраковых относят железистые аденоматозные полипы. Дисплазия разной степени выраженности в аденоматозных полипах отмечается в 40-60% случаев, а дисплазия III степени — в 5-10%. Если гиперпластические полипы перерождаются в рак в 1-2% случаев, то плоская аденома — в 6-21%, а папилловирусная аденома — в 20-75% случаев;
Клиника. Одиночные полипы могут протекать бессимптомно и быть случайной находкой. Клинически они проявляются, как правило, при сопутствующем хроническом гастрите. При распаде опухоли возможны кровотечения, при ущемлении полипа — приступ боли в эпигастрии, тошнота, рвота.
Диагностика. Ведущая роль в распознавании полипоза и полипов желудка принадлежит рентгенологическому и гастроскопическому методам.
Биопсия при эндоскопии позволяет дать цитологическую и морфологическую характеристику полипов.
Лечение. Аденоматозные полипы лечат хирургически. При одиночных полипах возможна эндоскопическая полипэктомия, при множественных — выполняется резекция желудка или гастрэктомия.
Оперированные больные находятся под диспансерным наблюдением. Не реже одного раза в 6 мес проводится эндоскопическое исследование, также периодически комплексное лечение, включающее рациональную диету, витаминотерапию, седативные средства, санаторно-курортное лечение.
Пернициозная анемия (болезнь Аддисона) может быть определена как отсутствие внутреннего фактора Касла, связанное с полной атрофией слизистой оболочки фундального отдела желудка и потерей париетальных клеток. Болезнь диагностируется, когда отмечается полная атрофия слизистой оболочки фундального отдела желудка, как правило, это бывает после 50 лет. На момент обнаружения болезни воспаление в слизистой оболочке отсутствует, т. е. патологический процесс представляет собой атрофию без гастрита.
Некоторые данные указывают на иммунологическую и наследственную основу пернициозной анемии, называемой также гастритом типа А.
При этой болезни в 90% случаев в организме присутствуют антитела к париетальным клеткам желудка; а в 60% случаев — антитела к внутреннему фактору Касла (как блокирующие, так и связывающие его). Анемия обычно развивается постепенно и незаметно, прогрессируя по мере истощения запасов витамина В в печени.
Рак желудка при пернициозной анемии встречается в 0,5-12,5% случаев.
Больные с пернициозной анемией обычно наблюдаются у терапевта и гематолога. Для больных старше 50 лет обязательно эндоскопическое исследование желудка 1 раз в год.
Болезнь Менетрие — поражение желудка неизвестной этиологии, проявляющееся очень большими желудочными складками, большими железами с незначительным их воспалением и кистозным расширением; при этом изредка затрагивается подслизистый слой; часто процесс ограничивается телом и дном желудка (антральный отдел обычно не поражается). Иногда ширина и высота складок достигает 3,5 см. Характерно повышенное слизеобразование, гипосекреция соляной кислоты и пепсина, Уменьшение содержания сывороточных белков, приводящее к появлению гипоальбумических отеков.
Клиника. Характерны боль в эпигастрии, потеря массы тела, тошнота.
Течение заболевания хроническое (ремиссии, обострения), иногда наступает спонтанное выздоровление либо переход в атрофический гастрит.
Болезнь Менетрие, как правило, встречается в возрасте 30-60 лет.
Диагностика. При рентгенологическом и эндоскопическом исследовании выявляются очень крупные складки, которые никогда не переходят на пилорический отдел (показана биопсия на всю толщину складки). В 5-10% случаев развивается рак желудка.
Лечение — консервативное; в случае тяжелой гипоальбуминемии может быть необходимой резекция желудка.
Атрофический гастрит резецированного желудка. Закономерным исходом резекции желудка является развитие хронического гастрита в культе, который сопровождается дисплазией и кишечной метаплазией эпителия вследствие снижения кислотности желудочного сока и заброса желчи в культю желудка.
Рак культи желудка возникает у 0,4-7,8% больных из числа оперированных по поводу неопухолевых заболеваний желудка через 10, 15, 20 лет после операции.
Пациенты с резецированным желудком нуждаются в постоянном диспансерном наблюдении на протяжении всей жизни. Один раз в год им должно выполняться гастроскопическое обследование культи желудка.