Почему сложных веществ больше чем простых
Разнообразие веществ. Простые и сложные, неорганические и органические вещества
Веществ существует очень много. Если химических элементов более ста, то веществ — более 10000000! Чтобы облегчить изучение и использование веществ, их разделяют на группы (классифицируют).
Какие вещества относятся к простым?
Вещества разделяют на простые и сложные. Рассмотрим примеры таких веществ: углерод, железо, кислород. Углерод образован атомами углерода. Из него изготавливают графитовые стержни карандашей. Железо, из которого сделано гвоздь, состоит из атомов железа. Эти тела, а следовательно, и вещества, из которых они образованы, вы видели не раз. Кислород мы не видим, но его недостаток чувствуем сразу. Это вещество состоит из молекул кислорода, образованных атомами кислорода.
Каждое из рассмотренных веществ образовано атомами одного химического элемента. Графит образуют атомы углерода, железо — атомы железа, кислород — атомы кислорода. Такие вещества называют простыми.
Молекулы некоторых простых веществ состоят из нескольких атомов. Например, молекула водорода состоит из двух атомов водорода, молекула кислорода — из двух атомов кислорода. Но несмотря на это, они остаются простыми веществами, так как их молекулы образовали атомы одного химического элемента.
Сложные вещества
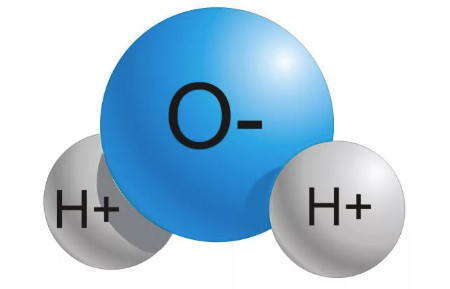
Вещества, образованные из атомов двух и более химических элементов, называют сложными. Например, каждая молекула воды содержит два атома водорода и один атом кислорода. Ее состав обозначают записью H2O, который читается «аш-два-о».
Другим примером сложных веществ является углекислый газ. Его выдыхают все живые организмы, а растениям он нужен для питания. Молекула углекислого газа образована одним атомом углерода и двумя атомами кислорода. Этот состав молекулы отражают записью СО2, который читается «це о два».
Почему сложных веществ больше, чем простых?
Ученые доказали, что атомы различных химических элементов способны соединяться друг с другом в разном количестве и последовательности. Подобно тому, как в языке сочетанием букв образуется разнообразие слов, сочетанием различных атомов и в разном количестве образовалось более 10000000 веществ. Так что неудивительно, что сложных веществ существует гораздо больше, чем простых.
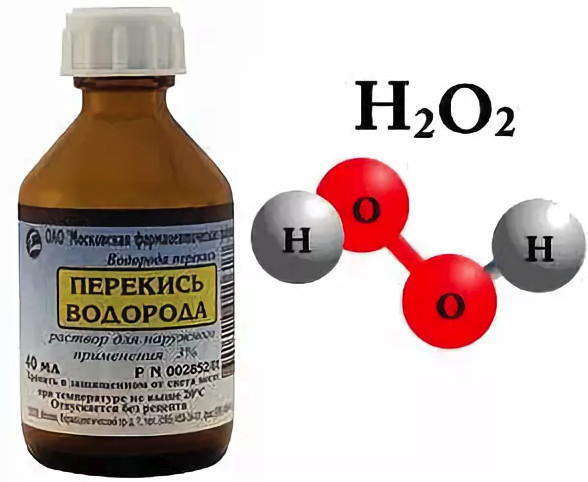
Рассмотрим еще раз рисунок и увидим, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Из таких же атомов состоит и вещество водород пероксида, однако она имеет совсем другие свойства, чем вода. Например, водород пероксида имеет температуру кипения выше на 50°С, обладает обеззараживающими свойствами. Ни одна аптечка не обходится без него, ведь раствором этого вещества под названием «перекись водорода» обрабатывают раны, чтобы они быстрее заживали. Такие отличные от воды свойства перекиси водорода обусловленные различиями в строении его молекулы. Ведь молекула этого вещества состоит из двух атомов водорода и двух атомов кислорода.
Органические и неорганические вещества
Вещества разделяют также на органические и неорганические. В состав всех органических веществ входят атомы углерода и, чаще всего, водорода. Так, из них образованы природный газ, вещества в составе нефти. В составе многих органических веществ содержатся еще и атомы кислорода. Это жиры, крахмал, сахар, уксус и другие. В состав важных для живых существ белков, кроме упомянутых элементов, обязательно входит азот.
Откуда такое название — органические вещества? Все очень просто. Первые из этих веществ ученые обнаружили в организмах — телах живой природы.
Есть и исключения. Некоторые вещества, содержащие атомы углерода, относят к неорганическим. Примерами являются углекислый газ, сода и еще несколько веществ.
Все тела природы, за исключением горных пород, воздуха и воды, состоят из органических веществ. Среди них больше всего углеводов (например, глюкозы и сахарозы), жиров (например, масла), белков (например, белок куриного яйца).
Многие органические вещества человек создал сам, например пластмассы, резину, полиэтилен. Они широко используются в машино- и самолетостроении, при сооружении зданий и мостов, а также в быту.
Без атомов углерода не существует никакой органического вещества. Так, атомы углерода вместе с атомами водорода и кислорода входят в состав органического вещества сахара, или сахарозы. Причем 1 молекула сахарозы состоит из 45 атомов. Среди них 12 атомов углерода, 22 атома водорода и 11 атомов кислорода. В том, что в составе сахара содержатся атомы углерода, убеждает черный цвет при сгорания кусочка сахара. Картофель или мясо, под действием высоких температур также обугливаются, приобретая черный цвет. Это является доказательством наличия углерода в составе органических веществ продуктов питания.
Заключение
Вещества разделяют на простые и сложные. Простые вещества образуются из атомов одного химического элемента. Сложные вещества образуются из атомов различных химических элементов.
Одной из классификаций веществ является разделение их на органические и неорганические. Органические вещества обязательно содержат атомы углерода.
Белки, жиры, углеводы — жизненно необходимые человеку органические вещества.
Почему в природе больше сложных веществ чем простых?
Мне приходит в голову аналогия с детскими кубиками, ан которых нарисованы различные буквы. Кубиков немного, но слов из них можно составить очень большое количество. Ведь есть слова состоящие из одной буквы, из двух, трех и так далее.
Еще проще представить себе просто буквы алфавита. Вот в русском языке их всего 33, а слов из них составлено многие тысячи.
Так и с простыми и сложными веществами. Простых веществ немного, потому что они образуются атомами одного химического элемента, а сложные могут содержать самые разные атомы, в самых разных комбинациях.
Мало того, человек научился сам получать сложные вещества комбинируя простыми.
Потому что сложные в-ва состоят из простых в-в.Простых в-в много и они образуют сложные.Именно поэтому сложных в-в больше
Каждое вещество состоит из одинаковых молекул. Молекулы состоят з атомов.
Простое вещество состоит из атомов одного и того же химического елемента, которых в природе 89. Сложные вещества состоят из молекул разных химических елементов в разных количествах. Из этого становится ясно, что сложных веществ намного больше, чем простых.
Люди «собирали» ветер парусами и он гнал по морям корабли с товарами и завоевателями, а так- ветер использовали для хозяйственных надобностей- муки смолоть, зерна от половы отделить, для выработки электроэнергии- недавно- ветер применяется, и давно- для забав всяких.
Трением мы называем механическое взаимовоздействие между соприкасающимися телами и эти воздействия могут нести как пользу, так и мешать.
Полезные свойства трения мы можем наблюдать при таких взаимодействиях, как крепление гвоздями, шурупами, анкерами и т.д., где сила трения просто оставляет в материале крепеж.
При постановке на ручной тормоз, машина даже на наклонной поверхности сохраняет свое положение и не скатывается и это все тоже сила трения.
При уменьшении трения, человек научился быстрее передвигаться, например на коньках или лыжах.
Во многих случаях, человек пытается снизить воздействия трения, изобретая различные приспособления, например подшипники, различные смазочные вещества.
C давних времен люди использовали воду для получения работы и энергии.Водяные мельницы,на этом же принципе колесо для подъема воды.Более современный способ Гидроэлектростанции падающая с высоты вода вращает лопасти турбины. Приливные электростанции используют энергию морского прилива и отлива. Геотермальные электростанции использование как источник энергии гейзеры.Установки работающие на разности температуры морской воды на поверхности и глубине, в трубе получается паток воды. Проект который хотел применить Кеннеди. Гидролиз воды расщепление на водород и кислород и последующим использованием в двигателях внутреннего сгорания.
Я частенько прибегал к ресурсам от «Моя Школа», как по мне так это лучший ресурс с Готовыми домашними заданиями. Там есть ответы на большинство лабораторных, практических и обычных тестовых работ. Советую вам воспользоватся именно этим ресурсом.
От жида Янкеля Тарас Бульба доподлинно узнал, что его сын Андрий предал казаков и отказался и от батьки и от братьев. Поэтому Тарас ждал появления Андрия на поле боя, ждал еще в первом бою. Но Андрий появился только под конец битвы, в самый ее решающий момент, когда казалось бы чаша весов стала клониться на сторону казаков. Он возглавил свежий гусарский отряд поляков, который и решил исход дела.
Тарас Бульба «оторопел». Он смотрел как Андрий рубит своих же казаков и не верил своим глазам. он кричал Андрию и называл его «чертов сын». А потом приказал своим казакам заманить Андрия к лесу.
Потому, что молекулы простых веществ могут содержать разное количество атомов одного элемента, в отличие от молекул сложных веществ.
Например : кислород и озон.
Чем отличается сложное вещество от простого?
Чем отличается сложное вещество от простого.
Чем сложные вещества отличаются от простых?
Чем сложные вещества отличаются от простых?
Приведите примеры простых и сложных веществ.
Сложные вещества состоят иза?
Сложные вещества состоят из
Химических элементов и простых веществ.
Фтор и бром являются соответственно1)простыми веществами2)сложными веществами3)простым и сложным веществами4)сложным и простым веществами?
Фтор и бром являются соответственно
3)простым и сложным веществами
4)сложным и простым веществами.
Почему газ кислород относится к простым веществам а вода к сложным?
Почему газ кислород относится к простым веществам а вода к сложным.
Почему вещества делятся на простые и сложные?
Почему вещества делятся на простые и сложные?
Предмет химии, Вещества?
Предмет химии, Вещества.
Простые, Сложные вещества.
Можно можно ли из одного сложного вещества получить?
Можно можно ли из одного сложного вещества получить?
А. два простых веществ
Несколько новых сложных веществ
Одно новое сложное вещество
Одно простое и сложное вещества
Одно простое вещество?
Число простых веществ в несколько раз больше, чем число известных химических элементов?
Число простых веществ в несколько раз больше, чем число известных химических элементов.
Чем это можно объяснить?
Что означает понятие : простое вещество и сложное вещество?
Что означает понятие : простое вещество и сложное вещество.
So3 + h2o = h2so4 H2so4 + 2koh = k2so4 + 2h2o Количество вещества оксида серы : 16 / (32 + 3 * 16) = 0. 2 моль Такое же количество кислоты образовалось и потом было нейтрализовать гидроксид ом. И такое же количество вещества соли образовалось, то е..
Решение смотри на фото.
MgO + 2HNO3 = Mg(NO3)2 + H2O n(MgO) = 20 / 40 = 0, 5 моль По уравнению реакции n(MgO) = n(Mg(NO3)2) = 0, 5 моль m(Mg(NO3)2) = 0, 5 * (24 + 28 + 96) = 74 г.
Означает 2 молекулы хлорида железа 3.
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Явление аллотропии вызывается двумя причинами:
Основные классы неорганических веществ
Бинарные соединения
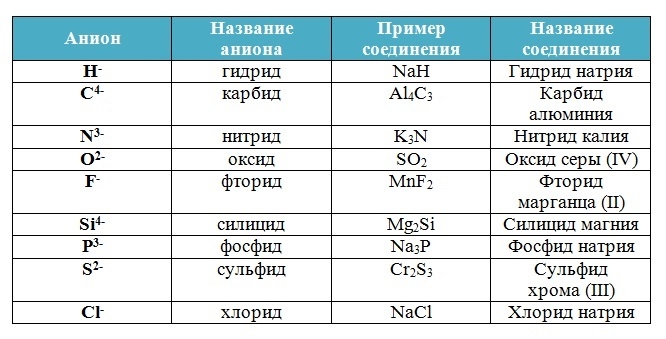
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Оксиды
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
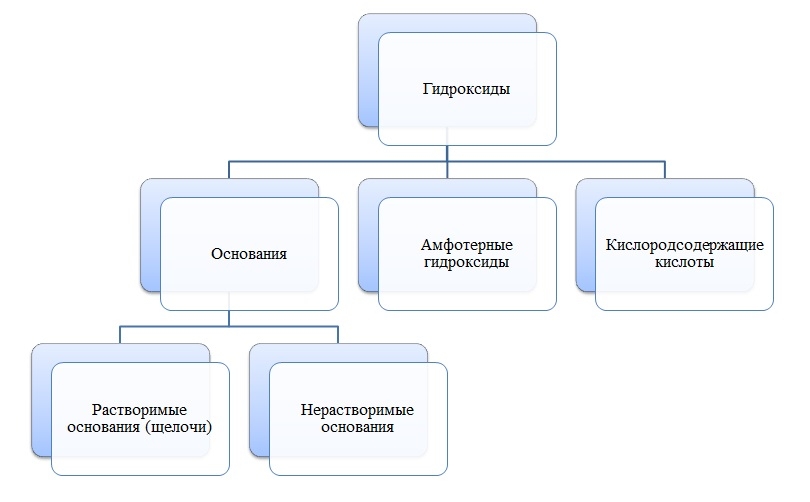
Гидроксиды
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
Пример
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Общая формула солей: MexAcy
Пример
KNO3 — нитрат калия
(NH4)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | H2S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | H2SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | H2SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | H2CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | H2SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | H3PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Дополнительные материалы
Станьте первым, кто оставит
комментарий к данному материалу.
Простые и сложные вещества
Простые вещества и их классификация
При изучении материала предыдущих параграфов, вы уже познакомились с некоторыми веществами. Так, например, молекула газа водорода, состоит из двух атомов химического элемента водорода –
Простые вещества – вещества, в состав которых входят атомы одного вида
К простым веществам, из числа известных вам веществ, относят: кислород, графит, серу, азот, все металлы: железо, медь, алюминий, золото и т.д. Сера состоит только из атомов химического элемента серы, а графит состоит из атомов химического элемента углерода. Нужно четко различать понятия «химический элемент» и «простое вещество».
Например, алмаз и углерод – не одно и тоже.
Углерод – химический элемент, а алмаз – простое вещество, образованное химическим элементов углеродом. В данном случае химический элемент (углерод) и простое вещество (алмаз) называются по-разному.
Часто химический элемент и отвечающее ему простое вещество называются одинаково. Например, элементу кислороду, соответствует простое вещество – кислород. Различать, где идет речь об элементе, а где о веществе, необходимо научиться! Например, когда говорят, что кислород входит в состав воды – речь идет об элементе кислороде. Когда говорят, что кислород – это газ, необходимый для дыхания – здесь идет речь о простом веществе кислороде. Простые вещества химических элементов подразделяют на две группы – металлы и неметаллы.
Металлы и неметаллы кардинально отличаются по своим физическим свойствам. Все металлы при нормальных условиях твердые вещества, исключение составляет ртуть – единственный жидкий металл.
Металлы непрозрачны, обладают характерным металлическим блеском. Металлы пластичны, хорошо проводят тепло и электрический ток.Неметаллы не похожи друг на друга по физическим свойствам. Так, водород, кислород, азот – газы, кремний, сера, фосфор – твердые вещества. Единственный жидкий неметалл – бром – жидкость коричнево-красного цвета.Если провести условную линию от химического элемента бора к химическому элементу астату, то в длинном варианте
Периодической Системы над линией расположены неметаллические элементы, а под ней – металлические. В коротком варианте Периодической Системы под этой линией расположены неметаллические элементы, а над ней – как металлические, так и неметаллические элементы. Значит, определять, является элемент металлическим или неметаллическим, удобнее по длинному варианту Периодической Системы.
Это деление условное, поскольку все элементы так или иначе проявляют как металлические, так и неметаллические свойства, но в большинстве случаев такое распределение соответствует действительности.
Сложные вещества и их классификация
Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О.
Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Сложные вещества – вещества, в состав которых входят атомы различных видов
Проведем следующий эксперимент. Смешаем порошки серы и цинка. Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.
Сложные вещества принято делить на две группы: неорганические вещества и их производные и органические вещества и их производные. Например, каменная соль – это неорганическое вещество, а крахмал, содержащийся в картофеле – органическое вещество.
Типы строения веществ
По типу частиц, входящих в состав веществ, вещества делят на вещества молекулярного и немолекулярного строения. В состав вещества могут входить различные структурные частицы, такие как атомы, молекулы, ионы. Следовательно, существует три типа веществ: вещества атомного, ионного и молекулярного строения. Вещества различного типа строения будут иметь различные свойства.
Вещества атомного строения
Примером веществ атомного строения могут быть вещества, образованные элементом углеродом: графит и алмаз. В состав этих веществ входят только атомы углерода, но свойства этих веществ очень сильно отличаются. Графит – хрупкое, легко расслаивающееся вещество серо-черного цвета. Алмаз – прозрачный, один из самых твердых на планете, минерал. Почему вещества, состоящие из одного типа атомов, имеют различные свойства? Все дело в строении этих веществ. Атомы углерода в графите и алмазе соединяются различным способом. Вещества атомного строения имеют высокие температуры кипения и плавления, как правило, нерастворимы в воде, нелетучи. Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла
Вещества молекулярного строения
Вещества молекулярного строения – это практически все жидкости и большинство газообразных веществ. Существуют и кристаллические вещества, в состав кристаллической решетки которых входят молекулы. Вода – вещество молекулярного строения. Лед также имеет молекулярное строение, но в отличие от жидкой воды, имеет кристаллическую решетку, где все молекулы строго упорядочены. Вещества молекулярного строения имеют невысокие температуры кипения и плавления, как правило хрупкие, не проводят электрический ток.
Вещества ионного строения
Вещества ионного строения – это твердые кристаллические вещества. Примером вещества ионного соединения может быть поваренная соль. Ее химическая формула NaCl. Как видим, NaCl состоит из ионов Na+ и Cl⎺, чередующихся в определенных местах (узлах) кристаллической решетки. Вещества ионного строения имеют высокие температуры плавления и кипения, хрупкие, как правило, хорошо растворимы в воде, не проводят электрический ток. Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать.
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Когда мы говорим о материале или компоненте смеси – например, колба наполнена газообразным хлором, водный раствор брома, возьмём кусочек фосфора, – мы говорим о простом веществе. Если же мы говорим, что в атоме хлора содержится 17 электронов, вещество содержит фосфор, молекула состоит из двух атомов брома, то имеем в виду химический элемент.
Нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже:
Сложные вещества необходимо отличать от смесей, которые тоже состоят из разных элементов. Количественное соотношение компонентов смеси может быть переменным, а химические соединения имеют постоянный состав. Например, в стакан чая вы можете внести одну ложку сахара, или несколько, а молекулы сахарозы С12Н22О11 содержит точно 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.
Таким образом, состав соединений можно описать одной химической формулой, а состав смеси – нет. Компоненты смеси сохраняют свои физические и химические свойства. Например, если смешать железный порошок с серой, то образуется смесь двух веществ.
И сера, и железо в этой смеси сохраняют свои свойства: железо притягивается магнитом, а сера не смачивается водой и плавает по ее поверхности. Если же сера и железо прореагируют друг с другом, образуется новое соединение с формулой FeS, не имеющее свойств ни железа, ни серы, но обладающее набором собственных свойств. В соединении FeS железо и сера связаны друг с другом, и разделить их методами, которыми разделяют смеси, нельзя.
Выводы из статьи по теме Простые и сложные вещества