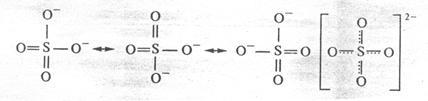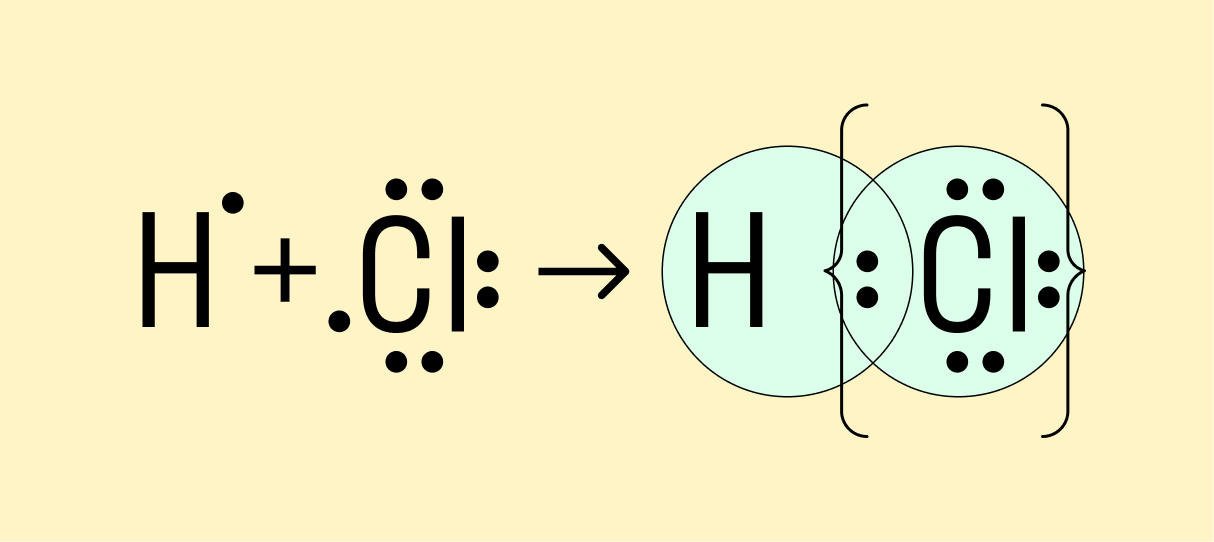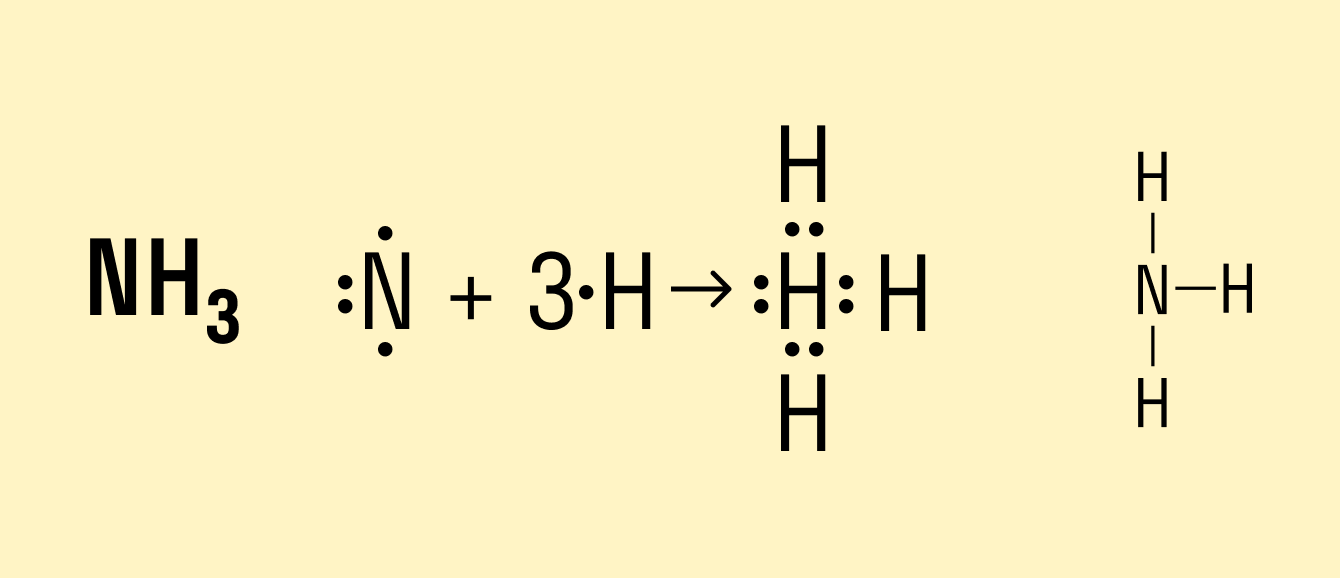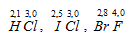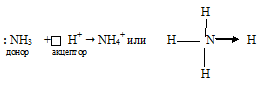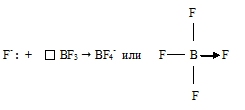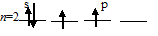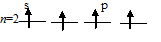Почему ковалентные связи имеют определенную направленность что она обуславливает
Направленность ковалентной связи



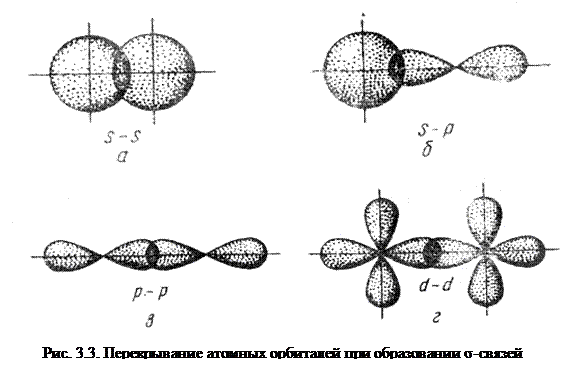
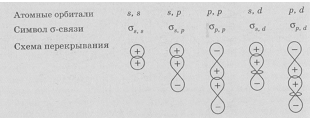
Согласно МВС наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей. Поскольку атомные орбитали имеют определённую форму, их максимальное перекрывание возможно при определённой пространственной ориентации, поэтому ковалентная связь характеризуется направленностью. Иначе говоря, направленность заключается в том, что максимальное перекрывание валентных электронных облаков взаимодействующих атомов возможно при определенной их взаимной ориентации. Направленность ковалентной связи определяет пространственную конфигурацию молекул.
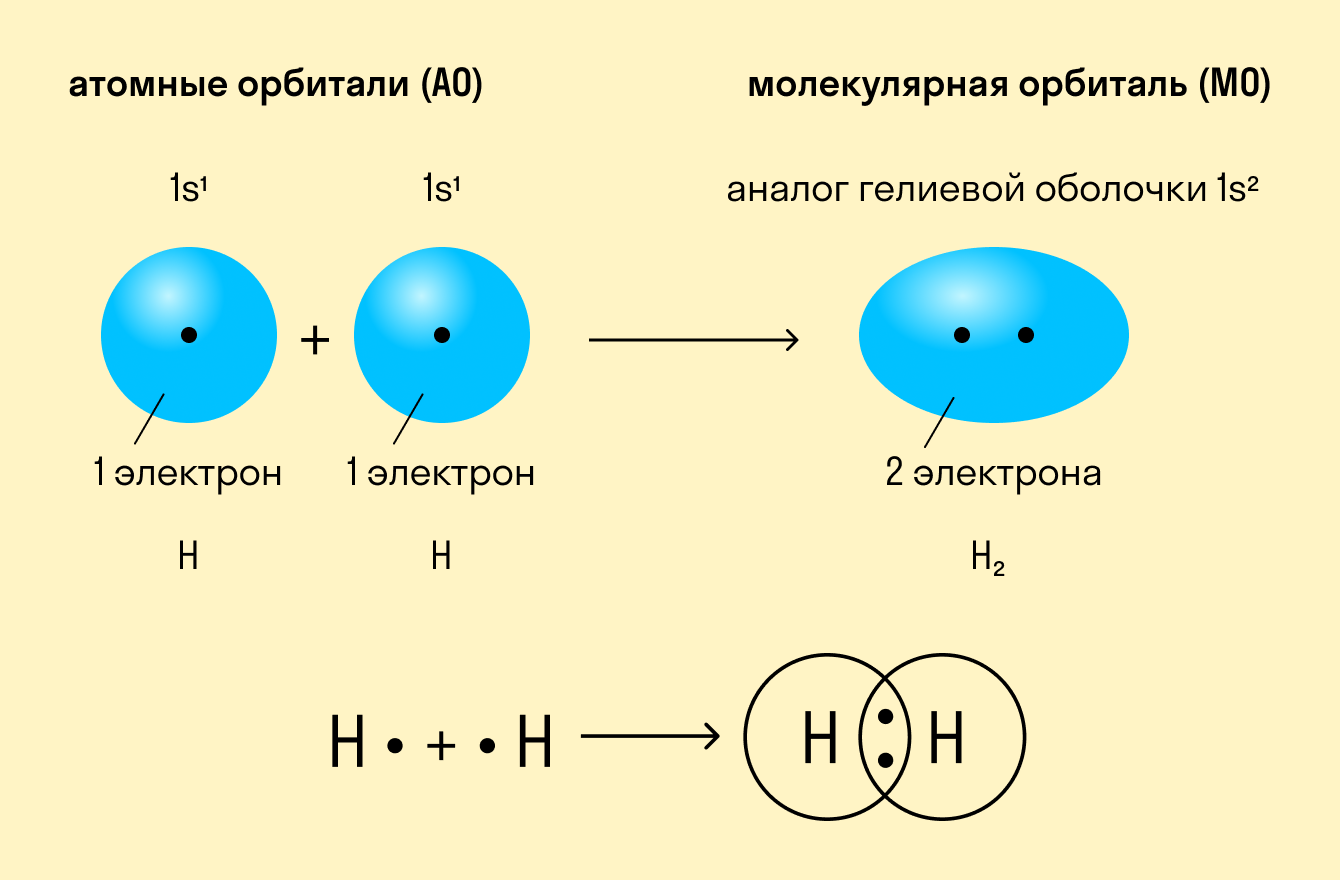
Простейший случай σ – связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (s-s перекрывание, рис. 3.4). Геометрическая форма молекулы линейная.
Рассмотрим образование молекулы HCl.
Исходя из стехиометрического состава молекулы HCl и валентности водорода, равной единице, мы видим, что хлор, находясь в невозбужденном состоянии, проявляет валентность В=1 (в возбужденном состоянии хлор проявляет валентности 3, 5, 7). При образовании молекулы HCl происходит перекрывание s – орбитали атома водорода с р – орбиталью атома хлора (s – р перекрывание). Молекула имеет линейную форму (рис. 3.5). Очевидно, такие же линейные молекулы должны образовать с водородом аналоги 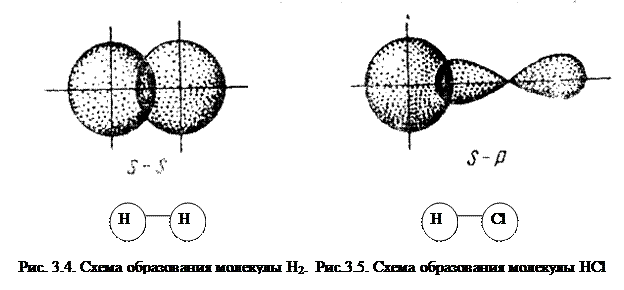
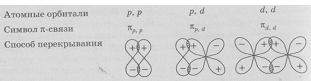
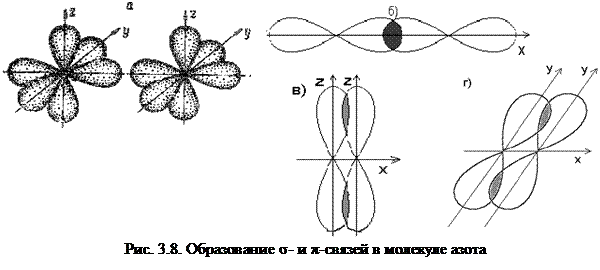
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р – р-орбиталей (рис. 3.6, a), p – d-орбиталей (рис. 3.6,б), d – d-орбиталей (рис. 3.6,в), а также f – p-, f – d- и f – f-орбиталей.
Связь, образованная перекрыванием d-орбиталей всеми четырьмя «лепестками» называется δ-связью (дельта-связью, рис. 3.7).
Соответственно, s-элементы могут образовывать только σ-связи, р-элементы – σ- и π-связи, d-элементы – σ-, π- и δ-связи, а f-элементы – σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.
Рис. 3.7. Направления перекрывания атомных d – орбиталей при образовании δ-связей
При наложении π-связи на σ-связь образуется двойная связь, например в молекулах кислорода, этилена, диоксида углерода.
Кратная связь изображается двумя черточками: О =О, С = С, О = С = О.
Хотя энергия π-связи меньше, чем энергия σ-связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи.
При наложении двух π-связей на σ-связь возникает тройная связь, например в молекулах азота, ацетилена и оксида углерода. Тройная связь изображается тремя черточками: N ≡ N, ─ C ≡ C ─, C ≡ O. Энергия тройной связи выше, а длина связи ниже, чем энергии и длины простой и двойной связей.
Число связей между атомами в МВС называется кратностью связи. Примером образования кратной связи может служить молекула азота N2.
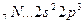

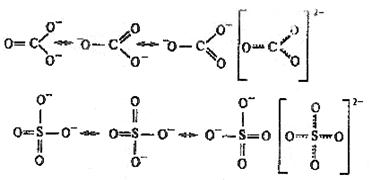
В действительности в чистом виде не существует ни та, ни другая структура, а гибридная структура, в которой π – электроны не принадлежат двум конкретным атомам, а всей молекуле в целом. Пи-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями, обозначаемыми пунктиром:
Приведенная структура называется резонансной.
Пространственные формы молекул весьма разнообразны. Так, молекула СО2 имеет линейную структуру, молекула СН4 – тетраэдрическую, молекула NH3 – пирамидальную, воды – угловую, SO3 – треугольную.
Для объяснения пространственной конфигурации молекул используется модель (теория) гибридизации атомных орбиталей.
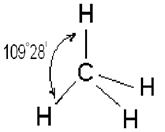
Гибридизация атомных орбиталей.В молекуле метана СН4 существуют четыре связи С – Н, имеющие одинаковые длины и энергии. Между тем у углерода в возбужденном состоянии имеются три р- и одна s-орбитали с неспаренными электронами, которые перекрываются s-орбиталями водорода. Исходя из этого, можно было бы ожидать, что характеристики одной из связей в молекуле метана будут отличаться от характеристик других связей. В действительности, все четыре связи в молекуле метана равноценны.
Для объяснения данного факта американский ученый Л. Полинг разработал теорию о гибридизации атомных орбиталей. Основные положения теории гибридизации АО:
1. Если у атома, вступающего в химическую связь, имеются разные АО (s-, р-, d- или f-АО), то в процессе образования химической связи происходит гибридизация (смешение) АО, т.е. из разных АО образуются одинаковые (эквивалентные) АО. Следует подчеркнуть, что гибридные АО образуются у одного атома, имеющего разные орбитали. Причем гибридизация происходит у орбиталей, имеющих близкие значения энергии.
Иначе говоря, гибридизация – выравнивание по форме и энергии АО (облаков) с образованием новых АО, одинаковых по форме и энергии. Новые облака называются гибридными, их число равно сумме АО, участвующих в гибридизации.
Следует отметить, что как физический процесс, гибридизация орбиталей не существует. Теория гибридизации АО – это удобный и наглядный прием описания сложных процессов, происходящих при образовании химических соединений.
2. Форма гибридной АО отличается от формы исходных АО (рис. 3.9). В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива.
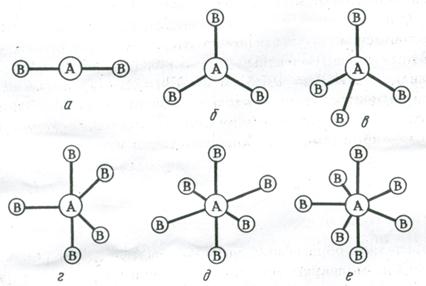
Пространственная конфигурация молекул. Характер гибридизации валентных орбиталей центрального атома и их пространственное расположение определяют пространственную конфигурацию (геометрическую форму) молекул:
1. Если в химическую связь вступает атом, у которого на внешней оболочке имеется s- и р – электроны, то у данного атома в процессе образования связи происходит sp – гибридизация АО (рис. 3.10).
(s+p) орбитали Две sp – орбитали
Рис. 3.10. Схема sp – гибридизации
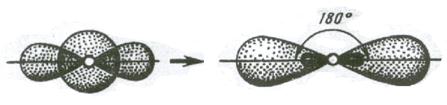
Две sp – гибридные орбитали расположены симметрично под углом 180˚, отсюда и связи, образуемые с участием электронов этих орбиталей, также располагаются под углом 180˚. Например, у атома бериллия sp – гибридизация орбиталей проявляется в молекуле BeCl2, которая вследствие этого имеет линейную форму (рис. 3.13,а)
s-p – гибридизация характерна для атомов элементов II группы периодической системы (Be, Mg, Cd, Hg и т. д.), для углерода в СО2, в органических соединениях с тройной углерод – углеродной связью.
2. Если у атома, вступающего в химическую связь, на внешней оболочке имеется один s- и два p- электрона, то происходит sp 2 – гибридизация АО орбиталей этого атома (рис. 3.11).
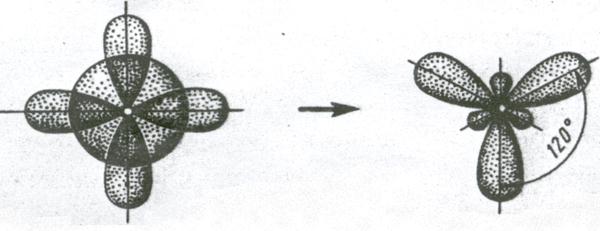
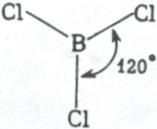
Три sp 2 – гибридные орбитали расположены под углом 120˚. Под таким же углом располагаются и связи, образованные с участием электронов этих орбиталей. Например, вследствие sp 2 – гибридизации орбиталей атома бора молекула BCl3 имеет треугольную форму (рис. 3.13, б). Распределение химических связей можно представить следующей схемой:
sp 2 – гибридизация встречается в молекулах элементов III группы периодической системы, а также в органических соединениях с двойной углерод – углеродной связью.
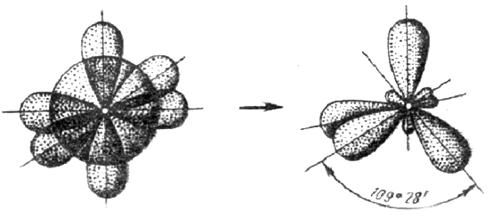
3. У атома, имеющего на внешней оболочке один s- и три р- электрона, при химическом взаимодействии происходит sp 3 – гибридизация этих АО (рис. 3.12).
(s+p+p+p) – орбитали Четыре sp 3 – орбитали
Рис. 3.12. Схема sp 3 – гибридизации
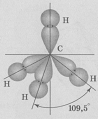
Четыре sp 3 – гибридные орбитали симметрично ориентированы в пространстве под углом 109˚28′ к четырем вершинам тетраэдра (рис. 3.13, в). Тетраэдрическое расположение связей и форма тетраэдра характерны для элементов IV группы, в том числе для многих соединений углерода, например, CH4:
4. Возможны также более сложные виды гибридизации с участием d- и f- орбиталей атомов, при которых образуются молекулы ещё более сложной конфигурации.
Рис. 3.13. Пространственное расположение связей и конфигурация молекул:
а – линейная; б – треугольная; в – тетраэдрическая; г – тригонально-бипирамидальная; д – октаэдрическая; е – пентагонально-бипирамидальная
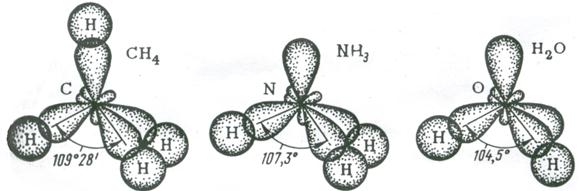
Влияние несвязывающей электронной пары центрального атома на строение молекул. Рассмотренная выше теория гибридизации орбиталей центрального атома (обозначен в общих формулах через А) применима к большому количеству молекул и ионов. Однако для ряда молекул и ионов, особенно имеющих несимметричное строение, рассмотренных представлений оказывается недостаточно. В подобных случаях применяют теорию полной гибридизации (Джиллеспи), в которой и связывающие, и неподеленные электронные пары центрального атома подвергаются sp 3 – гибридизации. sp 3 – гибридизация центральных атомов имеет место в молекулах NH3, H2O и им подобным, образованным их электронными аналогами.
У атома азота на четыре sp 3 – гибридные орбитали приходятся пять электронов.
Рис. 3.14. Перекрывание валентных орбиталей в молекулах CH4, NH3, H2O
В представлениях теории гибридизации уменьшение валентного угла НЭН в ряду СН4 (109,5˚) – NH3 (107,3˚) – H2O (104,5˚) объясняется следующим образом. В ряду С-N-О энергетическое различие между 2s- и 2р – орбиталями увеличивается, поэтому вклад 2s-орбиталей при гибридизации с 2р-орбиталями уменьшается. Это приводит к уменьшению валентного угла и постепенному приближению его к 90˚.
Ковалентные неполярные и полярные связи
Что такое ковалентная связь
На примере ковалентных связей удобно описывать механизм химической связи в целом. Впервые это сделал американский ученый Гилберт Льюис, анализируя взаимодействие между частицами в молекулах водорода, азота, кислорода и других простых неметаллов.
Как происходит такое взаимодействие? Атом водорода отличается очень простым строением — его электронное облако или орбиталь содержит лишь один свободный (валентный) электрон. При сближении двух атомов водорода их орбитали пересекаются и начинают частично перекрывать друг друга.
Свободные электроны на этих орбиталях объединяются в пару, которая принадлежит обоим участникам взаимодействия. Это и есть процесс образования ковалентной связи. По ее итогам каждый атом имеет уже два электрона и приобретает устойчивую внешнюю оболочку.
Ковалентная связь — это образование общей электронной пары у двух атомов вещества при сближении ядер этих атомов.
В зависимости от того, будет ли пара принадлежать обоим атомам в равной мере или сместится к одному из них, ковалентная связь бывает полярной или неполярной.
Ковалентная неполярная связь
Приведенный выше пример с атомами водорода иллюстрирует ковалентную неполярную связь. Образованная пара электронов находится на общей молекулярной орбитали и принадлежит обоим атомам. Это происходит потому, что в простых веществах взаимодействуют атомы с одинаковой электроотрицательностью (ЭО), т. е. они имеют равную способность притягивать электроны.
Ковалентная неполярная связь — это такое взаимодействие двух атомов, при котором их общая пара электронов равноудалена от атомных ядер и одинаково принадлежит обоим атомам. Другими словами, электронная плотность (область, в которой наиболее вероятно нахождение электронов) распределена равномерно.
Ковалентная неполярная связь образуется между атомами элементарных веществ с одинаковой ЭО.
Интересный пример ковалентной связи этого типа — молекула ромбической серы S8. У атома серы есть 2 свободных электрона, поэтому он может образовать 2 связи. Это простое вещество, а значит, все атомы будут притягивать электроны с одинаковой силой.
Формула данного вещества с ковалентной неполярной связью:
Ковалентная полярная связь
Мы рассмотрели, как проходит ковалентная химическая связь в молекулах, где все частицы одинаковы. Но если сблизить два атома с разной ЭО — например, водорода и хлора, получится другая картина. Поскольку у хлора ЭО выше и он притягивает электроны немного сильнее, чем водород, общая пара смещается в его сторону. Другими словами, у такой химической связи есть полярность.
Атом, принимающий электроны (в данном случае хлор), приобретает условно отрицательный заряд. Второй же атом, отдающий валентные электроны, заряжается положительно.
Ковалентная полярная связь — это электронный обмен между двумя атомами в молекуле вещества, при котором общая пара электронов смещается к одному атому (более электроотрицательному). Электронная плотность распределена неравномерно.
Ковалентная полярная связь образуется между атомами неметаллов с разной ЭО в составе сложных веществ.
Проиллюстрируем все, о чем сказано в определении ковалентной полярной связи, на примерах.
В молекуле аммиака NH3 атом азота имеет 3 свободных электрона, т. е. может образовать 3 химические связи. Поскольку это сложное вещество, состоящее из атомов неметаллов, можно говорить о полярности. Атом азота имеет общие электронные пары с тремя атомами водорода. При этом азот обладает более высокой ЭО, чем водород, поэтому электронная плотность смещена в его сторону.
Формула данного вещества с ковалентной полярной связью:
Механизмы образования ковалентной связи
Не всегда взаимодействие атомов происходит так, как в молекуле водорода. Иногда один атом отдает оба электрона, а второй забирает их на свою свободную орбиталь. В зависимости от этого выделяют два механизма ковалентной связи:
Обменный механизм — объединение в пару свободных электронов от взаимодействующих атомов (по одному электрону от каждого).
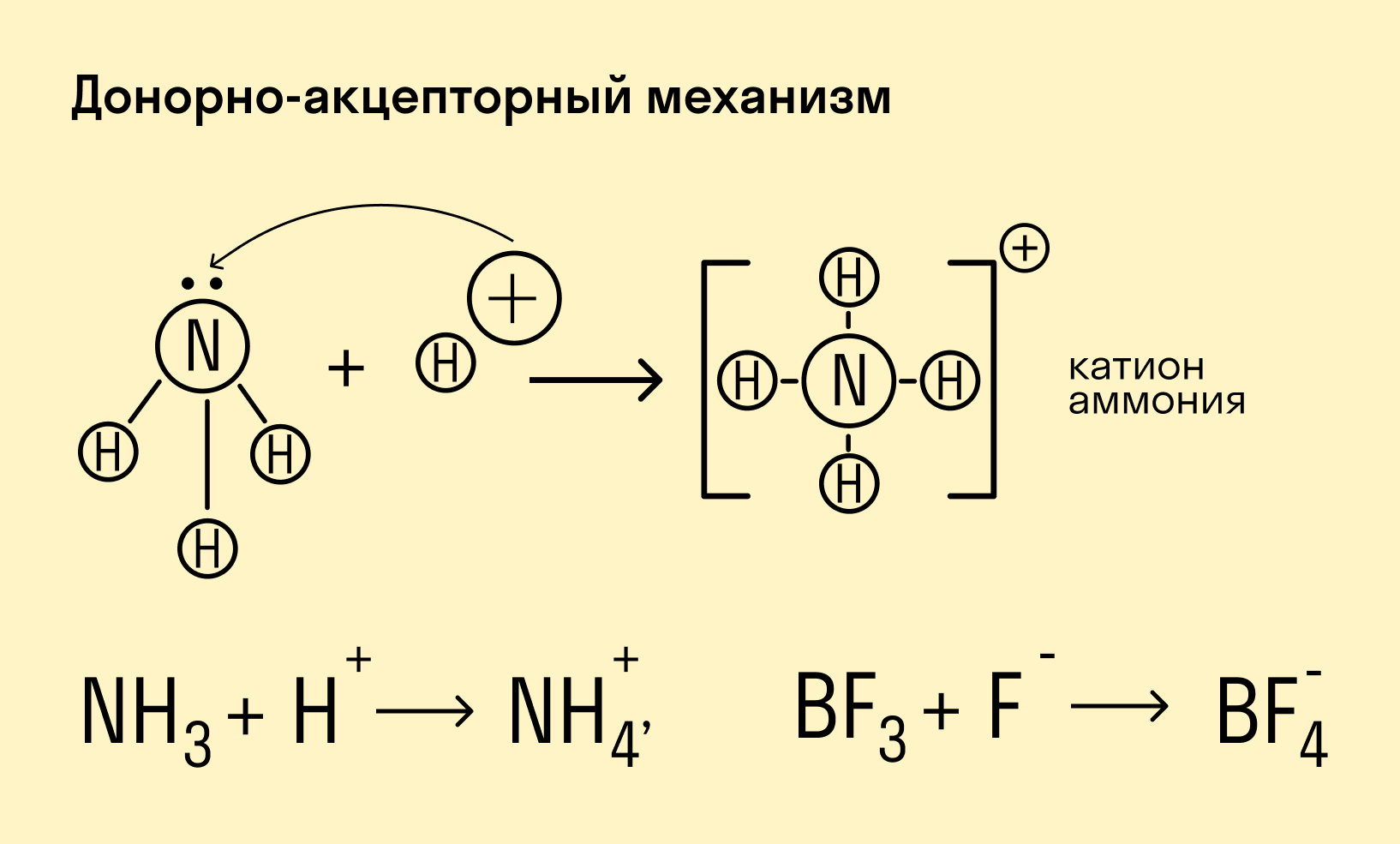
Донорно-акцепторный механизм — процесс, при котором атом-донор отдает два электрона, а атом-акцептор предоставляет для них орбиталь.
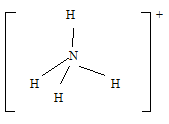
Химическую связь, образованную по донорно-акцепторному принципу, можно рассмотреть на примере молекулы катиона аммония. В данном случае атом азота, который содержится в аммиаке NH3, имеет неподеленную пару электронов и является донором. Он передает эти электроны на орбиталь атома водорода — акцептора. В результате такой связи образуется молекула NH4 + в форме тетраэдра, где углы представлены четырьмя атомами водорода.
Вещества, в молекулах которых есть хотя бы одна ковалентная химическая связь, осуществляемая по донорно-акцепторному принципу:
Механизм образования ковалентной связи
Ковалентная связь. Строение молекулы воды
Задание 61.
Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
Решение:
Связь, осуществляемая за счёт образования электронных пар, в одинаковой мере принадлежащей обоим атомам, называется ковалентной неполярной. Ковалентные связи определённым образом ориентированы в пространстве, т. е. имеют направленность. Причина того, что молекулы могут иметь линейное плоское или какое-либо другое строение, заключается в использовании атомами для образования связей разные орбитали и разное их количество. Молекулы, которые имеют дипольный момент, не являются линейными, а молекулы, у которых нет дипольного момента – линейные.
Полярная ковалентная связь
Значения ЭО водорода, хлора, брома, йода, фтора соответственно равны: 2,1; 3,0; 2,8; 2,5; 4,0. Исходя из значений ЭО элементов в соединениях
наиболее полярная связь в молекуле ВгF, так как разница электроотрицательностей между фтором и бромом наибольшая – 1,2 (4,0 – 2,8 = 1,2), чем у HCl и IСl.
Донорно-акцепторная связь
Катион аммония NH 4+ образуется по донорно-акцепторному механизму:
Он имеет форму правильного тетраэдра:
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи H — N, образованные по различным механизмам, никаких различий не имеют, т. е. все они равноценны. Донором является атом азота, а акцептором – атом водорода.
Ион BF 4- образуется из BF3 и иона F-. Этот ион образуется за счёт того, что неподелённая электронная пара иона F- «встраивается» в валентную оболочку атома бора ковалентносвязанной молекулы BF3:
В ионе BF 4- донором является ион фтора, а акцептором атом бора молекулы BF3.
Донорно-акцепторная связь в структурных формулах изображается стрелкой 
Метод валентных связей (ВС)
Задание 64.
Как метод валентных связей (ВС) объясняет линейное строение молекулы ВеCl2 и тетраэдрическое СН4?
Решение
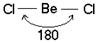
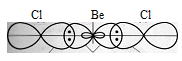
а) Представления метода валентных связей позволяют объяснить геометрию многих молекул. Так молекула BeCl2 состоит из одного атома бериллия и двух атомов хлора. Атом бериллия в возбуждённом состоянии имеет один s-электрон и один р-электрон. При образовании BeCl2 возникают две ковалентные связи. Одна из них должна быть s — p связью, образованная за счёт перекрывания s-облака атома бериллия и р-облака атома хлора, другая (р — р связь) за счёт перекрывания р-облака атома бериллия и р-облака атома хлора.
Рис. 1. Трёхатомная молекула BeCl2
В результате такого расположения гибридных облаков молекула BeCl2 имеет линейное строение.
б) Молекула СН4 состоит из одного атома углерода и четырёх атомов водорода, между которыми возникают четыре ковалентные связи. Атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, один из них на s-орбитали и три на р-орбиталях:
Заполнение внешнего энергетического уровня атома углерода в основном состоянии:
Заполнение внешнего энергетического уровня атома углерода в возбуждённом состоянии:
Рис. 2. Схема строения молекулы СН4;
Метан, несвязывающих электронных пар нет.
Образование сигма-связи и пи-связи
Задание 65.
Какую ковалентную связь называют 

Решение:
Связь, образующаяся за счёт перекрывания вдоль линии, соединяющей два атома, называют 

Варианты перекрывания атомных орбиталей, приводящие к образованию 
Связь, образованная за счёт перекрывания атомных орбиталей по обе стороны от межъядерной оси, называется 

Рис. 1.Схемы образования