Почему атомная масса кислорода меньше 16 несмотря на то что изотопный состав
Относительная атомная масса
Относительная атомная масса – это масса атома, выраженная в атомных единицах массы (а. е. м.). Относительную атомную массу принято абозначать как Ar. Большинство природных химических элементов представляют собой смесь изотопов, поэтому за относительную атомную массу элемента принимают среднее значение относительной атомной массы природной смеси его изотопов с учетом их содержания в земных условиях. Именно эти значения и приведены в Периодической системе. Например, кислород имеет три изотопа 16 О, 17 О и 18 О, их атомные массы и содержание в природной смеси приведены в таблице 1.
Таблица 1: Изотопный состав кислорода в природной смеси| Изотоп | Содержание в природной смеси, атомн., % ni | Атомная масса изотопа (а.е.м), Ar,i |
| 16 О | 99,759 | 15,995 |
| 17 О | 0,037 | 16,999 |
| 18 О | 0,204 | 17,999 |
Среднее значение атомной массы с учетом вклада каждого изотопа вычисляется по следующей формуле:
Ar = Σ Ar,i × ni, где Ar,i – атомные массы соответствующих изотопов, ni – содержание их в природной смеси (в мольных долях).
Подставляя в эту формулу соответствующие значения из таблицы 1 для атомной массы кислорода, получаем:
Ar = 15,995×0,99759+ 16,999×0,00037 + 17,999×0,0024 = 15,999 а.е.м.
Обратите внимание, что атомная масса и массовое число – совершенно различные понятия: первое – масса атома в а.е.м., а второе – число нуклонов в ядре. Атомная масса – дробная величина (имеет целое значение только для изотопа 12 С), в отличие от массового числа, которое всегда является целым.
Численно эти величины очень близки. Например, для водорода атомная масса равна 1,0078, а массовое число равно 1, для гелия атомная масса равна 4,0026, а массовое число – 4.
Относительные атомные массы имеют дробные значения по следующим причинам:
При образовании любой связи всегда выделяется энергия, на что расходуется часть массы связывающихся частиц. В случае образования химических связей эта величина очень мала, поэтому изменением массы здесь пренебрегают и считают, что масса образовавшейся частицы равна сумме масс частиц, участвующих в ее образовании. При образовании же ядра, выделяется очень большая энергия, и дефект массы хорошо заметен.
Почему атомная масса кислорода меньше 16 несмотря на то что изотопный состав
Если сравнить относительные атомные массы элементов А r в таблице Менделеева, можно обнаружить некоторые, на первый взгляд, «странности». Одна из них — разная степень точности представленных данных. Например, современное значение А r для С содержит пять значащих цифр, для О — шесть, для Al и Р — по семь, для F — девять, тогда как для Zn, Ge, Li, Se, Kr, Mo, Ni, Pb, Sr, Ti — лишь по четыре. Почему?
Оказывается, точность, с которой определяется относительная атомная масса элемента, зависит не только от тщательности измерений, но и от непостоянства его изотопного состава. В разных образцах соотношение изотопов не вполне одинаковое: лёгкие изотопы могут концентрироваться в одних породах, тяжёлые — в других. Поэтому давать очень точные значения атомных масс просто не имеет смысла. Кстати, по точности, с какой приводятся атомные массы, можно сразу сказать, происходит ли в природе «разделение изотопов» данного элемента, и насколько сильно.
Вторая «странность» заключается вот в чём. Относительные атомные массы, рассчитанные по «физической кислородной шкале» и углеродной, различаются. Хотя, казалось бы, они должны быть совершенно одинаковыми, так как при определении единицы измерения в первом случае делили массу атома 16 О (8 протонов, 8 нейтронов, 8 электронов) на 16, а во втором — массу атома 12 С (6 протонов, 6 нейтронов, 6 электронов) на Однако в действительности всё не так: 1/12 массы атома 12 С больше 1/16 массы атома 16 О! При образовании ядра слиянием протонов и нейтронов выделяется огромная энергия. В соответствии с уравнением Эйнштейна Е = m с 2 (с — скорость света), выделившаяся энергия Е «уносит» с собой часть массы т. Следовательно, масса нового атома не равна сумме масс его составляющих. Разница в массах (её назвали дефектом массы) может быть заметной — почти 1% для некоторых атомов. Больше всего «худеют» при образовании атомы с массовым числом около 50 (середина четвёртого ряда элементов в периодической системе). До этих элементов дефект массы растёт с увеличением атомного номера, после них — постепенно падает. Для 16 О дефект массы больше, чем для 12 С. Вот почему кислородная и углеродная единицы не совпадают.
Для иллюстрации дефекта массы просуммируем массы покоя двух электронов, двух протонов и двух нейтронов
в атоме 4 Не: 2 mp +2 mn + 2 me = 2•1,00728+2•1,00867+2х 0,00055 = 4,0330. Но на самом деле из-за дефекта массы А r ( 4 Не) = 4,0026 — и всё же больше 4. Итак, при образовании атомов из отдельных частиц обычная арифметика «не работает».
Теперь не покажется удивительным, что точные массы трёх изотопов кислорода в углеродных единицах составляют соответственно 15,9949; 16,9991 и 17,9992 и не равны массовым числам (т. е. 16, 17 и 18), а усреднённая масса кислорода, рассчитанная из этих значений с учётом распространённости изотопов в природе, как раз и равна 15,9994.
Для атомов углерода дефект массы тоже существует: он больше, чем у гелия и меньше, чем у кислорода. Однако А r ( 12 С) принята равной 12.
«Парадоксальные» относительные атомные массы можно найти и у других элементов — F, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Lu, Au, Bi, U, Th. Из них только у лютеция и урана имеются два или три стабильных (или очень долгоживуших) изотопа, остальные — элементы-одиночки с единственным стабильным изотопом, и для них дефект массы выявляется наиболее наглядно. Так, атомная масса марганца меньше 55 и равна 54,9380.
Несмотря на то что дефект массы несколько «портит» стройную гипотезу Праута, вряд ли сам учёный, живи он в наши дни, был бы этим огорчён. Скорее наоборот: он считал бы, что его гипотеза восторжествовала. Действительно, атомы (вернее ядра) любого химического элемента построены из целого числа простейших «кирпичиков» — протонов и нейтронов.
Большая Энциклопедия Нефти и Газа
Атомная масса кислорода равна 16; грамм-атом его равен 16 г; 8 г его составляют 8: 16 0 5 г-атома. [1]
Затем в 1860 г. Стае предложил считать атомную массу кислорода 16, и этот стандарт служил науке целое столетие. Стае, посвятивший большую часть своей жизни изучению этой проблемы, провел очень много выдающихся для своего времени исследований. Он занимался тщательной очисткой веществ, скрупулезно проводил химические реакции. [4]
Еще со времен Берцелиуса атомные массы элементов рассчитывались при допущении, что атомная масса кислорода равна 16 0000 ( см. гл. Но атомная масса кислорода могла быть только рассчитанной средней атомной массой трех изотопов, а соотношение изотопов кислорода могло от образца к образцу сильно меняться. [5]
Еще со времен Берцелиуса атомные массы элементов рассчитывались при допущении, что атомная масса кислорода равна 16 0000 ( см. гл. Но атомная масса кислорода могла быть только рассчитанной средней атомной массой трех изотопов, а соотношение изотопов кислорода могло от образца к образцу сильно меняться. [7]
При вычислениях атомных масс первоначально за единицу массы принимали массу атома водорода, как самого легкого элемента, и по отношению к нему вычисляли массы атомов других элементов. Изменение атомной массы кислорода повлекло бы за собой изменение атомных масс большинства элементов. [8]
При вычислениях атомных масс первоначально за единицу массы принимали массу атома водорода как самого легкого элемента и по отношению к нему вычисляли массы атомов других элементов. Изменение атомной массы кислорода повлекло бы за собой изменение атомных масс большинства элементов. [9]
При вычислениях атомных масс первоначально за единицу массы принимали массу атома водорода как самого легкого элемента и по отношению к нему вычисляли массы атомов других элементов. Изменение атомной массы кислорода повлекло бы за собой изменение атомных масс большинства элементов. [10]
Сравнив указанные в ней данные для кислорода и воды, можно сделать вполне определенный вывод, что молекула кислорода состоит из двух атомов или такого числа атомов, которое кратно двум. Данные для других соединений не позволяют утверждать, что атомная масса кислорода меньше 16, а, следовательно, это значение и может быть принято. [12]
Именно непостоянством изотопного состава кислорода объясняется, почему в таблицах последнюю четверку в значении атомной массы кислорода иногда ставят ниже других цифр или уменьшают в размерах: за эту четверку никто поручиться не может. То же справедливо и для некоторых других элементов. [13]
Почему атомная масса кислорода меньше 16 несмотря на то что изотопный состав
Названия элементов на латинском и русском языке и латинские символы этих элементов приведены для того, чтобы мы постепенно начинали знакомиться со всеми элементами.
Из приведенной таблицы видно, что средний измеренный атомный вес найденного в природе элемента зависит от того, сколько в нем содержится разных изотопов.
Как видно из таблицы 2-2, атомные веса элементов, найденных в природе в виде единственного изотопа (например, натрия), в точности равны атомному весу этого изотопа. Иначе обстоит дело с элементами, которые существуют на Земле в виде нескольких изотопов (например, хлор, кислород): их атомный вес зависит от того, какой изотоп этого элемента наиболее распространен и сколько в нем «примесей» других изотопов этого элемента.
Атомный вес элемента равен среднему значению из атомных весов всех его природных изотопов с учетом их распространенности.
34,97 × 0,75 + 36,96 × 0,25 = 35,5.
Если «разобрать» ядро атома на отдельные протоны и нейтроны (например, с помощью ядерной реакции), то их масса вновь примет именно те значения, которые нам уже известны: 1,00728 а.е.м. для протона и 1,00867 а.е.м. для нейтрона.
Нет никакой необходимости запоминать изотопный состав, заряд ядра, массовые числа и атомные веса разных элементов. Эти значения всегда можно найти в справочниках. Важно понимать физический смысл этих величин.
На первый взгляд кажется, что запомнить названия и символы элементов чрезвычайно трудно. К счастью, необходимо знать не все, а только важнейшие элементы. Например, только те, которые представлены в таблице 2-3. Кроме того, в конце этой главы мы расскажем о том, как можно довольно легко и весело помочь себе в этом нелегком деле.
Таблица 2-3. Названия и символы некоторых элементов.
Относительная атомная масса элемента в химии и история её определения
В процессе развития науки химия столкнулась с проблемой подсчёта количества вещества для проведения реакций и полученных в их ходе веществ.
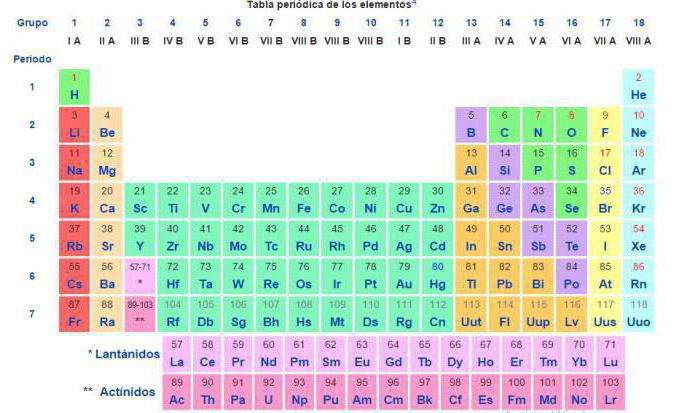
На сегодня для подобных расчётов химической реакции между веществами и смесями используют значение относительной атомной массы, внесённой в периодическую таблицу химических элементов Д. И. Менделеева.
Химические процессы и влияние доли элемента в веществах на ход реакции
Современная наука под определением «относительная атомная масса химического элемента» подразумевает, во сколько раз масса атома данного химического элемента больше одной двенадцатой части атома углерода.
С зарождением эры химии потребность в точных определениях хода химической реакции и её результатов росла.
Исторический ход подсчёта вещества
Изначально использовался водород, затем кислород. Но этот способ расчёта оказался неточным. Причиной тому послужило наличие в кислороде изотопов с массой 17 и 18.
Дальтон заложил основы относительной атомной массы элемента
Лишь спустя некоторое время, в 19-м веке, Дальтон предложил вести расчёт по самому лёгкому химическому элементу – водороду. На лекциях своим студентам он демонстрировал на вырезанных из дерева фигурках, как соединяются атомы. По другим элементам он использовал данные, ранее полученные другими учёными.
По экспериментам Лавуазье в воде содержится пятнадцать процентов водорода и восемьдесят пять процентов кислорода. Имея эти данные, Дальтон рассчитал, что относительная атомная масса элемента, входящего в состав воды, в данном случае кислорода, составляет 5,67. Ошибочность его расчётов связана с тем, что он считал неверно относительно количества атомов водорода в молекуле воды.
Изотопная составляющая вещества влияет на значение точности относительного атомного веса
Относительная атомная масса изотопов водорода составляет соответственно два и три. «Тяжёлая» вода (образованная дейтерием и тритием) испаряется хуже. Поэтому в парообразном состоянии изотопов воды меньше, чем в жидком состоянии.
Избирательность живых организмов к различным изотопам
Существование в природе нестабильных веществ
У некоторых элементов относительная масса указана в квадратных скобках. Как видно, это элементы, расположенные после урана. Дело в том, что они не имеют устойчивых изотопов и распадаются с выделением радиоактивного излучения. Поэтому в скобках указан наиболее устойчивый изотоп.
В процессе синтеза новых изотопов и измерения их продолжительности жизни порой удавалось обнаружить нуклиды с продолжительностью полураспада в миллионы раз дольше.