сколько жизней спасли антибиотики
Лекарство, спасшее миллионы жизней: 75 лет назад был впервые успешно применен пенициллин
В среде учёных ходит легенда. Якобы Тиберио, когда жил в небольшом городке Арцано, заметил одну странность. Как только местный колодец чистили, в семьях по округе вспыхивала дизентерия. И тогда итальянец подумал, а вдруг в колодце до того, как его почистили, было нечто, что мешало развитию опасных бактерий? К его большому удивлению, это оказалась плесень! Но Тиберио не довёл работу до конца. Успех ждал другого.
И всё же, откуда плесень взялась на рабочем столе у Флеминга? Художница из Москвы Дарья Фёдорова, по сути, раз за разом воспроизводит сценарий того, что случилось в лаборатории бактериолога. В чашках Петри девушка выращивает десятки видов плесени. Красивая и отталкивающая, оказывается, она просто всегда рядом с нами.
Величайшее открытие в медицине — чистая случайность, Флеминг это признавал. Как выигрыш в лотерею, в чашку со стафилококком попал гриб, который убивал стафилококк. Но в этой истории есть ещё один сюрприз — неприятный. За 75 лет бактерии научились противостоять антибиотикам.
В лабораториях по всему миру ищут способы победить новые супербактерии, устойчивые к лекарствам. А виновных в проблеме уже нашли. Это… мы сами! Антибиотики в домашней аптечке, антибиотики при малейшем чихе. Чем чаще мы принимали эти лекарства, тем лучше бактерии к ним адаптировались. Открывать новые антибиотики всё сложнее, сейчас их ищут на дне океанов, в антарктических грунтах, в растениях и даже на коже лягушек.
Борьба за выживание. Погибнет ли человечество из-за устойчивости к антибиотикам
Три года назад Всемирная организация здравоохранения (ВОЗ) объявила, что человечество может остаться без эффективных лекарств против инфекций и погрузиться в постантибиотическую эпоху. Иными словами, любая хирургическая операция, включая кесарево сечение, пустяковая царапина с попавшей инфекцией, воспаление легких или туберкулез, скорее всего, приведут к смерти. Лечение же нелетальных бактериальных болезней станет затяжным и мучительным. Даже случаи заболевания бубонной чумой в США в августе 2017 года, которые выглядят просто страшилками в изложении желтой прессы, могут обернуться ужасной мировой эпидемией в мире без антибиотиков.
Мультирезистентный золотистый стафилококк (Staphylococcus aureus, MRSA) — одна из главных угроз человечества. Он с трудом поддается лечению, угрожает жизни человека и может привести к сепсису, пневмонии и инфекциям кровотока. Согласно статистике, от MRSA ежегодно умирают более 18 000 человек, заражается же им в пять раз больше (только инвазивно, при операциях). Более того, почти 9 из 10 заражений устойчивым золотистым стафилококком происходит в больницах, когда пациент лечится от другой болезни.
Получается, что прибывая на лечение в госпиталь, уже сейчас пациенты могут быть заражены этим смертельно опасным микроорганизмом. Вероятность такого события пока низка, но далее будет пояснено почему ситуация будет только ухудшаться. Поэтому антибиотикорезистентность (АБР) требует немедленных действий со стороны здравоохранительных организаций и широкой общественности, и в этом году Всемирная неделя правильного использования антибиотиков, объявленная ВОЗ, прошла 13–19 ноября.
По последним данным ВОЗ, три пункта в списке 10 ведущих причин смертности в мире занимают бактериальные инфекции или болезни, ими опосредованные (респираторные инфекции нижних дыхательных путей, диарейные болезни и туберкулез). И от них умирает каждый десятый человек в мире.
Глобальную ежегодную смертность от самых распространенных лекарственно-устойчивых штаммов инфекций оценивают минимум в 700 000 человек. Если ситуация не изменится, 100 млн человек к 2030 году умрут преждевременно, а через 35 лет эта цифра достигнет 300 млн. Мировая ежегодная смертность из-за АБР достигнет к 2050 году 10 млн.
«Если мы не сможем никак на это повлиять, то мы сталкиваемся с почти немыслимым сценарием, в котором антибиотики перестают работать, а мы возвращаемся в темные века медицины», — прокомментировал ситуацию Дэвид Кэмерон, бывший премьер-министр Великобритании.
От первых открытий до наших дней
Тысячелетиями человечество боролось с микроорганизмами. Первый антибиотик — пенициллин — открыл британец Александр Флеминг в 1928 году. Широко использовать в клинике эту группу лекарств стали лишь в 40-х годах. Следующие два десятилетия считаются золотой эрой антибиотиков, но постепенно темп открытий сошел на нет, и сейчас антибактериальных лекарств, попадающих на рынок, крайне мало.
Много внимания уделяется веществам, нацеленным на клеточную стенку бактерий, которая часто защищает микроорганизм от действия антибиотика, как броня. Один из таких многообещающих препаратов — тейксобактин. Он известен еще и тем, что его разработчики создали уникальную технологию культивирования микроорганизмов iChip, которая может значительно облегчить поиск новых антибиотиков. Другое перспективное лекарство — лугдунин. Он эффективно справляется с мультирезистентным золотистым стафилококком, самой опасной супербактерией. Однако, к сожалению, гарантии того, что бактерии не выработают устойчивость и к этим препаратам, нет.
Потребление же антибиотиков во всем мире за 2000–2010 годы выросло более чем на треть, согласно работе исследователей из Принстонского университета. За три четверти этого всплеска ответственны пять стран — Бразилия, Россия, Индия, Китай и Южно-Африканская Республика (БРИКС).
Свою лепту вносят и США. Хотя общий объем принимаемых антибактериальных препаратов за указанный период времени по сравнению с БРИКС не очень изменился, в Америке на душу населения потребляется гораздо больше антибиотиков, чем в любой другой стране: к примеру, разница с Индией больше чем в два раза.
Как возникает АБР?
Когда говорят об АБР, подразумевают, что микроорганизмы выживают после воздействия лекарств, которые раньше их убивали или хотя бы останавливали рост. Однако это отнюдь не новое явление: это естественный процесс, о существовании которого известно со времени открытия этих лекарств. Тем не менее проблема стала глобальной только недавно из-за чрезмерного употребления антибиотиков во многих сферах жизнедеятельности человека, включая медицину и животноводство.
Кто виноват?
Результаты исследований их нового препарата гепотидацина выглядят многообещающе — однако до выхода на рынок ему пока далеко.
Почему же за последнее время появилось так мало новых антибиотиков? Как получилось, что, говоря словами Аннет Хайнцельманн из организации Médecins Sans Frontières, существующая система R&D (research & development) в фармацевтике не всегда разрабатывает именно те лекарства, которые нужны? Ответ прост: процесс разработки препарата и вывода его на рынок слишком затратны и продолжительны, гарантии на успех нет, а прибыли от продаж слишком малы. Поддержки же от государств, международных здравоохранительных организаций и органов, регулирующих процесс одобрения новых лекарств, не было. Долгое игнорирование проблемы властями разных стран дополнительно ухудшило ситуацию.
От продаж тоже многого ожидать не приходится из-за низких цен на антибиотики. «Обычно все пишут, что в целом лекарства слишком дорогие, но в случае антибиотиков — они слишком дешевые. Большая фарма решила перенаправить R&D в сторону так называемой хронической терапии, и они ищут препараты для лечения болезни Альцгеймера, рака, гипертонии или диабета», — рассказывает DDD magazine главный исполнительный директор молодой компании MotifBio, специализирующейся на разработке новых антибиотиков, Грэм Ламсден. Cамая успешная разработка MotifBio — антибиотик иклаприм против резистентных стафилококков — сейчас находится на последних стадиях клинических испытаний.
Государство на страже
Чтобы предотвратить это, многие страны решили действовать — как по-отдельности, так и сообща. Это привело к созданию множества программ по борьбе с устойчивостью бактерий. Главные их постулаты сходятся: это улучшение диагностики инфекционных заболеваний и определения резистентных бактерий, изменение подхода к использованию антибиотиков в различных областях, включая животноводство, разработка новых лекарств и антимикробных вакцин, и, наконец, объединение государств, фармпромышленности, научного сообщества и простых людей для борьбы — фактически за выживание человечества.
В США в 2014 году опубликовали «Национальную стратегию Белого дома по борьбе с антибиотикорезистентными бактериями», в реализации которой важное место принадлежит Центрам по контролю и профилактике заболеваний (CDC).
Кроме того, в 2012 году Конгресс принял Закон об инновациях и безопасности в сфере контроля за лекарствами и потребительскими продуктами. Восьмая часть закона стала широко известна под аббревиатурой GAIN (Generating Antibiotic Incentives Now, дословно «создание условий для инвестиций в антибиотики сейчас»). Она требовала от Управления по контролю за продуктами и лекарствами (FDA) — главного органа контроля за процессом одобрения новых лекарств в США — предпринять шаги, стимулирующие производителей инвестировать в разработку антибиотиков. Среди прочего, она повлияла на ускорение процесса одобрения этих препаратов и предоставляла дополнительные пять лет эксклюзивности на рынке. FDA же по итогам должно было пересмотреть и составить новые четкие рекомендации по разработке антибиотиков, нацеленных на определенные бактерии. К сожалению, эта инициатива не полностью увенчалась успехом — в этом году фармкомпании попросили прояснения этого акта.
США также объединились с Великобританией для создания CARB-X — возможно, самого крупного государственно-частного сотрудничества в мире. Его цель — доклинические исследования антибиотиков, на которые выделено около полумиллиарда долларов.
Кроме того, в 2014 году Большая фарма в лице Astellas, AstraZeneca, Cubist, GlaxoSmithKline, Roche, Pfizer and Sanofi присоединилась к инициативе ЕС DRIVE‐AB (Driving Reinvestment in R&D and Responsible Antibiotic Use) по разработке новых, более финансово выгодных экономических моделей ведения исследований по антибиотикам. Участники надеются, что в итоге удастся разработать стратегию привлечения инвестиций в эту область.
Наконец, фармкомпании в прошлом году создали свою коалицию по мониторингу устойчивости бактерий. Краеугольным камнем этого альянса стала «Декларация по борьбе с антибиотикорезистентностью», принятая представителями фармацевтической, биотехнологической и диагностической промышленности. Результаты их работы объявят в 2018 году.
Российская ситуация
Как же борьба с АБР идет в России? С одной стороны, реальность угрозы очевидна всем. К примеру, создана карта чувствительности микроорганизмов к антибиотикам по всей стране, а Минздрав буквально пару месяцев назад внес в Правительство Российской Федерации «Стратегию предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года». И на Московском международном форуме «Открытые инновации» 2017 года в обсуждении на тему антибиотикорезистентности подчеркнули необходимость создания на базе «Сколково» рабочей группы и программы по борьбе с антибиотикорезистентностью, аналогичной уже разработанным в других странах.
Новый перспективный объект для исследователей — это потенциаторы, соединения, которые в комбинации с антибиотиком усиливают его действие. Они борются с уже устойчивыми к лечению бактериями, не требуют разработки новых и, возможно, помогут вернуть в клинику старые антибиотики.
Подобные потенциаторы сейчас активно изучает команда российских ученых из компании Superbug Solutions UK Ltd. (Sbsplatform.io), резидента «Сколково». Исследователи работают над молекулами класса алкилрезорцинов — в естественных условиях подобные соединения выделяют, например, микробы и растения для защиты от паразитов. Они проникают внутрь бактерии и нарушают работу ключевых процессов ее жизнедеятельности, действуя на несколько мишеней одновременно: на мембраны, различные белки и геном бактерий. В результате у микроорганизма развивается стресс, а антибиотик получает более легкий доступ к своей цели.
Изучив множество алкилрезорцинов, исследователи выбрали самый перспективный из них — М13 (точная формула — коммерческая тайна). Исследования на мышах, зараженных смертельно опасной клебсиеллезной инфекцией, показали, что эффективность лечения антибиотиками в комбинации с М13 действительно повышается.
Европейская Комиссия признала разработку конкурентоспособной и инновационной, а также рекомендовала для инвестирования в программе Европейского Союза по научным исследованиям и инновациям «Горизонт 2020» (Horizon 2020). Superbug Solutions запланировала будущие эксперименты по изучению алкилрезорцинов и сейчас работает с 19 эффективными комбинациями с антибиотиками.
После этих опытов разработчики перейдут к клиническим исследованиям. Средства же на испытания и продвижение препарата рассчитывают собрать путем международного краудфандинга без привлечения финансирования от Большой фармы.
Заключение
Антибиотикорезистентность «поражает» всё новые штаммы бактерий, а инструментов борьбы с ней все еще немного. Что же дальше: темные века медицины без антибиотиков, либо же новый мир с другим подходом к лечению инфекций? Возможно, вопрос упирается в то, насколько удастся объединить общие усилия по борьбе с АБР и вовлечь общественность в эту войну — ведь она касается каждого. Однако исход этой битвы пока не ясен.
Текст опубликован в рамках спецпроекта Forbes и научно-популярного портала «Биомолекула», посвященного достижениям молекулярной биологии и их внедрению в биотехнологиях и медицине. Расширенная версия статьи — на сайте «Биомолекулы».
Новости Барнаула
Опросы
Спецпроекты
Прямой эфир
Лекарство, которое спасло миллионы. 10 удивительных фактов о пенициллине
Пенициллин / Фото: ru-static.z-dn.net
13 сентября мир празднует день рождения пенициллина. Открыл это лекарство Александр Флеминг. За всю историю человечества не было другого лекарства, которое спасло бы столько человеческих жизней. «Для победы во Второй мировой войне пенициллин сделал больше, чем 25 дивизий!» Именно такие слова прозвучали при вручении Флемингу, Чейну и Флори Нобелевской премии по биологии и медицине. ИА «Амител» подготовило подборку интересных фактов об этом удивительном лекарстве.
Факт №1
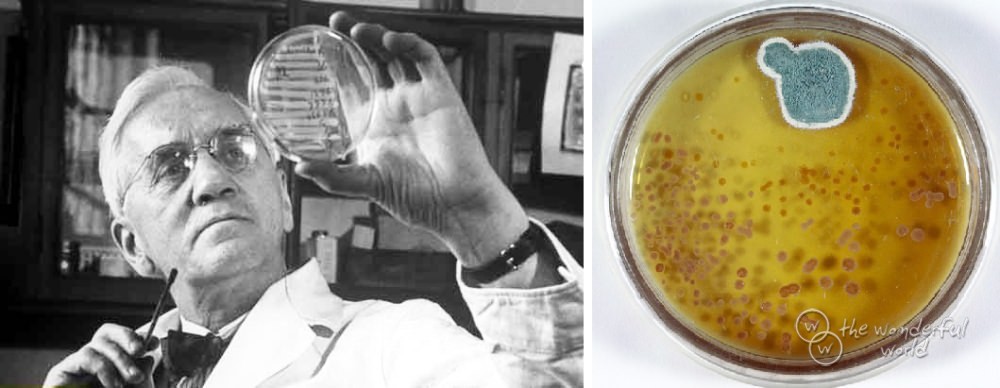
Неряшливость шотландского микробиолога Александра Флеминга явилась причиной открытия пенициллина. Когда 3 сентября 1928 года он возвратился в свою лабораторию, после того как целый месяц отсутствовал, то обратил внимание на чашку Петри, внутри которой образовался участок с плесенью. Ученый заметил, что вокруг плесени исчезли все микробные колонии. Этот феномен заинтересовал Флеминга, и он провел исследование содержимого чашки. Плесень принадлежала к роду пеницилловых, а вещество, погубившее микробов, ученый назвал пенициллином.
Отчет о своем новом открытии Флеминг опубликовал в 1929 году в одном британском журнале, который был посвящен экспериментальной патологии. В этом же году он все еще занимался исследованиями и вскоре обнаружил, что осуществлять работу с пенициллином сложно, его выработка чрезвычайно трудоемка и выделить в чистом виде его невозможно. К тому же экстракт плесени оказался нестойким, быстро выводился из тканей, и создать нужную концентрацию для полного уничтожения бактерий не получалось.
Флеминг продолжал в больнице свои опыты по местному применению пенициллина, используя экстракт плесени наружно для лечения воспалительных очагов. Результаты были довольно благоприятными, но отнюдь не чудодейственными, так как в нужный момент лекарство теряло свою активность. В 1931 году, выступая в Королевской зубоврачебной клинике, он снова охарактеризовал пенициллин как перспективный препарат. В 1932 году в журнале «Патология и бактериология» Флеминг опубликовал результаты своих опытов лечения инфицированных ран.
В середине 1939 года молодой английский профессор Хоуард Уолтер Флори, заведующий кафедрой патологии в Оксфордском университете, и биохимик Эрнест Чейн по просьбе Флеминга попытались получить в чистом виде пенициллин. Только после двух лет разочарований и поражений им удалось получить несколько граммов коричневого порошка.
Когда 3 сентября 1939 года Англия объявила войну Германии, Оксфордская группа, опасаясь немецкой оккупации, решила любой ценой спасти чудодейственную плесень. Чейн и Флори вывезли свой препарат на анализ в США контрабандным способом: они пропитали коричневой жидкостью подкладку своих пиджаков и карманов. Достаточно было выжить одному из них, чтобы сохраненные споры плесневых грибков позволили возобновить работу. Только в середине 1940 года пенициллин удалось получить в необходимом для исследований количестве.
Первые инъекции нового средства были сделаны человеку 12 февраля 1941 года. Один из лондонских полицейских во время бритья порезался. Развилось заражение крови. Первый укол пенициллина сделали умирающему пациенту. Состояние больного сразу улучшилось. Но пенициллина было слишком мало, запас его быстро иссяк. Болезнь возобновилась, и пациент умер. Несмотря на это, наука торжествовала, так как было убедительно доказано, что пенициллин прекрасно действует против заражения крови. Через несколько месяцев ученым удалось накопить такое количество пенициллина, которого могло с избытком хватить для спасения человеческой жизни. Счастливцем был пятнадцатилетний мальчик, больной заражением крови, которое не поддавалось лечению. Это был первый человек, которому пенициллин спас жизнь.
В 1941 году СССР запросил у союзников образец лекарства. Однако ответа не последовало. Тогда в 1942 году под руководством главы всесоюзного института экспериментальной медицины Зинаиды Виссарионовны Ермольевой из плесени, собранной со стен бомбоубежища, в тяжелейших условиях был получен отечественный пенициллин. Советский препарат был назван «пенициллин-крустозин». Его выпуск был начат в 1944 году на предприятиях химико-фармацевтической промышленности методом поверхностного культивирования гриба.
В 1943-м впервые пенициллин начали выпускать в массовом количестве в Пеории, штат Иллинойс, на заводе Хайрама Уолкера. Когда-то здесь с большим знанием дела «варили» виски, и на винодельческой фирме имелось превосходное оборудование для ферментации. Но вскоре выяснилось, что эти помещения слишком тесные для наращивания производства лекарства, что потребовало расширения бизнеса.
Потребность в пенициллине росла с каждым днем. Важно было увеличить не только количество препарата, но и его активность. Интересное испытание антибиотиков произошло в январе 1944 года, когда в Москву с группой зарубежных ученых приехал профессор Флори. Он привез свой пенициллин и решил сравнить его с российским. Наш препарат оказался активнее зарубежного: 28 единиц против 20 в 1 мл. Тогда профессор Флори и американский ученый Сандерс предложили провести клинические испытания по оценке действия препарата на больных. И вновь победу одержал наш отечественный пенициллин.
По просьбе профессора Флори предоставить для дальнейших исследований русский пенициллин ему намеренно, якобы как его образец, был выдан американский штамм. Вернувшись в Америку, Флори исследовал полученный материал и был разочарован. В своем отчете он написал: «Советская плесень оказалась не crustosum, а notatum, как у Флеминга. Ничего нового русские не открыли». А вот советские ученые как раз и «утерли нос» американским коллегам, но только наладить широкомасштабное производство этого препарата в разрушенной стране было непросто.
Сам пенициллин по настоянию Флеминга не был запатентован. Он считал, что лекарство, спасающее людям жизнь, не должно служить источником дохода.
Антибиотики перестают действовать: пневмония и сепсис наступают

По результатам опроса «Левада-Центра» в 2018 году, 34% россиян считают, что антибиотики убивают вирусы. Такая лекарственная неосведомленность стоит жизни: бактерии становятся все более и более устойчивыми к медикаментам. В результате ежегодно в мире от антимикробной резистентности (АМР, устойчивость бактерий к антибиотикам — прим. ред.) умирает около 700 тысяч человек.
Сепсис и антимикробная резистентность: актуальность для России
По словам Романа Козлова, члена-корреспондента РАН, доктора медицинских наук, профессора, президента Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), привыкание бактерий к антибиотикам ведет как к высокой смертности, так и к снижению экономических показателей.
«Мировые потери из-за резистентности антибиотиков в 2018 году составили порядка 400 млн долларов ВВП, к 2050 году они могут вырасти до 8 трлн долларов, — отметил эксперт. — Сегодня ежегодно в мире от резистентности умирают 700 тысяч человек, а от онкологии — порядка 8 млн 200 тысяч. К 2050 году количество смертей от последствий АМР возрастет до 10 млн человек в год».
При этом ежегодно на рынке появляется все меньше новых антибиотиков. Если в 1984 году их было 18, в 1998 году — 12, то к 2012 их количество сократилось до 4–5 в год. Чтобы изменить ситуацию с АМР, в 2017 году правительство России утвердило «Стратегию предупреждения распространения антимикробной резистентности в РФ на период до 2030 года».
«Мы ведем активную борьбу с ростом АМР. И для этого информируем население о том, что антибиотики работают только при бактериальной инфекции и бесполезны при вирусных. Также был разработан и внедрен профессиональный стандарт „Медицинская микробиология“, на основании которого сейчас готовятся специалисты, работающие в этой отрасли», — рассказал Козлов. Кроме того, по словам эксперта, в России активно изучают механизмы возникновения антимикробной резистентности, есть специальный банк бактериальных штаммов.
Сепсис и пневмонии: профилактика и проблемы при лечении
По словам Козлова, в результате роста антимикробной резистентности увеличивается количество больных, например, пневмонией. При тяжелом случае течения этого заболевания происходит заражение крови (сепсис), тогда спасение жизни пациентов — дело нескольких суток.
Сергей Авдеев, профессор, заведующий кафедрой пульмонологии Сеченовского университета отметил: «При тяжелой пневмонии больные на ИВЛ умирают в 64% случаев. Для предупреждения сепсиса необходимо ввести антибиотик хотя бы в первые четыре часа. Так, если антибиотик ввести в первые два-три часа, то летальность при сепсисе увеличивается в полтора раза. Если же на пятый-шестой час развития заболевания, то смертность вырастет уже в два раза. Вероятность минимальна, разумеется, в первый час введения лекарства».
Профессор кафедры госпитальной терапии Сеченовского университета, президент «Альянса клинических химиотерапевтов и микробиологов» (Москва) Сергей Яковлев рассказал, как АМР может внезапно привести к смерти человека. Одним из таких случаев стала гибель 48-летней женщины, которая была доставлена в больницу из-за длительных болей в животе. Дома больная принимала «Но-шпу», «Анальгин», но безрезультатно, поэтому вызвала скорую. После госпитализации женщине диагностировали аппендицит и перитонит (воспаление брюшной полости — прим. ред.), ее прооперировали. Затем назначили курс антибиотиков. Но пациентке не становилось лучше, анализ показал наличие в организме клебсиеллы — бактерии, устойчивой к большей части антибиотиков. Единственный антибиотик, который мог помочь, был недоступен. Лечение антибиотиками по разным схемам толку не дало, и через четыре дня женщина умерла от сепсиса.
Если в 80-е годы ряд бактерий был устойчив к четырем группам антибиотиков, то эффективными все же оставались пять. Летальность составляла порядка 10–20%. С 2010 года по наше время к клебсиелле стали устойчивы практически все группы антибиотиков, кроме трех. В итоге у зараженных этой бактерией пациентами летальность составляет уже 40–60%.
АМР доставляет клиникам проблемы
Среди них — быстрое распространение пациентами с АМР полирезистентных бактерий в отделении, что существенно увеличивает риск смертности больных.
По мнению Сергея Яковлева, для изменения ситуации необходимо внедрить в практику работы медицинских организаций и программ рационального применения антибиотиков и сдерживания резистентности. Также следует быстро включить все необходимые антибиотики в перечень ЖНВЛП, пока они сохраняют свою эффективность.
Сергей Яковлев отметил, что еще одной важной мерой является пересмотр тарифов на оплату медицинской помощи в стационаре по лечению инфекций, вызванных полирезистентными возбудителями в рамках территориальных программ ОМС. «Нужно обосновать постоянную доступность и неснижаемый остаток в стационаре всех антибиотиков для лечения полирезистентных инфекций (принцип „здесь и сейчас“)», — заявил Яковлев.
Проблемы доступа к эффективной антимикробной терапии сепсиса
По словам Сергея Зырянова, доктора медицинских наук, профессора, замглавврача по терапии ГКБ № 24 Москвы, при сложных случаях пневмонии пребывание в стационаре возрастает с 9 до 53 дней.
В России средняя курсовая стоимость современной антибактериальной терапии резистентных к антибиотикам инфекций (монотерапия инновационным препаратом или комбинацией из двух-четырех традиционных антибиотиков) обходится в более чем 300 тысяч рублей. Ожидаемая курсовая стоимость новых антибактериальных препаратов, которые ожидаются к регистрации в ближайшие два-три года (сейчас доступны к применению в других странах), составляет более 900 тысяч рублей.
«Сегодня тарифы на оказание медпомощи при АМР не покрывают расходы ЛПУ (ЛПУ — лечебно-профилактическое учреждение), в результате в больницах не оказывается во время нужных лекарств и пациенты гибнут», — рассказывает Зырянов.
Чтобы избежать этого нужно использовать комплексный подход. Это внедрение эффективной системы регистрации и учета инфекций, вызванных полирезистентностью бактерий. Такой учет поможет увидеть реальное количество смертей от сепсиса в России. Затем следует разработать и включить в стандарты оказания медицинской помощи системы дополнительного финансирования расходов ЛПУ на диагностику и антимикробную терапию АМТ.
Кроме того, перечень критически-важных антимикробных препаратов, обязательных для наличия в отделениях интенсивной терапии ЛПУ должен быть разработан и утвержден, модель оплаты инновационных жизнеспасающих антимикробных препаратов (АМП) для лечения инфекций, вызванных полирезистентных бактериями, должен быть оптимизирована.