с м меллори вейса код по мкб 10
Zetlex.net
При отсутствии явлений геморрагического шока необходимо провести: ЭКГ, УЗИ органов брюшной полости, R-графии ОГК, ФГДС.
1) ФГДС – определение разрывов пищевода, кровотечения и его остановка
Выполнение ФГДС нередко усугубляет состояние больного за счёт возобновления уже остановившегося кровотечения, появления новых разрывов (судорожные позывы к рвоте на ФГДС) или усугубления уже имеющегося разрыва пищевода.
ФГДС проводить с в/в седацией или наркозом, вводить противорвотные препараты.
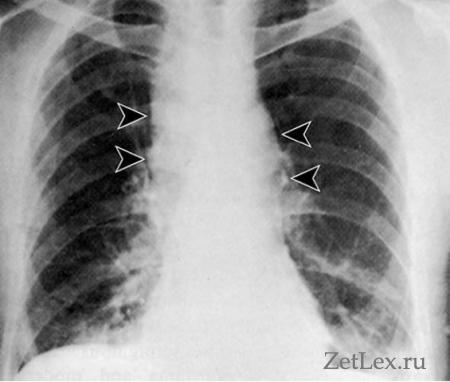
2) R-скопия ОГК: при разрыве пищевода признаки пневмоторакса и медиастинита
3) УЗИ кардиоэзофагеального отдела желудка (помогает уточнить стадию синдрома МэллориВейса)
4) Контрастная эзофагография в двух проекциях
5) МРТ-эзофагография
6) Лапароскопия – при подозрении на разрыв абдоминального отдела пищевода
Дифференциальная диагностика
Дифференциальный диагноз проводится с лёгочным кровотечением, кровавой пеной при сердечной астме переходящей в отёк лёгких.
Лечение
В большинстве случаев кровотечение прекращается самостоятельно в течение 24—48 часов. Обычно достаточно консервативного лечения: применяют холод, антациды, стимуляторы свёртывающей системы крови, аминокапроновую кислоту внутрь. Зонд Блэкмора НЕ применяется, т.к. увеличивает размер трещин. Иногда требуется эндоскопическое лечение. При невозможности эндоскопической остановки кровотечения или его рецидивах показано оперативное вмешательство — гастротомия, прошивание разрывов слизистой оболочки кардиального отдела желудка, иногда дополнительно перевязывают левую желудочную артерию.
I. Консервативная терапия при синдроме Мэлори-Вейса используются с целью восстановления объема циркулирующей крови. Для этого применяют различные кристалоидные (NaCl 0,9%, глюкоза 5%, раствор Рингера и др.), коллоидные растворы (альбумин, аминоплазмаль и др.), в случае тяжелой кровопотери возможно применение гемотрансфузии (эритроцитарная масса, свежезамороженная плазма)
При рвоте (или позывах на рвоту) применяют метоклопрамид (церукал).
II. Эндоскопическое лечение. При выполнении ФГДС и обнаружении продольного разрыва слизистой оболочки пищевода с кровотечением, можно попытаться остановить это кровотечение эндоскопически. При этом используется:
1. Обкалывание места кровотечения адреналином
Раствор адреналина гидрохлорида вводят в область кровотечения, а также вокруг источника кровотечения. Гемостатический эффект достигается за счет сосудосуживающего действия адреналина.
2. Аргоно-плазменная коагуляция
Данный метод является одним из наиболее эффективных и одновременно одним изи наиболее технически трудным. Применение метода аргонно-плазменной коагуляции позволяет добиться стойкого гемостаза.
3. Электрокоагуляция
Также достаточно эффективный метод. Часто применение электрокоагуляции сочетают с введением адреналина.
4. Введение склеразантов
Данный метод заключается в том, что гемостатический эффект достигается за счет введение слеразирующих препаратов (полидоканол).
5. Лигирование сосудов
При синдроме Мэлори-Вейса часто используется эндоскопическое лигирование кровоточащих сосудов. Применение эндоскопического лигирования сосудов особенно оправдано при сочетании синдрома Мэлори-Вейса и портальной гипертензии с варикозным расширением вен пищевода.
6. Клипирование сосудов
По своей сути этот метод схож с предыдущим. Разница лишь в том, что на кровоточащий сосуд накладывается не лигатура, а металлическая клипса. Наложение клипс возможно с помощью аппликатора. К сожалению, эндосопическое клипирование сосудов не всегда возможно из-за технических трудностей наложения клипс на сосуды.
III. Хирургическое лечение. При синдроме Мэлори-Вейса к хирургическому лечению прибегают в случае неэффективности консервативной терапии и эндоскопических методов лечения. В этом случае выполняют операцию Бейе:
Доступ: срединная лапоротомия.
Операция: гастротомия, прошивание кровоточащих сосудов
Госпитализация
При стабильном состоянии пациент госпитализируется в отделение общей хирургии.
При явлениях геморрагического шока в отделение реанимации.
Профилактика
Главной мерой профилактики синдрома Мэлори-Вейса является предотвращение рвоты, причиной возникновения которой, является алкогольная интоксикация. Поэтому необходимо отказаться от употребления алкоголя. Также важно своевременное проведение лечения сопутствующих заболеваний желудочно-кишечного тракта.
Составители:
Исаев Э.Л.

Размер: 19 Kb
Скачали: 47
Дата: 16-07-2018, 01:17
Синдром Меллори-Вейса ( Желудочно-пищеводный разрывно-геморрагический синдром )
Синдром Меллори-Вейса — линейные разрывы слизистой кардиоэзофагеальной зоны, возникшие на фоне рвоты, позывов на рвоту, икоты. Проявляется наличием крови в рвотных массах, эпигастральными или загрудинными болями, артериальной гипотензией, тахикардией. Диагностируется с помощью эзофагогастроскопии, обзорной рентгенографии брюшной полости. Для лечения применяется гемостатическая, кровезаместительная терапия, противорвотные препараты, сердечные аналептики, ингибиторы протонной помпы, Н2-гистаминоблокаторы, антациды. При необходимости выполняется эндоскопический гемостаз, терапевтическая эмболизация, гастротомия для ушивания повреждений.
МКБ-10
Общие сведения
Впервые клиника разрывно-геморрагического синдрома была описана в 1929 году американскими патологами Дж.К. Меллори и С. Вейсом. В настоящее время заболевание является одной из ведущих причин неязвенных кровотечений из верхних отделов пищеварительного тракта. Распространенность патологии достигает 5-10%. Болезнь Меллори-Вейса выявляется преимущественно у 45-60-летних пациентов, злоупотребляющих спиртными напитками. У мужчин разрывы желудочной и пищеводной слизистой возникают в 7 раз чаще, чем у женщин. У 79-80% больных поражается эзофагогастральный переход, у 16-17% — стенка пищевода, у 3-5% — кардиальная оболочка. Длина разрывов обычно составляет 0,4-4,5 см. В 77-78% случаев повреждения являются единичными, в 22-23% — множественными.
Причины синдрома Меллори-Вейса
Продольные разрывы слизистой в области пищеводно-желудочного перехода возникают при локальном повышении давления у пациентов со сниженной резистентностью эпителиального слоя. Предпосылками к развитию разрывно-геморрагического гастроэзофагеального синдрома служат патологические процессы, при которых повреждаются эпителиоциты или наблюдается повышенное кровенаполнение сосудов верхних отдела ЖКТ: асептическое воспаление слизистой при частом употреблении спиртных напитков, воспалительные заболевания ЖКТ (эзофагиты, гастриты), длительный прием НПВС, кортикостероидов, скользящая грыжа пищеводного отверстия диафрагмы, расширение пищеводных вен при портальной гипертензии у больных с гепатитами, жировым гепатозом, фиброзом, циррозом печени. Непосредственными причинами болезни Меллори-Вейса являются:
В спорадических случаях повышение давления, приводящее к разрыву эпителиального слоя, вызывается другими факторами — подъемом тяжестей, интенсивными физическими нагрузками с резким напряжением мышц брюшного пресса, тупой травмой живота. Крайне редко заболевание осложняет течение судорожного синдрома при эпилепсии, опухолях головного мозга, энцефалопатиях, менингите, энцефалите, эклампсии.
Патогенез
Пусковым моментом разрыва пищеводно-желудочной слизистой обычно становится многократная рвота, резкое повышение абдоминального давления при переполненном желудке или кардиоэзофагеальном спазме, реже — прямые механические воздействия. Возникновение избыточного давления в кардиальном отделе желудка способствует перерастяжению стенки органа. При морфологической несостоятельности эпителия, вызванной воспалительными процессами, растянутая слизистая желудка, пищевода разрывается в наиболее истонченном или патологически измененном участке. Обычно разрыв распространяется не глубже эпителиального и подслизистого слоя. В тяжелых случаях повреждается мышечная, серозная желудочная либо адвентициальная пищеводная оболочки с выходом агрессивного содержимого в средостение или брюшную полость.
Классификация
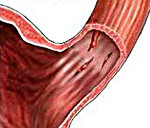
Систематизация клинических форм синдрома Меллори-Вейса основана на протяженности и глубине дефектов оболочек поврежденных органов, от размеров которых напрямую зависит тяжесть патологии. Разрывы бывают малыми (до 1 см) — наиболее частый вариант повреждения, выявляемый у 88-90% пациентов, средними (1-3 см), большими (более 3 см). С учетом глубины деструкции стенки пораженного отдела ЖКТ специалисты в сфере гастроэнтерологии и общей хирургии различают 4 стадии гастроэзофагеального разрывного синдрома:
Симптомы синдрома Меллори-Вейса
Клинические проявления заболевания обычно развиваются на фоне многократной рвоты. Основным признаком синдрома является выделение ярко-красной крови с рвотными массами (гематемезис), которое может иметь различную интенсивность – от нескольких капель до профузного кровотечения. Возникает резкая боль в эпигастральной области или за грудиной. Вследствие кровопотери у больного формируется острый анемический синдром, для которого характерны головокружение, бледность кожных покровов, мелькание «мушек» перед глазами, падение артериального давления, значительное учащение сердцебиения. При массивном кровотечении возможна потеря сознания.
Осложнения
Острая кровопотеря при симптомокомплексе Меллори-Вейса может привести к развитию геморрагического шока с тяжелыми нарушениями микроциркуляции, изменениями реологических свойств крови, прогрессирующей гипоксией. При отсутствии лечения шок переходит в декомпенсированную стадию, сопровождающуюся полиорганной недостаточностью. Наиболее тяжелым осложнением синдрома является тотальный разрыв стенки брюшного отдела пищевода, распространяющийся выше уровня диафрагмы. При этом у пациента возникает приступ одышки, цианоз кожи, сильнейшие боли в грудной клетке. Такое осложнение, известное как синдром Бурхаве, в 20-40% случаев заканчивается летальным исходом. Попадание содержимого желудка в средостение, полость брюшины провоцирует развитие медиастинита, перитонита.
Диагностика
Постановка диагноза при синдроме Мэллори-Вейса может быть затруднена, что обусловлено стремительным нарастанием клинической картины и необходимостью оказания пациенту экстренной медицинской помощи. Диагностика заболевания предполагает комплексное инструментальное обследование пищеварительного тракта для выявления первопричины кровавой рвоты. Наиболее информативными являются:
В клиническом анализе крови определяются изменения, характерные для анемического синдрома — уменьшения содержания эритроцитов и гемоглобина, снижение показателя гематокрита. Для исключения хронического кишечного кровотечения проводится реакция Грегерсена, позволяющая обнаружить скрытую кровь в кале. При выраженном диспепсическом синдроме может выполняться бактериологический посев кала для выявления патогенных микроорганизмов.
Дифференциальная диагностика синдрома осуществляется с легочным кровотечением, отеком легких, сердечной астмой, кровотечением из язвы желудка, варикозным расширением пищеводных вен, острым гастроэнтеритом, кишечными инфекциями, распадом опухоли желудка или пищевода, синдромом Рандю-Ослера. Кроме осмотра хирурга и гастроэнтеролога пациенту могут потребоваться консультации гематолога, инфекциониста, пульмонолога, кардиолога, гематолога, гепатолога.
Лечение синдрома Меллори-Вейса
Пациент подлежит неотложной госпитализации в хирургический стационар. На начальном этапе больному обеспечивается покой, холод на область желудка, при позывах на рвоту применяются блокаторы дофаминовых и серотониновых рецепторов с противорвотным эффектом. Назначается консервативное лечение и малоинвазивные манипуляции, направленные на остановку кровотечения, восполнение объема циркулирующей крови. При резком падении АД терапию дополняют введением средств для поддержания гемодинамики. Пациентам с болезнью Меллори-Вейса показаны:
Баллонная зондовая тампонада используется ограниченно из-за возможного усугубления разрывов. Важным условием быстрого восстановления поврежденной стенки является угнетение желудочной секреции при помощи ингибиторов протонной помпы, блокаторов Н2-гистаминорецепторов. Прием секретолитиков дополняют назначением невсасывающихся антацидов, препаратов коллоидного висмута. Хирургические методы лечения геморрагического разрывного синдрома показаны при неостанавливающихся или рецидивирующих кровотечениях, глубоких дефектах, полном разрыве пищеводной или желудочной стенки. Рекомендованным вмешательством является гастротомия с прошиванием надрывов, кровоточащих сосудов, ушиванием дефектов, иногда — перевязкой левой желудочной артерии.
Прогноз и профилактика
Исход патологического состояния зависит от величины кровопотери и тяжести основного заболевания пациента. В 90% случаев кровотечение останавливается самопроизвольно или консервативными способами. Прогноз синдрома относительно неблагоприятный при потере больше 10% ОЦК и наличии сопутствующей патологии. Меры профилактики при заболевании Меллори-Вейса заключаются в отказе от злоупотребления алкоголем, своевременном устранении провоцирующих факторов, выявлении и лечении болезней желудочно-кишечного тракта, соблюдении техники проведения инвазивных медицинских манипуляций на пищеводе, желудке.
Другие болезни пищевода (K22)
Исключено: варикозное расширение вен пищевода (I85.-)
Исключен: врожденный кардиоспазм (Q39.5)
При необходимости идентифицировать причину используют дополнительный код внешних причин (класс XX).
Перепонка пищевода (приобретенная)
Исключено: травматическое прободение (торакальной части) пищевода (S27.8)
Диффузный спазм пищевода
Карман пищевода приобретенный
Исключен: врожденный дивертикул пищевода (Q39.6)
Исключены: язва Барретта (K22.1)
Пищеводное кровотечение БДУ
Алфавитные указатели МКБ-10
Внешние причины травм — термины в этом разделе представляют собой не медицинские диагнозы, а описание обстоятельств, при которых произошло событие (Класс XX. Внешние причины заболеваемости и смертности. Коды рубрик V01-Y98).
Лекарственные средства и химические вещества — таблица лекарственных средств и химических веществ, вызвавших отравление или другие неблагоприятные реакции.
В России Международная классификация болезней 10-го пересмотра (МКБ-10) принята как единый нормативный документ для учета заболеваемости, причин обращений населения в медицинские учреждения всех ведомств, причин смерти.
МКБ-10 внедрена в практику здравоохранения на всей территории РФ в 1999 году приказом Минздрава России от 27.05.97 г. №170
Выход в свет нового пересмотра (МКБ-11) планируется ВОЗ в 2022 году.
Сокращения и условные обозначения в Международой классификации болезней 10-го пересмотра
БДУ — без дополнительных уточнений.
НКДР — не классифицированный(ая)(ое) в других рубриках.
† — код основной болезни. Главный код в системе двойного кодирования, содержит информацию основной генерализованной болезни.
* — факультативный код. Дополнительный код в системе двойного кодирования, содержит информацию о проявлении основной генерализованной болезни в отдельном органе или области тела.
С м меллори вейса код по мкб 10
С. Г. Шаповальянц, М. Е. Тимофеев, А. И. Михалёв, Е. Д. Фёдоров, П. Л. Чернякевич, С. А. Кудрявец, Т. В. Дземешкевич,
НОЦ абдоминальной хирургии и эндоскопии РГМУ им. Н. И. Пирогова (зав. проф. Шаповальянц С. Г.), 31 ГКБ (глав. врач. член-корр. РАМН, проф. Г. Н. Голухов)
г. Москва
Вступление:
Синдром Меллори–Вейсса (СМВ) — желудочно-пищеводный разрывно-геморрагический синдром (МКБ-10) — относится к числу остро развивающихся заболеваний и проявляется пищеводно-желудочным кровотечением из острых продольных разрывов слизистой оболочки абдоминального отдела пищевода или кардии. Детально они изучены в 1929 году, когда K. Mallory и S. Weiss, чьими именами и назван этот синдром, при вскрытии трупов 4-х больных, умерших от желудочно-кишечного кровотечения, обнаружили линейные разрывы слизистой оболочки пищеводно-кардиальной области. В 1955 г. Whiting и Barron выполнили первую успешную операцию в объеме гастротомии и ушивания разрывов, а в середине 70-х годов появились первые сообщения об успешной остановке кровотечений при синдроме Меллори – Вейсса через эндоскоп. СМВ считали большой редкостью до широкого внедрения в клиническую практику гибковолоконных эндоскопов. В настоящее время, по данным больших статистик, этот синдром диагностируется в 5 — 17 % всех случаев острых кровотечений из верхних отделов желудочно-кишечного тракта и в 36 — 50 % кровотечений неязвенной этиологии. В последние годы около 88-96 % больных лечатся консервативными и эндоскопическими методами с летальностью 2 — 3 %. В то же время при неэффективности такого лечения у 6-12 % больных выполняются оперативные вмешательства с послеоперационной летальностью достигающей 10-60%.
Цель работы:
Проанализировать данные клиники и показать роль и возможности современной эндоскопии в диагностике и лечении кровотечений, обусловленных синдромом Меллори-Вейсса.
Материалы и методы:
В нашей клинике с I. 1994 по XII. 2010 года находилось на лечении 573 пациента с СМВ, что составило 14,7 % от числа всех пациентов находившихся в клинике по поводу желудочно-кишечных кровотечений из верхних отделов пищеварительного тракта за это время и 23,3 % среди всех пациентов с кровотечениями неязвенной этиологии. Возраст больных колебался от 16 до 91 лет и в среднем составил 41,9 ± 2,7 года. Мужчин было 464 (81,0 %), женщин 109 (19,0 %). Больных с кровотечением лёгкой степени было 459 (80,1 %), средней степени тяжести 97 (17,0 %) и тяжёлой степени – 17 (2,9 %). Клиническая картина заболевания складывалась из симптомокомплекса желудочно-кишечного кровотечения и жалоб, характерных для фоновых заболеваний. Фоновые заболевания верхних отделов желудочно-кишечного тракта явились предрасполагающими факторами разрывов слизистой оболочки в области пищеводно-желудочного перехода и кардиального отдела желудка. Преобладали пептические и воспалительные заболевания пищевода на фоне гастро-эзофагеальной рефлюксной болезни, желудка и двенадцатиперстной кишки. Прогностически неблагоприятным явилось сочетание СМВ и варикозного расширения вен, вследствие цирроза печени. У многих пациентов встречалась язвенная болезнь желудка и луковицы 12-ти перстной кишки с признаками деформации и нарушения эвакуации из верхнего отдела желудочно-кишечного тракта или признаками дуодено-гастрального рефлюкса. У десяти больных были выявлены различные опухолевые поражения желудка, в том числе у одного из них в области пищеводножелудочного перехода. Значительную часть исследований — 482 (84,1 %) — выполнили под местной анестезией зева с использованием в премедикации наркотических анальгетиков, холинолитиков и антигистаминных средств. При беспокойном поведении больных, затрудняющем адекватный осмотр и выполнение гемостаза, у 83 (14,5 %) больных применили внутривенную анестезию. У 8 (1,4 %) пациентов с тяжелой кровопотерей исследование выполнялось под эндотрахеальным наркозом.
Результаты:
Неотложное эндоскопическое исследование, выполненное в первые часы от поступления или развития кровотечения в стационаре, позволило определить источник кровотечения у всех 573 (100 %) больных с СМВ. Эндоскопические вмешательства продолжались от 10 до 120 минут, составив в среднем 37,6 + 3,2 минуты.
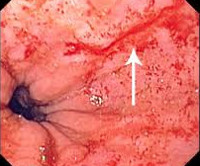
Продолжающееся кровотечение было выявлено у 179 (31,2 %) больных (рис.1): струйноеу 70 (12,2 %) и диффузное у 109 (19,0 %) больных. Остановившееся на момент эндоскопического осмотра кровотечение было выявлено у остальных 394 (68,8 %) больных, при этом стигмы перенесенного кровотечения в виде тромбированных сосудов и/или фиксированных сгустковбыли обнаружены у 241 (42,1 %) из них (рис.2), а разрывы слизистой оболочки без стигм кровотечения — у 153 (26,7 %) пациентов (рис.3). По количеству разрывов больные распределись следующим образом: единичные разрывы выявлены у 396 (69,1 %) больных; два разрыва — у 129 (22,5 %), три — у 30 (5,2 %), четыре разрыва у 14 (2,4 %) и пять у 4 (0,8 %) больных. Разрывы наиболее часто локализовались в области пищеводно-желудочного перехода — 437 (76,2 %), реже в области кардиального отдела желудка – 96 (16,8 %) и в области абдоминального отдела пищевода – 40 (6,9 %). Размеры повреждений имели различные характеристики: так длина разрывов колебалась от 5 до 50 мм и в среднем составила 17,3 ± 1,6 мм; ширина варьировала от 3 до 8 мм и в среднем составила 3,8 ± 0,3 мм; глубина разрывов колебалась от 2 до 6 мм, составив в среднем 3,2 ± 1,2 мм. Используя классификацию Bellmann и соавт., 1974 г., основанную на оценке глубины разрывов, мы выделили: 394 (68,8 %) больных с I степенью (разрыв, ограниченный слизистой оболочкой), 144 (25,1 %) больных со II степенью (разрыв слизистого и подслизистого слоёв) и 35 (6,1 %) больных с III степенью (разрыв стенки органа вплоть до мышечно-серозного слоя).
Всего лечебная эндоскопия была выполнена у 356 (62,2 %) из 573 пациентов с СМВ: с целью остановки продолжающегося кровотечения у всех 179 больных с активным, продолжающимся на момент осмотра кровотечением и с целью профилактики рецидива кровотечения у 177 со стигмами перенесенного кровотечения в виде крупных тромбированных сосудов и/или фиксированных сгустков. У остальных 217 больных с отсутствием стигм кровотечения или мелкими сосудами в краях разрыва лечебные профилактические мероприятия не проводились. С целью эндоскопического гемостаза у 268 пациентов использовали инъекционные методы (введение раствора адреналина — 36, этанол-новокаиновой смеси — 232, чистого этанола — 6); у 43 — термические (монополярная диатермокоагуляция — 15; аргоно-плазменная коагуляция- 28) и у 9 — механический метод в виде эндоскопического клипирования. У 36 пациентов с целью выполнения гемостаза использовали комбинацию этих методов.
Непосредственная эффективность эндоскопического гемостаза у больных с СМВ при продолжающемся кровотечении составила 99,5 % — остановить кровотечение эндоскопическими методами удалось у 178 из 179 пациентов с активным кровотечением. В одном случае у больного 55 лет с активным профузным кровотечением из разрыва слизистой в области пищеводно-желудочного перехода на фоне варикозно-расширенных вен пищевода и кардиального отдела желудка 3 ст. эндоскопическая остановка кровотечения комбинированным способом была неэффективна. Этот больной был экстренно оперирован в объеме лапаротомии, ушивания дефекта слизистой с летальным исходом в первые сутки после операции. Других неудач и осложнений во время эндоскопического вмешательства не было.
Рецидивы кровотечения в сроки от 18 часов до 5 суток возникли у 20 (3,5 %) из 573 пациентов. Наиболее часто (12 больных) рецидивы кровотечения развились у пациентов, у которых на момент первичного эндоскопического вмешательства имелось продолжающееся кровотечение высокой интенсивности из больших и глубоких разрывов пищеводно-желудочного перехода. У больных имевших стигмы перенесенного и остановившегося на момент первичного эндоскопического вмешательства кровотечения, рецидив последнего возник у 7 больных. У больных с отсутствием стигм кровотечения в момент первичной эзофагогастроскопии рецидив кровотечения отмечен в одном случае. При рецидиве кровотечения у всех 20 больных была предпринята повторная эзофагогастродуоденоскопия, при этом успешный гемостаз удалось осуществить у 19 из них. Лишь в одном случае, в связи с неэффективностью повторного эндоскопического гемостаза, было выполнено хирургическое вмешательство: лапаротомия, гастротомия с ушиванием глубоких разрывов пищеводно-желудочного перехода и варикозно расширенных вен этой области.
Выписка больных на амбулаторное лечение осуществлялась на 5-12 сутки; средний койко-день составил 7,7 ± 1,8 дней. Общая летальность у больных с СМВ за анализируемый период составила 2,8 % (умерло 16 из 573 больных). Лишь у 3 из них летальный исход был обусловлен массивным кровотечением из области разрыва, при этом непосредственным источником геморрагии явились варикозно расширенные вены в зоне кардии (2) и в одном непосредственно разрыв слизистой в области пищеводно-желудочного перехода. Летальные исходы у остальных 13 пациентов, подавляющее число которых (10) страдало хроническим алкоголизмом, были связаны с прогрессированием основного заболевания, а в одном случае с травмой не совместимой с жизнью в результате суицидальной попытки. У всех этих пациентов кровотечение было остановлено и не сыграло ведущей роли в танатогенезе.
Заключение:
Синдром Меллори-Вейсса — распространенное заболевание, составляющее весомую долю в структуре острых кровотечений из верхних отделов пищеварительного тракта и угрожающее жизни больного. Новые методы неотложной эндоскопической диагностики и лечения расширяют возможности эффективной остановки и профилактики кровотечений, обусловленных данным синдромом. Эндоскопические вмешательства являются методом выбора при этом заболевании, позволяя осуществить успешный гемостаз у 99,5 % больных и снизить количество неотложно оперируемых больных до 0,5 %.