Прозериновая проба что это
Прозериновая проба что это
Малкова Н.А., к.м.н.
Новосибирская государственная областная клиническая больница. Областной центр неврологии и нейрохирургии
В настоящее время проблеме миастении уделяется большое внимание специалистами практически всех отраслей медицинской науки. Статьи и обзоры по данному вопросу можно найти в публикациях по неврологии, хирургии, анестезиологии, акушерству и гинекологии, а также в различных теоретических журналах, освещающих аспекты нейрофизиологии, иммунологии, патоморфологии, молекулярной патологии, фармакологии и т.д. Трудности подстерегают врача на всех этапах общения с больными миастенией. Трудно поставить правильный диагноз, провести дифференциальную диагностику с близкими патологическими состояниями, выбрать оптимальную стратегию и тактику лечения, решить проблемы социальной и психологической адаптации больных, вопросы о возможности беременности и родов, а так же множество других проблем, возникающих при общении с данной категорий больных, нуждающихся в наблюдении и общении с врачом на протяжении долгих лет болезни.
Диагноз “миастения”, как правило, ставится с большим опозданием, несмотря на простоту клинических проявлений данного заболевания и общедоступность диагностических тестов, подтверждающих этот диагноз. Причинами являются, вероятно, относительная редкость данной болезни. Под маской миастении протекают многочисленные неврологические феномены, обусловленные поражением самых различных структур периферического нейромоторного аппарата ЦНС, патологией обмена веществ и желез внутренней секреции. Важным фактором является наиболее раннее выявление синдрома патологической мышечной слабости и назначение патогенетической терапии, способствующей нормализации нервномышечной передачи, что дает возможность больным миастенией сохранять работоспособность длительное время.
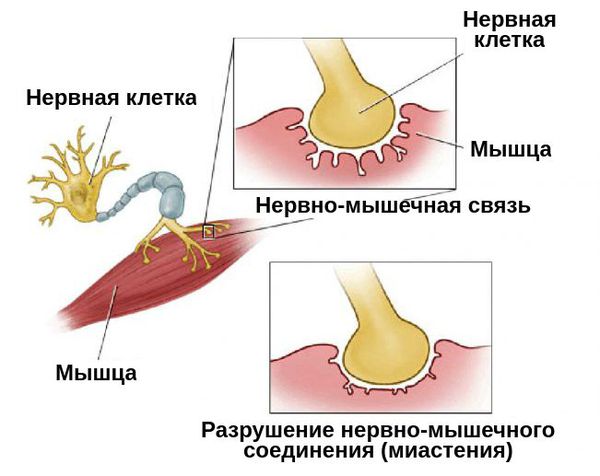
Миастения – заболевание, характеризующееся нарушением нервно-мышечной передачи и проявляющееся слабостью и патологической утомляемостью скелетных (поперечно-полосатых мышц).
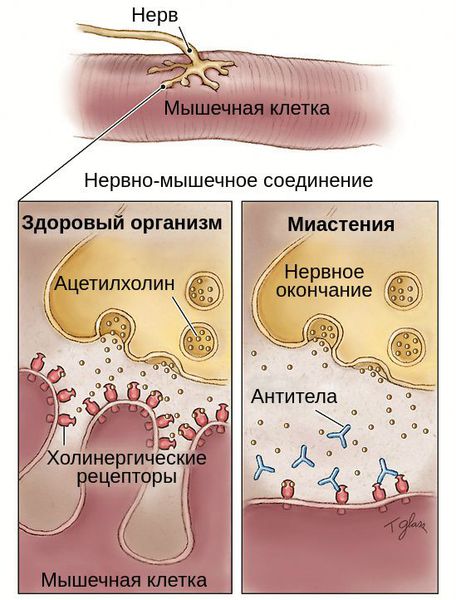
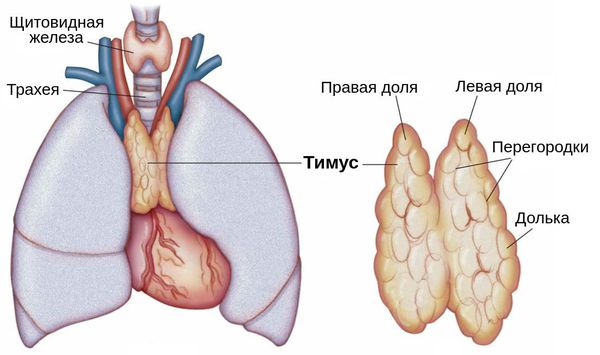
Приобретенная миастения связана с образованием антител против ацетилхолиновых рецепторов постсинаптической мембраны нервно-мышечного синапса. В патогенезе аутоиммунной реакции активную роль, по-видимому, играет вилочковая железа.
Значительно более редкая – врожденная миастения – обусловлена генетически-детерминированным дефектом нервно-мышечных синапсов.
Неонатальная миастения – преходящее состояние, наблюдающееся у младенцев, родившихся от матерей, страдающих миастенией, и обусловленное переходом через плаценту материнских антител к ацетилхолиновым рецепторам.
Подробнее патогенетический механизм заключается в аутоиммунном процессе. Изменения в вилочковой железе (гиперплазия или гиперфункция без увеличения), в которой вырабатываются антитела к белку холинорецепторов к поперечно-полосатым мышцам.
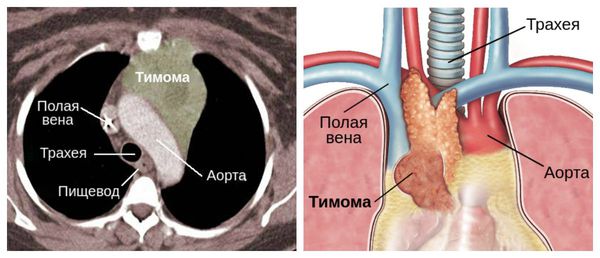
Часто выявляется не просто гиперплазия, а тимома, течение при этом более злокачественное. Аутоантитела вырабатываются в вилочковой железе (или других органах иммунитета), связываются с белком ацетилхолиновых рецепторов, вызывают деградацию и разрушают постепенно мембрану, в следствие чего расширяется синаптическая щель, снижается фактор надежности, следовательно, снижается возможность проведения (частичный или полный блок нейромышечной передачи), так как ацетилхолин поступает, но не связывается или связывается с малым количеством рецепторов.
I. По возрасту возникновения:
1. Неонатальная. Может быть у детей от матерей больных миастенией или транзиторная миастения новорожденных (синдром вялого ребенка).
2. Миастения юношеского возраста.
3. Миастения взрослых.
II. По выявлению антител:
III. Клиническая (Гехт Б.М. 1965)
1. Миастенические эпизоды – преходящие двигательные нарушения с полным регрессом (10-12%).
2. Миастеническое состояние – стационарная непрогрессирующая форма в течение многих лет (13%).
3. Прогрессирующая форма – неуклонное прогрессирование заболевания (50-48%).
4. Злокачественная форма – острое начало и быстрое нарастание нарушения функции мышц (25%).
Формы переходят друг в друга.
По степени гиперплазии:
По степени двигательных расстройств:
По интенсивности восстановления двигательной функции после введения АХЭп (степень компенсации):
Наличие нарушений жизненно-важных функций.
Патологическая утомляемость мышц лабильна – хороший эффект от АХЭп. Быстрое восстановления после отдыха.
Чаще поражаются поперечно-полосатые мышцы:
1. На основании клинических проявлений (миастенический синдром).
2. Электрофизиологическое исследование (ЭНМГ).
1. Прозериновая проба – вводится
Sol.Proserini 0,05% 1-3 мл п/к +
Оценка через 30 минут. Например, уменьшение птоза, восстановления артикуляции при чтении и др.
2. Электрофизиологическое. ЭНМГ – снижение амплитуды потенциала действия min на 10% от нормы. Лучше 12-15% при стимуляционной ЭНМГ.
3. Серологическое определение уровня антител к холиновым рецепторам и поперечно-полосатым мышцам в крови.
4. Рентгеновская компьютерная томография или магнитно-резонансная томография органов средостения. Надежность при выявлении тимомы 95%.
1. При вовлечении в процесс ядер черепно-мозговых нервов (например, опухоль в стволе головного мозга) в клинике есть рефлекторные нарушения, часто страдают проводники.
2. Рассеянный склероз.
3. Синдром Гиенна-Барре
5. Астенические депрессии и неврозы.
6. Соматические болезни.
Убретид, как правило, не применяется в связи с формированием коммулятивного эффекта и развитием холинэргического криза.
Тензилон используется только в диагностических целях.
Прозерин используется для оказания быстрого действия. Поэтому целесообразно применение калимина.
Принцип дозирования – следующая доза принимается за 30 минут до окончания действия предыдущей. При переводе больных на парентеральное введение препаратов, учитывается что 1 таблетка калимина (60 мг) равноценна 1 мл 0,05% раствора прозерина.
В некоторых ситуациях (mensis, инфекции, ремиссия) – чувствительность к АПЭ препаратам повышается. В этом случае доза препаратов уменьшается.
Больных нужно обучать коррегировать дозу индивидуально в зависимости от течения болезни.
Относительные противопоказания к применению АХЭп:
При назначении АХЭп сочетают с препаратами калия, так как последние пролонгируют действие АХЭп. Используется диета богатая калием (печеный картофель, курага, бананы и др.). Используют калийсберегающие препараты (верошпирон 25 мг – 1 таблетка 2 раза в сутки, хлорид калия 3,0 гр в сутки в растворах, порошках, таблетках) с целью предупреждения передозировки АХЭп.
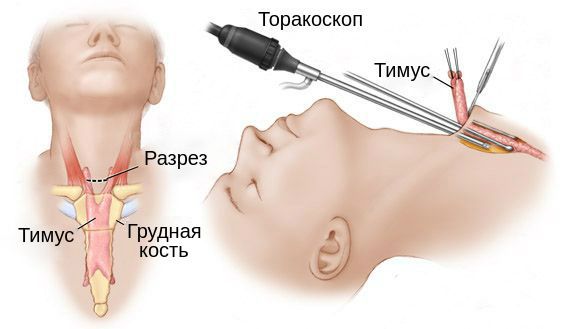
1. Тимэктомия – при тимоме обязательна, эффективность от 70-90%, возможны ремиссии.
Показанием к оперативному лечению являются:
а) злокачественные формы
б) прогрессирующая форма
в) миастеническое состояние в зависимости от степени выраженности дефекта.
При локальных формах подходят избирательно.
Противопоказания к тимэктомии:
До оперативного лечения обязательна предоперационная подготовка:
2. Глюкокортикостероиды (ГКС) показаны при недостаточном эффекте других методов лечения. При этом необходимо длительное применение.
Используют чаще таблетированные формы, такие как преднизолон, дексаметазон или пульс-терапия метилпреднизолоном.
Применяемые чаще схемы – прием ГКС ежедневно или через день. Преднизолон 1 таблетка – 5 мг. Назначают 60-150 мг/сутки утром при выраженном обострении ежедневно через 5-7 дней(до терапевтического эффекта) переходят на схему через день. С больших доз следует уходить быстро.
Длительно применяется поддерживающая доза через день 20-30 мг в сутки, возможно в течение нескольких месяцев или даже лет. При ухудшении состояния доза может быть увеличена. Используется так же ступенчатая схема приема ГКС. В разработанной схеме предлагается увеличение начальной дозы препарата до 25-30 мг в один прием утром. Каждый последующий прием гормонов увеличивается на 25-30 мг до достижения максимальной дозы 100 мг.
Длительный прием глюкокортикостероидов приводит к побочным эффектам, таким как синдром Кушинга, остеопороз, стероидный диабет, артериальная гипертензия, тенденция к нарастанию веса, поверхностный гастрит. Перечисленные побочные явления, развивающиеся у больных в результате длительной терапии преднизолоном или другим ГКС препаратами потребовала разработки и внедрения ряда средств коррекции перечисленных побочных явлений, особенно при наблюдающихся тенденциях к их прогрессированию.
Тенденция к нарастанию веса потребовала систематического использования ограничения калорийности употребляемой пищи, в особенности углеводов. Тенденция к снижению толерантности к углеводам и периодическое повышение сахара в крови, потребовало назначения препаратов, способствующих увеличению толерантности к углеводам, нормализации перекисного окисления липидов и сокращению переносимости к углеводным нагрузкам. Используются препараты липоевой кислоты (тиоксин, тиоктацин и альфа-липоевая кислота по 600 ед/сутки).
С целью профилактики остеопороза используют препараты: Са-Д 3 (Никомед). Альфа-Д 3 и миокальцек.
Для профилактики гастритов используют прерывистые курсы лечения блокаторами гистамина (зонтак по 300 мг 2-3 раза в сутки).
При симпатикотонии (повышение АД, тахикардия, беспокойство вплоть до преднизолонового психоза) необходимо назначение вегетотропных препаратов (анаприлин 20-40 мг 2-3 раза в сутки, грандаксин и др.). Чаще проявляются при пульс-терапии метилпреднизолоном.
3. Если нет эффекта от глюкокортикостероидов, то проводится иммуносупрессивная терапия. Применяются следующие препараты:
Азатиоприн (имуран) назначают с 50 мг в сутки до 100-200 мг в сутки вместе с поддерживающей дозой преднизолона.
При применении иммунодепрессантов могут быть осложнения в виде лейкопении, следовательно необходим контроль общего анализа крови 1 раз в 3 дня, при нарастании лейкопении препарат следует отменить.
Курсовая терапия проводится внутривенно капельно, эффективность 70-90%. Схема – ежедневно до 5-7 дней, затем через день 2-4 недели.
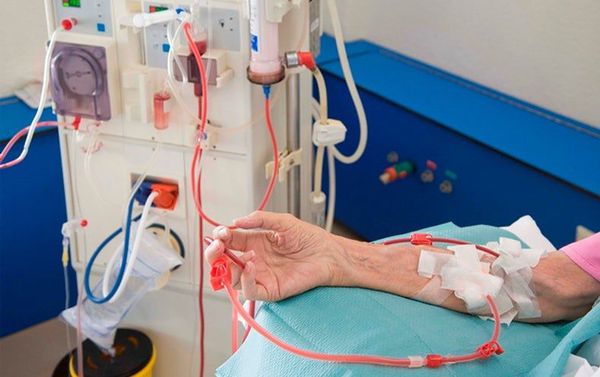
4. Хороший эффект достигается при проведении плазмафереза особенно при обострениях, в период миастенических кризов, при подготовке к операции, неэффективности кортикостероидной терапии. Проводится 3-5 сеансов. Сначала через день, затем 2-3 раза в неделю. Плазмаферез проводят с заменой плазмы или использованием белков-заменителей.
Можно использовать такие методы, как гемосорбция или энтеросорбция (угольные сорбенты СУМС 15-30 мг/кг веса 3 раза в сутки в течение 2-3 недель).
5. Иммуноглобулины G
Вспомогательная терапия включает в себя метаболическую терапию:
Кризы при миастении бывают:
Миастенические кризы развиваются при недостаточном назначении АХЭ препаратов.
Миастенический криз Холинэргический криз
1) Быстрое развитие (часы, минуты) 1) Медленное развитие (сутки и более)
3) Сухость кожи 3) Гипергидроз
4) Повышение АД, тахикардия 4) Снижение АД, брадикардия
5) Задержка при мочеиспускании 5) Учащенное мочеиспускание
6) Парез кишечника 6) Усиление перистальтики, диарея
7) Отсутствие фасцикуляций 7) Наличие фасцикуляций
8) Дыхательные нарушения 8) Дыхательные нарушения
В патогенезе кризов ведущим является развитие нервно-мышечного блока с выраженным прогрессированием патологической мышечной слабости и нарушением функции дыхательных мышц, следовательно лечение кризов должно быть направлено на компенсацию нарушений нервно-мышечной передачи и коррекцию иммунологических расстройств.
1. В качестве первого мероприятия предполагает необходимость адекватного дыхания с помощью принудительной ИВЛ. По показаниям к переводу на ИВЛ – нарушение ритма дыхания, цианоз, возбуждение, потеря сознания, участие вспомогательной мускулатуры, изменение величины зрачков отсутствие реакции на введение АХЭ препаратов.
2. Проведение плазмафереза или плазмасорбции. Проводится курсом на протяжении 1-2 недель с кратностью 2-5 операций.
3. Иммуноглобулины. Человеческий Ig представляет собой иммунореактивный белок. Препараты выделяются из плазмы здоровых людей. Применение высоких доз Ig обладает способностью подавлять иммунные процессы. В настоящее время терапия Ig является как альтернатива плазмафереза, на основании сходств механизмов, лежащих в основе этих методов лечения.
Общепринятым режимом терапии считают короткие 5-дневные курсы в/венного введения препарата в доза 400 мг/кг ежедневно. В среднем клинический эффект отмечается на 4 день терапии и продолжается в течение 50-100 дней. Может так же использоваться опыт при введении минимальных доз октагама и биовена 4-5 мг/кг в/венно капельно №10, суммарная доза 25 гр.
Возможность использования нормального человеческого Ig в дозе 50 мл в/венно капельно на 100-150 мл физиологического раствора. Введения повторяют через день в количестве 3-5 гр на курс лечения.
4. Антихолинэстеразные препараты. Чаще применяют парентеральное введение. Применение АХЭп в количестве диагностической пробы показаны при любой форме криза (наиболее эффективно их введение при миастеническом кризе). Прозерин вводится п/к от 1,5 до 2,5 мл, для уменьшения нежелательных эффектов вводят атропин 0,2-0,5 мл 01% раствора. Результат оценивается как при прозериновой пробе.
5. Глюкокортикостероидные препараты. Наиболее эффективно применение пульс-терапии 1000 мг метилпреднизолона в/в капельно. После которой рекомендуется использовать ежедневный прием преднизолона.
Таким образом, в основе миастениии лежит активный аутоиммунный процесс, повреждающий постсинаптическую мембрану. Заболевание носит как правило прогрессирующий характер. Это требует от врачей ранней диагностики и активной тактики в плане назначения иммунносупрессивной терапии (тимэктомия, кортикостероиды, цитостатики, плазмоферез, иммуноглобулины).
 |
При использовании материалов данного сайта ссылка на источник обязательна. Фонд SAPF©.
Миастения у детей
Общая информация
Краткое описание
Союз педиатров России
Клинические рекомендации: Миастения у детей
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Наиболее удобна для практического врача классификация, предложенная в 1965 г. Б.М. Гехтом. В ней учитывается характер течения заболевания, степень генерализации миастенического процесса, тяжесть двигательных расстройств и степень их компенсации на фоне ингибиторов ацетилхолинэстеразы (АХЭ), что помогает достаточно полно и точно сформулировать диагноз.
4. Злокачественная форма – острое начало и быстрое нарастание нарушения функции мышц (25%).
Этиология и патогенез
Эпидемиология
Диагностика
При сборе анамнеза и жалоб обращают внимание на изменчивость симптомов в течение суток, связь их с нагрузкой, наличие частичных или полных ремиссий, обратимость симптомов на фоне приема ингибиторов АХЭ (на время их действия) и на фоне адекватной иммуносупрессивной терапии.
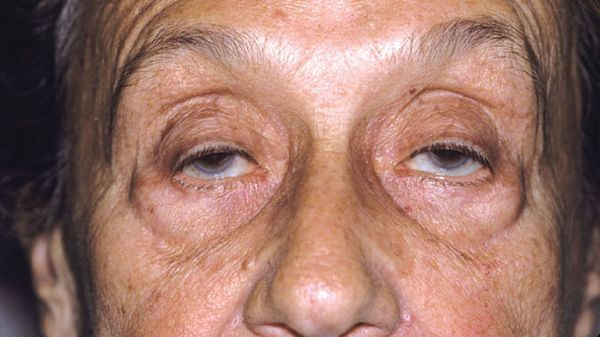
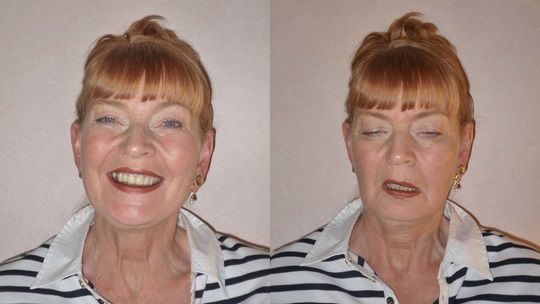
Клинический осмотр должен включать исследование общего неврологического статуса, а также проверку силы произвольных мышц лица, шеи, туловища и конечностей до и после нагрузки (оценка силы в баллах, где 0 – отсутствие силы, 5 – сила данной группы мышц здорового человека). Одним из самых важных клинических тестов для диагностики миастении является наличие синдрома патологической мышечной утомляемости: нарастание симптомов после нагрузки. Например, нарастание птоза, глазодвигательных нарушений при фиксации взора, после зажмуривания; снижение силы в отдельных группах мышц после повторных активных движений в исследуемой конечности, приседаний или ходьбы; появление или нарастание речевых нарушений при счете, чтении вслух и т.д. При этом не выявляется никаких симптомов органического поражения нервной и нервно-мышечной системы (при отсутствии сопутствующих заболеваний): нет нарушений в рефлекторной и координаторной сфере, сохранена чувствительность, в типичных случаях отсутствуют мышечные атрофии, сохранен мышечный тонус.
Первоначально мышечная сила может быть нормальной или почти нормальной, и поэтому мышечную силу нужно оценивать до и после физической нагрузки. Частота случаев, при которых поражение ограничено только глазодвигательными мышцами (глазная миастения), существенно отличается в различных публикациях, но, вероятно, составляет 20-50%, и до 80% у маленьких детей в Китае. МуСК-МГ чаще встречается у женщин, в клинической картине преобладает слабость глазодвигательных мышц и мышц черепа, отмечаются частые респираторные кризы. Различия между МуСК-МГ и АХР-МГ еще предстоит выяснить.
Таким образом, отличием всех симптомов миастении является динамичность в течение суток, усиление после нагрузки, обратимость или уменьшение степени их выраженности после отдыха.
Смешанные (миастенический + холинергический) кризы встречаются у больных миастенией при неправильном приеме и / или изначально узком диапазоне терапевтических доз ингибиторов АХЭ, а также на фоне состояний, вызывающих общую или мышечную слабость различного генеза (интеркуррентные инфекции, соматические, гормональные нарушения, прием препаратов, влияющих на сократительную функцию произвольных мышц и др.).
Комментарии: Этот тест вызывает стресс, особенно у маленьких детей, и поэтому должен выполняться щадяще. Технические трудности у маленьких детей также составляют проблему, и поэтому перед тем, как объявлять тест положительным, нужно быть полностью уверенным, что снижение амплитуды происходит по миастеническому типу. Суммарные потенциалы действия мышцы фиксируются с поверхностных электродов, лучше над слабой мышцей; частота стимуляции нерва 3Гц и 5Гц. Снижение амплитуды более чем на 10% в промежутке с третьего по пятый потенциал считается положительным результатом. Одноволоконная ЭМГ, позволяющая выявить усиленное «дрожание» при сокращении пар волокон, является более чувствительным, чем классическая ИСН, но трудновыполнимым у детей методом. Нормальная ИСН не исключает диагноза ЮМГ.
Комментарии: Основные качественные и количественные изменения при миастении обнаруживаются в постсинаптической мембране, которая содержит АХР, и в стадии развернутой клинической картины число АХР снижается до 10-30% от нормальных значений, падает их плотность.
Комментарии: Положительной полной проба считается при восстановлении мышечной силы до 5 баллов с компенсацией бульбарных и глазодвигательных нарушений, положительной неполной – при нарастании силы на 1-2 балла, но без полного ее восстановления и (или) сохранении редуцированного бульбарного или глазодвигательного дефекта. Частичная компенсация заключается в избирательном действии ингибиторов АХЭ на отдельные группы мышц, как правило, с нарастанием силы произвольных мышц на 1балл. Выделяется сомнительная прозериновая проба, когда отмечается некоторая положительная динамика в отношении отдельных симптомов (уменьшение птоза на 1-2мм, некоторое увеличение объема движений глазных яблок, несколько более звонкий голос, впечатление о некотором нарастании силы мышц конечностей и т.д.
Что такое миастения? Причины возникновения, диагностику и методы лечения разберем в статье доктора Попович Анны Мироновны, невролога со стажем в 33 года.
Определение болезни. Причины заболевания
Считается, что эта болезнь впервые была описана британским учёным-медиком Томасом Уиллисом в 1672 году, а первое доказательство её аутоиммунной природы появилось спустя более 200 лет.
Миастения — это хроническое аутоиммунное заболевание с прогрессирующим течением. Оно связано с разрушением рецепторов, которые участвуют в передаче нервных импульсов. При миастении эти рецепторы атакуются антителами, в результате чего нервно-мышечная передача нарушается.
Также причиной миастении может стать патология тимуса (вилочковой железы) — главного органа иммунной системы. В частности её развитие может быть связано с тимомой — группой опухолей вилочковой железы. В 30 % случаях он и являются злокачественными.
Провоцирующими факторами развития миастении являются:
Симптомы миастении
В целом симптомы миастении яркие и многообразные. Они зависят от формы патологии:
Патогенез миастении
Патогенез миастении до конца не выяснен. Но известно, что в развитии патологической утомляемости мышц главную роль играют аутоантитела. Они блокируют постсинаптические холинергические рецепторы нервно-мышечных соединений. В результате этой блокады развиваются структурные изменения и часть рецепторов гибнет.
Также на развитие миастении влияет вилочковая железа. При нарушении её функции в организме начинают синтезироваться антитела к холинергическим рецепторам, что в дальнейшем ведёт к развитию миастении.
Имеются данные о возможной роли персистирующей (постоянной хронической) инфекции вилочковой железы. Например, при миастении выявлено повышение титра комплемент-связывающих антител к цитомегаловирусу. У больных, которым проводилось лечение стероидами или тимэктомия (операция по удалению вилочковой железы), этот признак отсутствовал.
Классификация и стадии развития миастении
Миастения делится на генерализованные и локальные формы.
К локальным формам относятся :
К генерализованным формам относятся:
Последнюю форму генерализованной миастении можно разделить по стадиям:
Также миастению можно разделить по характеру течения. Выделяют:
Осложнения миастении
К наиболее значимым осложнениям миастении относятся холинергический и миастенический криз.
Чаще всего причинами возникновения миастенического криза становятся:
Отдельно стоит сказать о тимоме, при которой риск миастенического криза увеличивается в два раза.
Также существует ряд лекарственных препаратов, провоцирующих развитие осложнений миастении. К ним относятся:
Особенное внимание при подозрении на миастению следует уделять жалобам ребёнка, так как он не всегда может правильно сформулировать их. Это приводит к поздней диагностике заболевания и нарушению дыхания.
Диагностика миастении
При сборе анамнеза (истории болезни) следует обращать внимание:
При физикальном обследовании необходимо обращать внимание на птоз век, бульбарные расстройства (проблемы, связанные с глотанием пищи) и быструю мышечную утомляемость во время и после физической нагрузки.
Так как в большинстве случаев патогенез миастении связан с выработкой антител к холинергическим рецепторам, для подтверждения клинического диагноза достаточно выполнить иммунологический тест — анализ крови на наличие антител. В случае отрицательного результата могут потребоваться дополнительные методы диагностики.
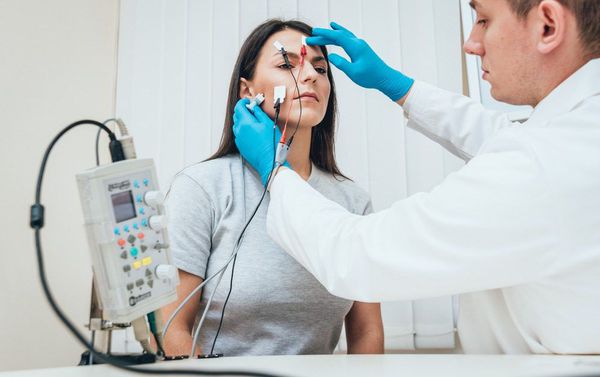
Наиболее современным и решающим методом диагностики при подозрении на миастению является электронейромиография (ЭНМГ) с проведением декремент-теста (исследования нервно-мышечной передачи). Для выполнения теста на области поражённых мышц фиксируются специальные электроды, через которые к мышцам ритмично поступают электрические импульсы. Получаемые мышечные ответы отображаются на нейромиографе в виде графика амплитуд.
Заподозрить миастению позволяет постепенное снижение амплитуд мышечной реакции более чем на 10 % от изначального мышечного ответа. Чтобы убедиться в диагнозе, после текста пациенту подкожно вводят прозерин 0,05 % и снова выполняют тестирование. В случае миастении данный препарат временно устранит нарушение нервно-мышечной передачи, тем самым увеличит амплитуду мышечных ответов.
Дифференциальная диагностика
Миастению необходимо отличать от следующих заболеваний:
Миастенические синдромы также возникают при:
Особое внимание следует уделять дифференциальной диагностике между холинергическим и миастеническим кризом. Первый тип криза встречается всего лишь у 3 % больных и начинается медленнее, чем миастенический криз. Он всегда связан с передозировкой антихолинэстеразными препаратами. В течение суток или более у пациента нарастает слабость и утомляемость, он не выдерживает прежнего интервала между приёмами данных средств, мышечная сила в ответ на стандартную или увеличенную дозу препарата снижается даже без предшествующей физической нагрузки.
Важное диагностическое значение при определении типа криза имеет прозериновая проба : пациенту подкожно вводят 2 мл 0,05 % прозерина. В течение 30 минут после введения препарата при холинергическом кризе отмечается уменьшение мышечной слабости, тогда как при миастеническом кризе мышечная сила увеличивается.
Лечение миастении
Методы лечения миастении делятся на две группы:
К средствам медикаментозного лечения относятся: антихолинэстеразные препараты, анаболические стероиды, АКТГ (адренокортикотропный гормон) и кортикостероиды. Как правило, применяется только один препарат, так как использование нескольких средств чревато холинергическим кризом.
Для лечения миастении также применяется внутривенное ведение иммуноглобулинов G 5 % и 10 %. Они быстро, но временно улучшают течение заболевания. Так как использование высоких доз человеческих иммуноглобулинов способно подавлять иммунные процессы, иммуноглобулины G позволяют снижать выработку антител к холинергическим рецепторам.
Прогноз. Профилактика
Миастения является достаточно тяжёлым заболеванием. Если пациент вовремя не обратится к врачу и диагноз не будет установлен, то возможен быстрый переход болезни в генерализованую форму и миастенический криз с летальным исходом.
При своевременной постановке диагноза и правильно подобранном лечении возможно наступление ремиссии. При нарушении режима приёма препаратов, после перенесённых инфекций, черепно-мозговых травм и стрессов возможно развитие миастенических кризов с острой дыхательной недостаточностью, нередко приводящих к гибели.
Пациентам с миастенией необходимо ограничить приём препаратов магния, миорелаксантов, петлевых диуретиков, D пеницилламина, нейролептиков, транквилизаторов, хинина, аминогликозидов, фторхинолонов, Стрептомицина, Арбидола и Дексаметазона. Данные средства способствуют развитию миастенических симптомов и усиливают слабость скелетных мышц, т. е. ведут к прогрессированию заболевания.
Больным миастенией следует избегать стрессов, интенсивных физических нагрузок, длительного нахождения на солнце, т. к. это может привести к усугублению дисфункции иммунитета и ухудшению состояния. Особое внимание следует уделять возрастной группе до 18 и старше 60 лет, которые длительно принимают антихолинэстеразные препараты.