Протоковый эпителий без атипии что это
Предраковые поражения и опухоли щитовидной железы
Рак щитовидной железы считается очень серьезной и тяжелой болезнью, которая может привести к летальному исходу. Чаще всего он выявляется у людей в возрасте старше сорока лет, но в последнее время заболевание особенно «помолодело». Рак является серьезной патологией щитовидной железы, поэтому в последнее время постоянно оказывается в фокусе внимания онкологов и эндокринологов. Более, чем в 30 % случаев, рак щитовидной железы преодолевает пределы данного органа, и появляются отдаленные метастазы. Чтобы избежать риск заболеть раков щитовидной железы, необходимо вовремя отследить предраковую стадию. Важно понимать, что опухоли щитовидной железы — самые внешне благополучные и «коварные» заболевания. В 10% случаев после операции в гистологическом материале находят признаки злокачественной опухоли, в связи с чем возникает необходимость в проведении повторной расширенной операции с удалением прилежащих лимфатических узлов.
Сегодня предраковые изменения щитовидной железы определяются в 15-20% случаев при иммуногистохимическом изучении послеоперационного материала. Если высокодифференцированные опухолевые образования своевременно выявить и начать качественное хирургическое лечение, можно забыть о данном заболевании.
Предраковые заболевания щитовидной железы представлены третьей степенью дисплазии, которую сложно отличить от рака. Это можно сделать только после получения иммуногистохимических анализов, определяющих наличие онкомаркеров. Для этого проводится пункционная тонкоигольная биопсия узлов щитовидной железы.
Предраковые заболевания щитовидной железы представлены узловым и эндемическим зобом, доброкачественным новообразованием — аденомой, кистой. Стоит отметить наличие наследственной предрасположенности к заболеваниям, в том числе и злокачественным.
Атипия щитовидной железы при эндемическом зобе
Эндемический зоб считается предраковым заболеванием щитовидной железы, возникающим по причине воздействия внешних факторов и требующим постоянного контроля. Именно данная патология опасна по вероятности озлокачествления. В регионах, относящихся к эндемическим по зобу, зафиксировано значительное число случаев рака щитовидной железы. Внешние факторы, повышающие риск формирования предракового состояния в рак щитовидной железы обусловлены радиационным воздействием, несбалансированным питанием, вредом от бытовой химии. Например, после аварии на Чернобыльской АЭС произошло увеличение частоты заболеваемости раком щитовидной железы.
Атипия щитовидной железы при узловатом зобе
Диагностика рака щитовидной железы чаще всего происходит у пациентов с узловатыми формами зоба. Если фиксируют резкий и значительный рост узла, надо серьезно отнестись к этому. Это может быть свидетельством перехода в злокачественную форму заболевания.
Атипия щитовидной железы при кисте и аденоме
Под кистой понимается образование, возникшее в щитовидной железе и достигающее в размерах более 15 миллиметров. Кисту, саму по себе, нельзя относить к причинам рака, так как к нему приводят причины, из-за которых образовалась киста. Согласно статистике, озлокачествление кист приходится только на 10 % всех случаев.
Аденома считается зрелой, доброкачественной опухолью щитовидной железы. Сложно прощупать переход доброкачественного поражения в злокачественное, в связи с чем стараются удалить аденому хирургическим путем до того, как произойдет атипия клеток щитовидной железы.
Атипия щитовидной железы: признаки озлокачествления
В начале перехода атипии щитовидной железы в стадию рака не наблюдаются никакие характерные симптомы, и у врача есть возможность лишь прощупать уплотнение с достаточно четкими границами. Соответственно в случае обнаружения узла в щитовидной железе врач обязан исключать процесс озлокачествление и решать вопрос, касающийся удаления узлов.
Следует обратить пристальное внимание на самочувствие пациентов, жалующихся на общую нарастающую слабость, отсутствие или снижение аппетита, потерю веса. Как правило, опухолевидное образование разной плотности и размеров определяется на передней поверхности шеи в месте расположения щитовидной железы. Помимо этого, у пациента может возникнуть ощущение «тугого воротничка» — чувства сдавления в области шеи больного.
Запишитесь на прием, позвонив по номеру телефона Волгограда +7 (8442) 52-03-03 или онлайн.
Атипичные клетки – это рак или нет?
Атипичные клетки – это такие клетки, которые под воздействием различных неблагоприятных факторов из обычной нормальной клетки человеческого организма преобразовались в нехарактерную структуру, изменили свой размер и форму. Организм в свою очередь теряет контроль над такими клетками, поэтому существует риск перерождения атипических клеток, что может привести к образованию рака.
Что может повлиять на образование атипичных клеток:
Это некоторые факторы, которые могут привести к образованию атипичных клеток. К сожалению, точной причины их возникновения сказать никто не может. Даже какой-то незначительный сбой в организме может привести к возникновению не одной и даже не двух таких клеток, а тысяч.
Как происходит перерождение атипичных клеток в рак
Давно известно, что образование клеток с измененной ДНК появляются постоянно. Но появление атипичных клеток не всегда приводят к раку. В нашем организме есть защитный механизм, процесс старение и уничтожение клеток, так называемый апоптоз. Он отвечает за то, чтобы аномальные клетки исчезали из организма. Но любая система может дать сбой, и в результате атипичные клетки затаятся в организме. При таком раскладе есть вероятность их перерождения в раковые клетки.
Что делать, если обнаружили атипичные клетки во время биопсии? Рак это или нет?
В такой ситуации лучше перестраховаться, чем что-то пропустить. Ведь ранняя диагностика рака может спасти вам жизнь.
Иногда врач назначает какое-то конкретное лечение, чтобы постараться остановить образование атипичных клеток. Либо может понадобиться еще один образец ткани – дополнительная биопсия, чтобы быть уверенным в отсутствии рака или какого-то другого заболевания.
Цитологическая диагностика заболеваний шейки матки
Цитологическое исследование мазков из шейки матки позволяет оценить состояние слизистой оболочки, наличие или отсутствие признаков патологических процессов (реактивных, предопухолевых, опухолей). При выявлении другими лабораторными методами инфекционного агента (вирус папилломы человека, бактериальные и паразитарные инфекции), цитологический метод позволяет оценить реакцию организма на инфекционный агент, наличие или отсутствие признаков повреждения, пролиферации, метаплазии или трансформации эпителия. Возможно также при исследовании мазка определить причину изменений эпителия (наличие воспаления с ориентировочным или уверенным определением патогенной микробиоты (микрофлоры), патологических процессов, связанных с гормональным, лекарственным, механическим, лучевым воздействием на организм женщины и шейку матки, состояний, чреватых опасностью возникновения дисплазии и рака шейки матки, а при их развитии установить правильный диагноз. В связи с этим цитологическое исследование применяют как при скрининге (мазки с визуально нормальной шейки матки), так и при наличии видимых при гинекологическом осмотре изменений слизистой оболочки.
Получение материала
Рак шейки матки чаще всего развивается в зоне трансформации, ему предшествуют фоновые процессы и внутриэпителиальные поражения (дисплазия эпителия), которые могут располагаться на небольших участках, поэтому важно, чтобы материал был получен со всей поверхности шейки матки, особенно из зоны стыка плоского и цилиндрического эпителия. Число измененных клеток в мазке бывает различным, и если их мало, то увеличивается вероятность, что патологические изменения могут быть пропущены при просмотре препарата. Для эффективного цитологического исследования необходимо учитывать:
Материал из шейки матки должен брать врач-гинеколог или (при скрининге, профилактическом осмотре) хорошо обученная медицинская сестра (акушерка).
Важно, чтобы в мазок попадал материал из зоны трансформации, так как около 90% опухолей исходит из зоны стыка плоского и цилиндрического эпителия и зоны трансформации и только 10% из цилиндрического эпителия цервикального канала.
С диагностической целью материал получают раздельно из эктоцервикса (влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с помощью шпателя и специальной щетки (типа Cytobrush). При проведении профилактического осмотра используют Cervex-Brush, различные модификации шпателя Эйра и другие приспособления для получения материала одновременно из влагалищной части шейки матки, зоны стыка (трансформации) и цервикального канала.
Перед получением материала шейку матки обнажают в “зеркалах”, дополнительных манипуляций не проводят (шейку не смазывают, слизь не удаляют; если слизи много – ее аккуратно снимают ватным тампоном, не надавливая на шейку матки.). Щетку (шпатель Эйра) вводят в наружный зев шейки матки, осторожно направляя центральную часть приспособления по оси цервикального канала. Далее ее наконечник поворачивают на 360° (по часовой стрелке), достигая тем самым получения достаточного числа клеток из эктоцервикса и из зоны трансформации. Введение инструмента выполняют очень бережно, стараясь не повредить шейку матки. Затем щетку (шпатель) выводят из канала.
Приготовление препаратов
Перенос образца на предметное стекло (традиционный мазок) должен происходить быстро, без подсушивания и потери прилипших к инструменту слизи и клеток. Обязательно перенести на стекло материал с обеих сторон шпателя или щетки.
Если предполагается приготовление тонкослойного препарата с помощью метода жидкостной цитологии, головку щетки отсоединяют от ручки и помещают в контейнер со стабилизирующим раствором.
Фиксация мазков выполняется в зависимости от предполагаемого метода окрашивания.
Окрашивание по Папаниколау и гематоксилин-эозином наиболее информативны в оценке изменений эпителия шейки матки; любая модификация метода Романовского несколько уступает этим методам, однако при наличии опыта позволяет правильно оценить и характер патологических процессов в эпителии и микрофлору.
Клеточный состав мазков представлен слущенными клетками, находящимися на поверхности эпителиального пласта. При адекватном получении материала с поверхности слизистой оболочки шейки матки и из цервикального канала в мазок попадают клетки влагалищной порции шейки матки (многослойный плоский неороговевающий эпителий), зоны стыка или трансформации (цилиндрический и, при наличии плоскоклеточной метаплазии, метаплазированный эпителий) и клетки цервикального канала (цилиндрический эпителий). Условно клетки многослойного плоского неороговевающего эпителия принято делить на четыре типа: поверхностные, промежуточные, парабазальные, базальные. Чем лучше выражена способность эпителия к созреванию, тем более зрелые клетки попадают в мазок. При атрофических изменениях на поверхности эпителиального пласта расположены менее зрелые клетки.
Интерпретация результатов цитологического исследования
Наиболее распространенная в настоящее время – классификация Bethesda (The Bethesda System), разработанная в США в 1988 г, в которую вносили несколько изменений. Классификация создана для более эффективной передачи информации из лаборатории врачам клинических специальностей и обеспечения стандартизации лечения диагностированных нарушений, а также последующего наблюдения за больными.
В классификации Bethesda выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions of low grade and high grade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени – умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак (cr in situ). В этой классификации имеются также указания на специфические инфекционные агенты, вызывающие заболевания, передавае мые половым путем.
Для обозначения клеточных изменений, которые трудно дифференцировать между реактивными состояниями и дисплазией предложен термин ASCUS – atypical squamous cells of undetermined significance (клетки плоского эпителия с атипией неясного значения). Для клинициста этот термин мало информативен, однако он нацеливает врача на то, что данная пациентка нуждается в обследовании и/или в динамическом наблюдении. В классификацию Bethesda в настоящее время введен также термин NILM – no intraepithelial lesion or malignancy, объединяющий норму, доброкачественные изменения, реактивные изменения.
Так как данные классификации используются в практике врача-цитолога, ниже приведены параллели между классификацией Bethesda и классификацией, распространенной в России (Табл. 22). Цитологическое стандартизованное заключениепо материалу из шейки матки (форма № 446/у), утверждено приказом Минздрава России от 24.04.2003 № 174.
Причины получения неполноценного материала различны, поэтому цитолог перечисляет типы клеток, обнаруженные в мазках и по возможности указывает причину, по которой материал признан неполноценным.
Предопухолевая патология молочной железы
Международные названия
Содержание
Дольковая (лобулярная) неоплазия молочной железы
Наиболее сложным в патологической анатомии является вопрос дифференциальной диагностики гиперпластических процессов, которые возникают на фоне гормональной стимуляции, прежде всего гиперэстрогении, и начальных форм РМЖ.
Дольковая неоплазия наиболее часто развивается у женщин в предменопаузальный период (в возрасте 45–47 лет) и составляет 1–3,8% всех эпителиальных патологических процессов молочной железы. В 0,5–4% материала биопсий, взятых по поводу доброкачественных заболеваний молочной железы, выявляют дольковую неоплазию разной степени дифференцировки. В 85% случаев дольковая неоплазия возникает мультицентрично и в 30–67% — билатерально.
Для лобулярной неоплазии характерна пролиферация мелкого эпителия, расположенного в просвете долек, со слабым межклеточным соединением, с педжетоидной реакцией или без нее. Происходит дольковая неоплазия из эпителия концевой (терминальной) протоково-дольковой единицы молочной железы. Выраженность атипии, степень пролиферации, количество атипических митозов зависят от степени дифференцировки неоплазии. Выделяют два типа клеток дольковой неоплазии: тип А и тип В. Тип А состоит из мономорфных эпителиальных клеток, тип В — из крупных полиморфных клеток с выраженными признаками атипии. Хотя клетки крупные, они гораздо мельче эпителия протоков.
Может быть смешанный тип, представленный сочетанием в разной пропорции клеток типа А и В.
Согласно Классификации РМЖ ВОЗ (2003) рекомендуется пользоваться термином «дольковая неоплазия», подразделяя ее на три степени и термин «дольковый рак in situ ».
Деление на степени дифференцировки дольковой неоплазии происходит в зависимости от выраженности клеточного полиморфизма, наличия некрозов, признаков атипии и количества митозов.
Легкая степень дольковой неоплазии (первая степень неоплазии) характеризуется сохранением альвеолярной архитектоники, пролиферацией в одной или нескольких дольках мелких мономорфных эпителиальных клеток, слабо сцепленных между собой (клетки типа А). Как правило, клетки в очаге пролиферации имеют округлое, нечетко отграниченное ядро и скудную цитоплазму. Некрозы, митозы и кальцинаты редки. Иногда отмечают очаги пролиферации и полиморфизма клеток, появляются скопления крупных клеток, но эти признаки представлены незначительно. В единичных дольках могут быть признаки апокриновой неоплазии (фото 3).
Фото 3. Легкая степень дольковой неоплазии. Общее строение дольки сохранено, однако количество долек значительно увеличено, отмечается выработка секрета, эпителий мелкий мономорфный. Гематоксилин-эозин, х 100
Умеренная дольковая неоплазия (вторая степень неоплазии) характеризуется нарастанием полиморфизма эпителия долек, появлением большего количества крупных клеток с неправильной формой ядра и обильной цитоплазмой, отмечают единичные митозы и отдельные перстневидные клетки. Миоэпителиальные клетки чаще располагаются вдоль базальной мембраны, но могут вытесняться из обычного места расположения и примешиваться к эпителиальному пролиферату. Базальная мембрана сохранна на всем протяжении (фото 4, 5).
Фото 4. Умеренная степень дольковой неоплазии. Отмечается пролиферация и формирование многорядного эпителия, очаги секреции. Гематоксилин-эозин, х 200
Фото 5. Умеренная степень дольковой неоплазии. Эпителий полиморфный, формирует сосочки, миоэпителиальные клетки местами вытесняют эпителиальные. Гематоксилин-эозин, х 400
Фото 6. Тяжелая степень дольковой неоплазии. Дольки расширены, просвет полностью заполнен эпителиальными клетками. Гематоксилин-эозин, х 100
Фото 9. Простая протоковая гиперплазия. Некоторые протоки расширены в виде кист, в отдельных протоках видны признаки апокриновой секреции, однако общее строение протоков сохранено. Гематоксилин-эозин, х 100
Для описания атипической дольковой неоплазии часто используют термин «дольковый рак in situ ». Все эти процессы имеют один морфологический код в Международном классификаторе онкологических заболеваний — 8520/2.
Рак in situ часто ассоциирован с микроинвазивным раком в окружающих участках, поэтому его исследование требует особой ответственности и внимания при установлении диагноза. Необходимо изучить большое количество срезов и края резекции. В сложных случаях для исключения инвазивного рака необходимо исследовать базальную мембрану для выявления ее целостности и доказать отсутствие нарушения миоэпителиального слоя и базальной мембраны.
Важным условием диагностики дольковой неоплазии является отсутствие инвазии опухолевыми клетками базальной мембраны. Для исключения инвазии применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Через довольно длительный промежуток времени у некоторых женщин на фоне рака in situ возникают инвазивные формы рака, но следует отметить, что дольковый рак in situ не обязательно является предраком инфильтративных форм.
Внутрипротоковые пролиферативные поражения
К ним относят простую протоковую гиперплазию, гиперплазию со слабо выраженной пролиферацией эпителия, атипическую протоковую гиперплазию и протоковый рак in situ (трех степеней дифференцировки).
Существуют два классификационных подхода к оценке эпителиальных пролиферативных поражений протоков. Касательно молочной железы одновременно используют две классификационные схемы.
Простая протоковая гиперплазия
Простая протоковая гиперплазия
Слабо выраженная протоковая атипия
Протоковая интраэпителиальная неоплазия Grade1А
Атипическая протоковая гиперплазия
Протоковая интраэпителиальная неоплазия Grade1В
Протоковый рак in situ Grade1
Протоковая интраэпителиальная неоплазия Grade1С
Протоковый рак in situ Grade2
Протоковая интраэпителиальная неоплазия Grade2
Протоковый рак in situ Grade3
Протоковая интраэпителиальная неоплазия Grade3
Левый столбик отражает взгляды большинства экспертов ВОЗ, терминологию, представленную справа, используют преимущественно в Северной Америке.
Нам кажется, что классификация ВОЗ более отражает сущность опухолевой трансформации, кроме того эта схема более воспроизводима и более наглядна для восприятия в реальных практических условиях.
Популяционный маммологический скрининг требует выделения патологических состояний, имеющих чрезвычайно высокий риск развития инвазивного рака молочной железы. Результаты дальнейших клинических исследований показали, что различные внутрипротоковые пролиферации с различной частотой переходят в рак in situ и инвазивный рак. Так, риск развития инвазивного РМЖ из простой протоковой гиперплазия составляет 1,5%, из атипической протоковой гиперплазии 4–5% и рака in situ 8–10% [1].
Термин «интраэпителиальная неоплазия» широко используют для описания патологии не только молочной железы, но и предстательной железы, шейки матки.
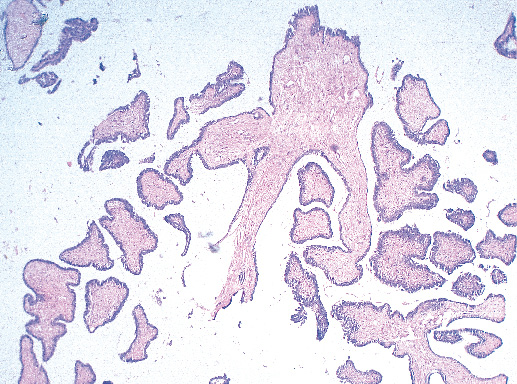
Простая (обычная) протоковая гиперплазия часто возникает на фоне мастопатии и выглядит как пролиферация эпителия с признаками некоторого полиморфизма внутри протоков. Протоки располагаются неравномерно, их размеры разные. Характерно изменение нормальной структуры протоков, формирование расширенных, неправильной формы протоков вокруг долек нормального строения. Протоки ветвятся в виде ручейков от центра участка гиперплазии к периферии. Клеточные пролифераты могут формировать солидные участки, криброзные структуры, мостики.
Фото 10. Простая протоковая гиперплазия. Участок апокриновой метаплазии. Гематоксилин-эозин, х 100
Фото 11. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 100
Критерии простой протоковой гиперплазии
Цитологические. Вариабельность форм ядер с гиперхромными округлыми и овальными ядрышками, ассиметричными нуклеолами.
Интерцеллюлярные расстояния отличаются по размеру и форме, часто отмечают щелеподобные структуры.
Риск развития инвазивного рака из простой протоковой гиперплазии составляет 2,6% за период наблюдения около 14 лет. Следует отметить, что такой процент инвазивного рака на фоне атипической протоковой гиперплазии формируется за 8,3 года [61]. В другом исследовании указывается, что в 4% случаев простая протоковая гиперплазия транформировалась в инвазивный РМЖ за 15 лет наблюдения [62]. Однако риск развития рака на фоне этой гиперплазии значительно ниже, чем при других вариантах гиперплазий.
Обычная протоковая гиперплазия является одним из морфологических проявлений гормональных изменений в организме женщины.
Морфофункциональные изменения, возникающие в различные периоды менструального цикла и беременности, могут симулировать обычную протоковую гиперплазию, поэтому патологоанатом должен иметь информацию о состоянии женщины, ее возрасте, наличии эндокринных и гинекологических заболеваний. Обязательно следует выдерживать сроки взятия биопсии или проведения операции в соответствии с менструальным циклом.
Протоковая неоплазия со слабо выраженной атипией
В данном варианте протоковой неоплазии по сравнению с предыдущим более выражена пролиферация эпителия, клетки формируют в протоке от 1 до 3–5 рядов, более существенно проявление атипии клеток. Папиллярные, криброзные, солидные пролифераты отсутствуют. Часто отмечают секрецию эпителия (цитоплазма клеток становится обильной светлой пенистой, ядро расположено ассиметрично, ближе к базальному краю) и секрет в просвете протоков (фото 12–14). Возможны микрокальцинаты. Морфологическая картина при этой патологии соответствует протоковой интраэпителиальной неоплазии Grade 1А.
Фото 12. Протоковая неоплазия со слабо выраженной атипией. Гематоксилин-эозин, х 200
Фото 13. Протоковая неоплазия со слабо выраженной атипией. Эпителий протоков формируют микропапиллярные структуры и сосочки. Гематоксилин-эозин, х 200
Фото 14. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами. Гематоксилин-эозин, х 200
Риск развития инвазивного рака на фоне простой протоковой атипии выше, чем на фоне простой протоковой гиперплазии.
Атипическая протоковая гиперплазия
Это заболевание характеризуется более выраженной пролиферацией эпителия, усилением признаков клеточного полиморфизма и появлением атипии разной степени выраженности. Заболевание характеризуется умеренным риском развития инвазивного рака молочной железы.
В протоках отмечают равномерное распределение мономорфных клеток с округлым ядром. Эпителиальные клетки формируют папиллярные структуры, солидные группы, пучки, аркады, криброзные структуры внутри протоков. Морфологическая картина соответствует протоковой интраэпителиальной неоплазии Grade 1В, местами протоки похожи на рак in situ G- 1. Для атипической протоковой гиперплазии обязательны участки простой протоковой гиперплазии. Для исключения рака in situ общим требованием является взятие на исследование ткани через каждый 1 мм и исследование серийных срезов гистологического блока.
Микрокальцинаты могут отсутствовать, быть представленными фокально или на большом протяжении. Это не является ведущим фактором для установления диагноза (фото 15–19).
Фото 15. Атипическая протоковая гиперплазия. Некроз и кальцинаты в протоках. Гематоксилин-эозин, х 200
Фото 16. Атипическая протоковая гиперплазия. Эпителий протоков полиморфный с гиперхромными ядрами, формирует криброзные структуры, слева отмечается очаг некроза, во многих протоках явления секреции. Гематоксилин-эозин, х 200
Фото 17. Атипическая протоковая гиперплазия. Атипичный эпителий в протоках формирует солидные пласты, однако нет инвазии стромы. Гематоксилин-эозин, х 200
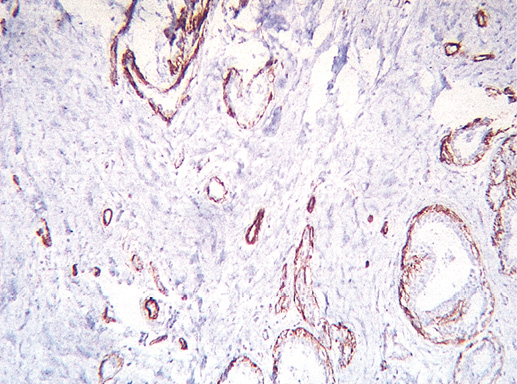
Фото 19. Экспрессия гладкомышечного актина (клон HHF35, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Миоэпителиальные клетки в виде непрерывной линии вдоль базальной мембраны. х 200
Атипическая протоковая гиперплазия имеет довольно высокий риск развития инвазивного РМЖ. По данным различных авторов инвазивный рак развивается в 3,7–22% случаев атипической протоковой гиперплазии [66, 67].
Важнейшим отличительным признаком любой формы протоковой интраэпителиальной неоплазии является наличие непрерывной базальной мембраны и слоя миоэпителиальных клеток. В зависимости от степени протоковой интраэпителиальной неоплазии количество эпителиальных клеток отличается.
Наиболее важная и сложная задача патологоанатома — не пропустить инвазию опухолевыми клетками базальной мембраны. Эта задача может быть выполнена только в результате кропотливого исследования большого количества срезов, отбора наиболее подозрительных на малигнизацию участков и проведения дополнительных методов окраски базальной мембраны и миоэпителиальных клеток. Неоценимую помощь в этом оказывает иммуногистохимический метод исследования. Для маркировки миоэпителиальных клеток мы часто применяем антитела к гладкомышечному актину, которые дают четкое окрашивание, и реакция легко воспроизводима.
Внутрипротоковая папиллома
Эти образования возможны в любом месте в пределах системы протоков от соска до терминальной дольково-протоковой единицы. Бывают доброкачественные варианты (внутрипротоковая папиллома), атипические (атипическая папиллома) и злокачественные (внутрипротоковый папиллярный рак).
Среди внутрипротоковых папиллом в зависимости от локализации выделяют центральные и периферические варианты. Центральная внутрипротоковая папиллома — это одиночное образование, располагающееся, как правило, в субареолярной зоне, часто в кистозно-расширенном протоке. Периферические внутрипротоковые папилломы чаще множественные. Большинство исследователей считают, что одиночные внутрипротоковые папилломы не имеют тенденции к малигнизации. Множественные папилломы, особенно в периферических отделах дольково-протоковой системы, склонны к озлокачествлению. Большие затруднения возникают при диагностике центральных внутрипротоковых папиллом, так как они могут клинически сопровождаться кровянистыми выделениями из соска [5].
Диагностика папиллом включает обязательно маммографию, ультразвуковое исследование (УЗИ), а также цитологическое исследование выделений из соска.
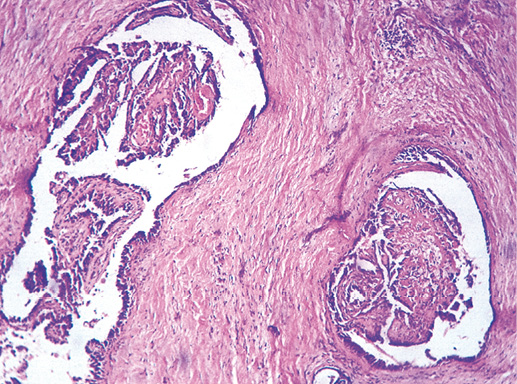
Внутрипротоковая папиллома — округлое образование с четкой границей размером 3–4 см, но возможны процессы, занимающие несколько сантиметров в диаметре. Внутрипротоковая папиллома представлена сосочковыми разрастаниями, состоящими из фиброваскулярной ножки, покрытой эпителием и миоэпителием (фото 20). Часто отмечают апокринизацию эпителия [5].
Фото 20. Внутрипротоковая папиллома. Гематоксилин-эозин, х 200
Фото 21. Внутрипротоковая папиллома. Видны отдельные сосочки с фиброзной стромой и однорядной эпителиальной выстилкой. Гематоксилин-эозин, х 200
Фото 22. Периферическая внутрипротоковая папиллома. Гематоксилин-эозин, х 200
Фото 23. Атипическая внутрипротоковая папиллома. Сосочки имеют грубоволокнистую соединительнотканную основу, миоэпителиальный компонент и один или несколько слоев эпителиальных клеток с гиперхромными ядрами. Гематоксилин-эозин, х 200
Термин «папилломатоз» молочной железы эксперты ВОЗ рекомендуют избегать и использовать термин «множественные внутрипротоковые папилломы».
Все внутрипротоковые папилломы имеют общий морфологический код в Международном классификаторе онкологических заболеваний — 8503/0.
Центральная внутрипротоковая папиллома
Гистологическое строение центральной и периферической внутрипротоковой папилломы одинаковое. Однако, учитывая большие размеры центральной папилломы, в ней можно отметить участки двух видов: протоковый и папиллярный. Папиллярные образования представлены фиброваскулярной ножкой, покрытой двумя слоями эпителия. Протоковый компонент имеет строение описанных выше протоковых гиперплазий. Опухоли, в которых преобладает протоковый компонент и склероз стромы, обычно называют «склерозирующая папиллома».
В центральных внутрипротоковых папилломах могут быть представлены участки пролиферации миоэпителия, апокринизация эпителия, плоскоклеточная, хрящевая и костная метаплазия, внутрипротоковая пролиферация эпителия, воспалительная инфильтрация. Отсутствие клеточной атипии, инвазии стромы позволит диагностировать центральную внутрипротоковую папиллому. Особенно кропотливой работы требуют папилломы с участками, имитирующими микроинвазию. Большую помощь в таких случаях оказывает иммуногистохимическое исследование компонентов базальной мембраны и миоэпителия. Чаще для этих целей применяют антитела, выявляющие коллаген IV типа и гладкомышечный актин.
Периферическая внутрипротоковая папиллома
В отличие от центральной внутрипротоковой папилломы, эта опухоль развивается у женщин более молодого возраста. Клиническое течение чаще протекает скрыто. Большие размеры папиллом могут пальпироваться. Маммография выявляет чаще множественные узловые образования с четкими контурами, возможны микрокальцинаты.
Характерный мультицентричный рост периферической внутрипротоковой папилломы может быть на фоне внутрипротоковой гиперплазии, карциномы in situ или инвазивного рака.
Термин «микропапиллома» применяют к малым формам периферической внутрипротоковой папилломы. Часто микропапилломы выявляют в больших фокусах аденоза молочной железы.
Атипическая внутрипротоковая папиллома
Эта форма внутрипротоковой папилломы выделена из-за ее важного прогностического значения, поскольку именно на фоне атипической внутрипротоковой папилломы чаще возникают инвазивные карциномы.
Внутрипротоковый папиллярный рак лишен (почти на всем протяжении) миоэпителиального клеточного слоя и характеризуется пролиферацией атипичного эпителия (фото 24). Часто бывает мультицентричный рост.
Фото 24. Внутрипротоковый папиллярный рак. Часть сосочков не имеет соединительной ткани в своей основе и состоит из атипичных эпителиальных клеток. Гематоксилин-эозин, х 400
Эта опухоль имеет свой морфологический код в Международном классификаторе онкологических заболеваний — 8503/2.