Протофиламенты микротрубочек представлены чем
Протофиламенты микротрубочек представлены чем
• При движении и делении клеток микротрубочки и актиновые филаменты функционируют совместно
• Микротрубочки определяют, где и когда актин собирает или генерирует сократительные усилия. Микротрубочки оказывают влияние на актиновый цитоскелет, непосредственно с ним связываясь или посылая сигналы
• Оба компонента цитоскелета могут быть связаны линкерными белками, посредством которых микротрубочки присоединены к актиновым филаментам
• Динамика роста и укорочение микротрубочек могут активировать ряд G-белков; эти активированные G-белки контролируют сборку актина и сокращение клетки
Для выполнения многих динамических функций клетке необходимы совместные усилия различных элементов цитоскелета. Например, при перемещении клетки в поисках питательных веществ или при делении микротрубочки функционируют вместе с актиновыми филаментами. Промежуточные филаменты также взаимодействуют с этими компонентами цитоскелета, что необходимо для поддержания целостности структур клеткок и тканей. В настоящем разделе мы рассмотрим несколько аспектов взаимодействия микротрубочек с актином при движении клеток и их делении.
Некоторые данные позволяют предполагать, что в клетке микротрубочки и актиновые филаменты взаимодействуют друг с другом. В течение почти 30 лет исследователям было известно, что деполимеризация микротрубочек при добавлении таких веществ, как колхицин, вызывает сжатие клетки. Сжатие достигается за счет изменений актинового цитоскелета и моторного белка миозина. Это говорит о том, что микротрубочки противостоят сжатию клетки или подавляют этот процесс. Клетки, у которых микротрубочки деполимеризованы, также теряют свою поляризованную форму. Обычно у клеток, распластывающихся по поверхности, наибольшее количество актиновых филаментов располагается спереди, где их полимеризация управляет движением. Когда в этих клетках микротрубочки деполимеризованы, актиновые филаменты более не проявляют преимущественной локализации на ведущем крае клетки. Эти экспериментальные наблюдения позволили предложить общую схему: микротрубочки играют управляющую роль, определяя, где должны собираться и сокращаться актиновые филаменты. Таким образом, актин служит источником силы, а микротрубочки организуют или контролируют точку ее приложения.
Функционируя вместе, актин и микротрубочки генерируют усилия для выполнения специфических клеточных функций в нужном месте и в нужное время.
Каким образом актин и микротрубочки взаимодействуют друг с другом на молекулярном уровне? Один из путей заключается в существовании линкера или набора линкеров, которые связывают актиновые филаменты с микротрубочками. Роль линкеров выполняют несколько МАР, которые связывают актиновые филаменты и микротрубочки, образуя между ними статические связи. Белок МАР2c, из группы МАР белков нейронов, является примером такого линкера, связывающего актин с микротрубочками. В растущих нейронах связывание актина с микротрубочками, вероятно, играет важную роль во время формирования нейроном длинных выростов.
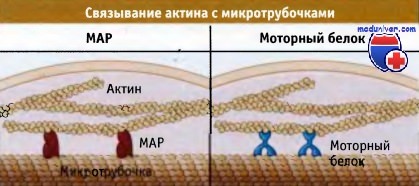
Слева показан белок, непосредственно связанный с обоими типами филаментов и скрепляющий их между собой.
Связь также может осуществляться за счет мотора, как это изображено справа.
В этом случае домены мотора связаны с одним из двух типов филаментов, в то время как хвост или другие белки, связанные с хвостом, связываются с другим типом.
При таком взаимодействии микротрубочки и актиновые филаменты движутся друг относительно друга.
Связи между актином и микротрубочками могут также возникать с участием моторных белков. В этом случае они носят динамический характер, что позволяет одному компоненту перемещаться по отношению к другому. Такие связи приводят к прикреплению микротрубочек к клеточному кортексу, как это наблюдается при ориентации веретена в эпителиальных клетках или при его позиционировании у дрожжей. В обоих случаях моторы микротрубочек связываются с актином цитоскелета и продвигаются по микротрубочкам с тем, чтобы при делении переместить веретено на нужное место.
За счет связывания микротрубочек с актиновыми филаментами растущие микротрубочки могут направляться в специфические области клетки. В подвижных клетках динамические микротрубочки растут по направлению к фокальным контактам, т. е. к сайтам адгезии к внеклеточному матриксу. Такие динамические микротрубочки направляются к маленьким фокальным контактам с помощью пучков акти-новых филаментов, присоединенных к этим местам. Предполагается, что белок + TIP, связанный с концами микротрубочек, может связывать последних с пучками актиновых филаментов, направляя рост микротрубочек к фокальным контактам. Микротрубочки направляются к сайтам адгезии позади клетки и могут доставлять сигнал, вызвающий распад этих сайтов, селективно высвобождая заднюю часть клетки от контакта с субстратом. При этом клетка может сократиться и продвинуть тело вперед. Многократное повторение этих процессов, скоординированное с протрузией клетки спереди, позволяет ей двигаться.
Таким образом, специфическое узнавание сайтов адгезии позади клетки и их элиминация представляют собой один из способов, посредством которого микротрубочки способствуют управлению движением клетки.
Актиновые филаменты и микротрубочки могут функционировать вместе и в отсутствие физического контакта. Сейчас известно, что два типа полимера способны обмениваться друг с другом сигналами, регулирующими место и время их роста. Способность генерировать сигналы и обмениваться ими является очень важной; она позволяет микротрубочкам и актиновым филаментам координировать свою активность и регулировать время и место образования каждого полимера, его распад, или использование для генерации силы. Хотя микротрубочки и актиновые филаменты сообщаются между собой посредством сигналов, они также контролируются с помощью сигнальных путей, возникающих в ответ на внутриклеточные или поступающие извне стимулы. Наряду с микротрубочками и актиновым компонентом цитоскелета, эти сигнальные системы на своем пути активируют различные сигнальные каскады и затрагивают многие мишени. В наибольшей степени изучены сигнальные каскады, регулирующие сборку и организацию актиновых филаментов. Организация в клетке актиновых филаментов в основном контролируется небольшим количеством белков, которые носят название G-белков.
При активации эти белки вызывают образование филоподий (актиновые шипы, расположенные в передней части клетки) и ламеллоподий (тонкие лепестки цитоплазмы, заполненные актиновыми филаментами и также расположенные на ведущем крае клетки). Также G-белки участвуют в образовании сократительных актиновых пучков, например стресс-фибрилл, связанных с фокальными контактами (см. выше), которые позволяют клетке продвигаться по субстрату. Вообще говоря, активированный G-белок стимулирует (часто непрямым образом) белок, связывающийся с актином, который затем регулирует цитоскелет. Интересно, что сборка или разборка микротрубочек может выполнять регуляторную роль по отношению к этим G-белкам, включая или выключая их. Таким образом, динамика микротрубочек регулирует сборку или сокращение актина, не будучи непосредственно связанными с актиновыми филаментами.
Образование сигнальных связей между микротрубочками и актиновыми филаментами играет критическую роль для передвигающихся клеток. Движение клетки требует постоянной полимеризации актина на ведущем крае, что является причиной движения, и сокращения в хвостовой части, облегчающее движение клетки вперед. При полимеризации актина возникают ламеллоподии, и этот процесс происходит под действием одного из G-белков, Rac1. Что вызывает активацию Rac1 на ведущем крае клетки и почему она движется в том же направлении? Сейчас выяснено, что растущие микротрубочки могут активировать Rac1, хотя мы не представляем себе, каким образом они это делают. Активация белка Racl микротрубочками играет важную роль, поскольку демонстрирует, что динамическое состояние микротрубочек может активировать сигнальный каскад в определенной части клетки.
Сообщение между микротрубочками и белком Rac1 происходит не только в одном направлении; как показано на рисунке ниже активированный белок также посылает сигнал микротрубочкам. Этот сигнал позволяет им поддерживать рост. Активированный Racl выключает функцию дестабилизирующего микротрубочки белка (онкобелка 18), что еще больше стимулирует рост микротрубочек. Таким образом, сообщение между Rac1 и микротрубочками создает положительную обратную связь, при которой растущие микротрубочки активируют Racl, и активный белок стимулирует рост микротрубочек. Эта обратная связь поддерживает микротрубочки в состоянии роста в направлении передней части клетки и стимулирует там процесс полимеризации актина.
По мере того как полимеризация распространяется за пределы этого участка, Rac1 стимулирует рост микротрубочки в новой области. Таким образом, вследствие существования обратной связи между микротрубочками и Racl клетка может поддерживать полярность и постоянно двигаться в том же направлении.
При деполимеризации микротрубочек также запускается сигнальный каскад. Деполимеризация активирует еще один G-белок, RhoA. Активный RhoA стимулирует стресс-фибриллы и сборку фокальных контактов и непрямым образом активирует миозин, который представляет собой мотор на основе актина. Эти изменения в актиновом цитоскелете вызывают сокращение клетки. Интересно, что активированный RhoA может также инициировать сигнальный каскад, который стабилизирует микротрубочки и превращает их в нединамическую форму. Ограничивает ли RhoA свою собственную активность, стабилизируя набор микротрубочек, неизвестно.
Предстоит еще многое выяснить относительно обмена сигналами между актином и микротрубочками цитоскелета. Исследуя эти взаимодействия и сигнальные белки, действующие как промежуточные звенья между двумя компонентами цитоскелета, мы больше узнаем о том, каким образом регулируется движение и деление клетки и как можно контролировать эти процессы при патологических состояниях организма.
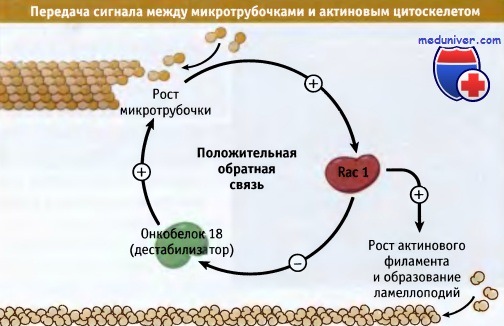
В качестве промежуточного компонента обычно выступает небольшой G-белок.
В изображенном на рисунке примере растущие микротрубочки активируют Rac1,
представляющий собой небольшой G-белок, стимулирующий полимеризацию актина со структурой, необходимой для образования ламеллоподий.
Активированный Rac1 выключает функцию белка, дестабилизирующего микротрубочки, онкобелка 18, и создает положительную обратную связь,
которая помогает поддерживать рост микротрубочек и образование филоподий.
Укорачивающиеся микротрубочки активируют еще один небольшой G-белок, который воздействует на другой тип актиновой структуры.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Динамические микротрубочки: от экспериментов к моделям
Никита Гудимчук, Павел Захаров, Евгений Ульянов, Фазоил Атауллаханов
«Природа» №10, 2015
Об авторах
Никита Борисович Гудимчук — кандидат физико-математических наук, старший научный сотрудник Центра теоретических проблем физико-химической фармакологии РАН и Детского центра гематологии, онкологии и иммунологии им. Дмитрия Рогачева. Область научных интересов — теоретическое и экспериментальное исследование механизмов деления клетки и динамики микротрубочек.
Павел Николаевич Захаров — младший научный сотрудник лаборатории биофизики Детского центра гематологии, онкологии и иммунологии. Занимается математическим моделированием митотического деления клетки.
Евгений Владимирович Ульянов — аспирант физического факультета Московского государственного университета им. М. В. Ломоносова. Область научных исследований — компьютерное моделирование динамики микротрубочек.
Фазоил Иноятович Атауллаханов — доктор биологических наук, профессор МГУ, директор Центра теоретических проблем физико-химической фармакологии, заведующий лабораторией биофизики Детского центра гематологии, онкологии и иммунологии. Научные интересы — клеточная биология, нелинейная динамика и самоорганизация в биологических системах.
Микротрубочки — один из трех основных типов белковых нитей клетки. Вместе с актиновыми и промежуточными филаментами они образуют клеточный каркас — цитоскелет. Благодаря своим уникальным механическим свойствам микротрубочки выполняют целый ряд ключевых функций на всех этапах жизни клетки, в том числе помогают организовать ее содержимое и служат «рельсами» для направленного транспорта внутриклеточных «грузов» — везикул и органелл. Микротрубочки — динамические структуры, они постоянно меняют свою длину за счет роста или укорачивания. Такое поведение, называемое динамической нестабильностью, существенно влияет на различные внутриклеточные процессы. Например, если клетка выпячивает часть цитоплазмы во время амебоидного движения, микротрубочки быстро заполняют новый объем, повышая в нем интенсивность внутриклеточного транспорта. Часть этих филаментов избирательно стабилизируется, тем самым задавая направление, вдоль которого перемещение «грузов» происходит более регулярно. Вдоль выделенной линии активизируются внутриклеточные процессы, а значит, создаются условия для возникновения у клетки полярности. Главенствующую роль динамика микротрубочек играет во время клеточного деления. Их способность менять длину интенсивно исследуется уже более 30 лет, однако механизмы, лежащие в основе этого феномена, все еще плохо изучены.
Строение и свойства микротрубочек
Рис. 1. Схема микротрубочки
Микротрубочки — это линейные полимеры. Они построены из димеров белка тубулина, которые образуют 13 цепей — протофиламентов (рис. 1). Каждый из них по бокам связан с двумя другими, и вся конструкция замкнута в цилиндр диаметром 25 нм. Такое строение обеспечивает микротрубочке прочность и большую изгибную жесткость: она может оставаться почти абсолютно прямой в масштабе клетки. Чтобы представить, насколько микротрубочка сложно сгибаема, мысленно увеличим ее до размеров стержня диаметром спагетти (около 2 мм). Такая «спица» не прогибалась бы, будь она длиной даже в сотни метров (высота современных небоскребов)! Жесткость позволяет микротрубочкам выполнять роль длинных прямых направляющих, которые организуют движение органелл внутри клетки. Остальные элементы цитоскелета (актиновые и промежуточные филаменты) существенно более гибкие, поэтому, как правило, используются клеткой в других целях.
Димер тубулина, из которого строится микротрубочка, состоит из мономеров двух типов. Внутри каждого протофиламента α-мономеры одного димера соединяются с β-мономерами соседнего. Поэтому по всей длине микротрубочки, содержащей десятки и сотни тысяч димеров тубулина, все они ориентированы одинаково. Тот конец микротрубочки, к которому обращены α-тубулины, называется минус-концом, а противоположный — плюс-концом. Благодаря такому упорядоченному расположению димеров микротрубочка имеет полярность, что обеспечивает направленность транспорта. Моторные белки, которые участвуют в перемещении «грузов» из одной части клетки в другую, «шагают» по микротрубочке, перетаскивая свою «ношу» за собой, как правило, только в одном направлении. Например, белок динеин двигает органеллы к минус-концу микротрубочки, а кинезин — к плюс-концу. Часто микротрубочки расположены в клетке радиально, а их плюс-концы направлены к ее периферии. Таким образом, кинезины осуществляют транспортировку из центра к внешней мембране, а динеины — от нее внутрь клетки. Поразительно, но в отростках аксонов везикулы и органеллы могут направленно передвигаться по микротрубочкам на расстояния в сотни микрометров и больше.
Динамическая нестабильность: в клетках и в пробирке

Рис. 2. Характерная кинетика полимеризации обычного биополимера (оранжевая кривая) и микротрубочки (синяя)
От обычных биополимеров микротрубочки отличаются не только механическими свойствами, но и уникальным динамическим поведением (рис. 2). Обычный полимер растет монотонно до тех пор, пока скорость присоединения новых субъединиц из раствора не сравняется со скоростью отделения уже прикрепленных. Полимеризация же микротрубочки носит колебательный характер. Ее длина попеременно то увеличивается, то уменьшается при фиксированной концентрации димеров тубулина в растворе. В одних и тех же условиях сосуществуют растущие и укорачивающиеся микротрубочки. Переходы от стадии роста к укорочению называют катастрофами, а обратные — спасениями. Впервые такое поведение — динамическую нестабильность — обнаружили Т. Митчисон (T. Mitchison) и М. Киршнер (M. Kirschner) около 30 лет назад [1].
Динамическая нестабильность микротрубочек особенно важна во время митоза. Из них строится специальный аппарат для разделения клетки — веретено деления. Оно центрируется благодаря микротрубочкам, которые отталкиваются от клеточной мембраны. Далее, удлиняясь и укорачиваясь, они «обыскивают» пространство клетки в поисках хромосом. Отыскав их и закрепившись за них своими концами, микротрубочки развивают тянущие и толкающие силы, перемещая хромосомы к экватору клетки. Четко выстроив на нем генетический материал и тем самым обеспечив готовность клетки к разделению, микротрубочки растаскивают хромосомы к клеточным полюсам. Все это происходит благодаря динамической нестабильности микротрубочек. Незаменимая роль динамики микротрубочек в митозе привела к разработке лекарств от онкологических заболеваний. Так, например, низкомолекулярное вещество таксол — известный противоопухолевый препарат, стабилизирующий микротрубочки, а значит, останавливающий деление раковых клеток.
Нестабильность микротрубочек проявляется не только в клетках, но и в пробирке — в растворе образующего их белка. Следовательно, для проявления ими этого свойства не требуется ничего, кроме тубулина. Он присоединяется из раствора к концу микротрубочки во время фазы ее роста или, наоборот, отделяется и уходит обратно в раствор во время стадии укорачивания. Тем не менее, другие клеточные белки могут влиять на параметры динамической нестабильности, например, ускорять рост микротрубочек в клетках, менять (увеличивать или уменьшать) частоты катастроф и спасений. Известно, что в пробирке скорость роста микротрубочек и эти частоты многократно ниже, чем в клетках при той же концентрации тубулина.
Модель ГТФ-«шапочки»
Почему микротрубочки, в отличие от других биополимеров, динамически нестабильны? Рост микротрубочки, как сказано, происходит благодаря присоединению к ее концу димеров тубулина. Каждый мономер этого белка связан с молекулой гуанозинтрифосфата (ГТФ). Однако вскоре после присоединения тубулина к микротрубочке молекула ГТФ, связанная с β-субъединицей, гидролизуется до гуанозиндифосфата (ГДФ). ГТФ-димеры тубулина в составе протофиламента стремятся вытянуться, образовать линейную структуру, а ГДФ-димеры — изогнуться в рожок с радиусом кривизны около 20 нм. За счет постоянного присоединения ГТФ-димеров микротрубочка удлиняется, а на ее конце формируется «пояс» из молекул, еще не успевших гидролизовать ГТФ. Пытаясь выпрямиться, этот слой — ГТФ-«колпачок» (или «шапочка») — не дает выгнуться наружу нижележащим ГДФ-димерам и таким образом предохраняет растущий конец микротрубочки от разборки. Считается, что микротрубочка устойчиво растет и защищена от катастрофы, пока на ее конце есть ГТФ-«шапочка». Исчезновение последней в результате гидролиза или случайного отделения ГТФ-димеров тубулина переводит микротрубочку в фазу укорочения.
Модель ГТФ-«шапочки» появилась практически сразу после открытия динамической нестабильности и покорила исследователей своей простотой и элегантностью. Получено уже довольно много экспериментальных фактов, подтверждающих эту модель. Один из классических опытов, показывающих, что на конце микротрубочки есть некая стабилизирующая структура, заключается в следующем. Растущую микротрубочку перерезают микроиглой или сфокусированным пучком ультрафиолетового света [2, 3]. Плюс-конец с отрезанной стороны немедленно начинает разбираться. Интересно, что минус-конец со стороны разреза обычно не разбирается, а продолжает расти. Р. Никлас (R. Nicklas) делал похожий опыт, но разрезал с помощью микроиглы микротрубочку в митотическом веретене внутри клетки [4]. Как и в предыдущем случае, микротрубочка тут же разбиралась со стороны разреза на плюс-конце и оставалась стабильной на минус-конце. Поведение последнего до сих пор остается загадкой, но результаты этих экспериментов сочли сильным доводом, подтверждающим наличие на растущем плюс-конце микротрубочки стабилизирующей ГТФ-«шапочки».
Другой важный аргумент в пользу этой модели появился, когда создали химически модифицированный ГТФ — очень похожий на свой прообраз, но практически неспособный к гидролизу. Когда в растворе плавают только такие молекулы, микротрубочки хорошо растут, но никогда не испытывают катастрофы [5]. Такое поведение подтверждает гипотезу о ГТФ-«шапочке»: ее слабогидролизуемый аналог никак не меняется со временем, а значит, не позволяет микротрубочке разбираться.
Косвенных доказательств существования ГТФ-«шапочки» много, однако ее до сих пор не удалось напрямую увидеть (хотя такие попытки предпринимались). По крайней мере, оценили размер минимальной структуры из слабогидролизуемого аналога ГТФ, которой достаточно, чтобы стабилизировать рост микротрубочки. Защитить ее от разборки, как оказалось, может «шапочка» всего в один слой димеров (при этом реально она может быть и толще). Наглядный способ оценить количество ГТФ-димеров на конце растущей микротрубочки — добавить белок с флуоресцентной меткой, который их распознает. Так называемый плюс-концевой белок EB1 in vitro светится на расстоянии порядка сотни слоев тубулина, причем интенсивность флуоресценции падает от конца к телу микротрубочки. Если этот белок действительно предпочитает связываться именно с ГТФ-димерами, то подобное распределение свечения указывает на то, что ГТФ-«шапочка» может быть значительно больше одного слоя. Примечательно, что белок ЕВ1 ярко окрашивает концы растущих микротрубочек, но начинает гаснуть за несколько секунд перед переходом филамента к катастрофе, как будто отражая постепенное исчезновение стабилизирующей ГТФ-«шапочки» [6]. Измеренная интенсивность флуоресценции белка EB1 на концах микротрубочек в живых клетках также свидетельствует в пользу большой (существенно толще одного слоя тубулинов) ГТФ-«шапочки» [7]. Кроме мечения микротрубочек белком EB1, «шапочку» также визуализировали в клетках с помощью специальных антител, узнающих ГТФ-тубулин [8]. Интересно, что они связывались не только с концами микротрубочек, но и образовывали «островки» на остальной поверхности.
Микротрубочки стареют?
Модель ГТФ-«шапочки» привлекла внимание исследователей прежде всего потому, что позволила объяснить, почему микротрубочка может устойчиво расти и укорачиваться и почему между этими фазами возможны переходы — катастрофы и спасения.
В 1995 г. Д. Одде (D. Odde) с соавторами провел простой, но важный эксперимент [9]. Они наблюдали за ростом микротрубочек в пробирке и решили построить распределение их длин. Оно предполагалось экспоненциальным, но оказалось, что у него есть пик (рис. 3). Значит, в начале роста микротрубочки имеют очень маленькую вероятность испытать катастрофу, а дальше, по мере их роста, эта вероятность повышается. Если пересчитать распределение длин микротрубочек в частоты катастроф, то получится возрастающая зависимость частоты катастроф от времени. Этот эффект назвали «старением» микротрубочек — они как будто «портятся» со временем. Иначе говоря, «молодые» микротрубочки могут расти стабильно, а «старые» уже более склонны к разборке. Необычное распределение времен жизни микротрубочек хорошо аппроксимируется гамма-распределением, которое характеризует процессы с фиксированным количеством последовательных шагов. Поэтому возникла идея, что лучше всего результаты проведенного эксперимента описывает теория, согласно которой катастрофа микротрубочки происходит за три последовательных стадии, когда в ней накопились определенные дефекты неизвестной природы [10]. Эта гипотеза, исходно достаточно сомнительная, тем не менее существенно подогрела интерес к исследованию динамики микротрубочек на уровне отдельных димеров тубулина.
Рис. 3. Экспериментальное распределение времен жизни микротрубочек и две альтернативные аппроксимации этих данных
Чего пока не может эксперимент и как помогает теория?
Обнаруженный феномен «старения» микротрубочек показал, что общепринятая, ставшая классической, модель ГТФ-«шапочки» — некоторое упрощение. Действительно, она только постулирует, что микротрубочка испытывает катастрофу, когда теряет свой стабилизирующий «колпачок», но не объясняет, как и почему это происходит, а также из-за чего же вообще микротрубочка может «стареть». Что за таинственные дефекты накапливаются внутри «стареющей» микротрубочки, приводя ее к катастрофе? Сколько их и в какой последовательности они должны проявляться? Может быть, речь идет о гидролизе отдельных молекул ГТФ внутри «шапочки» или о каком-то другом процессе, зависящем от не установленных пока событий совсем иной природы?
Естественно, исследователи хотели бы как можно тщательнее разглядеть «живые» микротрубочки, чтобы ответить на эти вопросы. Однако современный экспериментальный арсенал не позволяет это сделать. Мы можем или увидеть замороженную (обездвиженную) микротрубочку с нанометровым разрешением, например, с помощью электронного микроскопа, или проследить динамику микротрубочки со скоростью сотни кадров в секунду под оптическим микроскопом. К сожалению, невозможно получить соответствующие данные одновременно, чтобы четко их соотнести. Во многом по вине таких ограничений современной науке неизвестно, каков точный размер ГТФ-«шапочки» и как он меняется со временем, а также какую форму имеют концы микротрубочек и как она определяет их динамику.
На помощь экспериментам приходят теоретические методы исследования, в частности компьютерное моделирование. Оно может воссоздать микротрубочку с очень высоким пространственно-временным разрешением, правда, ценой неизбежных идеализаций и упрощений, адекватность которых нужно тщательно проверять (сравнивая результаты модельного и настоящего экспериментов). Идеальная компьютерная модель должна описывать все имеющиеся экспериментальные данные. Тогда на ее основе можно будет изучить механизмы наблюдаемого поведения микротрубочек и предсказать принцип действия белков, влияющих на динамику этих филаментов в клетках. Также станет возможным подбор химических соединений для управления поведением микротрубочек в медицинских целях.
Новая молекулярно-механическая модель
Ускорения расчетов нам удалось достичь главным образом за счет технологии параллельных вычислений на крупнейшем суперкомпьютере «Ломоносов» (в вычислительном центре МГУ) [23]. Он способен производить 1,7·10 15 операций в секунду, что выводит его на первое место в Восточной Европе по производительности.
Рис. 4. Два димера тубулина в молекулярно-механической модели. Светло-зеленым цветом изображены β-мономеры, темно-зеленым — α-мономеры. Красные и синие точки на поверхности мономеров соответствуют центрам бокового и продольного взаимодействия соответственно
В рамках нашей новой модели субъединицы тубулина — это шарики, на поверхности которых размещены центры взаимодействий с «соседями» (рис. 4). Рассматриваются два типа взаимодействий — продольные и боковые. Сами шарики могут существовать в двух состояниях, соответствующих ГТФ- и ГДФ-формам. В первом случае центры шариков стремятся выстроиться вдоль прямой, а во втором — вдоль дуги, соответствующей углу 22° (для каждой пары субъединиц). Центры взаимодействия притягиваются на близких расстояниях и перестают «чувствовать» друг друга на больших. Движения шариков описываются уравнениями Ланжевена (следствиями второго закона Ньютона), в которых мы пренебрегаем членами, содержащими ускорения частиц (так как эти слагаемые малы по сравнению с остальными). Субъединицы тубулина, удалившиеся от микротрубочки на расстояние, где они перестают с ней взаимодействовать, исключаются из рассмотрения. Также в систему периодически с некоторой вероятностью вводятся новые ГТФ-тубулины, которые появляются в случайной позиции на конце микротрубочки. Внутри нее они могут с определенной вероятностью подвергаться гидролизу — превращаться в ГДФ-субъединицы, которые тут же хотят расположиться по дуге, т. е. сформировать изогнутый протофиламент. Но последний необязательно сразу изгибается, так как от этого его могут удерживать боковые связи. Полученная таким образом система взаимодействующих тубулинов эволюционирует во времени: микротрубочка растет, испытывает катастрофу, укорачивается, спасается и вновь удлиняется. При этом наша модель хорошо описывает характерные формы концов растущей и укорачивающейся микротрубочек, воспроизводит наблюдаемые в экспериментах зависимости динамических характеристик от концентрации тубулина в растворе, а также феномен «старения» микротрубочек. Итак, с помощью моделирования, исходя из простых и понятных принципов и без каких-либо экзотических допущений, мы получили на экране компьютера виртуальную микротрубочку — объект, обладающий всеми основными свойствами своего реального прототипа. Рассчитав координаты всех субъединиц микротрубочки, мы можем с беспрецедентными разрешением и достоверностью узнать все о каждом элементе модельной микротрубочки в любой момент времени. Остается только проанализировать сложную последовательность событий в жизни микротрубочки и понять, какие из них и как приводят ее к переключению от роста к укорачиванию.
Что же происходит с микротрубочкой перед катастрофой? Сначала мы выяснили, выполняется ли в нашей модели какой-либо из двух ранее предложенных гипотетических сценариев этого события. Согласно одному из них, в структуре микротрубочки по мере ее роста могут возникать и сохраняться дефекты, например «дырки» в стенке, возникающие из-за того, что один из протофиламентов замедляет или прекращает свой рост (рис. 5, а) [10]. В нашей модели нет никаких искусственно вложенных оснований для приостановки роста отдельных протофиламентов. Поэтому такая ситуация практически никогда не реализуется, а следовательно, не может быть объяснением механизма «старения» микротрубочек и возникновения катастроф. Вторая гипотеза гласит, что увеличение склонности микротрубочки испытывать катастрофы («старение») происходит по мере постепенного заострения ее конца (рис. 5, б) [24]. Мы тщательно изучили разброс длин у протофиламентов микротрубочки в нашей модели и выяснили, что он быстро достигает некоей устойчивой формы, после чего микротрубочка остается с этим уровнем заостренности. Даже если искусственно создать конфигурацию микротрубочки с концом, в котором длины отдельных протофиламентов будут сильно различаться, то довольно скоро растущая белковая нить, предоставленная сама себе, достигнет все того же устойчивого уровня заостренности, к которому она обычно стремится. Таким образом, медленное заострение конца растущей микротрубочки тоже не может объяснить феномен ее «старения» в нашей модели. Мы также обратили внимание, что и размер ГТФ-«шапочки» не имеет тенденции постепенно уменьшаться (хотя существенно колеблется во время роста микротрубочки), а значит, он не может быть причиной катастрофы.
Рис. 5. Возможные сценарии «старения» микротрубочек. Возникновение катастрофы может происходить за счет накопления необратимых дефектов в виде прекративших расти протофиламентов (а); заострения конца микротрубочки (б); возникновения множества отогнутых протофиламентов на конце микротрубочки (в)
Отсутствие явного кандидата на медленный необратимый дестабилизирующий процесс привело нас к мысли, что, возможно, его и вовсе нет. А катастрофа происходит не в результате медленного накопления каких-либо дефектов, а из-за возникновения множества короткоживущих обратимых событий. Они время от времени накапливаются на конце микротрубочки и тогда приводят ее к катастрофе (рис. 5, в). Наиболее вероятное событие, приводящее к дестабилизации микротрубочки, — возникновение изогнутого «рожка» на ее конце. Действительно, если протофиламент отогнулся, то даже в случае присоединения к его концу новых субъединиц тубулина из раствора микротрубочка не становится более стабильной и продолжает укорачиваться. Однако один изогнутый протофиламент может легко обломиться и отделиться от микротрубочки. Поэтому по-настоящему дестабилизирующий эффект будут оказывать только несколько изогнутых протофиламентов, образовавшихся на конце микротрубочки одновременно. Количество непрямых протофиламентов, возникающих незадолго до катастрофы в наших расчетах, подтверждает этот вывод.
Таким образом, компьютерное моделирование позволило пролить свет на механизм возникновения катастроф. Оказалось, что в этом процессе важную роль играет не только число ГТФ-димеров, но и механические конфигурации протофиламентов. Катастрофа — результат единовременного образования множества обратимых короткоживущих событий (изогнутых протофиламентов) на конце микротрубочки. Это дополняет классическую модель ГТФ-«шапочки» недостающими деталями, объясняя, как и почему может происходить катастрофа микротрубочки. Мы надеемся, что компьютерное моделирование со временем позволит ответить и на другие вопросы о динамике этих филаментов. Каков механизм спасения микротрубочек? Почему их плюс- и минус-концы в экспериментах по перерезанию пучком ультрафиолетового света или микроиглой ведут себя по-разному? Как белки-модуляторы и потенциальные лекарства воздействуют на динамику микротрубочек?
Работа выполнена при финансовой поддержке фонда «Династия» (грант для молодых биологов) и гранта Президента РФ для молодых кандидатов наук.








