Противофиброзный препарат что это
Новые подходы к лечению фиброзирующих интерстициальных заболеваний легких
Фиброзирующие варианты поражения легких, приводящие к развитию дыхательной недостаточности, относятся к числу наиболее тяжелых интерстициальных заболеваний легких. Помимо идиопатического легочного фиброза, они включают в себя хронический гиперсенситивный пневмонит, неспецифическую интерстициальную пневмонию, поражение легких в рамках системных заболеваний соединительной ткани, неблагоприятные варианты течения легочного саркоидоза и некоторые другие. Применяющаяся для лечения этих заболеваний иммуносупрессивная терапия у части пациентов оказывается неэффективной и сопряжена с высоким риском тяжелых нежелательных явлений. Изучение новых лекарственных препаратов с антифиброзным действием, в частности нинтеданиба, открывает новые возможности для лечения этой непростой группы больных.
С.В. Моисеев. Среди хронических интерстициальных заболеваний легких (ИЗЛ) наиболее тяжелыми являются варианты поражения легких, протекающие с формированием выраженного фиброза и, следовательно, дыхательной недостаточности. Хотя механизмы образования соединительной ткани при этих заболеваниях были достаточно хорошо изучены, терапевтические подходы к торможению фиброгенеза до недавнего времени оставались мало эффективными, а широко назначавшаяся ранее при всех вариантах ИЗЛ иммуносупрессивная терапия оказалась неоправданной при многих заболеваниях. Действительно, при хроническом гиперсенситивном пневмоните, фибротическом варианте неспецифической интерстициальной пневмонии (в том числе в рамках системных заболеваний соединительной ткани), продвинутых стадиях легочного саркоидоза применение преднизолона и иммуносупрессивных препаратов не приводит к торможению фиброзного ремоделирования легочной ткани и значительно повышает риск респираторных инфекций и других нежелательных явлений [1].
М.Ю. Бровко. В начале XXI века для лечения идиопатического легочного фиброза, характеризующегося рентгенологической и гистологической картиной обычной интерстициальной пневмонии, были зарегистрированы два препарата с доказанным антифиброзным действием – нинтеданиб и пирфенидон [2,3]. Общность механизмов развития легочного фиброза при обычной интерстициальной пневмонии и других вариантах фиброзирующих ИЗЛ позволили предположить, что эти препараты могут найти применение и при других заболевания [4].
Нинтеданиб является низкомолекулярным ингибитором тирозинкиназ, блокирующим важнейшие сигнальные пути фиброгенеза в легочной ткани, в которых участвуют фактор роста тромбоцитов (PDGF), фактор роста эндотелия сосудов (VEGF) и фактор роста фибробластов (FGF) [5]. Первоначально этот препарат изучали при онкологических заболеваниях и применяли для лечения немелкоклеточного рака легкого, однако в 2014 году были завершены 52-недельные двойные слепые плацебоконтролируемые исследования INPULSIS-1 и INPULSIS-2, которые доказали способность препарата замедлять прогрессирование идиопатического легочного фиброза [2]. В целом в эти исследования были включены 1066 пациентов с идиопатическим легочным фиброзом, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день или плацебо. Первичной конечной точкой была ежегодная скорость снижения форсированной жизненной емкости легких (ФЖЕЛ). В обоих исследованиях в группе нинтеданиба она была примерно в два раза ниже, чем в группе плацебо (в исследовании INPULSIS-1 разница ежегодной скорости снижения ФЖЕЛ между группами составила 125,3 мл; p 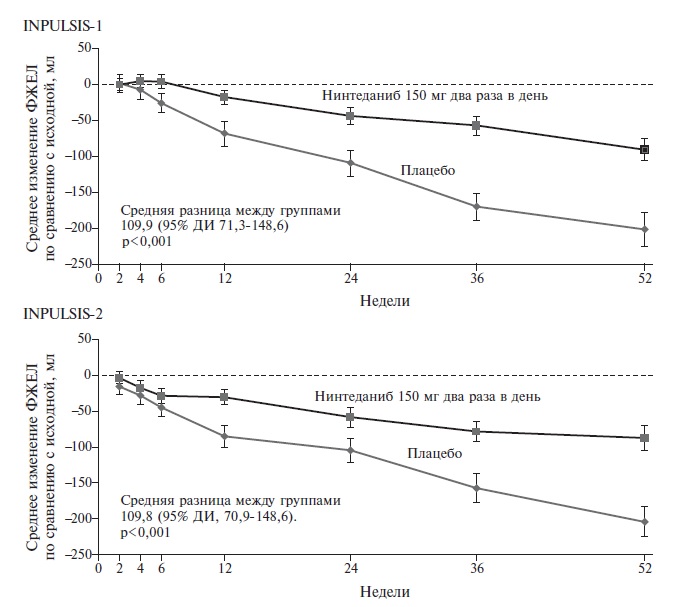
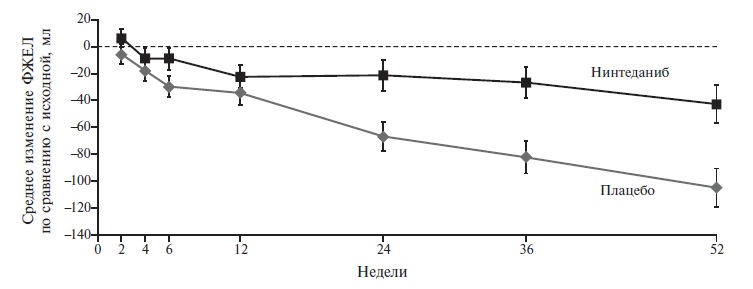
В 2018 г. после завершения двойного слепого, плацебо-контролируемого исследования SENCSIS была подтверждена эффективность назначения нинтеданиба при прогрессирующем поражении легких в рамках системной склеродермии (ССД) [6]. В исследование были включены 576 больных, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день внутрь или плацебо. Первичная конечная точка была такой же, как в исследованиях INPULSIS. Лечение нинтеданибом достоверно задерживало развитие фиброза у больных ССД, а разница ежегодной скорости снижения ФЖЕЛ между двумя группами составила 41,0 мл в пользу нинтеданиба (р=0,04; рис. 2).
П.И. Новиков. ССД – это аутоиммунное заболевание, в основе которого лежат генерализованная микроангиопатия и активация процессов фиброгенеза. На ранних стадиях заболевание проявляется кожными изменениями в виде плотного отека пальцев и синдромом Рейно, которые могут не сопровождаться ухудшением общего состояния или признаками поражения внутренних органов (в том числе одышкой), поэтому пациенты зачастую не сразу обращаются за медицинской помощью. В связи с этим ССД нередко диагностируют поздно, когда патологические изменения в органах необратимы, а лечение менее эффективно. По данным канадского регистра, у 408 пациентов диагноз ССД был установлен в среднем через 6,0 лет после развития феномена Рейно и через 2,7 года после появления первых «внекожных» проявлений [7]. В России ССД диагностировали через 2,0–2,7 года после появления феномена Рейно при диффузной форме заболевания [8]. При этом результаты крупного исследования (n=5860) показали, что смертность пациентов с ССД достигает 68 на 1000 человек в год [9]. Таким образом, своевременная диагностика ССД представляет собой сложную, но очень важную задачу для врача. Примерно у 75% больных уже в первые годы заболевания выяв ляют интерстициальное поражение легких, характеризующееся медленным прогрессирующим течением с исходом в фиброз разной степени тяжести [10]. Л.В. Теплова и соавт. с помощью компьютерной томографии высокого разрешения выявили признаки поражения интерстиция легких у 82% из 138 пациентов с ССД [11].
Лечение ИЗЛ в рамках ССД обычно начинают с иммуносупрессивных препаратов, в частности циклофосфамида [12]. В многоцентровом, проспективном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании лечение цифлофосфамидом внутривенно в течение 6 мес с последующей заменой на азатиоприн привело к увеличению ФЖЕЛ на 4,2% по сравнению с контролем [13], что указывало на способность препарата замедлять прогрессирование поражения легких при этом заболевании. Тем не менее, через 2 года после начала 12-месячной иммуносупрессивной терапии было выявлено ухудшение ФЖЕЛ и рентгенологической картины [14].
В рандомизированном, двойном слепом 24-месячном исследовании микофенолат мофетил в дозе 3000 мг/сут у больных ССД с поражением легких не отличался от циклофосфамида в дозе 2 мг/кг/сут внутрь по эффективности, но имел преимущества по переносимости [15]. Результаты небольших неконтролируемых исследований свидетельствуют о том, что ритуксимаб может улучшить течение ИЗЛ у больных ССД [16]. Недавно эффективность и безопасность ритуксимаба были изучены у 254 больных ССД (у 58% из них имелось ИЗЛ), получавших лечение в центрах, которые входят в программу EUSTAR (в Российской Федерации – НИИ ревматологии им. В.А. Насоновой и клиника им. Е.М. Тареева). Контрольную группу составили 9575 подобранных пациентов с ССД, которым проводилось лечение другими препаратами. Хотя ритуксимаб вызывал улучшение фиброза кожи, он не оказывал существенного влияния на динамику ФЖЕЛ или диффузионной способности по оксиду углерода (DLCO).
В целом приведенные данные свидетельствуют о том, что иммуносупрессивные препараты, в том числе циклофосфамид, микофенолат мофетил и ритуксимаб, позволяют стабилизировать течение ИЗЛ у части, но далеко не у всех больных ССД, что определяет необходимость применения других подходов к лечению, прежде всего с использованием препаратов, обладающих антифиброзной активностью.
С.В. Моисеев. Особенно трудным является ведение пациентов с поражением легких в рамках ССД, у которых легочный фиброз прогрессирует несмотря на адекватную иммуносупрессивную терапию. Приводим клиническое наблюдение:
Л.А. Акулкина. Пациентка А., 50 лет. С 35 лет отмечает онемение и посинение пальцев рук на холоде. Диагностирован синдром Рейно. В 2010 г. в возрасте 40 лет появились малопродуктивный кашель и одышка при физической нагрузке. По месту жительства респираторная симптоматика трактовалась как проявление инфекционного процесса, в связи с чем периодически проводились антибактериальная терапия, инфузии эуфиллина без существенного эффекта. В 2014 г. при мультиспиральной компьютерной томография органов грудной клетки (МСКТ) выявлены признаки интерстициальной пневмонии, однако какая-либо терапия назначена не была, а дыхательная недостаточность постепенно нарастала. При контрольной МСКТ через полтора года в обоих легких, преимущественно в нижних долях, определялись участки фиброза и «сотового легкого» на фоне значительных интерстициальных изменений по типу «матового стекла» с утолщением и уплотнением легочного интерстиция и междольковых перегородок (более выражено в периферических отделах), а также внутригрудная лимфаденопатия верхней паравазальной, ретрокавальной, трахеобронхиальных и бифуркационной групп до 13 мм. Обратилась к фтизиатру, который исключил туберкулез органов дыхания. В 2016 г. в возрасте 46 лет впервые госпитализирована в клинику им. Е.М. Тареева. При осмотре обращали на себя внимание изменения кожи с формированием «кисетного рта», плотный отек пальцев рук, синдром Рейно с дигитальными язвами. При обследовании выявлены антинуклеарный фактор (АНФ) в титре 1:1280, положительные антитела к цитоплазматическому антигену SS-A (Ro), резкоположительные антитела к топоизомеразе I Scl-70. ФЖЕЛ была снижена до 74%, а DLСО – до 58%. При эхокардиографии выявлены умеренные признаки легочной гипертензии с повышением систолического давления в легочной артерии до 45 мм рт. ст. Сочетание характерных кожных изменений, синдрома Рейно, изменений в легких по типу прогрессирующего фиброзирующего заболевания легких (утолщение, деформация внутридолькового и междолькового легочного интерстиция, участки кистозной трансформации легочной ткани, уменьшение нижних долей легких в размерах, наличие тракционных бронхоэктазов, уплотнение легочной ткани по типу «матового стекла» в субплевральных и базальных отделах обоих легких) и серологических маркеров позволило диагностировать ССД с поражением легких. Начата комбинированная иммуносупрессивная терапия циклофосфамидом в дозе 800 мг внутривенно ежемесячно в течение 5 месяцев, пероральный прием преднизолона 10 мг/сут и гидроксихлорохина 200 мг/сут. В результате терапии отмечены уменьшение одышки и кашля, повышение толерантности к физическим нагрузкам, однако каждая инфузия циклофосфамида сопровождалась инфекционными осложнениями. Тем не менее, при МСКТ через 6 мес наблюдалась умеренная отрицательная динамика в виде нарастания интерстициальных фиброзных изменений в легких. Циклофосфамид был заменен на микофенолат мофетил, а терапия преднизолоном продолжена в прежней дозе. Увеличить дозу микофенолата мофетила до целевой не удалось в связи с развитием стойкой диареи, поэтому препарат был отменен. В декабре 2016 г. начаты инфузии ритуксимаба. В результате лечения наблюдался некоторый положительный клинический эффект в виде уменьшения одышки и выраженности синдрома Рейно, повышения толерантности к физическим нагрузкам. В мае 2017 г. лабораторные признаки активности заболевания отсутствовали, а при МСКТ выявлено уменьшение выраженности изменений по типу «матового стекла» в обоих легких, однако площадь фиброзных изменений несколько увеличилась. С учетом полной деплеции CD19+ B-лимфоцитов в периферической крови повторное введение ритуксимаба было решено отложить. В апреле 2018 г. рентгенологическая картина и функциональные легочные показатели без динамики. Отмечено нарастание числа CD19+ В-лимфоцитов до 0,8%, в связи с чем проведена очередная инфузия ритуксимаба 1 г. В мае 2019 года функция легких оставалась относительной стабильной (ФЖЕЛ 67%, DLCO 46%), однако при МСКТ отмечено нарастание уплотнения легочной ткани по типу «матового стекла». Выполнено очередное введение ритуксимаба 1 г. При обследовании в декабре того же года клиническое состояние пациентки стабильно, признаков активности ССД нет, однако выявлено нарастание фиброзных изменений легочной ткани при отсутствии существенной динамики ФЖЕЛ и DLCO. В настоящее время обсуждается возможность назначения нинтеданиба.
М.Ю. Бровко. История заболевания пациентки де монстрирует недостаточную эффективность применявшихся иммуносупрессивных лекарственных препаратов – несмотря на лечение в течение 3 лет отмечено снижение показателей легочной вентиляции, в том числе ФЖЕЛ на 10% и DLCO на 12%. В этом случае оправдано применение антифибротической терапии, так как в исследовании SENCSIS лечение нинтеданибом у таких больных позволило замедлить нарастание респираторного дефицита у пациентов с ССД практически вдвое [6].
В.И. Шоломова. Опубликованные в 2019 г. результаты 52-недельного двойного слепого, плацебо-контролируемого исследования INBUILD подтвердили эффективность терапии нинтеданибом при практически полном спектре фиброзирующих ИЗЛ, не относящихся к ИЛФ. В исследовании приняли участие 663 пациента из 15 стран, включая Российскую Федерацию. Критериями включения были признаки интерстициального фиброза с вовлечением более 10% легочной паренхимы по данным МСКТ органов грудной клетки в сочетании с признаками прогрессирования заболевания за предыдущие 24 мес (нарастание рентгенологических изменений, снижение ФЖЕЛ, усугубление респираторной симптоматики) несмотря на иммуносупрессивную терапию. Лечение нинтеданибом 150 мг два раза в сутки и плацебо получали пациенты с гиперсенситивным пневмонитом, идиопатической неспецифической интерстициальной пневмонией, неклассифицируемой интерстициальной пневмонией, поражениями легких, ассоциированными с различными системными заболеваниями соединительной ткани (в том числе ССД, ревматоидным артритом), профессиональными заболеваниями и саркоидозом. У большей части пациентов (62,1%) имелись рентгенологические изменения, соответствующие паттерну обычной интерстициальной пнев монии.
А.Ш. Янакаева. Больная К., 65 лет. В 2014 г. в возрасте 60 лет появился постоянный сухой кашель, однако к врачу не обращалась. В январе 2016 г. при диспансеризации впервые выявлены патологические признаки на рентгенограммах легких. При МСКТ обнаружены изменения по типу «матового стекла» в базальных отделах обоих легких, увеличение внутригрудных лимфатических узлов до 14 мм. Признаков дыхательной недостаточности не выявлено. ФЖЕЛ составила 110%, однако исследование диффузионной способности не проводилось. При эхокардиографии без существенных отклонений. Диагностирована идиопатическая интерстициальная пневмония. Проводилась терапия преднизолоном 25 мг/сут и ацетилцистеином 600 мг/сут. При контрольной МСКТ через 6 мес положительной динамики не наблюдалось, сохранялся сухой кашель. Рекомендовано продолжить прием преднизолона в дозе 15 мг/сут.
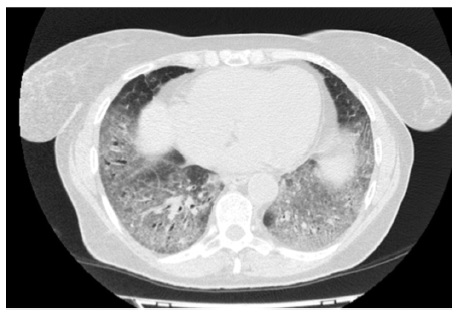
В апреле 2017 г. госпитализирована в Клинику им. Е.М. Тареева с жалобами на мучительный сухой кашель, слабость, умеренную одышку. В базальных отделах обоих легких выслушивалась крепитация. ФЖЕЛ – 91%, DLСО – 67%. Рентгенологически определялась картина неспецифической интерстициальной пневмонии. По сравнению с предыдущим исследованием отмечено нарастание фиброзных изменений, в то время как выраженность зон «матового стекла» существенно не изменилась (рис. 4). При иммунологическом исследовании обнаружено повышение титра АНФ до 1:320, слабоположительный титр SS-A. Неоднократно осматривалась ревматологом, данных за какое-либо системное заболевание соединительной ткани не было. Диагностирована интерстициальная пневмония с аутоиммунными признаками [18]. Продолжена терапия преднизолоном в дозе 20 мг/сут, к которому был добавлен микофенолат мофетил в дозе 2000 мг/сут. В ноябре 2017 г. отмечено уменьшение площади интерстициальных изменений по типу «матового стекла» при усилении выраженности тракционных бронхоэктазов. Несмотря на проводимую иммуносупресивную терапию вентиляционная функция продолжала снижаться, в том числе ФЖЕЛ до 82% и DLСО до 61%. С учетом неэффективности иммуносупрессивной терапии и соответствия пациенки критериям отбора в исследование INBUILD в декабре 2017 г. начато лечение нинтеданибом в дозе 150 мг два раза в сутки в сочетании с преднизолоном в дозе 10 мг/сут. На фоне 2-летней терапии нинтеданибом впервые отмечена стабилизация показателей функции внешнего дыхания: в сентябре 2019 г. ФЖЕЛ составила 81%, а DLСО – 59%. При МСКТ выраженность фиброзных изменений не изменилась, в связи с чем терапию антифиброзным препаратом решено продолжить.
С.В. Моисеев. Представленные истории болезни демонстрируют варианты неблагоприятного фиброзирующего течения ИЗЛ, отличных от идиопатического легочного фиброза. Обеим пациенткам показана длительная терапия антифиброзным лекарственным препаратом – нинтеданибом в дозе 150 мг два раза в сутки. Результаты плацебо-контролируемых клинических исследований свидетельствуют о том, что лечение этим препаратом оказывает благоприятное влияние на различные фиброзирующие заболевания легких. Очевидно, что лучших результаты терапии можно ожидать у второй пациентки, учитывая отсутствие системного заболевания. Однако и первой больной назначение нинтеданиба также показано, так как неблагоприятный прогноз в первую очередь определяется поражением легких и прогрессирующей дыхательной недостаточности.
Необходимость лечения нинтеданибом должна быть подтверждена в лечебном учреждении, занимающемся изучением ИЗЛ и имеющем опыт ведения таких пациентов. Нинтеданиб переносится удовлетворительно и обычно не вызывает тяжелые нежелательные реакции, поэтому препарат может применяться под наблюдением врача поликлиники. Био химические показатели целесообразно контролировать ежемесячно в течение первых трех месяцев после начала лечения, а затем ежеквартально.
Иннофил и его применение при лечении фиброза
С развитием косметологических услуг к лечению кожных заболеваний стали предъявляться все новые требования. К тому же со временем появились так называемые постпроцедурные пациенты. При их лечении от врача требуется особый подход к разработке косметологической программы. Она должна сопровождаться как стандартным протоколом подготовки к процедуре, так и специальной подготовительной терапией по усилению или разрушению/видоизменению уже существующего эффекта либо измененного состояния тканей. Ведь необходимо учитывать имеющиеся изменения в процессе мягкотканого птоза, которые обусловлены проведенными ранее хирургическими и косметологическими вмешательствами.
Что такое фиброз кожи?
Фиброз кожи – заболевание, характеризующееся ускоренным процессом выработки коллагена и разрастанием вторичных морфологических элементов, которые возникают после перенесенных травм, операций или воспалений. Эта болезнь все чаще встречается в косметологии. После деструкции кожа имеет очаговое патологическое изменение. Оно представляет собой разросшуюся соединительную ткань с несбалансированным распределением функциональных изменений. Степень фиброза вызвана соотношением синтеза и распада коллагена. Обратимость процесса зависит от состояния макрофагов и химической природы основного вещества.
Во врачебной практике нередко можно наблюдать пациентов с постпроцедурными фиброзными изменениями. Это могут быть фиброзные каналы, вызванные контурной пластикой, фиброзные каркасы, появившиеся после нитевого армирования, а также рубцовые изменения различного происхождения. Важно заметить, что в процессе старения возникает сформированный фиброз в виде спаек в местах гиподермальных и дермальных заломов. Причем он является непатологическим физиологическим изменением.
Сложности лечения фиброза
Традиционные способы лечения фиброза предполагают использование препаратов, которые имеют в своем составе компоненты, разрушающие соединительные волокна. Кроме того, применяется практика механической сепарации таких фиброзных изменений, как заломы со спайкой и рубцы. Использование препаратов в форме растворов в данном случае часто затруднено из-за их неконтролируемого распределения. Например, на практике клинических обращений нередко встречаются пациенты с осложнениями в виде различных атрофических изменений. Причем они вызваны применением растворов в патологической соединительной ткани.
Также важно понимание врача, что при работе с обычной сепарацией имеется дополнительный риск. Ведь у постпроцедурных пациентов она выполняется в местах, где уже был сформирован фиброз. Поэтому дополнительная травматизация часто приводит к активизации синтеза соединительной ткани и внутреннему рубцеванию.
Применение метода «ИННОФИЛЛ» для лечения фиброза
Эффективным решением для борьбы с фиброзными изменениями является метод «ИННОФИЛЛ». Он предполагает инвазивное воздействие иглы или RF-канюли на соединительную ткань, благодаря чему разрыхляется и видоизменяется состояние коллагеновых волокон. Процесс сепарации выполняется в режиме щадящего дефиброзирования. Причем на патологическую ткань оказывают не только механическое воздействие, но и радиоволну. В качестве ее проводника выступает игла или электрод-канюля. Метод «ИННОФИЛЛ» проводится инвазивно: проводник погружается на глубину залегания фиброза не только на дермальном, но и на гиподермальном уровне.
За счет радиоволны в диапазоне 1-2 МГц с помощью процедуры «ИННОФИЛЛ» в области воздействия формируется внутренняя температура до 50оC. Благодаря этому индуцируется проявление белка теплового шока (шаперона) HSP47 в фибробластах, что способствует оптимальной пространственной укладке белковых молекул, не вызывая коагуляции.
Механизм процесса метода «ИННОФИЛЛ»
Действие «ИННОФИЛЛА» происходит следующим образом:
Применение метода «ИННОФИЛЛ»
Метод радиоволнового дефиброзирования «ИННОФИЛЛ» является на данный момент единственным инвазивным способом лечения фиброза кожи и позволяет выполнять целый спектр задач:
Таким образом, «ИННОФИЛЛ» – это инновационный метод для борьбы даже со сложным фиброзом. Причем данный способ применяется далеко не во всех медицинских учреждениях. Специалисты центра косметологии «МАК» успешно используют «ИННОФИЛЛ» в своей врачебной практике, решая проблемы постпроцедурных пациентов с фиброзом кожи даже сложных форм.
Фиброз легких – симптомы, лечение фиброза после пневмонии
Фиброз легких — патологическое состояние, обусловленное замещением функциональной легочной ткани соединительнотканными элементами (рубцом). Формирующаяся плотная жесткая ткань не участвует в газообмене и нарушает работу органов. Пациенты в первую очередь жалуются на одышку. Это осложнение инфекционно-воспалительного процесса или самостоятельное заболевание, называемое фиброзирующим альвеолитом.
Диагностика проводится с помощью инструментальных и лабораторных процедур. Полное восстановление измененных тканей невозможно, но есть консервативные методы лечения.
Причины возникновения
Механизм формирования фиброзных очагов в легких обусловлен повреждением функциональной ткани под воздействием внутренних или внешних факторов. Фиброзное утолщение вокруг альвеол затрудняет газообмен и нарушает функции органа. Разнообразные токсины, вирусы, бактериальные клетки, медикаменты и методы лечения повреждают легочную ткань с последующим образованием рубца.
Для осуществления газообмена в альвеолы должен попадать воздух из окружающей среды. Вместе с необходимым организму кислородом в легкие проникают загрязняющие вещества, способные повредить альвеолы и вызвать воспаление. Это волокна асбеста, пыль, табачный дым, выхлопные газы и другие вещества. Хроническое загрязнение — фактор риска формирования рубца и нарушения дыхательной функции.
На фоне лечения
У некоторых пациентов на фоне проведения лучевой терапии по поводу рака легких или молочной железы признаки фиброза легочной ткани появляются через несколько месяцев или даже лет после проведения лечения. Тяжесть состояния зависит от области воздействия радиационного излучения, дополнительного применения химиотерапии и основной патологии. Лучевое воздействие зачастую вызывает обширное необратимое повреждение органа в качестве осложнения, поэтому врачи тщательно подбирают дозы и регулярно обследуют пациентов.
Вызывающие фиброз легких препараты:
Вероятность развития болезни на фоне медикаментозной терапии также зависит от дозировок и особенностей активного компонента.
Первичные заболевания
Фиброз легочной ткани — распространенное осложнение коронавирусной пневмонии. COVID-19 характеризуется проникновением вирусов в органы дыхания и возникновением выраженного воспалительного процесса. Определенная степень фиброза диагностируется у большинства пациентов по результатам компьютерной томографии. Также фиброз может быть осложнением полимиозита, системного заболевания соединительной ткани, системной красной волчанки, саркоидоза, склеродермии, пневмонии любой формы и ревматоидного артрита.
Фиброзирующий альвеолит, или идиопатический легочный фиброз, — первичное заболевание легких неизвестной этиологии, сопровождающееся замещением тканей рубцом. Патология постепенно прогрессирует по мере разрастания фиброзных участков и ухудшения газообмена. Пациенты жалуются на кашель, одышку и другие симптомы. Наследственность и неблагоприятные внешние воздействия относят к основным этиологическим факторам.
Факторы риска
Существуют следующие формы предрасположенности к развитию болезни:
При обнаружении такой болезни врачи изучают анамнез больного для обнаружения перечисленных факторов.
Симптомы фиброза легких
Одышка — главное проявление значительного замещения альвеол соединительнотканными компонентами. Нарушается процесс газообмена, из-за чего в крови снижается уровень кислорода. При идиопатической форме патологии одышка постепенно нарастает. Недуг усиливается во время физических и психоэмоциональных нагрузок.
Течение фиброза и тяжесть состояния могут значительно отличаться от пациента к пациенту. У некоторых людей развивается тяжелая форма патологии, негативно влияющая на качество и продолжительность жизни. Идиопатическая форма фиброза может прогрессировать несколько месяцев или лет. Реже наблюдается стремительное ухудшение симптоматики с появлением сильной одышки.
Диагностика
Для проведения обследования необходимо обратиться к пульмонологу. Врач изучает анамнез пациента и проводит аускультацию легких для обнаружения признаков патологии. Обнаружение факторов риска в анамнезе важно для последующей постановки диагноза. Главная задача — определить причину фиброза и оценить тяжесть состояния.
Инструментальные и лабораторные исследования:
Лечение фиброза после пневмонии
Восстановить утраченные альвеолы не получится, но грамотно подобранное консервативное лечение нормализует деятельность органов и устранит симптомы патологии. Схема лечения подбирается с учетом возраста, причины фиброза, клинического течения болезни и выраженности изменений. В качестве медикаментозной терапии пациентам назначают противовоспалительные и антифиброзные средства совместно с бронхолитиками и иммунодепрессантами. Если есть признаки инфекции, назначают препараты для устранения бактерий, вирусов или других возбудителей инфекции.
Кислородная терапия и физиотерапевтические процедуры благоприятно влияют на функцию легких. Пациенту требуется длительная реабилитация. Если консервативное лечение не помогает, а работа органов стремительно ухудшается, необходима трансплантация легких.


