Протеогликаны что это такое в медицине
Протеогликаны что это такое в медицине
• Протеогликаны состоят из центрального белкового «кора» (сердцевины), к которому присоединены длинные линейные цепи дисахаридов, называемые гликозаминогликанами (ГАГ)
• Цепи ГАГ несут отрицательный заряд. Это обеспечивает стержнеобразную жесткую форму протеогликанов, которая поддерживается за счет отталкивания зарядов
• Выступы, состоящие из цепей ГАГ, выполняют роль фильтров, ограничивающих проникновение в ткани вирусов и бактерий
• Протеогликаны поглощают воду, образуя гелеобразную структуру, которая поддерживает клетки в гидратированном состоянии и защищает ткани от избыточного гидростатического давления
• Протеогликаны способны связываться с различными компонентами внеклеточного матрикса, включая факторы роста, структурные белки и рецепторы, расположенные на клеточной поверхности
• Экспрессия протеогликанов зависит от типа клеток и регулируется в зависимости от стадии развития
Протеогликаны служат дополнением к структурным гликопротеинам внеклеточного матрикса (коллагену и эластину). В то время как структурные гликопротеины обеспечивают растягивающие усилия, протеогликаны гарантируют, что внеклеточный матрикс находится в состоянии гидратированного геля. Это необходимо для того, чтобы ткани могли противостоять силам сжатия.
Подобно другим гликопротеинам, которые в больших количествах экспрессируются на поверхности клеток, протеогликаны состоят из полипептидного кора или сердцевины (отсюда приставка протео-), к которому присоединяются сахара (гликаны). Известно более 40 различных коровых белков протеогликанов, и каждый содержит модульные структурные домены, которые могут связываться с такими компонентами внеклеточного матрикса, как углеводы, липиды, структурные белки, интегриновые рецепторы и другие протеогликаны.
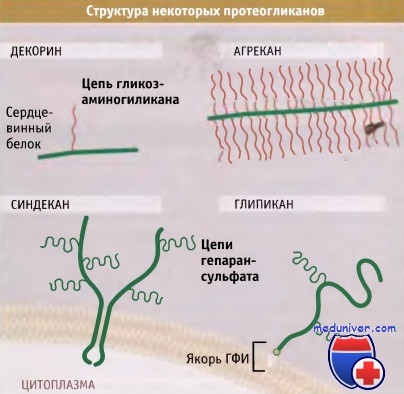
На рисунке ниже представлены различные типы протеогликанов. Большинство таких протеогликанов, как декорин и агрекан, выходят из клеток, однако два типа остаются связанными с мембраной. Так, представители синдека-нового семейства гликопротеинов содержат трансмембранный домен, и глипиканы присоединяются к мембране через гликозилфосфатидилинозитол (ГФИ).
Протеогликаны отличаются от гликопротеинов типом и расположением присоединенных к ним сахарных остатков. Сахара, присоединенные к протеогликанам, обозначаются термином гликозоаминогликаны (ГАГ). Они собраны в длинные линейные цепи повторяющихся остатков дисахаридов.
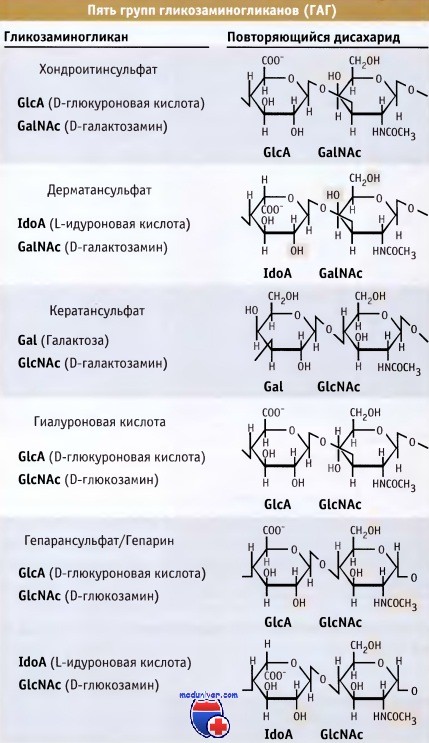
Эти цепи могут состоять из сотен сахарных остатков и достигать мол массы до 1000 кДа. Как показано на рисунке ниже, ГАГ подразделяются на пять классов, в зависимости от дисахаридов, которые они содержат. Все гликозоаминогликаны, кроме одного (гиалуроновой кислоты), могут связываться с белками, образуя протеогликаны. Все ГАГ содержат кислые и/или сульфатированные сахара, которые обусловливают их значительный отрицательный заряд.
На рисунке ниже представлены этапы синтеза протеогликанов. Сердцевинный белок образуется в гранулярном ЭПР. Все эти белки содержат сигнальные последовательности, которые направляют их в гранулярный ЭПР и большая часть которых представляет собой растворимые секретируемые белки, поступающие в просвет ЭПР. Синдеканы остаются встроенными в мембрану, поскольку содержат последовательность сигнала прекращения переноса. Глипикановые сердцевинные белки подвергаются модификации при добавлении гликозилфосфатидилинозитола, сахарного остатка связанного с липидами.
По мере того как сердцевинные белки продвигаются по секреторному пути, ферменты гликозилтрансферазы добавляют ксилозу, галактозу и глюкуроновую кислоту к остаткам серина и аспарагина. Тип сахарного остатка и его локализация определяется специальными последовательностями аминокислот в коровом белке. Присоединившиеся сахара служат сайтами дополнительного связывания таких углеводов, как N-ацетилглюкозамин, который формирует цепи ГАГ. Цепи ГАГ могут модифицироваться при действии ферментов, вызывающих перегруппировку структуры сахаров (эпимераз) или добавляющих к ним сульфатные группы (сульфотрансфераз).
Некоторые протеогликаны также содержат N- и О-связанные олигосахариды, типичные для гликопротеинов. В транс-Голъджи сети новосинтезированные протеогликаны подвергаются процессу сортировки, направляясь на регулируемый секреторный путь, и хранятся в секреторных гранулах до момента высвобождения при экзоцитозе. Различные сигналы, например увеличение давления, стимулируют секрецию протеогликанов.
К протеогликану могут быть присоединены от одного до более чем 100 больших ГАГ. Поскольку большая часть сахаров заряжена отрицательно, ГАГ взаимно отталкиваются. Если протеогликан содержит много ГАГ, то это приводит к тому, что сердцевинный белок принимает линейную стержнеобразную форму, а остатки ГАГ выдаются наружу. В результате строение зрелого протеогликана напоминает щетку для волос.
Такое строение придает протеогликанам особые свойства, которые помогают разобраться в свойствах внеклеточного матрикса. Во-первых, относительно жесткая структура способствует их функционированию в качестве структурного каркаса, поддерживающего форму тканей, в которых они находятся. Во-вторых, протеогликаны способствуют деятельности иммунной системы: щетинки ГАГ задерживают бактерии и вирусы во внеклеточной среде и снижают возможность инфицирования тканей. В-третьих, отрицательный заряд на цепях ГАГ притягивает катионы, которые, в свою очередь, притягивают молекулы воды, так что протеогликаны содержат достаточное количество влаги для образования геля.
Эти гели поддерживают гидратацию клеток и обеспечивают водное окружение, способствующее переносу между клетками небольших молекул. Гелевые структуры помогают тканям смягчать большие перепады давления и предотвращать их существенную деформацию. Такие перепады давления, например, могут происходить при травматических повреждениях или при интенсивных физических нагрузках.
В-четвертых, протеогликаны связываются с рядом других белков. Одной из наиболее важных групп таких белков являются факторы роста. Клетки секретируют эти факторы в кровоток, или они попадают в жидкие среды тканей и начинают циркулировать в организме. Как представлено на рисунке ниже, протеогликаны захватывают факторы роста и связывают их. Тем самым их концентрация во внеклеточном матриксе возрастает. Связывание также приводит к локализации факторов роста в специфических участках тканей и защищает их от деградации внеклеточными протеазами. В некоторых случаях такое концентрирование факторов роста необходимо для того, чтобы клетки могли их связать.
Таким образом, протеогликаны могут выполнять роль ко-рецепторов факторов роста и тем самым непрямым образом контролировать рост клеток в тканях. Факторы роста даже могут сохраняться в таком состоянии и высвобождаться позже, при деградации протеогликанов.
Протеогликаны также связываются с другими белками внеклеточного матрикса и участвуют в их сборке. Например, протеогликаны агрекан и декорин связываются с коллагеном. Как показано на рисунке ниже, агрекан образует крупные агрегаты с волокнами коллагена типа II, которые находятся в хряще. При образовании агрегатов молекулы агрекана посредством линкерных белков связываются с гиалуронаном. Декорин действует как спейсер между коллагеновыми волокнами и контролирует диаметр волокон и скорость их сборки. У мышей с нокаутом декоринового гена коллагеновые волокна имеют неправильную форму, и такие животные отличаются особенно непрочной кожей.
Экспрессия протеогликанов меняется в зависимости от стадии развития и от типа клеток. Например, в развивающемся курином эмбрионе агрекан экспрессируется, главным образом, в хрящевой ткани, и максимум экспрессии приходится на пятый день, когда происходит дифференцировка хондроцитов, клеток, образующих хрящевую ткань. Однако он также менее интенсивно экспрессируется в тканях развивающегося головного и спинного мозга, причем пик экспрессии приходится на 13-й день развития. Экспрессия таких протеогликанов, как агрекан, регулируется теми же факторами роста, которые связываются с протеогликанами. Это позволяет предполагать, что протеогликаны могут играть роль в регуляции своей экспрессии.
Сульфатные группы присоединяются к отмеченным остаткам дисахаридов. 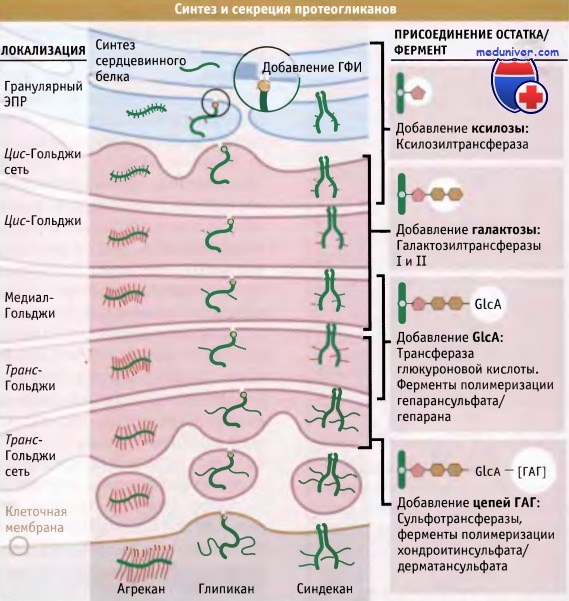
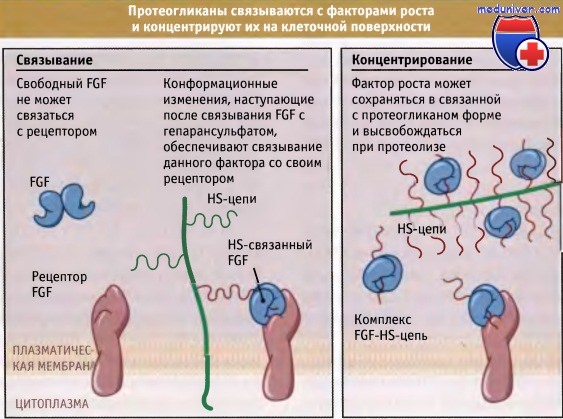
Эта модель иллюстрирует, каким образом гепарансульфат способствует связыванию фактора роста фибробластов (FGF) с клеточными рецепторами. 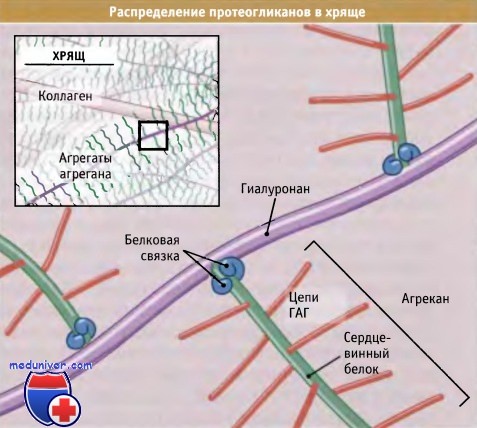
Агрекановые комплексы связываются с молекулами гиалуронана и притягивают воду, которая противодействует силам сжатия и действует как смазывающий агент.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Заместительная терапия специфичными протеогликанами в лечении алопеции. XV научно-практическая конференция «Трихологические болезни в ревматологии и другие междисциплинарные вопросы». Сателлитный симпозиум компании «Гленмарк»
Фолликулярные протеогликаны как базовый компонент цикличного роста волос
Как отметил доктор Омар Мильхем, медицинский директор компании Pharma Medico ApS (Лондон, Великобритания), потеря волос является значимой проблемой в силу ее распространенности и недостаточной эффективности лечения. Кроме того, традиционные методы терапии (финастерид, миноксидил, спиронолактон) могут сопровождаться развитием побочных эффектов, что ухудшает комплаентность. В отношении адъювантной терапии биотином, витаминными комплексами представлена недостаточная доказательная база, к тому же получены данные о том, что только в 2% случаев выпадение волос обусловлено дефицитом витаминов (рис. 1).
На сегодняшний день весьма перспективным направлением считается заместительная терапия протеогликанами – особая методика интенсивного насыщения организма специфичными белками протеогликанами.
В большинстве случаев причиной выпадения волос является нарушение цикла роста волос из-за снижения количества протеогликанов в структуре волосяного фолликула. Установлено, что для оптимальной модуляции нормального роста волос такие специфичные протеогликаны, как версикан, декорин и синдекан, должны присутствовать в определенных концентрациях как внутри волосяного фолликула, так и вокруг него.
Снижение содержания протеогликанов в волосяном фолликуле сопровождается развитием состояния, при котором угасает активность селективных протеогликанов дермального сосочка, что в свою очередь приводит к увеличению выпадения волос, ограничению их роста и снижению качества волос. Кроме того, одновременно уменьшается производство протеогликанов фибробластами. Фолликул, теряя протеогликаны, не может нормально функционировать, развивается фолликулярная гипогликания, приводящая к протеогликановой фолликулярной атрофии и миниатюризации волосяных фолликулов (рис. 2).
Восстановление содержания ключевых протеогликанов в волосяном фолликуле позволяет:
Ключевые протеогликаны, которые модулируют цикличность роста волосяных фолликулов, были выявлены в 1978 г. S.R. Waldstein и E. Thom. Это инициировало ряд исследований. Изучению эффективности заместительной терапии протеогликанами в стимулировании фазы анагена волосяного фолликула было посвящено свыше 100 работ. В 1986 г. был разработан натуральный комплекс протеогликанов для заместительной терапии – Marilex®, являющийся активным компонентом продукта Нуркрин.
В 1992 г. продукт Нуркрин стал применяться в Великобритании, затем в других странах мира.
Нуркрин неоднократно удостаивался престижных международных наград. Так, в 2012 г. он получил золотую медаль Всемирного общества трихологии как передовой метод лечения разных форм алопеций у женщин и мужчин, в 2020 г. – признание российской ассоциации «Профессиональное общество трихологов» (рис. 3).
Как было отмечено ранее, активным компонентом Нуркрина является натуральный комплекс Marilex®. Основанием для его разработки послужил тот факт, что для обеспечения терапевтического эффекта получить достаточное количество протеогликанов из дермы достаточно сложно. Проведена ферментативная экстракция специфического хряща рыб, в ходе которой были получены протеогликаны, которые имитировали протеогликаны кожи тела и головы человека. Сегодня в качестве активного компонента продукта Нуркрин используется комплекс Marilex® шестого поколения (Mark VI-Mark VIв). Данный комплекс характеризуется высоким соотношением специфичных протеогликанов, участвующих в сохранении здорового физиологического состояния человеческих волосяных фолликулов: версикана, декорина, синдекана.
Помимо комплекса Marilex® в состав продукта Нуркрин входят биотин и витамин С, восполняющие недостаток питательных веществ в волосяном фолликуле.
По мере восстановления оптимальной пороговой концентрации протеогликанов на фоне заместительной терапии уменьшается фолликулярная гипогликания, прекращается миниатюризация волосяных фолликулов, нормализуется число волос в фазе телогена. Продление фазы анагена позволяет сохранить активные фолликулы и восстановить рост волос.
Нуркрин может быть рекомендован для лечения разных форм алопеций. Поскольку восстановление естественного цикла роста волос требует времени, лечение проводится в течение шести месяцев с оценкой первого клинического эффекта уже через три месяца.
При потере волос по женскому типу в комплексе с продуктом Нуркрин можно использовать миноксидил наружно, плазмотерапию, негормональные антиандрогенные препараты. Для лечения облысения по мужскому типу Нуркрин может быть применен в сочетании с финастеридом и топическим миноксидилом.
Резюмируя вышесказанное, доктор О. Мильхем подчеркнул, что специфичные протеогликаны следует рассматривать как неотъемлемую часть процесса регулирования роста волосяного фолликула, а заместительную терапию протеогликанами (продуктом Нуркрин) – как оптимальную стратегию при лечении разных форм алопеций у женщин и мужчин.
Фармакологические аспекты метаболизма протеогликанов в тканях
Протеогликаны – сложные протеины, на 5–10% состоящие из белка с высокой степенью гликозилирования. По словам Александра Сергеевича ДУХАНИНА, д.м.н., профессора кафедры молекулярной фармакологии и радиобиологии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, особенностью протеогликанов также является высокое содержание углеводов, на долю которых приходится 90–95% общей массы. Углеводные цепи обеспечивают защиту белковой матрицы, что позволяет протеогликанам оставаться устойчивыми к расщеплению в проксимальном отделе желудочно-кишечного тракта и сохранять свои биологически активные свойства.
Синдеканы, ассоциированные с мембраной, служат низкоаффинными рецепторами большого количества факторов роста, защищающими их от разрушения. Речь, в частности, идет об эпидермальном факторе роста (Epidermal Growth Factor – EGF), факторе роста фибробластов (Fibroblast Growth Factor – FGF), факторе роста эндотелия сосудов (Vascular Endothelial Growth Factor – VEGF). Наряду с буферной протективной активностью синдеканы участвуют в активации факторов роста за счет контроля их димеризации. Доказано, что синдеканы модулируют Wnt-сигнальный каскад, который начинается на уровне мембраны. Таким образом реализуется двухуровневая регуляция цикла развития волосяного фолликула: рецепторная и пострецепторная.
Следует отметить, что синдекан 1 преимущественно определяется в эпителиальных клетках волосяного фолликула.
Распад протеогликанов происходит в межклеточном матриксе соединительной ткани под действием разных ферментов, прежде всего протеиназ и гликозидаз. В проксимальных отделах желудочно-кишечного тракта протеогликаны устойчивы к действию гидролаз, но чувствительны к бактериальным ферментам толстой кишки.
Далее профессор А.С. Духанин кратко охарактеризовал основные отличия протеогликанов от ксенобиотиков (табл. 1).
Ксенобиотики (ингибиторы 5-α-редуктазы, PPAR-γ, ингибиторы янус-киназ и др.) представляют собой чужеродные для организма химические соединения, имеющие, как правило, одну мишень действия, в то время как протеогликаны являются природными биоактивными молекулами.
Отличие биоактивных протеогликанов от ксенобиотиков также заключается в плейотропности действия первых, их возможности влиять сразу на несколько мишеней.
Первый этап – фармацевтический предполагает переход действующего вещества в растворимую форму. Протеогликаны (активный комплекс Marilex®) продукта Нуркрин являются высокогидрофильными, заряженными и сульфатированными молекулами, поэтому они легко высвобождаются из матрицы таблетки.
Третий этап – фармакодинамический. Установлено, что функциональная роль протеогликанов в регуляции цикла роста волосяного фолликула заключается в индукции и поддержании анагена, а также в модификации иммунного ответа.
Многочисленные данные свидетельствуют, что повышение концентрации фолликулярных протеогликанов в результате заместительной терапии Нуркрином может усилить пролиферацию и выживаемость основных популяций фолликулярных клеток и, таким образом, нивелировать патологические изменения механизмов инициации и поддержания фазы анагена.
Прямой противовоспалительный эффект терапии протеогликанами, выделенными из хрящей глубоководных рыб, был верифицирован в нескольких экспериментальных моделях.
В эксперименте in vitro показано, что повышение экспрессии версикана обеспечивает защиту от индуцированного перекисью водорода апоптоза. В клетках, экспрессировавших версикан, отмечалось усиление адгезии и жизнеспособности в ответ на окислительный стресс по сравнению с контрольными образцами. Эта функция критична для поддержания жизнеспособности активных фолликулярных клеток в течение фазы анагена.
Специфичные протеогликаны, выделенные из морепродуктов, могут служить потенциальным пребиотическим комплексом, что было подтверждено в исследовании in vivo. Протеогликаны вызывали достоверное повышение популяции сахаролитических бактерий, продуцирующих короткоцепочечные жирные кислоты из сложных гликанов. Данный класс жирных кислот относится к эффективным противовоспалительным средствам, защищающим кишечный барьер и регулирующим иммунную систему.
«На сегодняшний день пероральная заместительная терапия с помощью таких специфичных протеогликанов, как версикан, синдекан и декорин, является фармакологически обоснованной. Именно этими протеогликанами богат единственный в России запатентованный комплекс Marilex®, содержащий специфичные протеогликаны и входящий в состав продукта Нуркрин», – констатировал профессор А.С. Духанин.
Заместительная протеогликановая терапия при разных видах алопеций
Совместное выступление Аиды Гусейхановны ГАДЖИГОРОЕВОЙ, д.м.н., главного научного сотрудника Московского научно-практического центра дерматовенерологии и косметологии (МНПЦДК), главного врача клиники «Институт красивых волос», президента российской ассоциации «Профессиональное общество трихологов», и Юлии Юрьевны РОМАНОВОЙ, младшего научного сотрудника МНПЦДК, врача-дерматолога клиники «Институт красивых волос», было сфокусировано на обосновании возможностей заместительной протеогликановой терапии в восстановлении жизненного цикла волос и практических аспектах комплексного лечения разных видов алопеций с использованием продукта Нуркрин.
По словам А.Г. Гаджигороевой, на сегодняшний день уже не вызывает сомнений тот факт, что фолликулярные протеогликаны играют структурную, функциональную и регулирующую роль в развитии волосяных фолликулов, обеспечивая нормальный баланс сигнальных молекул. Экспрессия уникального состава протеогликанов волосяного фолликула, который отличается от состава дермального окружения, подтверждена данными гистологических исследований. Установлено, что распределение этих специализированных протеогликанов значительно меняется в течение цикла роста волос.
А.Г. Гаджигороева уточнила, что сначала изменения будут касаться синтеза протеогликанов и лишь по мере его снижения можно наблюдать определенные морфологические изменения в волосяном фолликуле.
В частности, синдекан 1 регулирует различные циклические процессы в волосяных фолликулах на рецепторном и пострецепторном уровнях. В фазе анагена синдекан 1 обнаруживается в эпителиальном отделе наружного корневого влагалища и сосочке. В фазе телогена его количество уменьшается.
Далее Ю.Ю. Романова дала характеристику еще одному ключевому протеогликану – декорину. Данный протеогликан богат лейцином. Он высоко экспрессирован в области bulge. Декорин блокирует действие различных эпидермальных факторов роста с отрицательными эффектами в отношении роста волос, в частности TGF-β1, ингибирующего рост волос и участвующего в стимулировании местного синтеза андрогенов, а также EGF, участвующего в реализации андрогенетической алопеции.
Экспрессия декорина с возрастом снижается, равно как и количество кератин-15-позитивных клеток, которые принято считать стволовыми клетками волосяного фолликула. Выявлено, что удаление декорина в моделях in vitro способствовало дифференцировке стволовых клеток. И напротив, если стволовые клетки фолликула культивировались на чашках с покрытием декорина, их состояние становилось еще более недифференцированным.
Установлено, что значительная концентрация протеогликанов внутри и вокруг фолликулярного эпителия и дермального сосочка в фазе анагена необходима для обеспечения иммунологической толерантности волосяного фолликула.
Вторым участником сохранности иммунной привилегии волосяных фолликулов в фазе анагена считаются хондроитин-протеогликаны. Данные протеогликаны препятствуют активации цитотоксических клеток, формируя защитный барьер вокруг луковицы.
Первоначально фолликулярная гипогликания вызывает гипотрофию фолликулов, не влияя на их макроскопический размер. В случае ее длительного течения происходит макроскопическое истощение протеогликанов и, как следствие, развитие протеогликановой фолликулярной атрофии и таких процессов, как грубая дисфункция ключевых фолликулярных клеток и нарушение цикла волос, а также видимый структурный распад дермальных сосочков, ведущий к постепенной миниатюризации волос.
Далее докладчики проанализировали современные терапевтические подходы к лечению разных типов облысения, начав с андрогенетической алопеции.
Согласно современной теории, наиболее значимым фактором развития андрогенетической алопеции является негативное влияние на волосяные фолликулы 5-α-редуктазы и дигидротестостерона. Однако данный фактор в большей степени имеет значение у мужчин.
Как отметила А.Г. Гаджигороева, повышение концентрации фолликулярных протеогликанов с помощью приема продукта Нуркрин с запатентованным комплексом Marilex® может нивелировать влияние половых гормонов на более низком уровне, чем рецептор. Этот подход способен прервать порочный круг дефицита экстрацеллюлярного матрикса, приводящий к клеточной дисфункции, завершающейся протеогликановой фолликулярной атрофией и уменьшением размеров фолликулов. Нуркрин может быть использован в качестве заместительной протеогликановой терапии андрогенетической алопеции у мужчин и женщин, рекомендуемая схема приема – по одной таблетке два раза в день в течение четырех – шести месяцев (табл. 2).
Докладчики поделились собственным опытом применения продукта Нуркрин в комплексной терапии андрогенетической алопеции.
В клиническом примере, представленном А.Г. Гаджигороевой, пациент с андрогенетической алопецией получал комплексное лечение миноксидилом 5% два раза в день наружно в сочетании с введением обогащенной тромбоцитами плазмы (Platelet-Rich Plasma – PRP) и приемом продукта Нуркрин по одной таблетке два раза в день в течение пяти месяцев. Подобный комплексный подход оказался эффективным в плане предотвращения выпадения волос и возобновления их роста (рис. 4).
В комплексном лечебном подходе, продемонстрированном в клиническом примере Ю.Ю. Романовой, применение лосьона на основе стемоксидина 5% наружно в сочетании с плазмотерапией один раз в месяц и заместительной протеогликановой терапией Нуркрином по одной таблетке два раза в день привело к нормализации цикла роста волос уже через три месяца лечения.
Ю.Ю. Романова, затронув проблему сенильной алопеции, проследила наличие связи между ее развитием и снижением уровня протеогликанов. Версикан и декорин принимают важное участие в регуляции синтеза коллагена. Установлено, что с возрастом уменьшается не только синтез протеогликанов, но и их качество. Снижение синтеза протеогликанов может быть связано с возраст-ассоциированным снижением эстрогенов: у мышей, подвергнутых овариоэктомии, толщина дермы и экспрессия декорина были снижены. Аналогичные изменения наблюдались при блокировании рецептора эстрогенов.
Морфологические изменения при сенильной алопеции характеризуются истончением дермы с изменением коллагеновых и эластиновых волокон, уменьшением количества и размера долек сальных желез, эккриновых потовых желез, снижением количества кровеносных сосудов, нарушением соотношения «веллусные/терминальные» волосы, уменьшением диаметра фолликулов и стержней. По словам Ю.Ю. Романовой, с учетом плейотропного действия на клетки волосяного фолликула и декорин, и версикан можно рассматривать как весьма перспективный метод заместительной протеогликановой терапии у таких пациентов. Это подтверждает и собственный клинический опыт использования продукта Нуркрин в комплексном лечении сенильной алопеции пациентки 65 лет с фиброзом и выраженным истончением волос (рис. 5).
Заместительная терапия протеогликанами может быть востребована при лечении ишемической алопеции, поскольку гипоксия является важным фактором нарушения роста волос. Исследования продемонстрировали, что при культивировании клеток волосяных фолликулов при различном парциальном давлении ишемия ассоциировалась с замедлением роста волос. Известно, что протеогликаны обладают цитопротективным эффектом, поэтому их применение можно рассматривать как потенциальную терапевтическую стратегию при ишемической алопеции (рис. 6, клинический пример Ю.Ю. Романовой).
Применение заместительной протеогликановой терапии обоснованно также при проведении регенеративных медицинских процедур.
В подтверждение Ю.Ю. Романова представила участникам симпозиума клинический случай комплексного использования методов регенеративной медицины в сочетании с заместительной терапией Нуркрином при андрогенетической алопеции (рис. 7).
Пациентке с выраженной андрогенетической алопецией, сопровождающейся фиброзом кожи, было назначено комплексное лечение, которое включало стромально-васкулярную активацию роста волос однократно, лосьон стемоксидина 5% наружно один раз в день и продукт Нуркрин по одной таблетке два раза в день в течение двух месяцев. Синергичный комплексный подход позволил быстро добиться активации роста здоровых волос.
Подводя итог, А.Г. Гаджигороева отметила, что таргетная заместительная протеогликановая терапия в комплексных методиках возможна:
Открытие роли протеогликанов как ключевых факторов в биологии волосяного фолликула позволило создать уникальный продукт Нуркрин, содержащий эксклюзивный комплекс Marilex®. Комплекс Marilex® является природным источником ключевых протеогликанов, участвующих в регуляции роста волос. По оценкам экспертов, использование продукта Нуркрин у пациентов, страдающих выпадением волос разной этиологии, позволяет нормализовать концентрацию протеогликанов в волосяных фолликулах и таким образом восстановить естественный цикл роста волос. В настоящее время продукт Нуркрин успешно применяется в 46 странах, в том числе в России, в качестве заместительной протеогликановой терапии при разных видах выпадения волос.