Протеаза что это такое
Когда желудку и кишечнику не хватает ферментов
Основным инструментом пищеварения являются ферменты, именно они выполняют всю основную работу. Логично, что при их недостатке процесс пищеварения нарушается, и организм начинает нам сообщать о проблемах, сигнализируя различными симптомами. Такие привычные всем симптомы как изжога, тяжесть в животе, боль, метеоризм, диарея или запор – являются прямым указанием на проблемы с пищеварением.
Ферменты поджелудочной железы – виды и функции
Пора узнать, что представляют собой ферменты, и как они влияют на пищеварение. Ферменты поджелудочной железы – это белковые комплексы или катализаторы, основной задачей которых является расщепление питательных веществ на простые, легкоусвояемые соединения. Таким образом, организм легко усваивает все необходимые элементы и витамины.
Какие ферменты вырабатывает поджелудочная железа и какие у них функции?
Особо интересно то, что организм может регулировать выработку тех или иных ферментов в зависимости от характера потребляемой пищи. То есть, если вы потребляете много хлебобулочных изделий, то упор в выработке будет сделан на амилазе, если потребляется жирная пища, то поджелудочная железа отправит в кишечник больше липазы.
Кажется, что работа полностью налажена, и сбоев быть не может. Но сбои случаются и достаточно часто: слишком тонкий механизм работы, который легко нарушить. Даже большой приём пищи с преобладанием жиров может сломать систему, и поджелудочная железа не сможет обеспечить нужное количество ферментов.
Появление проблем с пищеварением
Мы выяснили, что проблемы с пищеварением могут возникать из-за недостатка ферментов. Существует два основных механизма, при которых организму не хватает ферментов поджелудочной железы. В первом варианте проблема с выработкой ферментов кроется в самой поджелудочной железе, т.е. сам орган функционирует неправильно.
Во втором варианте нарушаются условия, при которых ферменты могут правильно работать. Подобное возможно в результате изменения кислотности среды кишечника, например, при воспалении или при изменении стандартной температуры окружения (36-37° С). Воспалительный процесс в кишечнике может возникать при различных состояниях: кишечные инфекции, аллергические реакции (пищевая аллергия, атопический дерматит).
Основные признаки нехватки ферментов поджелудочной железы
Выявить недостаток ферментов достаточно просто. Ключевыми симптомами являются тяжесть после еды, чувство распирания в животе и дискомфорт в животе. Нередко эти симптомы сопровождаются вздутием, урчанием, метеоризмом, диареей. Чаще всего такие симптомы могут возникать в рядовых ситуациях: при употреблении тяжелой, жирной пищи или при переедании, когда удержаться от множества вкусных блюд попросту не удалось. В этом случае не стоит бояться неполадок с поджелудочной железой или других заболеваний ЖКТ. Поджелудочная железа просто не справляется с большим объемом работы, и ей может потребоваться помощь.
Если нехватка ферментов и проблемы с пищеварением сохраняются длительное время, то это не остается незаметным для организма. Симптомы могут усугубляться и носить уже не эпизодический, а регулярный характер. Постоянная диарея дает старт авитаминозу, могут развиваться: белково-энергетическая недостаточность и обезвоживание во всем организме. Может наблюдаться значительное снижение массы тела. Помимо этого при тяжелых стадиях могут наблюдаться следующие симптомы недостатка ферментов поджелудочной железы 8 :
Поддержание пищеварения и лечение ферментной недостаточности
При проблемах с пищеварением могут помочь ферментные препараты (чаще они называются препаратами для улучшения пищеварения), основная задача которых компенсировать нехватку собственных ферментов в организме. Не зря такая терапия называется «ферментозаместительная». Критически важно, чтобы ферментный препарат максимально точно «имитировал» физиологический процесс.
На сегодняшний момент существуют различные препараты для улучшения пищеварения. Как же ориентироваться в многообразии средств и сделать правильный выбор?
Эффективный ферментный препарат должен соответствовать следующим критериям 5,6 :
Протеаза что это такое
• При нормальном развитии и заживлении ран клетки регулярно должны осуществлять процессы деградации и замещения внеклеточного матрикса
• Белки внеклеточного матрикса разрушаются под действием специфических протеаз, которые секретируются клетками в неактивной форме
• Эти протеазы активируются только в тех тканях, где это необходимо. Обычно активация происходит за счет протеолитического распада пропептида, входящего в состав протеазы
• Семейство металлопротеиназ матрикса (ММП) относится к наиболее представительному классу протеаз. Они способны разрушать все основные классы белков внеклеточного матрикса
• ММР активируют друг друга, отщепляя пропептиды. Это приводит к каскадной активации протеаз и к быстрой деградации белков внеклеточного матрикса
• ADAM представляют собой еще один класс протеаз, деградирующих внеклеточный матрикс. Эти протеазы также связываются с интегриновыми рецепторами внеклеточного матрикса, тем самым способствуя регуляции его сборки и его разрушению
• Чтобы защитить себя от нежелательной деградации, клетки секретируют ингибиторы протеаз
• Мутации в гене матриксной металлопротеиназы-2 у человека служат причиной многочисленных аномалий скелета. Это свидетельствует о значимости процессов перестройки внеклеточного матрикса в процессе развития
До сих пор мы обсуждали роль компонентов внеклеточного матрикса в регуляции функционирования клеток в многоклеточных организмах. Однако в организме также продуцируются протеазы, разрушающие внеклеточный матрикс. Зачем организму удалять компоненты, которые обеспечивают его целостность? Простейший ответ на этот вопрос состоит в том, что, подобно самим клеткам, внеклеточный матрикс должен обладать пластичностью, т. е. проявлять способность реагировать на изменения окружающей среды. Например, внеклеточный матрикс, окружающий развивающийся нейрон, не может быть того же типа, который необходим для поддержания жизнедеятельности нейрона после завершения дифференцировки, и должен замещаться при созревании этой клетки. Или внеклеточный матрикс, который образуется в раннем эмбриогенезе в местах перепонок между пальцами на руках и ногах, на поздних стадиях не требуется. Поэтому перепонки, включая матрикс, удаляются.
Вместе с тем, в результате различных травм и инфекций ткани повреждаются, и в процессе заживления раны поврежденные участки ткани деградируют и вместо них образуются новые. Кроме этого, небольшие пептиды, образующиеся при действии протеаз на белки внеклеточного матрикса, способствуют миграции клеток и, таким образом, стимулируют заживление ран. Эти пептиды также стимулируют миграцию опухолевых клеток. Наконец, при деградации внеклеточного матрикса иногда высвобождаются другие полезные компоненты, например факторы роста и гормоны, которые «попадаются» в сетку, образованную белками внеклеточного матрикса. На рисунке ниже представлены возможные субстраты действия протеаз, находящиеся во внеклеточном пространстве.
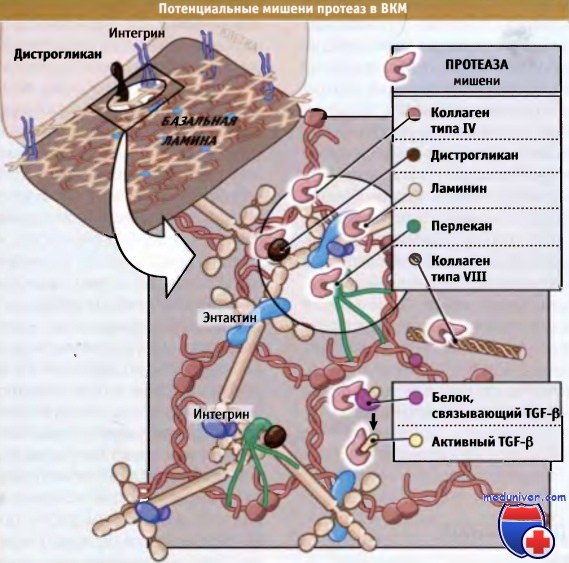
Иногда при деградации белков ВКМ образуются фрагменты, обладающие функциональной активностью.
Известно два семейства протеаз внеклеточного матрикса: металлопротеиназы матрикса (ММП) и ADAM (дезинтегрин и металлопротеиназа). Хотя представители обоих семейств разрушают белки внеклеточного матрикса, протеазы ADAM также участвуют в адгезии клеток, зависимой от интегрина.
У человека идентифицировано по меньшей мере 20 металлопротеиназ матрикса (ММП), и в зависимости от структуры и субстратной специфичности они подразделяются на шесть групп.
Все металлопротеиназы матрикса (ММП) имеют несколько общих свойств:
• Наличие сигнального пептида, который направляет протеазы из клеток, в которых они образовались.
• Присутствие в каталитическом домене высококонсервативного сайта связывания ионов цинка.
• Существование N-концевого пропептида, который действует подобно «рукоятке» в нашей аналогии карманного ножа: эта часть молекулы складывается, образуя ковалентную связь с ионом цинка, находящимся в каталитическом сайте. При этом ингибируется активность протеазы. При активации протеазы этот пропептид отщепляется с помощью фурина или близкого по свойствам фермента.
• Наличие домена гемопексина, который определяет субстратную специфичность протеазы.
• Присутствие «шарнирного» домена, с высоким содержанием пролина, связывающего каталитический домен с гемопексиновым.
Мембранные металлопротеиназы матрикса (ММП) на карбоксильном конце также содержат трансмембранный домен, который закрепляет белок в плазматической мембране.
Обычно каскад протеолиза начинается с захвата активированной протеазы в сайте деградации. Например, в кровяном сгустке активируется протеаза плазмин, и для того, чтобы начать процесс реформирования ткани при заживлении раны, эта протеаза активирует несколько ММП, расположенных рядом.
Семейство ADAM содержит около 30 протеаз, которые присутствуют во многих организмах, и в 15 из них обнаружен консервативный каталитический сайт, связывающий цинк. К числу протеаз, содержащих этот сайт, относятся ММП и многие другие протеазы. Протеазы ADAM также содержат пропептид (или продомен), который функционирует, как и у ММП, т. е. является ингибитором каталитического сайта. Эти протеазы могут разрушать множество внеклеточных белков, включая белки внеклеточного матрикса. Они также содержат домен, который находится в белках, называемых дизинтегринами, которые связываются с основным интегриновым рецептором тромбоцитов и ингибирует их агрегацию в момент образования кровяного сгустка. Дизинтегриновый домен в ADAM, вероятно, функционирует как субстрат интегрина, тем самым обеспечивая взаимную адгезию клеток. Таким образом, хотя функции ADAM разнообразны, они служат регуляторами целостности структуры внеклеточного матрикса.
Активность ММП и ADAM блокируется растворимыми белками, которые называются тканевыми ингибиторами металлопротеаз (ТИМП). Клетки выделяют ТИМП для того, чтобы защитить себя (и окружающий матрикс) от деградации активированными протеазами. Иногда клетки секретируют белки внеклеточного матрикса, протеазы, которые их деградируют, а также их ингибиторы. При этом между процессами сборки матрикса и его деградации устанавливается состояние равновесия, очень чувствительное к изменению активности этих факторов. Когда система становится разбалансированной, как в случае опухолевого роста, происходит быстрая деградация тканей, способствующая выходу в кровоток опухолевых клеток. Поэтому ТИМП интенсивно исследуются в качестве потенциальных противоопухолевых средств.
Поскольку для связывания с большинством белков внеклеточного матрикса клетки используют интегриновые рецепторы, деградация этих белков может существенно отразиться на таких функциях, связанных с интегрином, как адгезия, миграция и передача сигналов. В некоторых случаях разрушение молекул внеклеточного матрикса приводит к высвобождению функционально активных фрагментов протеолиза, которые маскированы в интактных молекулах. Например, согласно одной из современных моделей, адгезия к фибриллярному коллагену, которая осуществляется посредством интегрина а2b1 индуцирует экспрессию ММП-1 в ряде клеток. Эта протеаза атакует коллаген, демаскируя такие новые сайты связывания, как последовательность Arg-Gly-Asp (RGD), которая связывается с другим интегриновым рецептором, avb3. В свою очередь, связывание с avb3 стимулирует сигнальный путь, включающий МАР киназы, что приводит к усилению экспрессии ММП-2. Образующаяся ММП-2 активируется при действии ММП-1 и завершает деградацию коллагеновых волокон.
При этом происходит не только удаление коллагена как субстрата клеточной адгезии, но и высвобождаются его фрагменты, способные стимулировать миграцию клеток из области деградации.
Показательным примером, иллюстрирующим важность ММП, служит существование группы наследственных заболеваний, объединяемых в группу «болезней потери костной массы». Эти болезни известны под названием синдрома Винчестера, синдрома Торга, синдрома нодулярного-артропатического-остеолиза и синдрома Аль-Акиль Севаири. У больных проявляются многочисленные нарушения строения скелета, связанные с утратой костей, включая резорбцию костей запястья и лодыжки, появление выраженных признаков артрита, сильного остеопороза и заметных нарушений структуры костей лица. Причина развития этих заболеваний связана с наследованием мутантных форм гена ММП-2 по аутосомно-рецессивному типу, что приводит к образованию неактивных форм этой протеиназы.

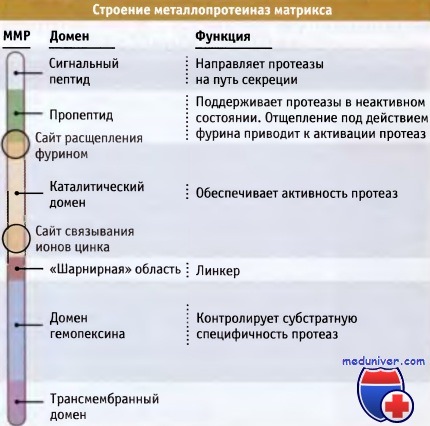
Представлена «усредненная» форма ММР, иллюстрирующая относительное расположение этих сайтов.
У некоторых ММР отсутствует один или несколько сайтов, однако у всех есть пропептид и каталитический домен. 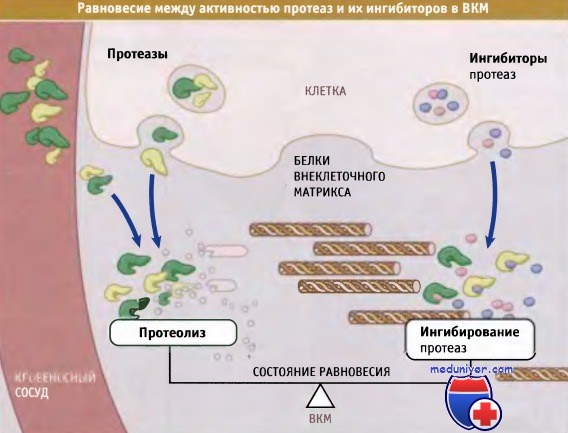
Они также секретируют ингибиторы протеаз.
Это позволяет контролировать в тканях процессы деградации и перестройки внеклеточного матрикса. 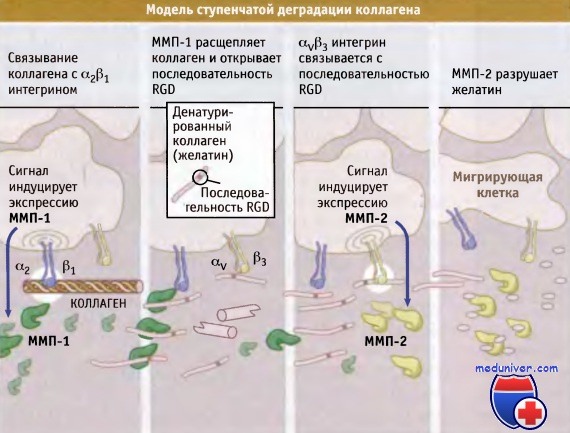
При действии ММП-1 структура коллагена меняется, и открываются сайты связывания для avb3 интегрина.
Адгезия посредством avb3 индуцирует экспрессию ММП-2 и дальнейшую деградацию коллагена.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Роль энзимов неживотного происхождения при нарушениях пищеварения различной этиологии

В статье представлен обзор литературы об особенностях и преимуществах препаратов пищеварительных ферментов неживотного происхождения, т. е. препаратов, в состав которых входят растительные, микробные или фунгальные ферменты. Патогенетически обоснованы заб
The review of literature on features and advantages of drugs of digestive enzymes of non-animal origin, i.e., drugs which include vegetative, microbial or fungal enzymes, is presented in the article. Diseases and conditions upon which such drugs are prescribed have been pathogenically substantiated. Digestion violations — the reasons, clinical features, ways of their correction are presented in detail. Special attention is paid to the dietary supplement, which includes not only amilo-, proteo- and lipolytic enzymes, but also cellulose, and lactase, and also phytoadditives which positively influence digestion processes.
Все-таки странно, насколько наш разум и чувства
подчинены органам пищеварения.
Джером Клапка Джером
Под пищеварением понимается переработка с помощью ферментов сложных веществ (белков, жиров, углеводов) в простые для их последующего всасывания. Процесс переработки осуществляется по мере продвижения пищевых масс по желудочно-кишечному тракту (ЖКТ). В ротовой полости пища смешивается со слюной, обладающей амилазной активностью, и подвергается механической обработке. Значение желудка состоит в депонировании и разжижении пищи под действием соляной кислоты и пепсина, денатурировании и начальном гидролизе белков, создании пищевого комка для эвакуации в двенадцатиперстную кишку.
Основные гидролитические процессы происходят в тонкой кишке, где пищевые вещества расщепляются до мономеров, всасываются и поступают в кровь и лимфу. Процесс переработки пищевых веществ в тонкой кишке имеет три последовательных взаимосвязанных этапа, объединенных A. M. Уголевым (1967) в понятие «пищеварительно-транспортный конвейер» [1]: полостное пищеварение, мембранное пищеварение, всасывание.
Полостное пищеварение включает формирование химуса и гидролиз пищевых компонентов до олиго- и мономерного состояния. Ключевая роль в полостном пищеварении отводится ферментам поджелудочной железы (ПЖ). Образующиеся в процессе полостного гидролиза короткие цепи белков, углеводов и жиров окончательно расщепляются с помощью механизмов мембранного пищеварения. Ферменты ПЖ, адсорбированные на нутриентах, продолжают играть активную роль и на этом этапе, который разворачивается в пристеночном слое слизи. Заключительный гидролиз нутриентов происходит на наружной мембране энтероцитов с помощью кишечных гидролаз.
После этого наступает последний этап — всасывание, т. е. перенос расщепленных компонентов пищевых веществ из просвета кишки во внутреннюю среду организма.
Наиболее частые жалобы пациентов при расстройстве пищеварения на диспепсические проявления. В переводе с древнегреческого «диспепсия» означает «несварение» (от «δυσ» — отрицание, «π?ψις» — пищеварение). Все варианты диспепсии в клиническом отношении делят на желудочную, кишечную и билиарную. К симптомам желудочной диспепсии относят тяжесть, дискомфорт в эпигастрии, раннее насыщение, отрыжку, изжогу, тошноту, рвоту, снижение аппетита. Проявлениями кишечной диспепсии считают метеоризм, флатуленцию, урчание, диарею, запоры, неустойчивый стул. Синдром билиарной диспепсии характеризуется снижением аппетита, ощущением чувства горечи во рту, нарушениями стула (запорами, поносами или их чередованием), метеоризмом, чувством дискомфорта, тяжести, распирания в правом подреберье [2].
Нарушение пищеварения является проявлением основного заболевания, например, органических и функциональных заболеваний билиарной системы, гастритов, дуоденитов, пептических язв, панкреатитов, гепатитов и циррозов печени, нарушений состава кишечной флоры, абдоминального ишемического синдрома. Нарушение пищеварения может быть обусловлено различными факторами. Как функциональные, так и органические поражения ЖКТ сопровождаются расстройством их двигательной, всасывающей, секреторной или выделительной функции, нарушая взаимосвязанный и сложный процесс переваривания пищи. К основным синдромам нарушения пищеварения относятся мальдигестия, мальабсорбция и мальнутриция. Если речь идет о расстройстве полостного пищеварения, т. е. нарушении гидролиза в просвете пищеварительного тракта, то это состояние называют мальдигестией, а если о нарушении мембранного пищеварения и всасывания, то мальабсорбцией и мальнутрицией. Традиционно выделяются несколько групп основных причин формирования этих синдромов [3]:
При описанном автором многообразии причин нарушения пищеварения чаще всего расстройства обусловливаются болезнями ПЖ с прогрессирующей недостаточностью ее внешнесекреторной функции (первичная панкреатическая недостаточность). В клинической практике также часто встречается вторичная или относительная внешнесекреторная недостаточность ПЖ.
Несмотря на приведенные выше органические причины нарушения пищеварения и диспепсии, значительно чаще встречаются функциональные заболевания ЖКТ, а также банальные диетические погрешности и «банкетные» переедания. При последних, как правило, нарушается соотношение основных компонентов обычного питания — преобладают жиры (животные и растительные) и углеводы, в том числе неперевариваемая клетчатка. В процесс пищеварения также часто «вмешивается» алкоголь, который в малых дозах (до 50 мл 40%) стимулирует пищеварительный процесс, а в более высоких дозах резко нарушает его, усугубляя диспепсию [4].
При всех приведенных нарушениях пищеварения кроме лечения, направленного на нормализацию моторики, уменьшение болевого синдрома, устранение микробной контаминации, восстановление микробного пейзажа кишечника, восстановление витаминно-минерального статуса, необходима ферментная терапия. Впервые ферментные препараты (ФП) в медицинской практике стали использоваться более 100 лет назад. Пищеварительные ферменты в настоящее время широко применяются при различной гастроэнтерологической патологии. В настоящее время в клинической практике используется большое число ферментных препаратов, характеризующихся различной комбинацией компонентов, энзимной активностью, способом производства и формой выпуска. При выборе ферментного препарата в каждом конкретном случае врач прежде всего должен обращать внимание на его состав и активность его компонентов [5].
Терапевтические возможности ферментов обнаруживают значительные различия, в зависимости от их животного или растительного происхождения. Сегодня «животные» ферменты в основном производятся из поджелудочных желез свиней. Они содержат самую высокую концентрацию энзимов среди всех ферментных препаратов, известных до настоящего времени. Эти ферменты использовались с начала 1900-х годов и были очень эффективными при определенных условиях. Некоторые ферменты получают из растений, включая бромелайн из ананаса, папаин из папайи и нанокиназу из ферментированной сои. Другие растительные ферменты «выращивают» из различных видов грибов и плесени, иногда в очень высоких концентрациях. Вопреки распространенному мнению, такие ферменты не содержат каких-либо остатков веществ, из которых они были выращены.
Ферментная промышленность, существующая сегодня, образовалась в конце XIX века. В 1894 г. доктор Джокити Такамину получил патент США 525 823 — «Способ получения диастатического фермента», в котором подробно описан процесс и извлечение амилаз из гриба Aspergillus oryzae (А. oryzae). Его запатентованный продукт Taka-diastase для улучшения пищеварения продавался компанией Parke, Davis & Company во всем мире. К 1932 г. д-р Е. Howell создал компанию в штате Иллинойс по производству дополнительных ферментов для замены тех, которые были уничтожены при приготовлении пищи и консервировании в пищевой промышленности. В обзоре д-ра Е. Howell 1947 г. «Состояние пищевых ферментов при пищеварении и метаболизме» цитируется использование папаина в качестве помощи пищеварению и пользы от «расстройств пищеварения самых разных видов». Грибковая амилаза аналогично цитируется в этом трактате как используемый в терапии заболеваний пищеварительного тракта источник липазы и других экстрактов ПЖ [6].
Ферменты из гриба А. oryzae изучались в многочисленных исследованиях, в которых оценивалась их роль в поддержании здорового пищеварения. Кроме того, исследования на людях предполагали, что протеолитические ферменты, полученные из гриба А. oryzae, могут играть роль в противовоспалительной и фибринолитической терапии. Ферменты являются относительно стабильными при нагревании и активны в широком диапазоне рН (рис.). Это важно, потому что большинство ферментов дезактивируются в желудочной кислоте. Описываемые ферменты синтезируются из гриба, но не содержат грибкового остатка, являясь непатогенными. Современные технологии фильтрации позволяют этим грибковым ферментам быть эффективными и безопасными для человека.
Любые пероральные ферменты должны выдерживать кислотность желудка, чтобы быть терапевтически эффективными. Большинство ферментов, полученных из животных, должны быть покрыты энтеросолюбильным покрытием, чтобы защитить их от кислотности желудка. Энтеросолюбильное покрытие действительно обеспечивает некоторую защиту от кислоты, но оболочка часто повреждается в желудке или полностью не растворяется в тонкой кишке. Это влияет на эффективность ферментного препарата. С другой стороны, грибковые протеазы удивительно устойчивы к кислоте и не требуют энтеросолюбильного покрытия [8].
Ферментированные микроорганизмы с многолетним использованием в пищевых продуктах, микробные ферменты были специально выбраны на основе уникальных характеристик каждого фермента. Другим ограничивающим фактором применения ферментов животного происхождения, таких как панкреатин, является отсутствие разнообразия. С другой стороны, грибковые ферментные смеси могут быть изготовлены на заказ для удовлетворения различных ферментативных потребностей пищеварения. Это возможно, потому что источники грибов содержат не только протеазы, амилазы и липазы, но также могут включать в себя множество других ферментов, таких как тилактаза, целлюлаза, лактаза и т. д. [9].
В целом грибковые ферменты превосходят панкреатин в отношении диапазона рН, кислотной стабильности, активности, разнообразия и безопасности. В дополнение к вышеуказанным преимуществам грибковые ферменты подходят для вегетарианской диеты.
По словам доктора Mark Percival (1985), пероральное добавление пищеварительных ферментов непосредственно перед или во время приема пищи может помочь пищеварению. Несмотря на то, что большинство дополнительных ферментов являются лабильными и дезактивируются при воздействии кислоты в желудке, Mark Percival считает, что некоторые из ферментов будут оставаться активными, если их принимают с пищей или непосредственно перед едой. Mark Percival говорит, что «ферменты физически защищены» при еде и позволяют проявлять ферментативную активность уже в желудке. рН играет важную роль в ферментативной активности, поэтому ферменты, полученные из Aspergillus, «могут быть весьма полезными, поскольку они кажутся чрезвычайно стабильными даже при воздействии кислой среды». Доктор Edward Howell добавляет, что, поскольку активность фермента начинается еще до проглатывания пищи, можно принимать содержимое этого фермента без капсулы с пищей, чтобы немедленно начать процесс пищеварения [10].
Температура окружающей среды играет решающую роль в активности ферментов. Фунгальные ферменты лучше всего работают в температурном диапазоне 95–105 °F (35,0–40,56 °C). При нормальной температуре тела 98,6 °F ферменты грибкового происхождения идеальны.
Для обеспечения липолиза животной липазой необходимо присутствие желчных кислот для активации фермента и эмульгации жиров. Поэтому традиционные ФП могут быть недостаточно эффективны при дефиците желчных кислот в ДПК (гепатогенная панкреатическая недостаточность при холестатических заболеваниях печени, при гипомоторике желчного пузыря, после холецистэктомии; в ряде случаев такой дефицит патогенетически обусловлен низкой желудочной секрецией). Существенное преимущество липазы микробного происхождения — отсутствие необходимости ее активации желчными кислотами [11].
В начале 1970-х гг. исследователи из Университета Иллинойса Leveille и соавт. обнаружили, что активность ферментов в тканях становится слабее с возрастом. Leveille проводил эксперименты на крысах и обнаружил, что в возрасте 18 месяцев («старый возраст» для крыс), активность ферментов на фоне бесферментной диеты сократилась более чем на 20% от уровня, который наблюдался в возрасте одного месяца. Е. Howell соглашается, что «чем более активно молодой организм отказывается от своих ферментов, тем быстрее достигается состояние ферментного дефицита или старости». Согласно Е. Howell, мы живем долго, а наше самочувствие определяется нашим ферментным потенциалом. Е. Howell ссылается на исследование Meyer и его коллег в Michael Reese Hospital в Чикаго, в котором сообщалось, что количество ферментов в слюне молодых людей в 30 раз выше, чем у людей старше 69 лет [12].
Характеристика отдельных пищеварительных ферментов
Амилаза (выделяется в активном состоянии) выполняет строго определенную функцию — расщепление полисахаридов. Начинает «работать» в полости рта, далее в желудке, в симбиозе с ферментами тонкой кишки мальтазой, инвертазой и лактазой расщепляет полисахариды в кишечнике. Именно действие этого фермента определяет качество катаболизма углеводов. Дефицит амилазы физиологичен в первом полугодии жизни. При этом ребенок не в состоянии переваривать крахмал. Обычно амилаза достигает нормальной активности к 9-му месяцу жизни. Возможен генетически детерминированный дефицит амилазы (ген локализован в первой хромосоме). При дефиците амилазы появляются следующие симптомы: непереносимость пищи, богатой углеводами; частый, рыхлый, объемный стул (кашицеобразный, водянистый — при избытке крахмала в пище); гипотрофия; изолированное снижение активности амилазы в панкреатическом соке, в сочетании с нормальной активностью липазы и трипсина при холецистокинин-секретиновой стимуляции нормальными значениями интрадуоденального рН; высокая контаминация в кишечнике условно-патогенной микробной флоры; синдром мальабсорбции; похудение.
Протеазы (активируются в просвете ДПК) являются гидролитическими ферментами, способными расщеплять связи пептидов и белков и восстанавливать полезные бактерии в кишечнике. К ним относятся пепсин, трипсин, эластаза и карбоксипептидазы. Первые два вещества расщепляют белки с крупной структурой молекул, а карбоксипептидазы преобразовывают пептиды с низкомолекулярной структурой в аминокислоты. Кроме того, выделяется химотрипсин, расщепляющий белки, которые остались после воздействия трипсина. Дефицит протеаз приводит к кашицеобразному (зловонному) стулу; выраженной креаторее, умеренной стеаторее; нарушению физического развития; прогрессирующей гипотрофии; гипопротеинемическим отекам (вплоть до анасарки); анемии, нейтропении, ретикулоцитозу, гипоплазии костного мозга; тотальной атрофии ворсин кишечника.
Липаза (активируется в просвете ДПК) расщепляет нейтральный жир на жирные кислоты и глицерин. В процессе эмульгации желчью липазы взаимодействуют с другими ферментами для многоступенчатого преобразования жиров в жирные кислоты. Дефицит липаз обуславливает стеаторею, которая является критерием тяжести экзогенной панкреатической недостаточности.
В организме человека нет ферментов, расщепляющих растительную клетчатку, — целлюлазы и гемицеллюлазы, их «производят» представители кишечной микрофлоры. Клетчатка не расщепляется в тонкой кишке, поэтому в неизменном виде поступает в толстую кишку, где гидролизуется ферментами микроорганизмов (целлюлазой), которые разрушают клеточные оболочки. Целлюлаза и гемицеллюлаза повышают пищевую ценность зерновых культур, фруктов и овощей. Связывают токсины и холестерин в пищеварительном тракте за счет освобождения растворимых волокон, стимулируя таким образом пищеварение, перистальтику кишечника и рост полезной микрофлоры. Нормальная микрофлора в слепой кишке расщепляет и сбраживает в сутки 300–400 грамм клетчатки с образованием короткоцепочечных жирных кислот, глюкозы и газов, которые также стимулируют моторику кишечника и дефекацию.
Основными кишечными ферментами, участвующими в пристеночном гидролизе углеводов, являются α-глюкозидазы (мальтаза, трегалаза и др.), лактаза, глюкоамилаза, инвертаза и др.
Лактаза — один из основных ферментов тонкой кишки, улучшающий усвоение молочных продуктов. Расщепляет лактозу (молочный сахар) до глюкозы и галактозы. При отсутствии или дефиците лактазы в кишечнике усиливаются процессы брожения. Возникновение осмотической (бродильной) диареи связано со скоплением в просвете дистальных отделов тонкой кишки и в толстой кишке нерасщепленного, осмотически активного дисахарида — лактозы (содержание лактозы в кале — более 2 г%) и продуктов его бактериальной ферментации. Это может стать причиной вздутия живота и кишечных спазмов. Принятие лактазы устраняет непереносимость молочного сахара (лактозы), который находится в очень многих продуктах питания. Но исключить все продукты, содержащие лактозу, сложно, так как она является очень распространенным компонентом многих из них. Заместительная терапия ФП на основе лактазы является принципиальным методом лечения гиполактазии [4].
Глюкоамилаза представляет собой фермент, который катализирует высвобождение D-глюкозы с невосстановленных концов крахмала или молекул родственного олиго- и полисахарида, играет важную роль во внутриклеточном обмене гликогена и образовании энергии. Она синтезируется многими микроорганизмами и образуется в животных тканях, особенно в печени, почках, плаценте, кишечнике и т. д.
Пектиназа — фермент, расщепляющий пектин, полисахарид, который встречается в клеточных мембранах растений, в основном во фруктах. Нормализует работу пищеварительной системы, способствует росту полезной микрофлоры кишечника и улучшает пассаж пищеварительного химуса по ЖКТ.
Изолированные дефициты ферментов поджелудочной железы и тонкой кишки встречаются, как правило, при генетических заболеваниях.
Но наиболее распространенной причиной проблем с пищеварением, как уже указывалось выше, являются погрешности в питании — прием слишком большого количества пищи и ее «тяжелый» химический состав. Нередко обильное застолье сопровождается приемом значительных доз алкоголя, нарушающего работу поджелудочной железы. В этом случае, несмотря на адекватное выделение ферментов и их нормальную активность, в организме человека возникают симптомы, подобные гастрогенной недостаточности (табл.).
Пищеварительная недостаточность опасна тем, что в полости кишечника остается часть поступивших продуктов питания в неизмененном виде, что приводит к изменению внутренней среды кишечника (сдвиг кислотности, химического состава, осмотического давления). Это вызывает повреждение слизистой оболочки кишечника и развитие патогенной микрофлоры — формирование синдрома избыточного бактериального роста в тонкой кишке.
В конце 2017 г. на российском рынке появилась биологически активная добавка Гастромед, которая по своему составу способна восполнять дефицит пищеварительных ферментов как при панкреатической, гастро- и энтерогенной недостаточности, так и при погрешностях в диете, в том числе банкетном переедании. В состав этого продукта входят 75 мг Natenzym D — энзимы, которые представляют собой пищеварительный ферментный комплекс из продуктов дрожжевого брожения Aspergillus oryzae, описанные выше в настоящей статье, и три фитокомпонента. Ферментная часть биологически активной добавки Гастромед представлена следующими энзимами:
Фиточасть включает в себя:
Фитокомпоненты, входящие в состав биологически активной добавки Гастромед, характеризуются следующими свойствами.
Горечавка желтая содержит горькие иридоидные гликозиды генциопикрин, генциин, амарогентин, амаросверин, амаропанин, генциакаумол, трисахарид генцианозу, алкалоид генцианин, генциостерин, аскорбиновую кислоту, флавоноиды, катехины, микроэлементы молибдена, селена, бора. Горькие вещества, содержащиеся в корнях и корневищах горечавки, стимулируют секрецию и моторную функцию желудочно-кишечного тракта, усиливают аппетит, улучшают пищеварение и усвоение пищи.
Корни одуванчика обыкновенного содержат тритерпеновые соединения, стерины, холин, никотиновую кислоту, никотинамид, каучук, смолы, воск, инулин, жирное масло, органические кислоты (олеаноловая, линолевая, пальмитиновая и др.). Одуванчик относится к лекарственным растениям, содержащим горечи. Применяют его для возбуждения аппетита и улучшения пищеварения. Рефлекторное действие препаратов одуванчика осуществляется путем раздражения вкусовых рецепторов языка и слизистой оболочки ротовой полости, что ведет к возбуждению пищевого центра, а затем к усилению секреции желудочного сока и секреции пищеварительных желез. Биологически активные вещества одуванчика лекарственного обладают также желчегонным, диуретическим, спазмолитическим и слабительным свойствами. Инулин, который содержит корень одуванчика, является пребиотиком. Его успешно ферментируют бифидобактерии толстой кишки, стимулируя свой рост и метаболическую активность. В свою очередь нерасщепленная часть инулина выводится из организма, «захватив» с собой продукты распада, холестерин, токсины и прочие вредные вещества.
Плоды-семянки расторопши пятнистой содержат около 32% жирного масла, флавоноиды, среди них кверцетин, смолы, слизь, витамин К, следы алкалоидов, биогенные амины (тирамин, гистамин), флавонол-лигнаны: силибин, силидианин, таксифолин, силихристин. В отечественных и зарубежных литературных источниках описаны следующие фармакологические эффекты лекарственных форм из расторопши пятнистой: улучшающие пищеварение, антиоксидантный, антитоксический, гемостатический, гепатопротекторный, дезинтоксикационный, желчегонный, противовоспалительный, ранозаживляющий, репаративный, слабительный, тонизирующий, холекинетический, холесекретический [13, 14].
Таким образом, Гастромед, который является оригинальной комбинацией семи ферментов и экстрактов трав, может быть назначен в составе комплексной терапии пациентам с легким течением хронического панкреатита при нормальных результатах фекального эластазного теста, при кишечной диспепсии различной этиологии, сахарном диабете, синдроме раздраженной кишки, для подготовки к рентгенологическому или ультразвуковому исследованию. Также показанием для назначения биологически активной добавки Гастромед является первичная (врожденная) и вторичная (вследствие заболеваний тонкой кишки) лактазная недостаточность. И конечно, Гастромед будет необходим людям, соблюдающим различные диеты или при переедании.
Литература
Е. Ю. Плотникова, доктор медицинских наук, профессор
ФГБОУ ВО КемГМУ МЗ РФ, Кемерово
Роль энзимов неживотного происхождения при нарушениях пищеварения различной этиологии/ Е. Ю. Плотникова
Для цитирования: Лечащий врач № 1/2019; Номера страниц в выпуске: 56-61
Теги: пищеварение, нарушения, фитодобавки, пищеварительные ферменты

.gif)
.gif)