Простаплант или простагут форте что лучше
Простагуд-Форте в терапии доброкачественной гиперплазии предстательной железы: патогенетический подход?
С. Х. Аль-Шукри, И. В. Кузьмин
Кафедра урологии Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова
Цель исследования: оценить эффективность комбинированного фитопрепарата простагутфорте у больных с ДГПЖ, клинически проявляющейся симптомами нижних мочевых путей. Пациенты и методы: простагут-форте назначали 86 больным с ДГПЖ (средний возраст 59,3 ± 3,4 года) в виде монотерапии по 1 капсуле (280 мг) 2 раза в сутки на протяжении 6 месяцев. Результаты исследования показали эффективность применения простагут-форте у больных с ДГПЖ. На улучшение симптоматики к концу 1-го месяца лечения указали 68 (79,1%) больных, к концу 3-го месяца — 72 (83,7 %) больных, а концу 6-го месяца — 76 (88,4 %) больных. В указанные сроки уменьшение суммы баллов по шкале I-PSS составило соответственно — 31,9 %, 38,6 % и 41 %. Субъективное улучшение сопровождалось улучшением показателей, характеризующих отток мочи из мочевого пузыря. К окончанию лечения максимальная скорость потока мочи выросла в среднем на 30,8 %, а объем остаточной мочи уменьшился на 48,4 %. Достоверного изменения размеров предстательной желзы и уровня ПСА в процессе лечения не отмечено. Наиболее быстрый эффект наблюдали в первый месяц терапии. Заключение: назначение простагут-форте в виде монотерапии способствует уменьшению интенсивности клинических проявлений ДГПЖ.
Ключевые слова: доброкачественная гиперплазия предстательной железы; простагут-форте.
Введение
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является наиболее распространенным заболеванием у мужчин старше 50 лет. На ее долю приходится более трети всех регистрируемых заболеваний в этой возрастной группе [1].
В современной урологии под термином ДГПЖ обозначают несколько различающихся понятий. Во-первых, выделяют гистологическую ДГПЖ. На микроструктурном уровне ДГПЖ представляет собой гиперплазию железистых и стромальных клеток предстательной железы. Установлено, что гистологические признаки ДГПЖ практически отсутствуют у мужчин в возрасте до 30 лет, редки у пациентов в возрасте от 30 до 50 лет, однако у мужчин старше 50 лет частота их обнаружения прогрессивно увеличивается. Так, ДГПЖ выявляют у 42 % мужчин в возрасте от 51 до 60 лет, у более 70 % — в возрасте от 61 до 70 лет и почти у 90 % — в возрасте от 81 до 90 лет [4].
Для практических врачей значительно большее значение имеет так называемая клиническая ДГПЖ. Необходимо отметить, что это понятие не тождественно термину гистологическая ДГПЖ. Клиническую ДГПЖ наблюдают у значительно меньшего числа пациентов, чем гистологическую.
Клинически ДГПЖ проявляется ирритативными и обструктивными симптомами, получившими общее название симптомы нижних мочевых путей (СНМП). В этой связи важно подчеркнуть, что значимость ДГПЖ обусловлена не высокой распространенностью ее гистологической формы, а развитием связанных с ней клинических проявлений, в первую очередь инфравезикальной обструкции (ИВО). Именно нарушение оттока мочи из мочевого пузыря ответственно за появление клинических симптомов и развитие тяжелых осложнений заболевания. Поэтому лечебные мероприятия при ДГПЖ должны быть направлены в первую очередь на восстановление оттока мочи из мочевого пузыря.
Длительное время основным методом лечения ДГПЖ являлся оперативный. Однако в последние десятилетия в связи с активным внедрением в клиническую практику медикаментозной терапии хирургическое лечение применяют все реже и только на поздних стадиях заболевания. Лекарственную терапию получают 85–90 % больных ДГПЖ, и только 10–15 % подвергаются оперативным вмешательствам [21]. В настоящее время для лекарственной терапии больных ДГПЖ применяют ингибиторы 5-α-редуктазы, блокаторы α-1-адренергических рецепторов, препараты растительного и биологического происхождения. Общепризнано, что медикаментозная терапия ДГПЖ должна быть патогенетически обоснована.
Вопросам изучения патогенеза ДГПЖ посвящены сотни научных исследований, но до сих пор многие принципиальные вопросы развития заболевания остаются неразрешенными. На сегодняшний день достоверно известно, что развитие гистологической ДГПЖ связано со старением мужского организма и изменениями баланса половых гормонов [16]. Основной причиной усиления пролиферации клеток предстательной железы является увеличение содержания в ней дигидротестостерона (ДГТ). ДГТ является активным метаболитом тестостерона и образуется из него с помощью фермента 5αредуктазы. Ингибирование 5α-редуктазы приводит не только к прекращению дальнейшего роста простаты, но и к уменьшению ее размеров.
Размер предстательной железы играет важную роль в развитии клинических проявлений болезни — выраженность СНМП и ИВО напрямую связана со степенью гиперплазии. Так, у мужчин с объемом предстательной железы более 50 см3 в 5 раз чаще выявляют среднюю и тяжелую степень СНМП и в 3 раза чаще выраженную ИВО, чем у пациентов с объемом простаты менее 50 см3 [13]. Таким образом, препараты, способные уменьшать размер простаты, в частности, ингибиторы 5α-редуктазы, могут не только снижать степень ИВО, но и уменьшать выраженность ирритативных симптомов. Другая группа часто используемых препаратов для лечения ДГПЖ, альфа-адреноблокаторы, также способствуют уменьшению выраженности ирритативных и обструктивных симптомов посредством расслабления гладких мышц уретры, шейки мочевого пузыря и простаты, не изменяя при этом размеров предстательной железы.
Правомерность гипотезы о гормональной природе развития ДГПЖ не подлежит сомнению. Однако некоторые факты указывают на более сложный характер патогенеза этого заболевания. И главным из таких необъяснимых фактов является отсутствие прямой корреляции между степенью увеличения простаты и содержанием в ней ДГТ [23]. Это указывает на наличие наряду с гормональными и других факторов, влияющих на появление и прогрессирование ДГПЖ. В последние годы появились доказательства, что вторым важнейшим патогенетическим фактором развития ДГПЖ является хроническое воспаление [18, 19]. Хроническое воспаление предстательной железы, то есть хронический простатит, традиционно считается заболеванием молодых мужчин. Однако для пациентов старшего возраста эта проблема также весьма актуальна.
Так, у мужчин в возрасте до 50 лет частота подтвержденного простатита только в 2 раза больше, чем у мужчин старше 50 лет [20]. При этом у мужчин старшей возрастной группы достаточно часто простатит сочетается с ДГПЖ. Результаты репрезентативного исследования, выполненного в США, показали, что у 57,2 % из 5053 больных с хроническим простатитом имелась ДГПЖ, а у 38,7 % из 7465 больных с ДГПЖ — хронический простатит [6]. У больных с ДГПЖ выявлена корреляционная связь между присутствием гистологических признаков воспаления в простате и выраженностью у них клинической симптоматики, оцениваемой по шкале I-PSS [17]. Следовательно, снижение интенсивности воспаления должно приводить к клиническому улучшению у больных ДГПЖ. Это предположение может объяснить механизм клинического действия при ДГПЖ противовоспалительных лекарственных средств и ряда фитопрепаратов [5].
Обнаружено, что наличие хронического простатита в молодом возрасте может быть фактором риска развития ДГПЖ позднее. Проведенные исследования показали, что ДГПЖ развивается в 2,4 раза чаще у пациентов, у которых ранее диагностировали хронический простатит [22]. Таким образом, наличие хронического простатита можно рассматривать как своего рода ранний маркер дальнейшего развития ДГПЖ. Каким же образом хроническое воспаление может способствовать развитию ДГПЖ? На сегодняшний день известно следующее. При воспалении в ткани простаты образуются инфильтраты, состоящие в основном из Т-клеток и макрофагов. В этих воспалительных инфильтратах продуцируются цитокины (ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-15 и гамма-интерферон), которые усиливают пролиферацию клеток предстательной железы, в частности, фибробластов. Кроме того, граничащие с очагами воспаления клетки простаты по неясным причинам гибнут, и их место занимают участки стромальной гиперплазии [8, 9, 10, 12]. Подобное влияние воспаления на пролиферацию ткани простаты связывают с возрастным ослаблением иммунной системы, что наряду с измененным гормональным статусом способствует повреждению популяции супрессорных клеток, приводя к постепенной инфильтрации простаты лимфоцитами и запуская каскад событий, ведущий к развитию ДГПЖ [11].
Таким образом, исходя из патогенеза заболевания, лекарственный препарат для медикаментозного лечения ДГПЖ должен обладать антиандрогенным, противовоспалительным и иммуномодулирующим эффектами. В этой связи патогенетически обоснованным представляется использование при лечении больных с ДГПЖ препарата простагут-форте.
Последний представляет собой комбинацию двух растительных экстрактов: каждая капсула простагутфорте содержит 160 мг экстракта плодов пальмы Сабаль и 120 мг экстракта из корней крапивы. Простагут-форте имеет несколько значимых фармакологических эффектов. Антиандрогенное действие препарата связано с ингибированием ферментов ароматазы и 5α-редуктазы, что, в свою очередь, препятствует образованию из тестостерона ДГТ, способствующего росту предстательной железы. Противовоспалительный эффект обусловлен ингибированием основных звеньев каскада арахидоновой кислоты и синтеза простагландинов и лейкотриенов с последующим уменьшением проницаемости сосудистой стенки и улучшением микроциркуляции в пораженном органе. Иммуномодулирующее действие определяется подавлением аутоиммунного воздействия на ткань предстательной железы при воспалительных процессах, а также снижением пролиферации активных лимфоцитов [5].
За последние несколько лет выполнен ряд исследований, указавших на возможность применения простагута в лечении больных с ДГПЖ.
Применение простагута у больных с ДГПЖ достоверно по сравнению с плацебо уменьшало выраженность симптоматики ДГПЖ, оцениваемой по шкале I-PSS [2; 14]. В исследовании U. Engelmann и соавт. (2006) было проведено сравнение результатов длительного, в течение 60 недель, применения простагут-форте и тамсулозина. Уменьшение выраженности СНМП под влиянием этих двух препаратов было примерно одинаковым [7].
Н. А. Лопаткин и соавт. (2007) сообщили о результатах плацебо-контролируемого исследования эффективности простагута-форте у 257 пациентов с умеренными или выраженными СНМП вследствие ДГПЖ. Авторы назначали больным простагут-форте или плацебо в первые 24 недели, следующие 24 недели проводили только наблюдение, и затем в течение 48 недель все пациенты опять принимали простагут-форте. К концу наблюдения за пациентами выраженность симптоматики ДГПЖ, оцениваемой по шкале I-PSS, уменьшилась в среднем на 53 %, максимальная скорость потока мочи увеличилась на 19 %, а количество остаточной мочи снизилось на 44 %. Переносимость простагутфорте была хорошая и ни один из пациентов не был исключен из исследования вследствие побочных эффектов терапии [15].
Опубликованы результаты применения простагут-форте в течение 90 дней в виде монотерапии у 31 больного с ДГПЖ [3]. Авторы отметили уменьшение выраженности СНМП уже к 30-м суткам от начала приема препарата. К концу лечения зарегистрировано достоверное снижение суммы баллов по шкале I-PSS, увеличение скорости потока мочи, снижение объема остаточной мочи, а также уменьшение объема предстательной железы. Ни у одного из 31 больных в процессе лечения простагут-форте не было отмечено нежелательных явлений.
Задачей настоящего исследования явилось изучение эффективности и переносимости препарата простагут-форте у больных с ДГПЖ при длительном его применении.
Методы обследования и характеристика больных
Под наблюдением в клинике урологии СанктПетербургского государственного медицинского университета им. акад. И. П. Павлова находились 86 больных с ДГПЖ, клинически проявлявшейся СНМП. Критериями включения в исследования были умеренная и выраженная симптоматика заболевания по шкале I-PSS (более 8) и умеренная или легкая степень ИВО (Qmax менее 12 мл/c и объем остаточной мочи более 50 мл).
Мы не включали в исследование больных, которые имели другие, кроме ДГПЖ, возможные причины для расстройства мочеиспускания (камни и опухоли мочевого пузыря, стриктура уретры и др.), острые или в активной фазе хронические инфекции нижних мочевых путей и половых органов, подозрение на нейрогенный характер нарушений мочеиспускания, уровень ПСА выше 4,0 нг/мл. Кроме того, критериями невключения в исследование было наличие показаний к оперативному лечению ДГПЖ — острая задержка мочеиспускания в анамнезе или наличие на момент осмотра выраженной инфравезикальной обструкции, критериями которой считали Qmax менее 4,0 мл/с и объем остаточной мочи более 200 мл. В исследовании также не участвовали пациенты, ранее оперированные по поводу ДГПЖ или других заболеваний предстательной железы и нижних мочевых путей.
Средний возраст пациентов был 59,3 ± 3,4 года. Всем наблюдаемым нами больным назначали простагут-форте по 1 капсуле 2 раза в сутки на протяжении 6 месяцев. Каждая капсула препарата содержала 160 мг экстракта плодов пальмы Сабаль и 120 мг экстракта корней крапивы. Никаких других лекарственных препаратов для лечения симптомов, связанных с ДГПЖ, пациенты в этот период не получали.
До начала лечения, в конце 1-го, 3-го и 6-го месяцев терапии всем пациентам проводили комплексное обследование, включавшее в себя оценку выраженности симптоматики с помощью анкеты I-PSS, урофлоуметрию, ультразвуковое измерение объема остаточной мочи и объема предстательной железы. До начала и в конце лечения исследовали уровень ПСА. Переносимость простагут-форте оценивали по наличию и тяжести побочных эффектов лечения.
Таблица 1. Результаты лечения больных доброкачественной гиперплазией предстательной железы простагут-форте (n = 86)
Современные возможности медикаментозного лечения доброкачественной гиперплазии ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2].
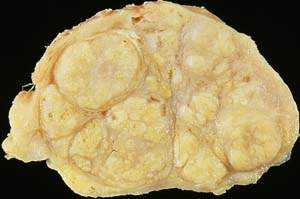 |
| Рисунок 1. Доброкачественная гиперплазия предстательной железы (макропрепарат) |
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2]. Около 80% мужчин старше 80 лет страдают этим заболеванием. Другая статистика свидетельствует, что из всех заболеваний, которым подвержены мужчины старше 50 лет, на долю доброкачественной гиперплазии простаты приходится 36% [1]. Эти сведения настолько общеизвестны, что ухудшение качества мочеиспускания часто рассматривается как естественное явление.
Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям. При значительно выраженной инфравезикальной обструкции, как правило, прибегают к хирургическому вмешательству. Оперативное лечение по поводу ДГПЖ показано 30% больных в возрасте от 50 до 80 лет [4]. Однако в последние годы все большую популярность завоевывает медикаментозная терапия доброкачественной гиперплазии предстательной железы. Это, с одной стороны, объясняется вполне логичным желанием врача и пациента по возможности избежать операции, с другой — развитием представлений о патогенезе расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы.
До недавнего времени патогенез расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы рассматривали с позиции классических представлений о механической инфравезикальной обструкции и развитии вторичных структурно-функциональных изменений детрузора (компенсация, декомпенсация). За последние два десятилетия получены принципиально новые данные о природе повышенного внутриуретрального сопротивления. Его перестали отождествлять исключительно с механическим сдавлением шейки мочевого пузыря и задней уретры. Обнаружен динамический компонент обструкции, который состоит в повышении тонуса указанных анатомических структур за счет активности a-адренорецепторов. Появились также иные трактовки происхождения ирритативных симптомов. Их считают проявлением первичного нестабильного мочевого пузыря и не связывают напрямую с обструкцией [5].
Результаты нашей работы свидетельствуют, что при ДГПЖ клиническая симптоматика развивается вследствие недостаточности энергетического метаболизма и гипоксии детрузора в условиях повышенного уретрального сопротивления [3]. Об этом свидетельствуют:
Причины нарушений энергетического метаболизма и функций детрузора крайне многообразны. В частности, к таким нарушениям могут привести повышение активности симпатической нервной системы, расстройства органного кровообращения, авитаминоз (группа В), хронические заболевания дыхательной и сердечно-сосудистой систем, влияние приема ряда фармакологических препаратов, угнетающих дыхательную цепь, и, естественно, обструктивные нарушения уродинамики и т. д. Весьма важно, что нарушения гипоксического характера в гладкомышечной ткани могут иметь и первичный митохондриальный генез (первичные нарушения энергетического метаболизма детрузора [3].
Необходимо отметить, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность).
Подобное представление патогенеза расстройств мочеиспускания открывает широкие возможности для фармакотерапии. Сокращения и расслабления детрузора можно достичь с помощью средств метаболической терапии, прямого улучшения снабжения детрузора кислородом и т. д. Наиболее значимые расстройства основных функций мочевого пузыря все же опосредованы расстройствами кровообращения. И если процесс обратим, то до или после хирургического вмешательства можно существенно влиять на функциональное состояние мочевого пузыря с помощью вазоактивных препаратов, к которым в первую очередь относятся a1-адреноблокаторы.
При определении критериев отбора пациентов для медикаментозной терапии ДГПЖ мы воспользовались рекомендациями IV Международного консультативного комитета по ДГПЖ.
Основу настоящего исследования составили собственные клинические наблюдения за 1724 пациентами (средний возраст 61,4 года), страдающими ДГПЖ и получавшими различные варианты медикаментозного лечения. Нами применялись препараты всех групп, использующихся в настоящее время для лечения ДГПЖ: a-адреноблокаторы, блокаторы 5-a-редуктазы, препараты растительного происхождения и их комбинации. Схемы проведенного лечения и характеристика групп пациентов приведены в табл. 1.
Из наиболее многочисленной и популярной сегодня группы препаратов для медикаментозного лечения ДГПЖ — селективных a-адреноблокаторов мы использовали альфузозин, теразозин, доксазозин и тамсулозин. Общее число пациентов, получавших a-адреноблокаторы, составило 1408. Финастерид был взят нами как классический представитель блокаторов 5-a-редуктазы. Из препаратов растительного происхождения мы использовали пермиксон и таденан.
В пяти группах общей численностью 1305 человек проводилась терапия селективными a-адреноблокаторами в течение длительного периода времени по стандартным схемам и в стандартных дозах. Результаты лечения приведены в табл. 2.
Улучшение качества мочеиспускания отметили в среднем 86,74% пациентов. Суммарный балл I-PSS сократился на 38,68% к окончанию первого года лечения и на 43,4% к окончанию курса терапии. Балл QOL уменьшился на 29,04% и 35,58% соответственно. Максимальная скорость потока мочи увеличилась на 45,25% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. Количество остаточной мочи сократилось в среднем на 57,6%. Процент пациентов, по тем или иным причинам выбывших из исследования, был тождествен во всех группах и равнялся 14,38%.
Особо следует остановиться на препарате тамсулозин (омник, Yamanouchi) — пока единственном простатселективном a1А-адреноблокаторе на отечественном рынке. Этот препарат обладает рядом свойств, которые позволяют его использовать в различных функциональных тестах. Прежде всего это возможность назначения единой терапевтической дозы (один раз в сутки по 0,4 мг). А отсутствие выраженного влияния на артериальное давление и сердечную деятельность избавляет от необходимости титрования дозы. Мы согласны с рядом авторов, которые считают возможным применение коротких курсов терапии тамсулозином в качестве прогностических тестов эффективности лечения a1-адреноблокаторами, что может иметь решающее значение при выборе того или иного метода медикаментозного лечения ДГПЖ [4].
Части больных (группа А5) проведена проверка возможности разрешения острой задержки мочеиспускания (ОЗМ) приемом альфузозина по 5 мг два раза в сутки. Эта терапия проводилась пациентам с впервые возникшей ОЗМ и отсутствием симптомов нарушения мочеиспускания в анамнезе. Положительный эффект был достигнут у 8 из 14 пациентов (57,1%), которым параллельно приему альфузозина производилось кратковременное (трое суток) дренирование мочевого пузыря катетером. Единовременный прием суточной дозы альфузозина (10 мг) способствовал восстановлению самостоятельного мочеиспускания лишь у одного из четырех пациентов, которым проводилась подобная терапия. Вероятно, это объясняется гипотонией детрузора, усугубляющейся в ситуации длительного перерастяжения мочевого пузыря на фоне задержки мочеиспускания.
Для изучения эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ препаратами разных групп, а также для уточнения целесообразности проведения терапии нами были созданы три группы.
В первой группе (К1) пациенты получали проскар по 5 мг/сут. параллельно с приемом теразозина по 5-10 мг/сут. Обращало на себя внимание значительное повышение показателей максимальной скорости потока мочи (+40%), характерное для группы монотерапии a-адреноблокаторами, и постепенное, на протяжении курса лечения, снижение объема предстательной железы (-20,4%), характерное для группы монотерапии финастеридом. Очевидно, что положительные изменения показателей мочеиспускания в этой группе являются следствием воздействия обоих препаратов. Тем не менее процент выбывших пациентов в этой группе был крайне высоким — 32,3%. Основной причиной прекращения комбинированной терапии ДГПЖ пациенты называли неприемлемо высокую стоимость лечения.
В третьей группе комбинированной терапии (К3) лечение проводилось финастеридом по 5 мг/сут. в сочетании с пермиксоном по 160 мг два раза в сутки. Через два года после начала лечения 50% пациентов покинули группу, приводя причиной отказа от дальнейшей терапии высокую стоимость лечения при отсутствии быстрого улучшения качества мочеиспускания. При сравнении полученных данных с результатами в других группах очевидно, что эффективность лечения в третьей существенно ниже.
Таким образом, эффективность медикаментозной терапии больных ДГПЖ при соблюдении показаний и противопоказаний к ее назначению, правильном выборе препарата и схемы его назначения высока и достигает в среднем 80,2%. При этом эффективность монотерапии a-адреноблокаторами составляет 86,7%, блокаторами 5a-редуктазы — 69,4%, препаратами растительного происхождения — 69,3% и при комбинированной терапии — 95,45%. Комбинированная медикаментозная терапия a-адреноблокаторами в сочетании с блокаторами 5a-редуктазы эффективнее монотерапии этими препаратами. С целью снижения стоимости лечения возможен переход на монотерапию блокаторами 5a-редуктазы после достижения выраженного регресса обструктивной симптоматики. Медикаментозная терапия a-адреноблокаторами является эффективным способом консервативного лечения острой задержки мочеиспускания. Терапия должна проводиться на фоне кратковременного (трое суток) дренирования мочевого пузыря уретральным катетером.
Литература
1. Гориловский Л. М. Эпидемиология и факторы риска развития доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 10-18.
2. Лопаткин Н. А., Перепанова Т. С. Клинический опыт лечения больных доброкачественной гиперплазией предстательной железы a1-адреноблокатором альфузозином // Урол. и нефрол., 1997, № 5, с. 14-17.
3. Лоран О. Б., Вишневский Е. Л., Вишневский А. Е. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты a-адреноблокаторами. Монография. М., 1998.
4. Сивков А. В. Медикаментозная терапия доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 67-83.
5. McConnell J. D. Prostatic growth: new insights into hormonal regulation // Br. J. Urol. 1995. Vol.76.(suppl.1). P. 5-10.
Простагут Форте (Prostagutt ® Forte)
Владелец регистрационного удостоверения:
Произведено:
Активные вещества
Лекарственная форма
Форма выпуска, упаковка и состав препарата Простагут Форте
| 1 капс. | |
| сухой экстракт плодов серенои ползучей (10-14.3:1)* | 160 мг |
| сухой экстракт корней крапивы (7.6-12.5:1)** | 120 мг |
* Экстрагент: этанол 90%.
** Экстрагент: этанол 60%.
Состав оболочки капсулы: глицерол 85% (глицерин), желатина полисукцинат, железа оксид черный (Е172), железа оксид желтый (Е172), патентованный синий V (Е131).
Фармакологическое действие
Комбинированное лекарственное средство растительного происхождения. Оказывает противовоспалительное, противоотечное, иммуномодулирующее, антипролиферативное и антиандрогенное действие.
Противовоспалительное и противоотечное действия обусловлены ингибированием основных звеньев каскада арахидоновой кислоты и синтеза простагландинов и лейкотриенов с последующим уменьшением проницаемости и, как следствие, снижением боли, воспаления и отека тканей предстательной железы.
Иммуномодулирующее действие обусловлено подавлением аутоиммунного воздействия на ткань предстательной железы при воспалительных процессах, а также снижением пролиферации активных лимфоцитов.
Антипролиферативное и антиандрогенное действия обусловлены ингибированием ферментов ароматазы и 5-альфа-редуктазы, что препятствует образованию из тестостерона эстрадиола и дигидротестостерона, способствующих росту ткани предстательной железы.
Простагут форте уменьшает симптомы нарушения мочеиспускания, обусловленные доброкачественной гиперплазией предстательной железы. Уменьшает боль и чувство жжения при мочеиспускании, способствует быстрому опорожнению мочевого пузыря и снижает частоту ложных и ночных позывов к мочеиспусканию.
Показания активных веществ препарата Простагут Форте
Нарушения мочеиспускания при доброкачественной гиперплазии предстательной железы I и II степени; нарушения мочеиспускания при простатите; профилактика рецидивов доброкачественной гиперплазии предстательной железы после операции.
Режим дозирования
Побочное действие
Редко: раздражение слизистой оболочки желудка (при приеме натощак).
Возможно: аллергические реакции.
Противопоказания к применению
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Применение у пожилых пациентов
Препарат разрешен для применения у пожилых пациентов
Особые указания
Следует учитывать, что данное средство только уменьшает выраженность симптомов, обусловленных увеличением предстательной железы, не устраняя само увеличение. Необходимо проводить регулярный контроль клинического состояния пациента.
Пациент должен быть предупрежден, что при появлении крови в моче и/или при острой задержке мочи следует обратиться к врачу.