Простамол уно и простаплант что лучше
Эффективные лекарства от простатита у мужчин
Простатит неодинаково протекает у разных мужчин. Какие-то симптомы бывают более выраженными, какие-то отсутствуют. Большое значение имеет стадия болезни, наличие гиперплазии предстательной железы или аденомы. Врачи учитывают, впервые развилось воспаление или уже имеется стаж.
Подобрать лечение простатита у мужчин, найти самые эффективные средства для каждой стадии простатита может только врач-уролог, после обследования и получения результатов анализов.
Тем не менее ориентироваться в средствах для лечения простатита должен каждый, кто столкнулся с этой проблемой.
Виды лекарств от простатита у мужчин
Урологи применяют несколько групп препаратов.
Антибиотики борются с инфекцией в мочевом тракте, все прочие средства снижают воспаление, уменьшают отёк и боль, облегчают отхождение мочи, улучшают кровоснабжение половых и мочевыводящих органов.
Существует масса гомеопатических средств от простатита и потенции, производные интерферона, которые в статье не рассматриваются. Их польза не доказана в исследованиях.
Каким должно быть лучшее средство от простатита у мужчин
Лечение, назначенное врачом, должно достигать следующих целей:
Единственного препарата, который в полной мере отвечает всему перечисленному, нет. Поэтому урологи прописывают приём 2–3 препаратов, подобранных индивидуально в каждом случае. Лекарства сочетают с массажем, физкультурой, физиопроцедурами.
Для лечения простатита у мужчин самыми эффективными средствами считаются ректальные свечи, поскольку поставляют лекарство к железе, минуя печень и создают в тканях высокую лечебную концентрацию.
Топ-5 эффективных средств для лечения простатита
Эти препараты обладают комплексным действием, проверены в клинической практике.
Витапрост
Свечи и ампульный препарат экстракта простаты. Эффективен при остром и хроническом воспалении, поскольку в состав лекарства входит антибиотик.
Лонгидаза
Бактерицидным действием не обладает, назначается вместе с антибиотиком. Подходит в хронических случаях, когда уже появился воспалительный фиброз в органе, спайки, разрастание ткани простаты. Результативна при болезни Пейрони.
Простатилен
Инъекции и ректальные свечи. В сочетании с антибактериальным средством снимает воспаление, нормализует мочеиспускание, улучшает эрекцию.
Простамол Уно
Растительный препарат. Выпускается в капсулах. Уменьшает боли, восстанавливает ток мочевой струи, нормализует потенцию.
Простанорм
Лекарство из растительного сырья. Применяется больше для профилактики, продления ремиссии при хроническом процессе. Имеет небольшой антибактериальный эффект, убирает боль, стимулирует иммунитет, улучшает кровоснабжение железы и отток мочи.
При снижении тонуса мочевыводящей системы врачом по рецепту назначается Омник. В осложнённых случаях при аденоме простаты может потребоваться применение финастерида для регуляции баланса тестостерона.
Хорошо себя зарекомендовали как лекарства от простатита недорогие Ихтиоловые свечи, ампульный Простакор.
Недопустимо самостоятельное применение медикаментов без учёта бактериальной флоры и стадии болезни. Терапия острого простатита под присмотром врача убережёт от осложнений и перехода в хроническую форму.
Для назначения лечения обращайтесь к урологу клиники Dr. AkNer по телефону или через форму обратной связи. Звоните, опытный специалист выберет вам препараты и проконтролирует лечение до выздоровления.
Простаплант и Простамол уно — что лучше: Сравнение препаратов, Альтернативные средства
Доброкачественная гиперплазия предстательной железы (ДГПЖ, ранее называлась аденомой простаты) представляет собой разрастание нормальной ткани простаты. Это доброкачественный процесс, поддающийся лечению на любой стадии. На раннем этапе выявления возможно применение препаратов для устранения симптомов нарушения мочеиспускания и восстановления качества жизни пациентов.
Однако, полного излечения медикаментозными средствами не происходит. Единственный путь эффективной терапии — радикальный, операция по иссечению тканей, резекции. Фармацевтические средства незаменимы на всех этапах лечения.
Основные препараты, которые назначаются урологами-андрологами — Простаплант, Простамол Уно. Рассмотрим, что эффективнее, если выбирать между этими и другими существующими на фармацевтическом рынке средствами.
Сравнение препаратов
В основе двух препаратов Простамол Уно и Простаплант лежит одинаковое вещество — вытяжка из растения сереноа ползучая в форме сухого экстракта. Концентрация на одну таблетку (капсулу) по 320 мг.
В обоих случаях речь о натуропатическом средстве. Значит ли это, что Простамол или Простаплант не достойны внимания? Нет. Оба прошли клинические испытания и доказали эффективность на практике.
Остальные компоненты имеют вспомогательный характер. Они не имеют терапевтического смысла, выступают наполнителями.
Сереноя ползучая оказывает несколько полезных эффектов:
Оба препарата относятся к средствам симптоматической терапии. Они редко используются изолированно, возможно параллельное использование других медикаментов, на усмотрение ведущего пациента специалиста.
Показания и противопоказания
Основные показания идентичны. Доброкачественная гиперплазия предстательной железы на любой стадии, независимо от намеченной стратегии лечения. Неофициально Простаплант и Простамол Уно используются также в терапии простатита неинфекционного, дегенеративно-дистрофического происхождения для снятия отека, облегчения симптоматики.
Противопоказание одно — индивидуальная непереносимость к сереноа ползучей или вспомогательным компонентам препаратов.
Следует обратить внимание, если развились множественные симптомы аллергии. Поливалентная реакция организма на натуропатические средства, лекарственные растения, также на традиционные медикаменты требует повышенного внимания.
Побочные эффекты
Побочные реакции также одинаковы:
Зависят от особенностей организма каждого пациента.
Производители
Простаплант немецкого производства и Простамол Уно российского — аналоги. Второй не считается дженериком первого, несмотря на разницу в цене. Удорожание происходит за счет расходов на логистику, импорт, стоимость рабочей силы в стране производства.
Подведение промежуточных итогов
Чем различаются Простамол Уно и Простаплант:
Эффект имеют идентичный по результатам клинических испытаний³. При этом эффективность напрямую зависит от длительности терапии. Использование препаратов на основе вееролистной пальмы короткими курсами (16 недель) мало повлияло на уродинамику. Улучшение состояния наблюдалось на 1,7%³. Спустя 6 месяцев симптомы вернулись. И напротив, применение Простамол Уно или Простаплант на протяжении 2 лет значительно уменьшило сужение простатической части уретры (на 70%)³, улучшилось качество жизни, скорость потока мочи и иные клинические показатели эффективности (источник №3).
Это аналоги с различными торговыми наименованиями.
Альтернативные средства
Чем рекомендуется заменить Простамол Уно из перечисленных и иных средств с доказанной эффективностью? Это:
Некоторые лекарства из списка могут быть недоступны во всех странах. Выбор конкретного торгового наименования должен быть произведен лечащим врачом. Самолечение не рекомендуется, это опасно и неэффективно.
Что лучше: Простаплант или Простамол Уно
Простаплант
Простамол Уно
Исходя из данных исследований, Простамол Уно и Простаплант почти одинаковые.
Активные вещества одинаковые. Поэтому выбирайте исходя из цены
Сравнение эффективности Простапланта и Простамола Уно
Эффективность у Простапланта достотаточно схожа с Простамолом Уно – это означает, что способность лекарственного вещества оказывать максимально возможное действие схоже.
Например, если терапевтический эффект у Простапланта более выраженный, то при применении Простамола Уно даже в больших дозах не получится добиться данного эффекта.
Также скорость терапии – показатель быстроты терапевтического действия у Простапланта и Простамола Уно примерно одинаковы. А биодоступность, то есть количество лекарственного вещества, доходящее до места его действия в организме, схожа. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Простапланта и Простамола Уно
Безопасность препарата включает множество факторов.
При этом у Простапланта она выше, чем у Простамола Уно. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений. Метаболизм протекает спонтанно, но чаще всего задействует основные органы, такие как печень, почки, лёгкие, кожу, мозг и другие. При оценивании метаболизма у Простапланта, также как и у Простамола Уно мы смотрим, какой орган является метаболизирующим и наколько критично действие на него.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Простапланта рисков при применении меньше, чем у Простамола Уно.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Простапланта и Простамола Уно.
Сравнение противопоказаний Простапланта и Простамола Уно
Исходя из инструкции. Количество противопоказаний у Простапланта достаточно схоже с Простамолом Уно и составляет малое количество. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Простапланта и Простамола Уно может быть нежелательным или недопустимым.
Сравнение привыкания у Простапланта и Простамола Уно
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значения таких параметров, как «cиндром отмены» и «развитие резистентности», у Простапланта достаточно схоже со аналогичными значения у Простамола Уно. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной. При этом у Простапланта значения «синдрома отмены» и «резистентности» достотачно малое, впрочем также как и у Простамола Уно.
Сравнение побочек Простапланта и Простамола Уно
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Простапланта состояния нежелательных явлений почти такое же, как и у Простамола Уно. У них у обоих количество побочных эффектов малое. Это подразумевает, что частота их проявления низкая, то есть показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано – низкий. Нежелательное влияние на организм, сила влияния и токсическое действие у Простапланта схоже с Простамолом Уно: как быстро организм восстановиться после приема и восстановиться ли вообще.
Сравнение удобства применения Простапланта и Простамола Уно
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Простапланта примерно одинаковое с Простамолом Уно. При этом они не являются достаточно удобными для применения.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2020-12-04 13:43:08
Современные возможности медикаментозного лечения доброкачественной гиперплазии ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2].
 |
| Рисунок 1. Доброкачественная гиперплазия предстательной железы (макропрепарат) |
К числу наиболее распространенных урологических заболеваний у пациентов пожилого возраста относится доброкачественная гиперплазия предстательной железы (ДГПЖ) [2]. Около 80% мужчин старше 80 лет страдают этим заболеванием. Другая статистика свидетельствует, что из всех заболеваний, которым подвержены мужчины старше 50 лет, на долю доброкачественной гиперплазии простаты приходится 36% [1]. Эти сведения настолько общеизвестны, что ухудшение качества мочеиспускания часто рассматривается как естественное явление.
Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям. При значительно выраженной инфравезикальной обструкции, как правило, прибегают к хирургическому вмешательству. Оперативное лечение по поводу ДГПЖ показано 30% больных в возрасте от 50 до 80 лет [4]. Однако в последние годы все большую популярность завоевывает медикаментозная терапия доброкачественной гиперплазии предстательной железы. Это, с одной стороны, объясняется вполне логичным желанием врача и пациента по возможности избежать операции, с другой — развитием представлений о патогенезе расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы.
До недавнего времени патогенез расстройств мочеиспускания при доброкачественной гиперплазии предстательной железы рассматривали с позиции классических представлений о механической инфравезикальной обструкции и развитии вторичных структурно-функциональных изменений детрузора (компенсация, декомпенсация). За последние два десятилетия получены принципиально новые данные о природе повышенного внутриуретрального сопротивления. Его перестали отождествлять исключительно с механическим сдавлением шейки мочевого пузыря и задней уретры. Обнаружен динамический компонент обструкции, который состоит в повышении тонуса указанных анатомических структур за счет активности a-адренорецепторов. Появились также иные трактовки происхождения ирритативных симптомов. Их считают проявлением первичного нестабильного мочевого пузыря и не связывают напрямую с обструкцией [5].
Результаты нашей работы свидетельствуют, что при ДГПЖ клиническая симптоматика развивается вследствие недостаточности энергетического метаболизма и гипоксии детрузора в условиях повышенного уретрального сопротивления [3]. Об этом свидетельствуют:
Причины нарушений энергетического метаболизма и функций детрузора крайне многообразны. В частности, к таким нарушениям могут привести повышение активности симпатической нервной системы, расстройства органного кровообращения, авитаминоз (группа В), хронические заболевания дыхательной и сердечно-сосудистой систем, влияние приема ряда фармакологических препаратов, угнетающих дыхательную цепь, и, естественно, обструктивные нарушения уродинамики и т. д. Весьма важно, что нарушения гипоксического характера в гладкомышечной ткани могут иметь и первичный митохондриальный генез (первичные нарушения энергетического метаболизма детрузора [3].
Необходимо отметить, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность).
Подобное представление патогенеза расстройств мочеиспускания открывает широкие возможности для фармакотерапии. Сокращения и расслабления детрузора можно достичь с помощью средств метаболической терапии, прямого улучшения снабжения детрузора кислородом и т. д. Наиболее значимые расстройства основных функций мочевого пузыря все же опосредованы расстройствами кровообращения. И если процесс обратим, то до или после хирургического вмешательства можно существенно влиять на функциональное состояние мочевого пузыря с помощью вазоактивных препаратов, к которым в первую очередь относятся a1-адреноблокаторы.
При определении критериев отбора пациентов для медикаментозной терапии ДГПЖ мы воспользовались рекомендациями IV Международного консультативного комитета по ДГПЖ.
Основу настоящего исследования составили собственные клинические наблюдения за 1724 пациентами (средний возраст 61,4 года), страдающими ДГПЖ и получавшими различные варианты медикаментозного лечения. Нами применялись препараты всех групп, использующихся в настоящее время для лечения ДГПЖ: a-адреноблокаторы, блокаторы 5-a-редуктазы, препараты растительного происхождения и их комбинации. Схемы проведенного лечения и характеристика групп пациентов приведены в табл. 1.
Из наиболее многочисленной и популярной сегодня группы препаратов для медикаментозного лечения ДГПЖ — селективных a-адреноблокаторов мы использовали альфузозин, теразозин, доксазозин и тамсулозин. Общее число пациентов, получавших a-адреноблокаторы, составило 1408. Финастерид был взят нами как классический представитель блокаторов 5-a-редуктазы. Из препаратов растительного происхождения мы использовали пермиксон и таденан.
В пяти группах общей численностью 1305 человек проводилась терапия селективными a-адреноблокаторами в течение длительного периода времени по стандартным схемам и в стандартных дозах. Результаты лечения приведены в табл. 2.
Улучшение качества мочеиспускания отметили в среднем 86,74% пациентов. Суммарный балл I-PSS сократился на 38,68% к окончанию первого года лечения и на 43,4% к окончанию курса терапии. Балл QOL уменьшился на 29,04% и 35,58% соответственно. Максимальная скорость потока мочи увеличилась на 45,25% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. Количество остаточной мочи сократилось в среднем на 57,6%. Процент пациентов, по тем или иным причинам выбывших из исследования, был тождествен во всех группах и равнялся 14,38%.
Особо следует остановиться на препарате тамсулозин (омник, Yamanouchi) — пока единственном простатселективном a1А-адреноблокаторе на отечественном рынке. Этот препарат обладает рядом свойств, которые позволяют его использовать в различных функциональных тестах. Прежде всего это возможность назначения единой терапевтической дозы (один раз в сутки по 0,4 мг). А отсутствие выраженного влияния на артериальное давление и сердечную деятельность избавляет от необходимости титрования дозы. Мы согласны с рядом авторов, которые считают возможным применение коротких курсов терапии тамсулозином в качестве прогностических тестов эффективности лечения a1-адреноблокаторами, что может иметь решающее значение при выборе того или иного метода медикаментозного лечения ДГПЖ [4].
Части больных (группа А5) проведена проверка возможности разрешения острой задержки мочеиспускания (ОЗМ) приемом альфузозина по 5 мг два раза в сутки. Эта терапия проводилась пациентам с впервые возникшей ОЗМ и отсутствием симптомов нарушения мочеиспускания в анамнезе. Положительный эффект был достигнут у 8 из 14 пациентов (57,1%), которым параллельно приему альфузозина производилось кратковременное (трое суток) дренирование мочевого пузыря катетером. Единовременный прием суточной дозы альфузозина (10 мг) способствовал восстановлению самостоятельного мочеиспускания лишь у одного из четырех пациентов, которым проводилась подобная терапия. Вероятно, это объясняется гипотонией детрузора, усугубляющейся в ситуации длительного перерастяжения мочевого пузыря на фоне задержки мочеиспускания.
Для изучения эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ препаратами разных групп, а также для уточнения целесообразности проведения терапии нами были созданы три группы.
В первой группе (К1) пациенты получали проскар по 5 мг/сут. параллельно с приемом теразозина по 5-10 мг/сут. Обращало на себя внимание значительное повышение показателей максимальной скорости потока мочи (+40%), характерное для группы монотерапии a-адреноблокаторами, и постепенное, на протяжении курса лечения, снижение объема предстательной железы (-20,4%), характерное для группы монотерапии финастеридом. Очевидно, что положительные изменения показателей мочеиспускания в этой группе являются следствием воздействия обоих препаратов. Тем не менее процент выбывших пациентов в этой группе был крайне высоким — 32,3%. Основной причиной прекращения комбинированной терапии ДГПЖ пациенты называли неприемлемо высокую стоимость лечения.
В третьей группе комбинированной терапии (К3) лечение проводилось финастеридом по 5 мг/сут. в сочетании с пермиксоном по 160 мг два раза в сутки. Через два года после начала лечения 50% пациентов покинули группу, приводя причиной отказа от дальнейшей терапии высокую стоимость лечения при отсутствии быстрого улучшения качества мочеиспускания. При сравнении полученных данных с результатами в других группах очевидно, что эффективность лечения в третьей существенно ниже.
Таким образом, эффективность медикаментозной терапии больных ДГПЖ при соблюдении показаний и противопоказаний к ее назначению, правильном выборе препарата и схемы его назначения высока и достигает в среднем 80,2%. При этом эффективность монотерапии a-адреноблокаторами составляет 86,7%, блокаторами 5a-редуктазы — 69,4%, препаратами растительного происхождения — 69,3% и при комбинированной терапии — 95,45%. Комбинированная медикаментозная терапия a-адреноблокаторами в сочетании с блокаторами 5a-редуктазы эффективнее монотерапии этими препаратами. С целью снижения стоимости лечения возможен переход на монотерапию блокаторами 5a-редуктазы после достижения выраженного регресса обструктивной симптоматики. Медикаментозная терапия a-адреноблокаторами является эффективным способом консервативного лечения острой задержки мочеиспускания. Терапия должна проводиться на фоне кратковременного (трое суток) дренирования мочевого пузыря уретральным катетером.
Литература
1. Гориловский Л. М. Эпидемиология и факторы риска развития доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 10-18.
2. Лопаткин Н. А., Перепанова Т. С. Клинический опыт лечения больных доброкачественной гиперплазией предстательной железы a1-адреноблокатором альфузозином // Урол. и нефрол., 1997, № 5, с. 14-17.
3. Лоран О. Б., Вишневский Е. Л., Вишневский А. Е. Лечение расстройств мочеиспускания у больных доброкачественной гиперплазией простаты a-адреноблокаторами. Монография. М., 1998.
4. Сивков А. В. Медикаментозная терапия доброкачественной гиперплазии предстательной железы. В кн.: Доброкачественная гиперплазия предстательной железы / Под ред. Н. А. Лопаткина. М., 1997, с. 67-83.
5. McConnell J. D. Prostatic growth: new insights into hormonal regulation // Br. J. Urol. 1995. Vol.76.(suppl.1). P. 5-10.
Пермиксон: место препарата в патогенетической терапии ДГПЖ
А.В. Сивков
К.м.н., заместитель директора по науке НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России (г. Москва)
Соавтор – д.м.н., профессор В.Н. Синюхин
Проблема лечения больных доброкачественной гиперплазией предстательной железы (ДГПЖ) до сих пор остается актуальной. Согласно литературным данным, 15–25% мужчин в возрасте 50-65 лет страдают этим заболеванием, которое приводит к выраженному снижению качества жизни за счет симптомов нарушения функции нижних мочевых путей (СНМП). В настоящее время считают, что в патогенезе ДГПЖ имеет значение как генетическая предрасположенность, так и дисрегуляция гормонального обмена, которая приводит к активации гиперпластических процессов в предстательной железе (ПЖ), торможению апоптоза, а также к выделению целого ряда медиаторов, вызывающих хроническое воспаление.
Современные представления о патогенезе ДГПЖ
Постоянная стимуляция АР необходима прежде всего для роста и функции ПЖ. Этот процесс работает путем трансактивации домена, закодированного в первом экзоне гена АР (Xq 11-12), которому в норме свойственен полиморфизм CAG, GGN и GGC повторов, кодирующих тракты полиглутамина и полиглицина. При исследовании генетического полиморфизма некоторых генов, ответственных за метаболизм стероидов, показана их тесная связь с вероятностью возникновения ДГПЖ. Об этом свидетельствует тот факт, что у родственников мужчин, больных с ранним возникновением ДГПЖ, кумулятивный риск возникновения этого заболевания составляет 66%, тогда как в контрольной группе – лишь 17% (p = 0,01).
Кроме того, при исследовании полиморфизма генов, кодирующих 5α-R 2 типа (SRD 5A1 и SRD 5 A2), было установлено, что имеется тесная взаимосвязь между выраженностью полиморфизма генов, объемом ДГПЖ, эффективностью проводимой антиандрогенной терапии и концентрацией половых гормонов и их метаболитов
Интересна роль α1-адренорецепторов в патогенезе ДГПЖ. Предполагают, что в ПЖ они участвуют в процессе кооперативной регуляции работы внутриклеточных эффекторов, гормонов, факторов роста, которые влияют не только на тонус гладкомышечных элементов ПЖ, но и на их объем.
В последнее время появилось большое число исследований, показывающих, что ДГПЖ – это иммуновоспалительное заболевание. При этом в ткани ПЖ обнаруживают воспалительные инфильтраты, содержащие лимфоциты и макрофаги, количество которых коррелирует с объемом ДГПЖ. Они секретируют факторы роста, включая фактор роста фибробластов (FGF), цитокины: интерлейкин-1 (IL-1), интерлейкин-6 (IL-6), фактор некроза опухоли-α (TNF-α). Также наблюдают повышенную активность Т-клеток и аутоиммунные реакции, которые способствуют пролиферации стромальных и эпителиальных клеток. Было показано, что повышенное содержание в ткани при ДГПЖ провоспалительных цитокинов и цитокинов семейства IL-17 A, E, F и их рецепторов сопровождает повышение содержания клеток воспаления и сосудов с экспрессией CD 31+, а также провоспалительных хемокинов: MCP-1/CCL2 (фактор, хемотаксиса моноцитов), IP10/CXCL10 (индуцируемый гамма-интерфероном белок), MIF (фактор ингибирующий миграцию макрофагов). Провоспалительные цитокины повышают активность циклооксигеназы-2 (COX-2) и вызывают образование простагландинов и окиси азота, что стимулирует пролиферативные процессы в ПЖ и вызывает ее отечность. Ряд авторов считают, что активные формы кислорода приводят к повреждению ткани ПЖ, так как после завершения процесса трансляции вызывают модификацию структуры ДНК и ее клеток, что может привести к малигнизации процесса
Сахарный диабет и метаболический синдром являются факторами риска образования ДГПЖ. Отмечена взаимосвязь между резистентностью к инсулину, гиперинсулинемией и ДГПЖ. Гиперинсулинемия приводит к образованию в печени инсулиноподобных факторов роста (IGF), которые обладают митогенным и антиапоптическим эффектом. Эти факторы связываются в ПЖ со своими рецепторами и стимулирует увеличение ее объема. Концентрация IGF и белков, связывающих IGF в крови и ПЖ, коррелирует с выраженностью в ней пролиферативных процессов и участвует в регуляции образования андрогенов и гормона роста.
Гипергликемия и гиперинсулинемия также стимулируют образование в стромальных фибробластах ПЖ инсулиноподобного фактора роста-1 (IGF-1). Последний связывается со своим рецептором на эпителиальных клетках ПЖ и стимулирует их пролиферацию через целевой ген.
Общие подходы к лечению ДГПЖ
Современное лечение ДГПЖ / СНМП воздействует на различные звенья патогенеза этого заболевания. На первом месте стоят α1А-адреноблокаторы (доксазозин, теразозин, алфузозин, тамзулозин, силодозин): их считают препаратами выбора при ДГПЖ. Затем идут ингибиторы 5α-редуктазы (финастерид, дутастерид), которые при длительной терапии у пациентов с величиной ПЖ более 40 куб. см способны привести к уменьшению объема ДГПЖ. М-холинолитики (толтеродин, троспиума хлорид, солифенацин) и агонист β3-адренорецепторов – мирабегрон чаще используют в комбинации с α1А-адреноблокаторами для купирования проявлений гиперактивного мочевого пузыря при ДГПЖ. Тадалафил (ингибитор фосфодиэстеразы 5 типа) улучшает симптомы ДГПЖ у больных, страдающих эректильной дисфункцией. По показаниям применяют нестероидные противовоспалительные препараты. Обсуждают возможность применения антиоксидантов при ДГПЖ [16]. Однако все эти препараты обладают целым рядом побочных эффектов и воздействуют только на отдельные фазы патогенеза ДГПЖ.
Современное лечение ДГПЖ / СНМП воздействует на различные звенья патогенеза этого заболевания. На первом месте стоят α1А-адреноблокаторы (доксазозин, теразозин, алфузозин, тамзулозин, силодозин): их считают препаратами выбора при ДГПЖ. Затем идут ингибиторы 5α-редуктазы (финастерид, дутастерид), которые при длительной терапии у пациентов с величиной ПЖ более 40 куб. см способны привести к уменьшению объема ДГПЖ. М-холинолитики (толтеродин, троспиума хлорид, солифенацин) и агонист β3-адренорецепторов – мирабегрон чаще используют в комбинации с α1А-адреноблокаторами для купирования проявлений гиперактивного мочевого пузыря при ДГПЖ. Тадалафил (ингибитор фосфодиэстеразы 5 типа) улучшает симптомы ДГПЖ у больных, страдающих эректильной дисфункцией. По показаниям применяют нестероидные противовоспалительные препараты. Обсуждают возможность применения антиоксидантов при ДГПЖ [16]. Однако все эти препараты обладают целым рядом побочных эффектов и воздействуют только на отдельные фазы патогенеза ДГПЖ.
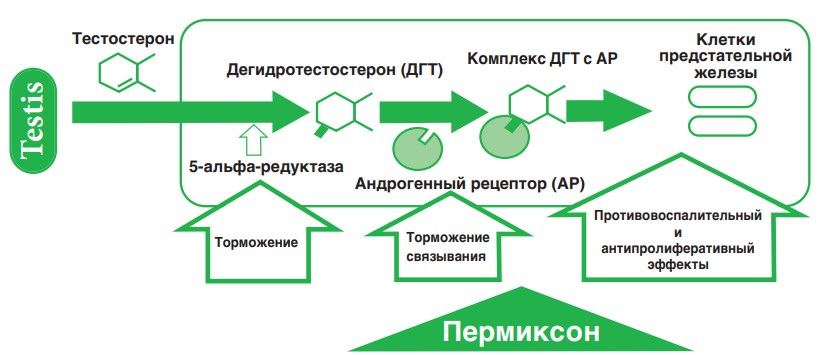
Механизмы действия Пермиксона
Пермиксон (Permixon) представляет собой комплексную смесь свободных и эстерифицированных жирных кислот, полипренов и фитостеролов, полученных из плодов пальмы ползучей (Serenoa repens или Sabal serrulata). Препарат содержат несколько ингредиентов и поэтому при его применении возможен комплексный фармакологический эффект, действующий на различные звенья патогенеза ДГПЖ (рис. 1). Другими словами, эффект этой смеси можно сравнить с комбинированной лекарственной терапией, каждый компонент которой может обладать по отношению к другому аддитивным или синергическим действием.
Рис.1. Патогенез ДГПЖ и механизм действия Пермиксона
Влияние Пермиксона на клеточные структуры ПЖ
При исследовании любого препарата, как правило, проводят изучение специфичности и селективности его действия. Это касается и Пермиксона. C.W. Bayne и соавт. в культуры тканей из различных органов добавили нарастающие концентрации Пермиксона. При исследовании препаратов этих культур на электронном микроскопе оказалось, что только в клетках ПЖ были отмечены выраженные структурные изменения, которые заключались в накоплении липидных капель в цитоплазме, изменении мембраны ядра, его поляризации, разрушении органелл, конденсации хроматина. Это подтвердило специфичное действие Пермиксона именно на клетки ПЖ [20]. При присоединении радиоактивной метки к входящим в состав Пермиксона свободным жирным кислотам и введении его крысам оказалось, что в наибольших количествах метка накапливалась в ПЖ (рис. 2), что свидетельствует в пользу селективности действии лекарственного препарата на этот орган.
Таким образом, преимущественное накопление компонентов Пермиксона в ПЖ вызывает в ней морфологические изменения, которые могут отразиться на физико-химических характеристиках и повлиять на различные системы регуляции работы органа как на клеточном, так и молекулярном уровнях.
Влияние Пермиксона на гормональный статус ПЖ
В 1998 г. F. Di Silverio с соавт. сообщили, что трехмесячная терапия Пермиксоном приводит к выраженному уменьшению содержания ДГТ в ПЖ. Затем в опытах in vitro на культуре эпителиальных клеток и клеток рака ПЖ было показано, что Пермиксон тормозит активность 5α-R 1 и 2 типов и не вызывает повышения концентрации простатспецифического антигена (ПСА) в культуральной среде. Это, по-видимому, связано с тем, что препарат не влияет на опосредованный АР процесс транскрипции. Данный феномен был подтвержден и in vivo. Интересно отметить, что при культивировании клеток других органов не наблюдали торможения активности 5α-R. Тем не менее до сих пор не удалось объяснить, почему Пермиксон тормозит активность 5α-R и рост ПЖ, но не влияет на продукцию эпителиальными клетками ПСА. Возможно, это связано тем, что препарат воздействует на клеточную и внутриклеточные мембраны стромальных и эпителиальных клеток ПЖ, приводит к изменению микроокружения 5α-R и, как следствие, торможению ее активности. При этом Пермиксон не влияет на работу генов, от которых зависит действие андрогенов и выработка ПСА.
Таким образом, Пермиксон обладает антиандрогенным действием, тормозит активность 5α-R, блокирует АР ПЖ, уменьшает в ней число эстрогенных рецепторов и снижает стимуляцию пролактином гиперпластических процессов. Кроме того, препарат имеет еще одно преимущество перед синтетическими ингибиторами 5α-R, так как не влияет на концентрацию ПСА.
Противовоспалительное действие Пермиксона
Противовоспалительное действие Пермиксона начали исследовать еще в 90-е годы прошлого столетия. В одной из первых работ было изучено его влияние на образование из арахидоновой кислоты полиморфоядерными лейкоцитами крови человека хемоаттрактанта нейтрофилов – лейкотриена (LTB 4) после их стимуляции ионофором А 23127. Было показано, что Пермиксон тормозит продукцию ее метаболитов: 5-HETE, 20-COOH LTB4, LTB4 и 20-OH LTB. Эти результаты были подтверждены дальнейшими иммуногистохимическими исследованиями удаленного гиперплазированного участка ПЖ, которые показали, что трехмесячный прием Пермиксона вызывает резкое снижение количества В-лимфоцитов (но не T-лимфоцитов и макрофагов), TNF-α и IL-1β. При оценке по международной шкале простатических симптомов (IPSS) эти изменения коррелировали с клинически значимым улучшением состояния пациентов, что свидетельствует о противовоспалительном действии препарата. Это затем нашло подтверждение в работах других авторов.
Еще одна исследовательская группа провела изучение противовоспалительной активности Пермиксона при ДГПЖ. В опытах in vitro было оценено влияние препарата на пролиферацию и жизнеспособность клеток ПЖ с использованием клеточных линий из тканей здоровой и гиперплазированной железы. В тканях при ДГПЖ были отмечены повышенные индексы пролиферативной активности. Добавление разных концентраций Пермиксона уменьшало клеточную пролиферацию во всех клеточных линиях. Наиболее выраженный эффект отметили в стромальных и эпителиальных клетках при гиперплазии ПЖ. Добавление провоспалительных медиаторов IL-6, IL-17 и FGF в клеточную культуру провоцировало выраженную пролиферацию всех трех типов клеток: стромальных, эпителиальных и здоровых. Последующее добавление Пермиксона уменьшило клеточную пролиферацию, индуцированную FGF-2 в стромальных и здоровых клетках, а IL-6 и IL-17 – в клеточной линии гиперплазированных тканей. Авторы выполнили микроматричный анализ для сравнения экспрессии генов в эпителиальных и стромальных клетках при ДГПЖ после добавления Пермиксона и без него. При добавлении препарата была выявлена недостаточная экспрессия генов, кодирующих провоспалительные медиаторы (IL-1β, IL-6 и хемокина C-X-C motif). Также отмечено уменьшение экспрессии гена, кодирующего человеческий рецептор эпидермального фактора роста 3 (ERBB3), что привело к избыточной экспрессии человеческого гена блокировки роста (GAS1).
В исследовании de la Taille A. на модели in vivo у самцов крыс линии Спрег-Доули вызвали ДГПЖ путем 14-дневного введения тестостерона пропионата. Животные были рандомизированы на три группы лечения: ЭППП ( Пермиксон), финастерид и контроль (без активного лечения). Проводили количественное определение в ПЖ мРНК для 90 генов. Оказалось, что Пермиксон обеспечил статистически значимое снижение (p 14 мл/сек) наблюдали у 33 и 48% больных соответственно. Объем остаточной мочи (Vres) снизился, начиная с 16 недели, на 27 и 32% у больных I и II групп, соответственно. При приеме препарата в дозе 320 мг/сут субъективная симптоматика исчезла у 46% больных, 960 мг в день – у 60%. В результате исследования было показано, что оптимальной терапевтической дозой Пермиксона является 320 мг/сут.
Подобные результаты были получены в 1999 г. в исследовании В.Н. Степанова и соавт. на 100 амбулаторных больных с ДГПЖ в рандомизированном 3-месячном исследовании в параллельных группах. Было показано, что к концу первого месяца приема препарата значительно улучшились показатели IPSS, Qmax, Qave, V. К концу третьего месяца лечения все они, за исключением V и Qave, продолжали улучшаться. Таким образом, прием Пермиксона в дозе 320 мг/сут. улучшает суммарный балл IPSS и все показатели мочеиспускания. Препарат оказывает тот же эффект в дозе 160 мг два раза в день.
Исследование D. Authie и J. Cauquil включало 500 пациентов с ДГПЖ (средний возраст 68,2 года). У большинства из них имели место симптомы расстройства мочеиспускания: ноктурия – у 97%; дневная поллакиурия – у 67%; дизурия – у 92% и императивные позывы – у 70%. Все пациенты получали Пермиксон (320 мг/сут.) в течение 3 месяцев. Авторами зарегистрирован выраженный симптоматический эффект препарата: к концу лечения средняя частота позывов в ночное время снизилась с 4,0 до 1,8, причем улучшение по данному показателю было отмечено у 82%, а полное исчезновение симптома – у 45% больных. Частота дневных мочеиспусканий сократилась с 6,3 до 4,6 у 2/3 мужчин, а уменьшение дизурии и императивности позывов достигнуто у 75 и 85% пациентов соответственно.
F. Foroutan изучал клиническую эффективность Пермиксона в дозе 320 мг/сут. в течение 3 месяцев у 592 пациентов с ДГПЖ. В результате лечения отмечено статистически значимое уменьшение симптомов заболевания и снижение показателя IPSS с 17 до 10 баллов, а также достоверная положительная динамика объективных параметров: Qmax, количества остаточной мочи и объема ПЖ, хотя последнее и было незначительным – 1,84 мл. Похожие результаты были получены рядом отечественных авторов в коротких несравнительных исследованиях Пермиксона.
В НИИ урологии в 1999 г. проанализированы результаты лечения 48 больных ДГПЖ, которые получали Пермиксон по 160 мг дважды в день в течение 12 месяцев. Было отмечено уменьшение выраженности симптомов по шкале I-PSS с 14,35 до 10,61 балла (-26,1%) через 6 месяцев и до 10,42 (- 27,4%) через 12 месяцев лечения. В те же периоды времени средний показатель Qmax увеличился с 10,62 до 12,60 мл/сек (+18,7%) и до 12,73 мл/сек (+19,9%) соответственно. Индекс качества жизни QOL через 6 месяцев наблюдения снизился с 3,49 до 2,60 баллов (-25,3%), достигнув к концу года 2,49 (-28,7%). Также было зарегистрировано небольшое уменьшение среднего объема предстательной железы: на 11,8% через 6 месяцев и 15,6% через 12 месяцев. Показатель ПСА не изменялся в течение всего периода лечения.
Изучение эффективности Пермиксона у больных с различными исходными значениями IPSS и Qmax дало нам возможность сделать заключение о том, что препарат наиболее результативен у пациентов с умеренной выраженностью симптомов ДГПЖ (IPSS 10 мл/сек).
Большое клиническое значение имеют данные уродинамических исследований, характеризующие влияние Пермиксона на состояние мочевого пузыря и степень инфравезикальной обструкции. На основании анализа данных комплексного уродинамического обследования больных ДГПЖ, получавших Пермиксон, был сделан вывод, что препарат оказывает позитивное влияние на функциональное состояние мочевого пузыря и уменьшает степень инфравезикальной обструкции. Вместе с тем ни в одном случае полностью устранить проявления обструкции не удалось.
Особый интерес представляют работы, в которых сравнивали эффективность и безопасность Пермиксона с плацебо и другими лекарственными средствами. Результаты 7 плацебо-контролируемых исследований, в которых приняло участие в общей сложности 559 человек, обобщены в 1996 г. G. Plosker и R. Brogden. В трех наиболее значимых из них, где участвовало 410 больных ДГПЖ, пациенты были разделены на две практически равные группы: принимавшие Пермиксон (320 мг/сут.) и плацебо. В этих исследованиях продолжительностью от 1 до 3 месяцев достоверно продемонстрирована клиническая эффективность препарата по сравнению с плацебо. При этом частота ночных мочеиспусканий уменьшилась на 33–46%, дневная поллакиурия – на 11–20%, a Qmax увеличилась на 29–50%, что было существенно выше, чем в группе плацебо, где аналогичные показатели составили 15–18, 1–3 и 5–9% соответственно.
В трех других опубликованных исследованиях продолжительностью 1–2 месяца с участием 79 больных на фоне приема Пермиксона было отмечено уменьшение ноктурии на 50–74%, снижение частоты дневных мочеиспусканий на 29–43% и рост Qmax на 26–43%, тогда как в группе плацебо эти же показатели были равны 13–39%, 8-29% и 2–19%. Лишь в одном из 7 опубликованных исследований авторы не выявили существенных различий между изучаемыми признаками.
Показано, что эффективность Пермиксона возрастает с продолжительностью лечения, которое должно быть рассчитано не менее 4–6 месяцев), а то и годы. С одной стороны, это необходимо учитывать специалистам, планирующим лечение препаратом Пермиксон, а с другой – на это надо ориентировать и пациентов при обсуждении с ними программы медикаментозной терапии ДГПЖ.
Препарат практически не имеет противопоказаний, не влияет на уровень ПСА и не затрудняет диагностику рака ПЖ. Не описано случаев его взаимодействия с другими лекарственными средствами, что расширяет возможности применения Пермиксона у лиц пожилого возраста с отягощенным соматическим статусом.