Пролиферация покровно ямочного эпителия желудка что это такое
Современная стратегия ведения пациента с предраковыми заболеваниями желудка

Представлен обзор, обобщающий существующие международные рекомендации по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка. Показано, что пациенты с хроническим атрофическим гастритом или кишечной метаплазией имеют повы
The review summarize existing international recommendations for managing patients with atrophic gastritis, intestinal metaplasia and gastric dysplasia. It is shown that patients with chronic anthropic gastritis or intestinal metaplasia have an increased risk of stomach adenocarcinoma development. Helicobacter pylori eradication tends to relieve indications of chronic nonatrophic gastritis and can lead to partial regression of atrophic gastritis, and reduces the risk of stomach cancer development.
Несмотря на успехи в области диагностики и лечения, рак желудка остается серьезной проблемой в мировом масштабе, занимая шестое место по уровню заболеваемости и второе — в структуре смертности от онкологических заболеваний [1–2]. Самые высокие показатели отмечаются в странах Восточной и Центральной Азии, Латинской Америке, самые низкие — в Северной Америке. В Восточной Азии заболеваемость раком желудка составляет 32,1 на 100 000 у мужчин, 13,2 — у женщин, в Южной Корее — 57,8 и 23,5 на 100 000, в Японии 40,7 и 16,0 на 100 000 для мужчин и женщин соответственно [1–2]. Наименьшая заболеваемость наблюдается в Северной Америке и большинстве районов Африки. Так, в Соединенных Штатах Америки (5,5 на 100 000 у мужчин; 2,8 — у женщин) [1]. Россия относится к странам с умеренным риском рака желудка, наряду с Португалией, Сингапуром, Эстонией. По итогам 2018 г., согласно российской статистике, в структуре общей заболеваемости удельный вес опухолей желудка достигал 20,4 на 100 000 населения у мужчин и 8,8 — у женщин [3]. Улучшение эпидемиологической ситуации по раку желудка наблюдается, как правило, в странах, где разработаны профилактические мероприятия, высокий уровень осведомленности населения и длительное время существуют национальные программы скрининга и ведения пациентов с предраковыми заболеваниями [4].
Цель представленного обзора — обобщение существующих международных рекомендаций по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка.
В 2012 г. Европейским обществом гастроинтестинальной эндоскопии (ESGE), Европейской группой по изучению Helicobacter и микробиоты (EHMSG), Европейским обществом патологов (ESP) и Португальским обществом гастроинтестинальной эндоскопии (SPED) были разработаны первые международные рекомендации по лечению предраковых состояний и изменений желудка (MAPS I). В 2019 г. опубликована обновленная версия рекомендаций под названием MAPS II [4]. Данные рекомендации были представлены на рассмотрение в разных странах.
Различные формы рака имеют свои специфические характеристики, знание которых позволит оптимизировать диагностику рака желудка на ранних стадиях. Подавляющее большинство раков желудка — аденокарциномы (АК, около 90%), которые происходят из желез слизистой оболочки желудка. Аденокарциномы желудка (АКЖ) подразделяют на кардиальные и некардиальные. Выделяют два основных гистологических типа некардиальных АКЖ: диффузные и кишечные. Кардиальной формой рака желудка является некардиальная аденокарцинома кишечного типа (90% АКЖ). Последняя имеет строение опухоли, сходное с картиной рака кишки. Для них характерны отчетливые железистые структуры, состоящие из высокодифференцированного цилиндрического эпителия с развитой щеточной каемкой. Диффузный тип опухоли представлен слабо организованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки) и характеризуется диффузным инфильтративным ростом. Возможен смешанный тип — в опухоли присутствуют участки кишечного и диффузного типа [5]. Дифференцированный тип чаще встречается у пожилых мужчин и развивается медленно, тогда как диффузный тип чаще встречается у женщин более молодого возраста и имеет худший прогноз [5].
Обзор представленных рекомендаций не распространяется на наследственный/семейный диффузный рак желудка, для которого разработаны специальные рекомендации [6].
Аденокарцинома желудка кишечного типа представляет собой окончательный исход последовательности «воспаление — атрофия — метаплазия — дисплазия — карцинома», известной как каскад Корреа [7–11].
Рекомендация 1 (MAPS II). Пациенты с хроническим атрофическим гастритом или кишечной метаплазией подвержены риску развития аденокарциномы желудка (высокий уровень доказательности) [4].
Хронический атрофический гастрит и кишечную метаплазию (КМ) рассматривают как предраковые состояния, поскольку они сами по себе связаны с риском развития рака желудка и на их фоне возможно развитие дисплазии и аденокарциномы [7–11].
Рекомендация 2 (MAPS II). Гистологически подтвержденная кишечная метаплазия — наиболее надежный маркер атрофии слизистой оболочки желудка (высокий уровень доказательности) [4].
Рекомендация 3 (MAPS II). Необходимо выявлять пациентов с гастритом на поздних стадиях, т. е. с атрофией и (или) кишечной метаплазией, слизистой оболочки как антрального отдела желудка, так и тела желудка, поскольку считается, что они подвержены более высокому риску развития аденокарциномы желудка (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 4 (MAPS II). Дисплазию тяжелой степени и инвазивную карциному следует рассматривать как исходы, которые необходимо предотвратить при лечении пациентов с хроническим атрофическим гастритом или кишечной метаплазией (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 5 (MAPS II). У пациентов с эндоскопически определяемыми патологическими изменениями, указывающими на дисплазию легкой или тяжелой степени или карциному, следует определить стадию заболевания и начать лечение (высокий уровень доказательности, сильная рекомендация).
Рекомендация 6 (MAPS II). Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии (высокий уровень доказательности).
Рекомендация 7 (MAPS II). При наличии возможности и после надлежащего обучения для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений (умеренный уровень доказательности, сильная рекомендация).
Рекомендация 8 (MAPS II). Для надлежащего определения стадии предраковых состояний желудка первая диагностическая эндоскопия верхнего отдела желудочно-кишечного тракта должна включать взятие биопсийных образцов из желудка для определения наличия инфекции Helicobacter pylori и выявления атрофического гастрита на поздних стадиях (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 9 (MAPS II). Следует выполнить биопсию как минимум на двух топографических участках (по малой и большой кривизне, как в антральном отделе желудка, так и в теле желудка). Следует дополнительно выполнить биопсию видимых предполагаемых неопластических поражений (умеренный уровень доказательности, сильная рекомендация) [4].
Рекомендация 10 (MAPS II). Для выявления пациентов с гастритом на поздних стадиях можно использовать системы гистопатологического определения стадии заболевания (например, оперативную систему оценки гастрита (OLGA) и оперативную систему оценки гастрита, основанную на кишечной метаплазии (OLGIM)). Стадии III и IV могут указывать на пациентов, подверженных более высокому риску развития рака желудка [12].
Следует рассмотреть возможность выполнения дополнительной биопсии из угла желудка (умеренный уровень доказательности, слабая рекомендация). Данный подход позволяет обеспечить максимальную степень выявления пациентов с предраковыми состояниями, в особенности в случаях, когда применение хромоэндоскопии для прицельной биопсии невозможно [4].
В случае выявления патологического изменения и результатов эндоскопической оценки, указывающих на наличие дисплазии, рекомендуется проводить резекцию патологического участка без дополнительной биопсии [4].
При наличии возможности для диагностики предраковых состояний желудка следует применять виртуальную хромоэндоскопию с увеличением или без увеличения изображения, что позволяет выполнять контролируемую биопсию на участках атрофических и метапластических изменений, а также обеспечивает выявление неопластических поражений. Эндоскопия высокого разрешения в сочетании с хромоэндоскопией более эффективна, чем эндоскопия высокого разрешения в белом свете, при диагностике предраковых состояний желудка и неопластических поражений на ранней стадии. Если при такой эндоскопии высокого разрешения не выявлены патологические изменения, рекомендуется выполнить биопсию для определения стадии гастрита (если ее не выполняли ранее) и эндоскопическое наблюдение в течение от 6 месяцев (при дисплазии тяжелой степени) до 12 месяцев (при дисплазии легкой степени) [4].
Дисплазия желудка представляет собой предпоследнюю стадию последовательности желудочного канцерогенеза. Ее определяют как гистологически подтвержденные неопластические изменения эпителия без признаков тканевой инвазии, что указывает на непосредственное неопластическое предраковое изменение [13]. Всемирная организация здравоохранения подтвердила классификацию дисплазии/интраэпителиальной неоплазии [14]:
Диагноз «неопределенная дисплазия/неоплазия» не следует изначально рассматривать как безобидный, несмотря на то, что у большинства пациентов прогноз будет благоприятным. В действительности в одном из исследований было установлено, что 26,8% резецированных поражений, классифицированных как неопределенная дисплазия/неоплазия по результатам биопсии перед резекцией, фактически представляли собой неопластические поражения (5,0% — аденома и 21,8% — ранний рак желудка) [15].
Следует помнить, что даже дисплазия легкой степени может представлять собой злокачественное новообразование [16].
В случае видимых патологических изменений одной эндоскопической биопсии недостаточно для диагностики злокачественного новообразования, при наличии любого эндоскопически определяемого патологического изменения с любыми неопластическими изменениями необходимо производить его эндоскопическую резекцию[4].
Рекомендуется проверка гистологических препаратов и немедленная (в кратчайшие возможные сроки) повторная оценка с применением эндоскопии высокого разрешения и хромоэндоскопии [4].
При отсутствии эндоскопически определяемых патологических изменений у пациентов с дисплазией рекомендуется выполнять немедленную повторную оценку с применением эндоскопии высокого разрешения и хромоэндоскопии (виртуальной или с применением красителя) [4].
Пациентам с неопределенной дисплазией, дисплазией, как и с карциномой, диагностированными на основании результатов неприцельной биопсии, необходимо дообследование и лечение только в клиниках, специализирующихся на диагностике и эндоскопическом лечении рака желудка [4].
Неинвазивные методы диагностики предраковых изменений слизистой оболочки желудка
Низкий уровень пепсиногена I в сыворотке крови и (или) низкое соотношение пепсиногена I/II позволяет выявлять пациентов с атрофическим гастритом на поздних стадиях. У таких пациентов рекомендуется выполнять эндоскопию, в особенности при отрицательном результате серологического теста на H. pylori. В качестве предельных значений указывается уровень пепсиногена I
* ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, Москва
** ФГБОУ ВО ОмГМУ МЗ РФ, Омск
*** МЦ ЦБ РФ, Москва
**** ФГБОУ ВО СибГМУ Минздрава России, Томск
# ФГБОУ ВО КубГМУ Минздрава России, Краснодар
## ГБУЗ ГБ № 3 г. Сочи Минздрава КК, Сочи
### ИГМАПО — филиал ФГОУ ДПО РМАНПО Минздрава России, Иркутск
#### ФГБОУ ВО КрасГМУ им. проф. В. Ф. Войно-Ясенецкого Минздрава России, Красноярск
@ ФГБОУ ВО УрГМУ Минздрава России, Екатеринбург
@@ ФГБОУ ВО Южно-Уральский ГМУ Минздрава России, Челябинск
Современная стратегия по ведению пациента с предраковыми заболеваниями желудка/ Л. Б. Лазебник, Е. А. Лялюкова, Г. В. Белова, И. В. Долгалёв, Н. В. Корочанская, В. К. Косёнок, А. С. Лялюкова, Е. В. Онучина, М. М. Петрова, Л. В. Прохорова, А. С. Сарсенбаева
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 60-64
Теги: хронический атрофический гастрит, кишечная метаплазия, аденокарцинома желудка
Гиперплазия
Оглавление
Под гиперплазией понимают изменение строения тканей, сопровождающееся увеличением в них количества составляющих их клеток. При этом в клеточных элементах растет количество внутренних структур. Такое разрастание тканей связано с тенденцией к ускоренному клеточному делению под действием физиологических (естественных) или патологических причин. Оно может привести к увеличению органа или его части в размере, что напоминает доброкачественную опухоль.
Гиперплазия может быть предраковым состоянием. При дальнейшем увеличении количества клеток в них появляются мутации, характерные для опухолевого роста, меняется форма. Поэтому необходимо своевременное распознавание этого процесса и лечение соответствующих заболеваний.
Классификация гиперплазии
Гиперплазии в первую очередь подвергаются клетки, которые и в норме достаточно быстро делятся. Чаще всего они выстилают слизистые оболочки (эндотелий), образуют железы (железистая гиперплазия) или входят в состав иммунной системы (лимфоидная гиперплазия).
В зависимости от распространенности патологического процесса различается очаговая гиперплазия, диффузная, а также подобные клетки могут образовывать ограниченные образования – узлы и полипы.
Примером физиологического процесса служит гиперплазия молочных желез во время беременности и грудного вскармливания. При этом разрастаются клетки, секретирующие молоко. Этот процесс обратимый, впоследствии железистая ткань постепенно сменяется жировой.
При заболевании в начальной стадии под действием патологических стимулов возникает доброкачественная гиперплазия. Она проявляется лишь увеличением количества клеток в ткани без изменения их свойств. В дальнейшем в таких клетках происходят структурные изменения, и процесс приобретает черты предракового. Так возникает, например, атипическая гиперплазия эндометрия.
Причины и признаки гиперплазии
Основные причины гиперплазии:
Гиперплазия считается естественной реакцией организма на воздействие какого-либо стимула, например, гормона. При устранении провоцирующего фактора постепенно исчезают и симптомы гиперплазии. Этим она отличается от неопластических процессов, лежащих в основе рака и доброкачественных опухолей, которые не реагируют на прекращение действия вредного фактора. Однако патологическая гиперплазия может постепенно трансформироваться в неоплазию.
Симптомы и диагностика гиперплазии
Диагноз этого состояния основан на морфологической характеристике тканей, то есть на обнаружении увеличенного количества клеток при исследовании под микроскопом. Для этого используются разные виды биопсии – мазок, соскоб с поверхности эндотелия, пункция, щипковая, браш-биопсия и так далее. При обнаружении патологических изменений ставится предварительный диагноз заболевания и проводится его дальнейшая диагностика – анализы крови на гормоны, УЗИ органов и другие необходимые исследования.
Наиболее часто встречаются такие клинические формы:
Лечение гиперплазии
Эти морфологические изменения тканей могут привести:
Лечение гиперплазии зависит от того, в каком органе она сформировалась и насколько она выражена. Например, при поражении эндометрия необходима консультация гинеколога, а сама терапия включает назначение лекарственных препаратов, выскабливание при кровотечении или другие хирургические методы.
При гиперплазии щитовидной железы может быть достаточно восстановить поступление йода в организм. Если образовавшийся узел слишком крупный и сдавливает трахею, мешает дыханию и глотанию, его удаляют хирургическим путем.
Гиперплазия простаты лечится с помощью лекарственных средств, а при их неэффективности назначается операция – резекция железы.
Определить, как лечить гиперплазию в каждом индивидуальном случае, может только врач. Народные методы в этом случае будут малоэффективны, а отсутствие своевременной помощи может стать причиной злокачественного перерождения гиперплазированных тканей.
Преимущества клиники для всей семьи «Мама Папа Я»
Сеть семейных клиник «Мама Папа Я» приглашает на обследование и лечение при гиперпластических процессах любой локализации:
Для записи на прием приглашаем позвонить по телефону, указанному на сайте, или заполнить соответствующую заявку.
Рекомендовано к прочтению:
© Сеть семейных клиник
«Мама Папа Я», 2018
Пролиферация покровно ямочного эпителия желудка что это такое
Изучение заболеваний желудочно-кишечного тракта, в частности желудка и двенадцатиперстной кишки, является основой узкого направления медицины – гастроэнтерологии. Причин возникновения заболеваний желудка множество: неправильное питание, стрессы, нарушение режима труда и отдыха, воздействие вредных веществ, активность бактерий Helicobacter pylori и т.д. [1–3]. Желудок – важный орган, отвечающий за общее состояние организма, из-за желудочных состояний страдают все системы. Поэтому важно знать причины болезней желудка, основные его заболевания. Если рассматривать заболевания желудка с ракурса онкологии, то предвестниками данной патологии могут стать часто встречающиеся в повседневной практике гастроэнтерологов язвенная болезнь желудка, острый и хронический гастрит, дуоденогастральный рефлюкс, полипы, а также эрозия желудка. В ходе мониторинга пациентов стационарного и амбулаторного лечения данная группа заболеваний желудочно-кишечного тракта занимает лидирующее положение среди расстройств, которые в совокупности различных факторов окружающей среды, а также индивидуальных особенностей чаще других приводят к канцерогенной активности. Любое предраковое заболевание развивается поэтапно с нарастанием и углублением отрицательных изменений, происходящих в желудке. На некоторых стадиях любой процесс полностью обратим, то есть болезнь излечима. По мере углубления деструкции возможность обратимости снижается, наступает стойкая хронизация процесса, а болезнь становится неизлечимой. Переходу в предрак или рак способствуют наиболее глубокие стадии, когда болезнь развивается внутри клеток. Гастрит – это одно из наиболее распространенных желудочно-кишечных заболеваний воспалительного или воспалительно-дистрофического характера, поражающих слизистую оболочку желудка [4]. В связи со множеством разновидностей этой болезни термин «гастрит» является собирательным и служит для обозначения различных по происхождению воспалительных и дистрофических изменений в слизистой этого органа. Гастриты классифицируют по нескольким показателям – по типу, локализации воспалительного процесса, этиологическому фактору, эндоскопической картине, морфологическим изменениям слизистой оболочки желудка. Все эти показатели очень важны для диагностики и выбора способа лечения заболевания. Особого внимания заслуживает атрофический гастрит – длительно текущая форма хронического заболевания, при которой происходят деструктивные изменения в слизистой оболочке желудка. В результате патологического процесса ее площадь и количество функционирующих клеток резко уменьшаются. Многие специалисты считают [5–7], что этот подвид хронического гастрита является предраковым состоянием, как следствие угроза развития злокачественного процесса очень велика. При атрофическом гастрите запускается механизм перерождения нормальных клеток желудка; главные и добавочные клетки, принимающие участие в выработке пепсиногена и хлороводородной кислоты – основных составляющих желудочного сока, перестают функционировать в оптимальном режиме. Вместо него добавочные клетки желудка в большем объеме начинают продуцировать мукополисахариды – слизь. В результате резко снижается кислотность желудочного сока. То, что клетки меняют свою специализацию и перестают выполнять основную функцию, свидетельствует о том, что в организме есть сбой в системе гормональных, иммунных, ферментных и прочих регуляторов физиологических процессов. Язвенная болезнь желудка является одной из основных причин заболеваемости и смертности среди более семи миллионов ежегодно диагностируемых патологий желудочно-кишечного тракта [8]. Диагностика язвенной болезни желудка и двенадцатиперстной кишки предполагает наличие таких симптомов, как потеря веса, перенасыщенность, боли в эпигастральной области, чувство переполнения, вздутие живота, тошнота. К сожалению, наличие данных симптомов также вписывается в клиническую картину гастроэзофагеальной рефлюксной болезни, диспепсии и гастрита, в связи с чем диагностирование язвенной болезни желудка затруднено. Бессимптомное протекание данной патологии часто не позволяет провести диагностику на ранних стадиях развития болезни, заболевание остается незамеченным вплоть до клинических проявлений, а именно кровотечений желудочно-кишечного тракта [9]. Слизистая оболочка желудка выстлана одним слоем эпителиальных клеток, который поддерживается тонкими элементами рыхлой соединительной ткани, покрытой тонким слоем гладких мышечных волокон. У многих людей желудочный эпителий, помимо собственных кислых и ферментативных выделений желудка, подвергается воздействию Helicobacter pylori. Маленькие грамотрицательные палочки Helicobacter pylori обладают уникальной приспособленностью к колонизации желудка человека [10]. Наличие данных микроаэрофильных микроорганизмов приводит к возникновению ряда субклинических и клинических показателей, которые зависят от свойств заражающего штамма, хозяина и окружающей среды [11]. Ряду пациентов с язвенной болезнью желудка или развивающейся лимфомой желудка, которые ранее подвергались лечению с использованием нестероидных противовоспалительных препаратов, показана эрадикационная терапия. Но нельзя игнорировать тот факт, что данная терапия может ухудшить гастроэзофагеальную рефлюксную болезнь и увеличить риск развития рака пищевода [12]. Желудочные полипы представляют собой аномально растущую массу клеток, которые образуются на слизистой оболочке желудка. Наличие данной патологии является редкостью, и чаще всего заболевание протекает бессимптомно [13]. Большие полипы вызывают кровотечение, анемию, боль в животе или редко могут приводить к обструкции из-за своей локализации. Только определенные типы полипов способны обладать канцерогенной активностью и увеличивать риск развития онкологии в будущем, и в зависимости от этого выбирается дальнейшая стратегия лечения, которая может включать как хирургическое удаление полипа, так и мониторинг его изменений, и консервативное лечение [14].
Оценка морфологической структуры клеток возможна с помощью цитологического исследования, которое широко применяют в клинической практике как исключительно чувствительный, точный, эффективный метод диагностики злокачественных опухолей и ряда неопухолевых поражений всех органов пищеварительной трубки у больных с симптомами заболевания органов ЖКТ, а также при скрининге в группах высокого риска по развитию рака этих органов [15]. Микроскопически злокачественные клетки выстилают желудочные железы и крипты и представляют собой эпителиальные клетки, прорывающиеся через базальную мембрану и вторгающиеся в подслизистую оболочку и мышечный слой. Отдельные клетки теряют свою дифференцированность по отношению к соседним клеткам и представлены многочисленными митотическими фигурами [16]. Для предупреждения развития онкологических заболеваний важно раннее выявление таких состояний, а также их качественное обследование. Внедрение и максимальное использование современной эндоскопической техники значительно расширило возможности цитологической диагностики органов ЖКТ и, более того, открыло перспективы применения метода, поскольку цитологический материал пригоден для проведения имеющих неоценимое дифференциально-диагностическое значение иммуноморфологических, молекулярно-биологических и генетических исследований [17, 18].
Провести сравнительный анализ и выявить характерные морфологические цитологические признаки при различных доопухолевых заболеваниях желудка.
Материал и методы исследования
Результаты исследования и их обсуждение
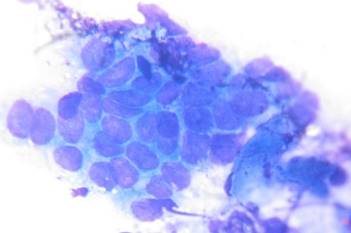
Рис. 1. Клетки покровно-ямочного эпителия с признаками гиперплазии
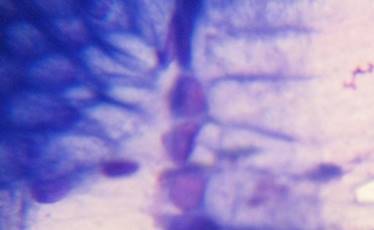
В случаях кишечной метаплазии в мазках-отпечатках обнаруживались высокие клетки цилиндрической, призматической или бокаловидной формы (рис. 2).
Рис. 2. Клетки покровно-ямочного эпителия с признаками кишечной метаплазии по тонкокишечному типу
Наблюдаются ядра больших и средних размеров, их расположение в клетках эксцентричное, окрашены интенсивно. Цитоплазма характеризуется базофильной окраской, у ядра и апикальной части почти прозрачная, широкая в апикальной части и узкая, более вытянутая в базальной. В исследуемых тканях имеются скопления лимфоидных элементов, а также плазматические клетки и сегментоядерные нейтрофилы. Эндоскопическая картина заживающей язвы характеризуется уменьшенной гиперемией слизистой оболочки, отсутствием некротических тканей и гнойных масс. Исчезает глубина язвы, воспаленные края язвы сглаживаются, формируется «красный рубец» – гиперемированная ткань слизистой оболочки, которая впоследствии после втяжения стенок формирует соединительнотканный «белый рубец» [23, 24]. Микроскопическое строение слизистой оболочки зависит от периода развития язвы. В цитологических мазках определяли десквамированные клетки эпителия, лейкоциты и эритроциты, фибробласты, гистиоциты, плазматические клетки и лимфоциты. Непосредственно по краю хронической язвы слизистая оболочка желудка подвергается значительному утолщению за счет интенсивной пролиферации ямочного эпителия. В цитологических препаратах можно найти все упомянутые выше клеточные элементы. В материале, полученном с краев хронической язвы, обычно обнаруживали полиморфные, различной степени зрелости клетки покровно-ямочного эпителия. Преобладание незрелых крупных клеток с большими ядрами и базофильной цитоплазмой может свидетельствовать об интенсивной пролиферации эпителия. В период обострения язвы в большом количестве встречаются дегенеративно измененные эпителиальные клетки без четких границ с укрупненными ядрами. Рисунок хроматина в них разреженный, в виде грубых волокон. В связи с большим клеточным распадом и явлениями цитолиза в материале, особенно полученном со дна язвы, можно видеть много «голых» ядер. В этих препаратах преобладали сегментоядерные лейкоциты и в значительном количестве встречаются элементы грануляционной ткани. В период рубцевания язвы в мазки попадают очень полиморфные клетки гистиоцитарного типа, которые бывает трудно отличить от атипических эпителиальных клеток [25]. В ходе эндоскопического исследования полипов оценивались количество, форма, размеры, поверхность, цвет, консистенция, воспалительные процессы и локализация новообразований. Цитологические препараты характеризовались большим количеством пластов и скоплений покровно-ямочного эпителия. При аденоматозных полипах встречаются также и железистоподобные структуры. По сравнению с цитологическими описаниями гастритов при этих заболеваниях отмечалось преимущество незрелых клеток, ядра светлые, укрупнены, рисунок хроматина нежно-сетчатый. Клетки эпителия желез и лимфоидные элементы определяются в небольшом количестве. В случаях грануляционных полипов с обильными воспалительными инфильтратами в их строме в цитологические препараты могут попадать в значительном количестве нейтрофильные лейкоциты.
В ходе проведенных исследований выявлены изменения в составе и морфологии клеток слизистой оболочки желудка, которые наблюдаются при гастрите, полипозе и язве, не являются строго специфическими. При всех этих заболеваниях может определяться различная степень пролиферации покровно-ямочного эпителия: в одних наблюдениях отмечается только незначительный полиморфизм эпителиальных клеток, в других – явно преобладают молодые элементы с некоторыми признаками атипии. Для установления диагноза необходимо применять дополнительные методы исследования, так как на основании только цитологических данных не представляется возможным диагностировать эти процессы.