Пролиферация кератиноцитов что это
Пролиферация кератиноцитов что это
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
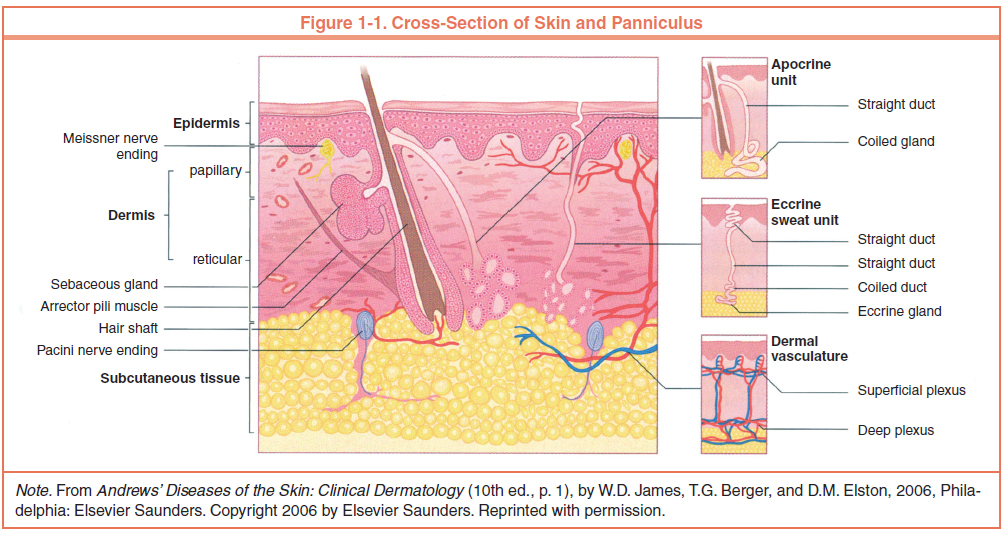
Эпидермис
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
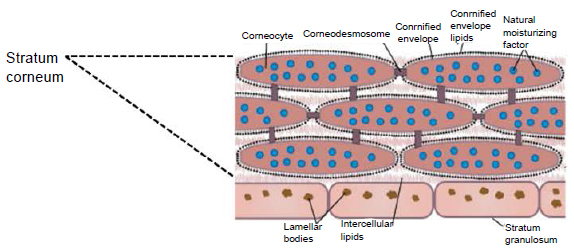
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
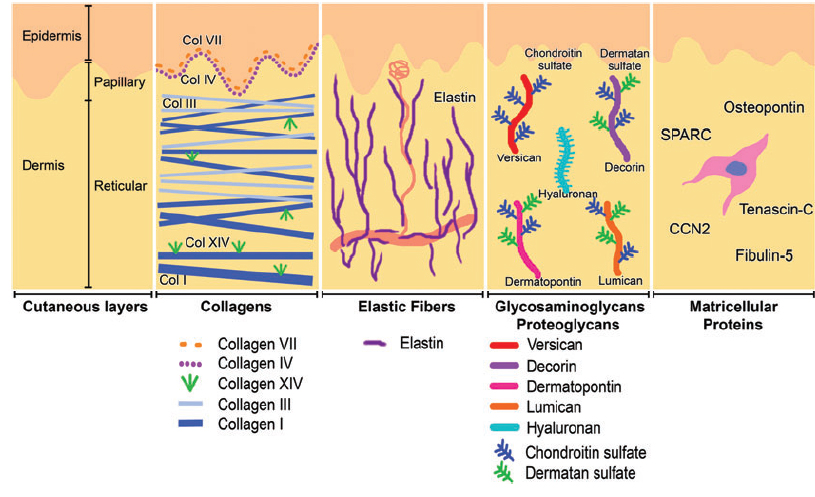
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
Подкожно-жировая клетчатка
Содержание
Дерматология в России
Зарегистрируйтесь!
Если Вы врач, то после регистрации на сайте Вы получите доступ к специальной информации.
Если Вы уже зарегистрированы, введите имя и пароль (форма в верхнем правом углу или здесь).
Кто виноват в развитии псориаза: кератиноциты или иммунные клетки?
Кто виноват в развитии псориаза: кератиноциты или иммунные клетки?
Введение
Псориаз является одним из наиболее распространенных и наиболее изученных иммунно-опосредованных хронических кожных заболеваний, поражающих около 3% населения во всем мире [1]. Помимо кожных проявлений псориаз может оказывать существенное влияние на качество жизни пациента [2]. Хронический бляшечный псориаз, называемый вульгарным псориазом, характеризуется ограниченными эритематозными бляшками, которые покрыты серебристыми чешуйками. В патологический процесс могут вовлекаться любая часть тела, но чаще всего разгибательные поверхности (такие как локти и колени) и кожа головы.
В 1985 году Heng et al. [3] попытались описать гистологическую картину псориаза на различных стадиях болезни и пришли к выводу, что во всех случаях имеется пролиферация эпидермиса.
В настоящее время хорошо известно, что псориаз является продуктом взаимодействия между факторами окружающей среды и сложным генетическим фоном [1]. Псориатические бляшки характеризуются (1) аномальной пролиферацией и дифференцировкой кератиноцитов, приводящей к гиперплазии эпидермиса, (2) дермальной инфильтрацией дермы различными иммунными клетками и (3) повышенной плотностью кожных капилляров с повышенной проницаемостью в сосудах широкого калибра [4]. Несмотря на значительные прорывы в понимании патофизиологии псориаза, последовательность возникновения этих патогномоничных изменений до конца не изучена.
Этот обширный обзор призван обсудить вклад иммунных клеток и кератиноцитов в патогенез псориаза и выделить специфику каждой категории.
Результаты
Проведен обзор литературы, исследующей роль кератиноцитов и иммунных клеток в патогенезе псориаза. Первичный обзор научной литературы проводился в PubMed, Science Direct и Google Scholar. Используемые термины были «псориаз”, “патофизиология”, “патогенез”, “кератиноциты”, “ПСОРЫ”, “генетика”, “иммунитет» и » HLA.- Используемые логические операторы были «и» и «или». Критерии исключения не были определены. Уместность каждой статьи оценивалась внимательным и критическим взглядом на тип и содержание статьи, дату публикации и импакт-фактор публикационного журнала.
Локусы внутри главного комплекса гистосовместимости повышают риск развития псориаза
В связи с его ассоциацией с множественными заболеваниями, начиная от аутоиммунных до злокачественных [10], основной комплекс гистосовместимости (МНС), расположенный на коротком плече хромосомы 6, является одним из наиболее изученных участков генома человека. Среди всех локусов MHC наиболее характерным, несомненно, является классический человеческий лейкоцитарный антиген (HLA). Давно установлено, что HLA ассоциируется с псориазом [11]. МНС признается в качестве основного локуса восприимчивости псориаза; действительно, молекулы класса I на антигенпрезентирующих клетках участвуют в активации Т-клеток, которые имеют решающее значение в патофизиологии псориаза [12].
В пределах области класса 1 MHC локус восприимчивости к псориазу 1 (PSORS1) является наиболее значимым генетическим фактором, определяющим псориаз [13]. На этот локус приходится 50% генетической дисперсии при псориазе [14]. Пациенты с ранним началом псориаза проявляют вариабельность аллеля HLA-Cw6 в локусе HLA-C, по сравнению с пациентами со спорадическим, поздним началом псориаза [7, 15]. Было показано, что наличие HLA-Cw6 влияет на различные аспекты псориаза, включая генетическую восприимчивость, клинические проявления, сопутствующую патологию и эффективность лечения [16]. HLA может инициировать иммунный ответ и, кроме того, HLA-C является субъединицей MHC I, которая позволяет представлять антиген CD8+ Т-клеткам и регулирует их активацию, пролиферацию и цитотоксичность (по данным Cluster 17 Collaboration, 2005). Однако, учитывая сложный характер патогенеза псориаза, необходимы дополнительные исследования для выяснения функциональной роли HLA-Cw6 в псориазе.
Характеристика основных кожно-ифильтрирующих иммунных клеток при псориазе
Преобладающим типом клеток в коже человека является кератиноцит. Кожный цикл включает в себя ряд запрограммированных изменений, которые преобразуют базальные кератиноциты в ануклеарные корнеоциты. Эта трансформация происходит в течение приблизительно 50 дней в здоровой коже, но занимает только 5 дней в пораженной псориатической коже – свидетельство увеличенного оборота клеток при этом заболевании [17]. Среди кератиноцитов встречаются и другие клетки с иммунорегуляторными свойствами [18].
Плазмацитоидные Дендритные Клетки
Хотя патофизиология псориаза еще полностью не выяснена, описаны роли различных клеток в развитии псориаза [18]. Важнейшей ячейкой в фазе инициации псориаза являются плазмоцитоидные дендритные клетки (ПДК). Вирусные и бактериальные частицы могут стимулировать PDCs, активируя toll-подобный рецептор (TLR)7 и TLR9, секрецию IFN-α типа 1 [19], вызывая воспалительный ответ, связанный с псориазом, через активацию миелоидных дендритных клеток (MDCs) [20].
Понимание роли TLRs имеет решающее значение в разгадке патофизиологии псориаза. TLR является фундаментом для способности дендритных клеток распознавать антимикробные частицы и влиять на адаптивную иммунную систему [21]. TLR7 и TLR9 являются высоко гомологичными [22], но распознавание неметилированной CpG-ДНК, экспрессируемой бактериями, приписывается TLR9 [23], а распознавание имидазохинолиноподобных вирусных частиц РНК приписывается TLR7 [22].
Механизм, с помощью которого PDCs инициируют псориазиформную реакцию, может быть частично объяснен наблюдательными исследованиями, проведенными с имиквимодом [24, 25] – синтетическим имидазохинолином, распознаваемым TLR7 [22]. Применение имиквимода на нерезиональной коже чувствительных пациентов [25] индуцирует высвобождение ФДК I типа IFN-α [24, 25] и интерферонового регуляторного фактора 7 (IRF7) [26]. Этот ответ аналогичен тому, который наблюдается, когда PDCs распознают бактериальные и вирусные пептиды [24, 25].
Антимикробный пептид, LL37, идентифицирован как ключевой активатор PDCs in vivo. Было высказано предположение, что высвобождение LL37 активированными кератиноцитами и последующее связывание молекулы с собственной ДНК у восприимчивых особей может вызвать конформационные изменения связанной молекулы ДНК, превращая эту в противном случае безобидную молекулу в агрегированную, плотную структуру, которая распознается ранним рибосомным TLR9, что приводит к продукции IFN-α, но не созреванию PDC [27, 28]. Следовательно, активированные LL37 PDCs мигрируют в эпидермис, где они распознают кератиноцитарно-экспрессированные аутоантигены, которые затем могут увековечить патогенный механизм. Эта гипотеза предполагает, что дизрегуляции LL37 может быть связью между кератиноцитами и ЦПК в патофизиологии псориаза [28]. LL37 также связан с активацией как CD4+, так и CD8+ LL37-специфичных псориатических Т-клеток через их взаимодействие с HLA-DR и аллелями класса I [27].
Миелоидные Дендритные Клетки
Миелоидные дендритные клетки: ось IL-12/IL-23 и IL-17. Путь IL-12/IL-23 был выделен в патофизиологии псориаза [32]. IL-12 представляет собой гетеродимер, состоящий из субъединиц IL-12p35 и IL-12p40. Эти субъединицы могут стимулировать Янус-киназу 2 (JAK2) и тирозинкиназу 2 (TYK2), регулируя сигнал преобразователя транскрипционных (STAT) факторов транскрипции, в частности STAT4 [32]. IL-12 искажает дифференцировку наивных CD4-клеток в IFN-γ-секретирующий Th1 [33].
Подобно IL-12, IL-23 является гетеродимером, состоящим из субъединиц IL-12p40 (IL-12B) и IL-23p19 (IL-12A). IL-23 высоко экспрессируется в псориатической коже [34]. IL-23 также участвует в индукции JAK2 и TYK2, что приводит к преимущественной регуляции STAT3 [33]. Источники IL-23 включают моноциты (также под влиянием CCL20 [29]) В дерме, а также кератиноциты и клетки Лангерганса в эпидермисе. Связывание IL-23 с рецептором IL-23, экспрессируемым Th17 клетками, запускает внутриклеточную нисходящую сигнализацию, что приводит к продукции IL-17A (наиболее мощный активатор IL-17 [35]) и IL-17F [36] (менее мощный, чем IL-17A, несмотря на то, что он на 50% гомологичен [35]). С другой стороны, активация рецептора IL-12 приводит к созреванию Th1 и секреции IFN-γ [33].
Биопрепараты, нацеленные на ось IL-12/IL-23/IL-17, являются терапевтическими модальностями для лечения псориаза [5]. Устекинумаб представляет собой человеческие МАБ таргетирования Ил-12p40, субъединицы, общие как Ил-12 и Ил-23 [39]. Тилдракизумаб представляет собой гуманизированный IgG1 MAB, который имеет высокое сродство к IL-23p19, но не имеет сродства к IL-12 или IL-23p40 [40]. Секукинумаб является первым в своем классе IgG1, полностью человеческим МАБ, нацеленным на IL-17A [41]. Иксекизумаб является гуманизированным IgG4 антителом, которое нейтрализует Ил-17А [42]. Бродалумаб является полностью человеческим, IgG2 анти-Il-17RA MAB, и связывает IL-17RA с высоким сродством; эта активность препятствует взаимодействию между рецептором и IL-17A/E / F, тем самым нарушает путь IL-17 [43].
Т-Лимфоциты
Успех применения циклоспорина А для лечения псориаза [48, 49] выделяет важную роль Т-клеток в патофизиологии псориаза [50]. Быстрое иммуносупрессивное действие циклоспорина связано с подавлением Т-лимфоцитов и последующим снижением уровня IL-2 [48]. Эти наблюдения сформировали представление о том, что псориаз является Т-клеточно-опосредованным заболеванием [51]. Однако концепция псориаза как строго Th1 / Th2 – зависимого заболевания была недавно оспорена открытием других Т-клеток, таких как CD4+ Th17 (клетки, которые продуцируют IL-17 [65], IL-23 [52], IL-22 [53], IFN-γ и TNF-α) и Тh22 клетки, которые продуцируют IL-22. Повышенные уровни IL-22 в плазме крови были связаны с тяжестью заболевания [53]. Th22 клетки могут работать совместно с другими IL-22-продуцирующими клетками в эпителии, такими как NK22 [53], IL-22, IL-17 и INF-γ мРНК [54].
Другие Т-клетки, участвующие в патофизиологии псориаза, включают дермальные γδ [55], дендритные эпидермальные [56] и vγ9vδ2 [38] клетки. Дермальные γδ Т-клетки конститутивно экспрессируют рецепторы IL-23, что делает их восприимчивыми к действию цитокинов и последующему высвобождению IL-17. Было показано, что кожные антиген-положительные и CCR-6-положительные Т-клетки Vγ9Vδ2 тяготеют к напряженной коже, активируя кератиноциты высвобождением IL-17A, а затем TNF-α и INF-γ. Успешное лечение активных псориатических бляшек приводит к повышению уровня циркулирующих Т-клеток Vγ9Vδ2 до нормального уровня, что свидетельствует о перераспределении Т-клеток Vγ9Vδ2 из очагов поражения кожи в периферическое кровообращение [38]. На противоположном конце спектра, у пациентов с хроническим бляшечным псориазом, CD25high, CTLA-4+ и Fox3high (CD4+CD25high) клетки, известные как регуляторные Т-клетки, имеют недостаточную способность подавлять Т-клеточный ответ [57].
С другой стороны, Т-клеточная молекулярная мимикрия была предложена в качестве потенциального объяснения тесной связи между микробиомом кожи [58] и псориазом. Известно, что поверхностные антигены стрептококка высоко гомологичны кератинам человека, в частности кератину 1 типа [59]. Эта гомология может привести к перекрестной реактивности с последующими Т-клеточными опосредованными ответами [60].
Псориаз – кератиноцит-управляемая болезнь
Внутренние изменения в эпидермальных кератиноцитах также могут участвовать в патогенезе псориаза аутокринным или паракринным способом. Это еще больше ставит под сомнение концепцию псориаза как заболевания, опосредованного исключительно активацией Т-клеток [18, 61]. Эта теория подтверждена с помощью исследования на мышах, лишенных В- и Т-лимфоцитов, которым пересаживали здоровую кожу, либо с патологическими изменениями. Псориазиформную реакцию давало первое потомство мышей после инъекции иммуноцитов [62].
Иммуномодулирующие функции кератиноцитов
Эпидермальный барьер является первой линией защиты от повреждения кожи и вторжения патогенов. Кератиноциты являются основным источником ингибирующих цитокинов. Эти цитокины позволяют коже «быть спокойной», не реагировать воспалительной реакцией, в отсутствие триггеров, которые в противном случае активировали бы местные дендритные клетки [63]. Однако дисбаланс между анти- и провоспалительными сигналами может привести к развитию хронических воспалительных заболеваний кожи, таких как псориаз и атопический дерматит [61]. Через рецепторы клеточной поверхности кератиноциты также способны регулировать иммунный ответ. Как упоминалось ранее, псориатическая кожа инфильтрируется различными иммунными клетками [18]. Кроме того, при активации кератиноциты могут косвенно привлекать иммунные клетки в кожу через высвобождение мощных хемокинов. Была подчеркнута роль CXCL8, поскольку считается, что он отвечает за накопление внутриэпидермальных нейтрофилов [64]. Другие цитокины, такие как ccl2, ccl5, cxcl10 и cxcr3 лиганды, преимущественно привлекают моноциты и Th1-клетки [65]. Напротив, CCL20 и IL-18 рекрутируют клетки Лангерганса, дендритные клетки и CLA+ Т-клетки [66, 67].
Другой важной ролью кератиноцитов является их способность функционировать как антигенпрезентирующие клетки, инициирующие или усиливающие активность иммунных клеток путем экспрессии антигенов HLA [68]. Как упоминалось ранее, HLA-Cw 0602 является аллелем заболевания в локусе PSORS1 [69]. Известно, что кератиноциты могут экспрессировать антигены HLA I и II классов при стимуляции [70, 71], но функцию этой способности в патогенезе псориаза еще предстоит понять.
Рецепторы клеточной поверхности позволяют кератиноцитам играть важную роль в качестве ключевых регуляторов как врожденного иммунитета, так и адаптивного иммунитета. Они взаимодействуют с сохраненными микробными структурами, названными патоген-связанные молекулярные картины (PAMPs), как липополисахарид и ДНК CpG. Семейство TLR является наиболее важной группой рецепторов клеточной поверхности, экспрессируемых преимущественно иммунными клетками и кератиноцитами при патологических состояниях [72, 73]. Изучена экспрессия TLR в псориатическом эпидермисе, но полученные результаты не дают целостной картины. В одном исследовании экспрессия TLR2 была усилена в верхних слоях эпидермиса при псориазе, но экспрессия была сильнее в нижних слоях нормальной и нерезиональной кожи [74]. Другое исследование показало, что экспрессия TLR5 была снижена в базальных кератиноцитах пораженной псориатической кожи по сравнению с нормальной кожей [75]. Еще одно исследование показало, что TLR1 был высоко экспрессирован в псориатическом эпидермисе [76]. Помимо существенной роли TLRs как в врожденных иммунных реакциях, так и в адаптивных иммунных системах, функциональные роли экспрессии TLR в кератиноцитах еще предстоит исследовать.
Внутренние изменения в эпидермальных кератиноцитах могут быть вовлечены в регуляцию основных воспалительных путей. Это было проиллюстрировано на трансгенной модели мыши, которая несла эпидермальную кератиноцитарно-специфическую делецию IkB, негативного регулятора пути трансдукции NF-kB, который участвует в синтезе важных провоспалительных цитокинов. У этих мышей вскоре после рождения развилось тяжелое воспалительное заболевание кожи [77].
Идея эпидермиса как основного места для организации эпидермального и отдаленного воспаления, связанного с воспалительным заболеванием кожи, была также обоснована в исследованиях с трансгенными моделями мышей. Изучая трансгенных мышей с делецией тристетрапролина (TTP/Zfp36; кератиноцит-специфический ген), Andrianne et al. [78] иллюстрируют, как ТТП действует как РНК-связывающий белок, который понижает экспрессию генов, кодирующих провоспалительные цитокины в эпидермисе кожи. У таких мышей развился псориазоподобный фенотип, сопровождающийся сильной воспалительной реакцией. Кроме того, эта воспалительная реакция не происходила, когда ТТП был специфически удален в иммунных клетках, таких как дендритные клетки или лейкоциты. В другой трансгенной мышиной модели у мышей, истощенных рецептором антагониста IL-1 (IL1rn) (эндогенный ингибитор провоспалительного цитокина, IL-1), развилось тяжелое псориазоподобное заболевание, которое гистологически имитировало псориатическую кожу человека. Более того, исследователи демонстрируют, что это псориазоподобное заболевание развивалось под влиянием ФНО-α [79]. Интересно, что это псориазоподобное заболевание также возникло у мышей IL-1rn-/- SCID [80]. Такие данные свидетельствуют о том, что Т-лимфоциты не являются существенными для развития псориаза.
Аутоантигены кератиноцитов при псориазе
Недавно описанные «аутоантигены псориаза» LL37 [27] (кателицидин – антимикробный пептид) и дезинтегратоподобный и металлопротеазный домен, содержащий тромбоспондин типа 1 мотив-подобный 5 (ADAMTSL5), могут пролить новый свет на патофизиологический механизм псориаза. Аутоантигены можно описать как хемокины, высвобождаемые нативными клетками, которые инициируют или поддерживают патологическое состояние против себя.
Было обнаружено, что ADAMTSL5, ранее считавшийся связанным исключительно с меланоцитами, высоко экспрессируется кератиноцитами и играет роль в активации IL-17-реализующих псориатических клеток [81], а также модуляции микрофибрилл [82]. LL37 и ADAMTSL5 являются потенциальными антигенами, обнаруженными в значительно более высоких концентрациях в пораженной коже, но они также экспрессируются иммунными клетками, которые классически ассоциированы с псориазом, а именно дендритными клетками и макрофагами [83]. Эти аутоантигены также, по-видимому, находятся под влиянием хорошо установленного псориатического лечения, с концентрацией ADAMTSL5 и LL37, регулируемой этанерцептом, иксекизумабом и бродалумабом [83].
Self-ДНК также может рассматриваться как аутоантиген псориаза в силу его способности активировать PDCs после прохождения электростатических LL37-индуцированных конформационных изменений, которые впоследствии позволяют молекуле взаимодействовать с рецепторами TLR9 клеток [28]. LL37 также способен образовывать комплексы с собственной РНК, которые затем взаимодействуют с TLR7 и TLR8, активируя как PDCs, так и классические миелоидные дендритные клетки соответственно [84]. Интересно, что комплексы LL37 и self-ДНК и self-РНК, высвобождающиеся в местах травмы, могут частично объяснить изоморфный феномен при псориазе [85].
Проангиогенная роль кератиноцитов
Кератиноциты являются резервуаром факторов роста для эндотелиальных клеток, таких как сосудистый эндотелиальный фактор роста (VEGF), индуцируемые гипоксией факторы, ангиопоэтины и проангиогенные цитокины, такие как TNF-α, IL-8 и IL-17 [86].
Проангиогенный VEGF является основным фактором, чрезмерно выраженным в псориатической коже. VEGF может высвобождаться активированными кератиноцитами и иммунными клетками [87], способствуя увеличению плотности псориатических кожных капилляров, в дополнение к повышенной проницаемости и дилатации [88]. Расширенные капилляры поддерживают патологически гиперпролиферативный эпидермис и регулируют движение иммунных клеток путем экспрессии молекул межклеточной адгезии (ICAM-1). В дополнение к своим проангиогенным эффектам, VEGF может действовать аутокринным образом и стимулировать пролиферацию опухолевых клеток при злокачественных новообразованиях кожи [89, 90]. Потенциальный аутокринный эффект VEGF на кератиноциты еще предстоит исследовать.
Измененная пролиферация и дифференцировка в кератиноцитах
Эпидермальный гомеостаз поддерживается жестко регулируемым балансом процессов обновления и дифференцировки [91]. Этот гомеостатический баланс нарушается при хронических воспалительных заболеваниях, таких как псориаз, что приводит к аномальной дифференцировке, связанной с сокращением времени дифференцировки клеток [92].
PSORS4-это ген восприимчивости к псориазу в области хромосомы 1q21. Область 1q21 содержит комплекс эпидермальной дифференцировки (EDC) [93], который содержит основные гены, участвующие в эпидермальной дифференцировке. Гены EDC делятся на 3 основных семейства, которые кодируют (А) белки-предшественники ороговевшей оболочки (лорикрин, инволюкрин, пролин), (Б) белки, связанные с кератиновыми нитями (филаггрин, трихогиалин, репетин, хорнерин и корнулин) и (В) кальцийсвязывающие белки S100 [94]. Измененная эпидермальная дифференцировка является важной отличительной чертой псориатической кожи; поэтому гены EDC считаются кандидатами на ген псориаза.
Псориатическая кожа проявляла сверхэкспрессию кальцийсвязывающих белков, S100A7, S100A8 и S100A9 [95]. Белки S100 являются ключевыми регуляторами внутри-и внеклеточных биологических путей, которые регулируют клеточную пролиферацию, дифференцировку, гибель и иммунные реакции. Показано, что белки S100A8/S100A9, называемые комплексом калпротектина, сверхэкспрессируются в трансгенной мышиной модели псориаза, в которой отсутствует эпидермальная экспрессия cJun и JunB [96, 97]. cJun и JunB принадлежат к семейству белков-активаторов транскрипционного фактора 1 (AP-1), который включает димеры, главным образом состоящие из критических эпидермальных гомеостатических факторов, Jun и Fos [98]. Интересно, что JunB находится в локусе PSORS6 [96]. Как уже упоминалось ранее, фенотип псориаза наблюдался у мышей Rag-2, которые имеют эпидермальные делеции cJun и JunB. Это наблюдение позволило предположить, что дисрегулированная активность AP-1 может быть причинно вовлечена в инициацию развития заболевания до возникновения воспаления [96].
Во время прогрессирования псориаза, рост кератиноцита повышен через активацию аутокринной петли. Эта петля включает в себя различные факторы роста, такие как инсулиноподобный фактор роста, фактор роста кератиноцитов, трансформирующий фактор роста α (TGF-α), амфирегулин и члены ингибирующего семейства TGF-β [99, 100].
Выводы
Несмотря на неоспоримый факт, что активированные Т-клетки имеют решающее значение для развития и персистенции псориатических поражений, патофизиология заболевания не может быть объяснена исключительно ролью Т-лимфоцитов. Другие резидентные клетки кожи, включая кератиноциты и дендритные клетки, способствуют развитию псориатических бляшек. Этот клеточный вклад сочетается с сильным, сложным генетическим влиянием.
В этом обзоре авторы выделили и попытались связать основные научные прорывы, которые выявили ключи к патофизиологии псориаза. Они стремились упорядочить различные патофизиологические механизмы, способствующие развитию псориатических бляшек
(Рис.1). 1). Точная последовательность событий, которые приводят к инициации каскада патологических изменений при псориазе остается неизвестной, но идентификация ранних триггеров и роль, которую играют кератиноциты, могут обеспечить новые, перспективные терапевтические мишени для профилактики и контроля над болезнью.