Прокинетики что это за лекарства
Перспективы применения нового прокинетика с двойным механизмом действия в терапии гастроэзофагеальной рефлюксной болезни
И.В. Маев, А.А. Самсонов, А.Н. Одинцова, Е.В. Белявцева, М.Г. Задорова
ГОУ ВПО РГМУ Росздрава, Москва Обсуждаются проблема развития гастроэзофагеальной рефлюксной болезни (ГЭРБ) и тактика ее лечения с учетом основных патогенетических механизмов. На сегодняшний день ведущим направлением в лечении ГЭРБ является кислотосупрессивная терапия, в частности, с использованием ингибиторов протонной помпы (ИПП). Однако с учетом того, что даже самые эффективные ИПП не влияют на первопричину болезни – нарушение двигательной функции пищеварительного тракта, при лечении больных ГЭРБ дополнительно показано использование лекарственных средств, обладающих прокинетическим эффектом на верхние отделы желудочно-кишечного тракта. Препаратом нового поколения прокинетиков является итоприда гидрохлорид (Ганатон) – антагонист дофаминовых D2-рецепторов и блокатор ацетилхолинестеразы. Особенности фармакодинамики и фармакокинетики Ганатона позволяют применять его у больных ГЭРБ в режиме длительной противорецидивной терапии как в комбинации с ИПП, так и в виде монотерапии.
Ключевые слова: гастроэзофагеальная рефлюксная болезнь, нижний пищеводный сфинктер, дуодено-гастральный рефлюкс, прокинетики, итоприда гидрохлорид, ингибиторы протонной помпы
В развитии многих распространенных гастроэнтерологических заболеваний, в первую очередь гастроэзофагеальной рефлюксной болезни (ГЭРБ), важную роль играют нарушения двигательной функции пищеварительного тракта. В основе развития ГЭРБ лежит нарушение моторно-эвакуаторной функции органов эзофагогастродуоденальной зоны, приводящее к систематическим, длительным забросам в пищевод желудочного и дуоденального содержимого, являющегося повреждающим агрессивным агентом для слизистой оболочки пищевода.
Патогенетические механизмы развития ГЭРБ
Считается, что ГЭРБ развивается как результат дисбаланса между агрессивным воздействием забрасываемых компонентов и трехступенчатой системой защиты пищевода, включающей противорефлюксные барьеры, механизмы очищения от кислоты и тканевую резистентность [1–3]. Компоненты, определяющие повреждающие свойства забрасываемых веществ, представлены соляной кислотой, пепсином, солями желчных кислот (связанными и свободными) и панкреатическими ферментами. Повреждение пищевода определяется значением рН желудочного содержимого. Если значение рН нейтральное или щелочное, как у пациентов после гастрэктомии или с атрофическим гастритом, повреждающими агентами являются свободные соли желчных кислот и ферменты поджелудочной железы. Вместе с тем ионы водорода являются основным повреждающим агентом рефлюктата, причем их способность оказывать повреждающее действие зависит и от времени воздействия, и от концентрации, т. е. от рН [2, 4].
Антирефлюксные барьеры, представляющие первую ступень трехступенчатой защиты пищевода, включают нижний пищеводный сфинктер (НПС), интраабдоминальный сегмент пищевода, диафрагмальные ножки, диафрагмально-пищеводную связку, розетку слизистой оболочки и острый угол Гиса [5]. Большое значение придается снижению базального давления в области НПС [6]. НПС и диафрагма – главные структуры, ответственные за создание высокого давления (от 10 до 30 мм рт. ст.) в желудочно-пищеводном переходе. Эта зона предотвращает рефлюкс, поскольку отделяет две смежные зоны низкого давления: в полости желудка (на 5 мм рт. ст.выше атмосферного давления) и в полости пищевода (на 5 мм рт. ст. ниже атмосферного давления). Тоническое давление, создаваемое гладкой циркулярной мышцей НПС, усиливается при сокращении ножек диафрагмы во время вдоха и выдоха и в моменты, когда повышается внутрижелудочное давление, например при чихании, кашле, наклоне туловища [5]. В покое тоническое сокращение НПС поддерживается кроме внутренностного тонуса его мышцы холинергическими возбуждающими нейронами. Краткое расслабление НПС при проглатывании пищи сопровождается перистальтической волной, которая закрывает и очищает просвет пищевода.
Как у здоровых людей, так и при ГЭРБ наблюдается такое явление, как преходящее, транзиторное расслабление НПС [7, 8], которое вызывается чаще всего растяжением стенок желудка при приеме пищи для уменьшения внутрижелудочного давления путем сброса воздуха из газового пузыря желудка (отрыжка воздухом). При этом кроме отрыжки воздухом (часто при расслаблении НПС) возникновение рефлюкса желудочного содержимого объясняется тем, что преходящие расслабления НПС сохраняются в зоне высокого давления так же длительно (около 20 секунд), как и расслабления НПС, инициированные глотанием, но при этом не возникает очищающей просвет пищевода перистальтической волны [9]. У больных ГЭРБ описанные явления отмечаются часто, длительно [10] и являются причиной появления симптомов заболевания (изжоги, отрыжки, срыгивания).
В целом при ГЭРБ описаны три основные ситуации, когда возникает патологический рефлюкс: при преходящем расслаблении НПС, недостаточной функции НПС и вследствие повышенного внутрибрюшного давления.
Причина частого преходящего расслабления НПС при ГЭРБ остается неясной. Вместе с тем все большее число исследователей склоняются к мнению о взаимосвязи патологии запирательного механизма НПС при ГЭРБ с нарушенной моторной активностью желудка, его замедленным опорожнением, приводящим к растяжению стенок органа, или с повышенной чувствительностью к нормальному растяжению желудка, в т. ч. на фоне воспалительного процесса в стенке желудка [11–14]. По мнению Трухманова А.С., с патофизиологической точки зрения ГЭРБ является кислотозависимым заболеванием, развивающимся на фоне первичного нарушения двигательной функции верхних отделов пищеварительного тракта [11]. Более того, ряд авторов утверждают, что нарушение моторной функции желудка может быть важным, если не главным, фактором возникновения и развития ГЭРБ [13, 15–17]. Особое внимание уделяется таким нарушениям моторики желудка и 12-перстной кишки, как желудочные дисритмии, сопровождающиеся замедленной эвакуацией из проксимальных отделов желудка, нарушения антродуоденальной координации и дуодено-гастральный рефлюкс (ДГР) [18–21]. Примечательно, что для антродуоденальной дискоординации характерными симптомами являются изжога, отрыжка кислым, горьким, срыгивание пищи, т. е. характерные симптомы ГЭРБ.
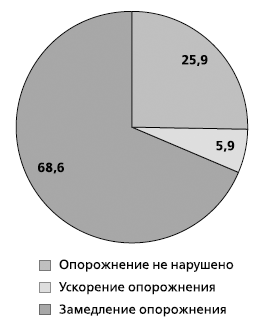
При изучении нами моторной активности желудка и 12-перстной кишки методом динамической гастросцинтиграфии у 204 пациентов с ГЭРБ выявлено значительное преобладание (68,6%) случаев замедленной желудочной эвакуации (рис. 1). Причем при III степени ГЭРБ по классификации Savary–Miller данный тип дисмоторики наблюдался в 100% случаев.
Рис. 1. Частота выявления нарушений эвакуаторной
функции желудка у больных ГЭРБ
(данные динамической гастросцинтиграфики) (%)
Периферическая компьютерная электрогастроэнтерография (ПКЭГЭГ) в 76% случаев выявила изменения по типу функциональной дискоординации моторики желудка и 12-перстной кишки. Причем до приема пищи 23,2% пациентов демонстрировали сниженную электрическую активность желудка при нормальных показателях моторной активности 12-перстной кишки с последующей нормализацией моторики желудка после приема пищи. У 45,8% больных натощак обнаружена повышенная электрическая активность 12-перстной кишки с нормализацией моторной активности после пищевой стимуляции при неизмененных показателях электрической активности желудка, т. е. транзиторная гиперкинезия 12-перстной кишки. В 31% случаев были выявлены пониженные показатели электрической активности 12-перстной кишки натощак, которые нормализовались после пищевой стимуляции с одновременным отсутствием каких-либо изменений электрической активности на частотах желудка. Характерно, что во всех трех случаях, но с разной частотой, наблюдался ДГР, который значительно чаще (93%) регистрировался у пациентов со вторым вариантом дисмоторики.
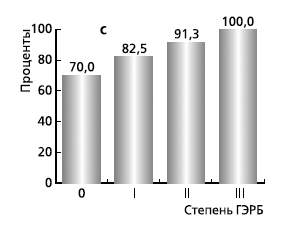
В целом частота выявления ДГР у всех больных ГЭРБ методом ПКЭГЭГ составила 82,4%, возрастая прямо пропорционально степени тяжести болезни (рис. 2). Это подтверждает данные о том, что с ростом степени тяжести ГЭРБ растет и число смешанных рефлюксов (содержимое желудка + содержимое 12-перстной кишки). Такая закономерность не может не учитываться, т. к. именно смешанные рефлюксы в большом числе случаев приводят к такому грозному осложнению ГЭРБ, как пищевод Барретта (появление в пищеводе цилиндроклеточной метаплазии плоского эпителия с угрозой развития в дальнейшем аденокарциномы).
Рис. 2. Частота выявления ДГР
у пациентов ГЭРБ методом ПКЭГЭГ
Также важную роль в патогенезе ГЭРБ играет нарушение моторики самого пищевода, включающее изменение силы и продолжительности перистальтических сокращений, повышение или снижение тонуса его сфинктеров. В патогенезе ГЭРБ имеют значение ослабление перистальтики пищевода, которое приводит к замедлению его опорожнения и снижению сократительной способности стенок пищевода при рефлюксе; снижение давления НПС; избыточная релаксация и деструктуризация его антирефлюксной функции [2].
Немаловажная роль в возникновении моторных нарушений пищевода и желудка, лежащих в основе развития ГЭРБ, отводится дисбалансу парасимпатического и симпатического звеньев нервной регуляции органов желудочно-кишечного тракта (ЖКТ) и как следствие его – нарушению перистальтической активности. Вегетативная регуляция моторно-эвакуаторной активности органов эзофагогастродуоденальной зоны осуществляется с участием основных рецепторов (холинергических, адренергических, дофаминергических, серотониновых, мотилиновых, холецистокининовых) и важнейших мессенджеров, включая гастроинтестинальные гормоны, стимулирующие (ацетилхолин, мотилин, гастрин, серотонин, инсулин, субстанция Р) и тормозящие, угнетающие моторную активность (дофамин, секретин, холецистокинин, оксид азота, глюкагон, соматостатин, энкефалины, вазоактивный интестинальный пептид). Одним из важнейших мессенджеров, оказывающих угнетающее влияние на гладкомышечные элементы желудка, является дофамин, секретируемый в отдельных участках желудочной стенки и действующий через специализированные, здесь же расположенные дофаминовые рецепторы. Дисбаланс координирующего действия стимуляторов и ингибиторов моторики органов пищеварительного тракта, выражающийся, к примеру, в избыточной дофаминовой активности, приводит к гипомоторной дискинезии пищевода, желудка, 12-перстной кишки вплоть до появления некоординированных сокращений, антордуоденальной дискоординации, функциональному гастро- и дуоденостазу. При этом часто наблюдается параллельное снижение давления в НПС, развиваются недостаточность кардии и патологический гастроэзофагеальный рефлюкс.
Определенное значение в развитии моторных нарушений, лежащих в основе патогенеза ГЭРБ, имеют влияние на моторику некоторых компонентов пищи (жиров, шоколада, цитрусовых, томатов, кофе, алкоголя и др.), а также прием медикаментозных средств (холинолитиков, β-адреноблокаторов, антагонистов кальция и доноров оксида азота – нитратов) и курение.
К органическим причинам, приводящим к развитию ГЭРБ, относят рефлюкс при грыже пищеводного отверстия диафрагмы, связанный с исчезновением угла Гиса – важного анатомического элемента запирательного механизма кардии [2].
Все вышесказанное указывает на то, что нарушение моторной активности верхних отделов ЖКТ в патогенезе ГЭРБ является определяющим фактором, который создает условия для контакта агрессивного содержимого желудка со слизистой оболочкой пищевода, возникновения морфологических изменений и клинических проявлений болезни.
Тактика лечения ГЭРБ
Вместе с тем на сегодняшний день ведущим направлением в лечении ГЭРБ является устранение закисления в пищеводе путем блокады кислотной продукции, осуществляемой обкладочными железами желудка с помощью ингибиторов протонной помпы (ИПП); связывания агрессивных компонентов желудочного содержимого; создания препятствия для контакта последних со слизистой оболочкой пищевода (путем применения антацидов, альгинатов).
Следует сказать, что данный подход к лечению ГЭРБ продиктован, с одной стороны, реальными успехами в купировании не только клинических, но и морфологических проявлений болезни, предотвращением осложнений, а при длительной поддерживающей кислотосупрессивной терапии – и стабилизацией состояния на нормальных показателях закисления пищевода. С другой стороны, до последнего времени в арсенале терапевта, гастроэнтеролога отсутствовали эффективные и безопасные средства для коррекции моторных расстройств у больных ГЭРБ, которые бы позволяли осуществлять достаточно длительный контроль моторики, не вызывая побочных эффектов, свойственных имеющимся на фармакологическом рынке прокинетикам.
В связи с этим на сегодняшний день препаратами выбора в лечении ГЭРБ, эффективно подавляющими кислотную секрецию в желудке, являются ИПП, особенно последнего поколения (пантопразол, рабепразол). При эрозивных формах болезни они становятся обязательным компонентом.
Однако следует иметь в виду, что даже самые эффективные на сегодняшний день ИПП не влияют на первопричину болезни – нарушенную функцию запирательного механизма кардии, моторику желудка и 12-перстной кишки, поэтому после прекращения их приема у большей части больных сравнительно быстро возникает рецидив заболевания. В ряде случаев ИПП не устраняют некоторые симптомы, чаще всего ассоциируемые с нарушением моторики пищевода и желудка, гиперчувствительностью желудка к растяжению. В подобных случаях при лечении больных ГЭРБ дополнительно показано использование прокинетиков.
Разбирая особенности средств, обладающих прокинетическим эффектом на верхние отделы ЖКТ, необходимо отдельно остановиться на следующих препаратах:
Опыт применения перечисленных прокинетиков при ГЭРБ, особенно таких препаратов, как метоклопрамид, домперидон и цизаприд, как в нашей стране, так и за рубежом достаточно велик, однако из-за большого спектра побочных эффектов, вызываемых препаратами прежних поколений, и кратковременности их действия целесообразность применения последних нередко ставилась под сомнение [25, 26].
Ганатон в лечении ГЭРБ
Препаратом нового поколения прокинетиков, хорошо зарекомендовавшим себя (по данным нескольких мета-анализов) при лечении ГЭРБ и функциональной диспепсии, зарегистрированным за рубежом, а с 2007 г. и в России, является итоприда гидрохлорид – Ганатон (от “gastric natural tone” – восстанавливающий нормальный тонус желудка). Это новый препарат с комбинированным механизмом действия, являющийся антагонистом дофаминовых D2-рецепторов и блокатором ацетилхолинестеразы. Итоприда гидрохлорид активизирует высвобождение ацетилхолина, одновременно препятствуя его деградации. Он обладает минимальной способностью проникать через гематоэнцефалический барьер, не влияет на продолжительность интервала Q-T и не взаимодействует с лекарственными средствами, метаболизирующимися ферментами системы цитохрома Р450, в т. ч. ИПП, часто применяемыми в лечении ГЭРБ и функциональной диспепсии. Итоприда гидрохлорид оказывает выраженное противорвотное действие, усиливает пропульсивную моторику желудка и ускоряет его опорожнение.
Открытые клинические исследования итоприда гидрохлорида в США, Японии, Германии, Индии и других странах показали высокую клиническую эффективность препарата у больных функциональной диспепсией, хроническим гастритом, диабетическим гастропарезом и ГЭРБ. Препарат отличает хорошая переносимость и отсутствие значимых побочных эффектов. У пациентов с функциональной диспепсией и диабетическим гастропарезом итоприд эффективно стимулирует сократительную способность желудка, ускоряет его опорожнение, устраняет антродуоденальную дискоординацию [27–29].
При использовании итоприда гидрохлорида в составе комбинированной терапии с ИПП у пациентов с ГЭРБ обнаружено, что данный прокинетик достоверно усиливает сократительную активность НПС, что подтверждается увеличением давления в его области, а также усиливает моторную активность желудка, ускоряет желудочную эвакуацию и нормализует нарушенную гастродуоденальную координацию [30]. Важной положительной стороной использования итоприда при ГЭРБ является не только быстрый и стойкий клинический эффект, но и возможность его длительного применения без развития каких-либо значимых побочных эффектов. Так, Inoue K. и соавт. (1999), применяя итоприд по 50 мг 3 раза в сутки в течение 7 недель у больных хроническим гастритом с явлениями рефлюкс-эзофагита, получили хороший клинический эффект: исчезновение жалоб у 67% пациентов с изжогой в отсутствие побочных эффектов [31].
Имеется и отечественный положительный опыт использования Ганатона для лечения больных ГЭРБ. Так, Минушкин О.Н. и Лощинина Ю.Н. (2008) проводили лечение больных ГЭРБ 0–I стадии рецидивирующего течения препаратом Ганатон (в режиме монотерапии) в стандартной дозе (50 мг 3 раза в сутки) в течение 25 дней. На фоне монотерапии Ганатоном изжога была полностью купирована к концу первой недели у 90% больных, а эпителизация эрозий пищевода после полного курса лечения зарегистрирована у всех пациентов с эрозивной формой ГЭРБ. Зарегистрирована также положительная динамика вегетативного статуса и показателей качества жизни пациентов по шкале SF-36 (Short-Form Health Survey).
Таким образом, с появлением на отечественном рынке эффективного и безопасного прокинетика итоприда гидрохлорида (Ганатона) открываются новые возможности проведения полноценной патогенетической терапии ГЭРБ, включая коррекцию моторных расстройств пищевода, желудка и 12-перстной кишки, восстановление их нормальной миоэлектрической активности и взаимной координации.
Применение Ганатона у больных ГЭРБ возможно как в режиме монотерапии при легких формах болезни, так и в составе комбинированного с ИПП лечения.
По-видимому, с учетом особенностей фармакодинамики и фармакокинетики препарата Ганатон возможно его применение у больных ГЭРБ в режиме длительной противорецидивной терапии и в комбинации с ИПП, и в режиме монотерапии. При этом не исключена коррекция стандартных доз обеих составляющих в сторону уменьшения.
Прокинетики: настоящее и будущее
Поиск средств, нормализующих моторно-эвакуаторную деятельность пищеварительного тракта, привлекает внимание врачей-исследователей на протяжении нескольких столетий. Вероятно, одним из первых представителей этой группы является имбирь, издревле применяемый
Поиск средств, нормализующих моторно-эвакуаторную деятельность пищеварительного тракта, привлекает внимание врачей-исследователей на протяжении нескольких столетий. Вероятно, одним из первых представителей этой группы является имбирь, издревле применяемый в традиционной китайской медицине [1] как средство, устраняющее тяжесть в животе и тошноту, обладающий слабой антагонистической активностью в отношении 5-HT3-рецепторов [2]. К настоящему времени средства, воздействующие на моторную активность пищеварительного тракта и препятствующие антиперистальтическим сокращениям гладкой мускулатуры, объединены в группу прокинетиков [3].
Прежде всего, необходимо очертить круг показаний, по поводу которых получены доказательства в эффективности применения прокинетиков.
Во-первых, заболевания пищеварительного тракта, в развитии которых существенную роль играют нарушения моторной активности пищеварительного тракта (гастроэзофагеальная рефлюксная болезнь, постпрандиальный дистресс-синдром как вариант функциональной диспепсии, язвенная болезнь с нарушением антродуоденальной координации, идиопатический гастропарез, функциональная тошнота, функциональный запор, а также синдром раздраженного кишечника — вариант с запором).
Во-вторых, применение прокинетиков в качестве противорвотных средств (например, при тошноте и рвоте, ассоциированных с приемом цитостатиков) [4].
В-третьих, диабетический гастропарез, при котором замедленное опорожнение желудка влияет на вариабельность всасывания глюкозы, что обусловливает трудности контроля гликемии и может привести к хронизации симптомов гастропареза и низкому гликемическому контролю. Сюда же следует отнести и назначение прокинетиков при гастропарезе другой этиологии [5].
Какие же препараты обладают прокинетической активностью?
Домперидон по своей химической структуре также относится к производным бензимидазола, является высокоселективным блокатором периферических допаминовых рецепторов (D) 2-го типа и в отличие от метоклопрамида лишен многих побочных эффектов ввиду отсутствия проникновения препарата через гематоэнцефалический барьер [6]. Подавляя влияние дофамина, домперидон увеличивает спонтанную активность желудка, увеличивает давление нижнего пищеводного сфинктера и активирует перистальтику пищевода и антрального отдела желудка. Препарат также усиливает частоту, амплитуду и продолжительность сокращений двенадцатиперстной кишки и уменьшает время пассажа пищевых масс по тонкой кишке.
Метоклопрамид. Метоклопрамид по своей химической структуре относится к подтипу бензамидов с несколькими прокинетическими механизмами (рис.): агонизм 5-гидрокситриптамин (НТ) 4-рецепторам, антагонизм по отношению к центральным и периферическим допамин (D) рецепторам 2-го типа, а также прямая стимуляция сокращений гладкой мускулатуры пищеварительной трубки [7].
Прокинетический эффект метоклопрамида ограничен верхними отделами пищеварительного тракта, он повышает тонус нижнего пищеводного сфинктера, усиливает моторику желудка и тонкой кишки, ускоряет опорожнение желудка, улучшает антродуоденальную координацию. Однако, наряду с доказанной эффективностью, назначение метоклопрамида ограничено развитием побочных эффектов [8] (около 30%), а именно экстрапирамидными расстройствами, головной болью, головокружением, сонливостью, депрессией и гормональными нарушениями: гиперпролактинемией с галактореей, гинекомастией, нарушениями менструального цикла.
Метоклопрамид и домперидон оказывают противорвотный эффект, который обусловлен подавлением активности хеморецепторных триггерных зон, расположенных на дне четвертого желудочка вне пределов гематоэнцефалического барьера. Однако способность действовать на аденогипофиз, также лишенный гематоэнцефалического барьера, способствует при длительном применении домперидона у части пациентов повышению уровня пролактина в сыворотке крови, приводящему к развитию гинекомастии, галактореи и аменореи. Следует подчеркнуть, что это нежелательное явление становится клинически значимым лишь при длительном применении препарата (например, если домперидон назначается у больных болезнью Паркинсона). Так, при применении домперидона в суточной дозе 80 мг (в течение 12 лет) частота нежелательных явлений не отличается от плацебо, при этом препарат переносится лучше, чем метоклопрамид в дозе 40 мг/сут [9]. Домперидон широко применяется в клинической практике как эффективный и безопасный прокинетик. Даже в странах с жесткими требованиями к отпуску безрецептурных средств этот препарат обычно продается без рецепта, например, в Германии он доступен при условии, что общая доза домперидона в упаковке не превышает 200 мг.
Итоприда гидрохлорид является одновременно антагонистом допаминовых рецепторов и блокатором ацетилхолинэстеразы. Препарат активирует освобождение ацетилхолина и препятствует его деградации, обладает минимальной способностью проникать через гематоэнцефалический барьер в центральную нервную систему, включая головной и спинной мозг. Метаболизм препарата позволяет избежать нежелательного лекарственного взаимодействия при приеме лекарственных препаратов, метаболизирующихся ферментами системы цитохрома Р450. Как показали экспериментальные и клинические исследования [10, 11], итоприда гидрохлорид усиливает пропульсивную моторику желудка и ускоряет его опорожнение. Кроме того, препарат оказывает противорвотный эффект, которой реализуется благодаря взаимодействию с D2-дофаминовыми хеморецепторами триггерной зоны.
Цизаприд — агонист 5-HT4-рецепторов с незначительной антагонистической активностью в отношении рецепторов 5-HT3, был отозван с рынка США в 2000 году в связи с многочисленными сообщениями о внезапной смерти (удлинение интервала Q-T, опасные желудочковые аритмии) [12]. В последующем были созданы препараты с аналогичным прокинетическим механизмом. Так, еще один агонист 5-HT4-рецепторов мозаприд продемонстрировал влияние на ускорение опорожнения желудка в исследованиях с участием здоровых добровольцев, а также в случаях диабетического гастропареза. В отличие от цизаприда, мозаприд оказывает незначительное влияние на активность каналов калия [13], в связи с чем имеет существенно меньший риск в отношении нарушений сердечного ритма. Прокинетическая активность другого препарата этой подгруппы — рензаприда обусловлена двумя механизмами: агонизмом с рецепторами 5-HT4 и антагонизмом по отношению к 5-HT3-рецепторам. К настоящему моменту уровень доказанности данных по эффективности и безопасности мозаприда и рензаприда не определен за недостаточностью данных. Тегасерод — агонист 5-HT4 пресинаптических рецепторов [14] с преимущественной стимуляцией перистальтической активности толстой кишки. Teгасерод улучшает консистенцию кала и способствует появлению позывов к дефекации у пациентов с хроническим запором. Однако согласно проведенным в 2007 году по инициативе FDA 29 рандомизированным, контролируемым исследованиям с коротким периодом наблюдения (1–3 месяца) тегасерод повышает риск кардиоваскулярных событий (в т. ч. стенокардии), в результате чего этот препарат был полностью изъят с американского фармацевтического рынка в апреле 2008 года. В настоящее время из препаратов этой подгруппы применяются также алосетрон и рамосетрон (антагонисты 5-HT3-рецепторов) с более хорошим профилем безопасности. Тем не менее окончательно говорить о высоком профиле безопасности средств этой подгруппы пока еще рано.
Бетанехол — агонист мускариновых рецепторов повышает давление нижнего пищеводного сфинктера, координирует сокращения дна и антрума, ускоряя опорожнение желудка [15]. Однако применение бетанехола ограничено только случаями рефрактерного к стандартной терапии гастропареза ввиду высокой частоты побочных эффектов: абдоминальная боль, бронхоспазм, дизурия, повышение артериального давления и пр.
Агонисты рецепторов мотилина. Полипептидный гормон мотилин вырабатывается в дистальном отделе желудка и двенадцатиперстной кишке, способствует повышению давления нижнего пищеводного сфинктера и повышает амплитуду перистальтических сокращений антрума, стимулируя опорожнение желудка. Антибиотик из группы макролидов эритромицин обладает прокинетической активностью как агонист рецепторов мотилина. Интересно, что эритромицин способствует опорожнению желудка и после ваготомии, а также после антрэктомии [16]. Однако в качестве прокинетика эритромицин вряд ли найдет свою терапевтическую нишу, и дело здесь не только в антибактериальном действии препарата. Эритромицин при длительном приеме (месяц и долее) в 2 раза повышает риск смертности, ассоциированной с нарушением сердечной проводимости [17]. Подобный эритромицину, хотя и менее выраженный эффект в отношении рецепторов мотилина был позднее описан и для других макролидов — азитромицина и кларитромицина. Однако, как и эритромицин, эти антибактериальные средства вряд ли когда-либо найдут применение в практике врача в качестве самостоятельных прокинетиков. Вместе с тем эти препараты дали толчок для синтеза новых молекул с агонистической активностью по отношению к рецепторам мотилина. Один из наиболее перспективных препаратов этой подгруппы — атилмотин [18] продемонстрировал влияние на ускорение опорожнения как жидкой, так и твердой пищи в исследованиях с участием здоровых добровольцев, а также у лиц с диабетическим гастропарезом. Изучение эффективности и безопасности длительного применения атилмотина, как и исследования по созданию новых средств-агонистов мотилина, продолжается. Так, в качестве одного из перспективных средств этой подгруппы прокинетиков изучаются эффекты грелина [19] — нейрогуморального нейротрансмиттера, секретируемого слизистой оболочкой желудка. Грелин относится к физиологическим стимуляторам моторики пищеварительного тракта и структурно связан с мотилином, оказывает прокинетическое действие с нормализацией эвакуации содержимого желудка у пациентов как с диабетическим, так и идиопатическим гастропарезом.
Исследователи продолжают активное изучение новых средств с направленной селективной прокинетической активностью [20], среди которых физостигмин и неостигмин — агонисты мускариновых рецепторов, стимулирующие деятельную активность кишечника и лишь незначительно улучшающие опорожнение желудка; ускоряющие желудочный транзит антагонисты рецепторов холецистокинина локсиглумид и декслоксиглумид, а также ингибитор фосфодиэстеразы-5 силденафил; альфа-2 агонист (адреномодулятор) клонидин, нормализующий эвакуацию содержимого желудка при функциональной диспепсии (постпрандиальный дистресс-синдром), замедляющий кишечный транзит со снижением висцеральной гиперчувствительности толстой кишки.
Широкий спектр показаний, при которых эффективно назначение прокинеков, а также особенности каждой из подгрупп прокинетиков (различные механизмы прокинетического влияния, профиль безопасности, преимущественная активность в отношении верхнего или нижнего этажа пищеварительного тракта) позволяют врачу в каждом клиническом случае выбрать наиболее эффективный и безопасный прокинетик.
По вопросам литературы обращайтесь в редакцию.
М. А. Ливзан, доктор медицинских наук, профессор
ГОУ ВПО «Омская государственная медицинская академия Росздрава», Омск