Пробирка эдта что это
Современные технологии для качественного анализа капиллярной крови
В клинической практике довольно часто возникают ситуации, когда невозможно взять кровь для лабораторных исследований из периферических вен. Это, прежде всего, недоношенные дети и дети первого года жизни, пожилые люди и тучные пациенты, находящиеся в критическом состоянии. Для этого существуют системы, предназначенные для взятия, транспортировки и последующего исследования капиллярной крови. Наибольший спектр микропробирок (микротейнеров со встроенным коллектором) для взятия капиллярной крови с тем же спектром реагентов, что и для пробирок, предназначенных для взятия венозной крови (за исключением пробирок для исследования гемостаза), производится компанией «Бектон Дикинсон». Как известно, лабораторное исследование делится на три основных этапа: преаналитический (внелабораторный), аналитический и постаналитический. Аналитический этап непосредственно связан с функцией лаборатории, и он легко контролируется специалистами лабораторий, а использование современных систем для диагностики (автоматические анализаторы, диагностические наборы, контрольные материалы и калибраторы) сводят к минимуму ошибки на лабораторном этапе. Преаналитический этап в наименьшей степени может контролироваться лабораторией, т. к. значительная часть этого этапа осу ществляется сотрудниками лечебных учреждений. И именно с этим этапом связано до 93% ошибок при производстве анализов [5].
Централизованная клинико-диагностическая лаборатория центра «Охраны материнства и детства» выполняет исследования для 40 лечебных учреждений города Красноярска. Поэтому очень остро стоит вопрос правильной подготовки пациентов и взятия биологического материала у детей. Контроль преаналитических факторов является ключевым для обеспечения качественных результатов. За счет снижения числа ошибок на любом этапе преаналитической подготовки можно существенно улучшить качество исследований, снизить количество повторных проб, сократить расходы рабочего времени и средств на обследование пациентов. Немаловажным является психологический и физический дискомфорт пациента, когда встает вопрос о повторном получении биоматериала (дети и беременные женщины).
В ЦКДЛ выполняются исследования для детей амбулаторно-поликлинической службы города, что составляет 43% от всех выполняемых исследований. И 57% выполняется для пациенток женских консультаций города.
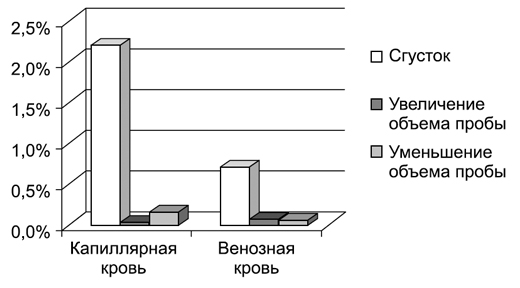
Проведенный анализ отбракованных гематологических проб за год позволил оценить частоту возникновения ошибок на преаналитическом этапе. Исследования гемограмм в среднем в месяц составляют 17 500. Для выполнения гематологических исследований мы используем капиллярную и венозную кровь. Гематологические исследования из капиллярной крови мы проводим только у детей, и эта доля составляет 58%, а 42% составляет исследование венозной крови (это дети старшего возраста и женское население). Процент брака при получении капиллярной крови составил 2,2%, при венепункции процент составил 0,7%. Таким образом, процент ошибок при взятии капиллярной крови в три раза выше, чем при взятии венозной. Основные причины низкого качества взятых проб крови: сгустки в пробе и нарушение объема пробы, которое приводит к нарушению соотношения кровь-антикоагулянт (рис. 1).
Рис. 1. Основные причины низкого качества взятых проб крови
Пробы, полученные со сгустками, составили наибольшую долю ошибок как при получении капиллярной, так и при получении венозной крови. Сгустков в капиллярной крови было получено в три раза больше, чем в венозной. Чем можно объяснить данный факт?
Венозная кровь считается лучшим материалом для лабораторных исследований. При известной стандартизации процессов взятия, хранения, транспортировки венозной крови удается добиться минимальной травматизации и активации клеток, примеси тканевой жидкости, при этом всегда имеется возможность повторить и/или расширить анализ (например: при низком гемоглобине назначить ретикулоциты) и, как следствие, минимизировать необходимость повторных процедур взятия крови (очень важный фактор для детей) и влияние на правильность и точность результатов.
Взятие капиллярной крови для лабораторных исследований возможно в следующих ситуациях:
Анатомическое строение кровеносной системы детей обуславливает необходимость правильно сделать выбор места пункции и медицинского инструментария. В педиатрической практике возможно взятие капиллярной крови из пальца, пятки и в редких случаях из мочки уха. Пункция пальца не должна производиться у младенцев, так как это может привести к повреждению костной ткани. В таком случае подходящим местом прокола для получения образца является пятка у дистальной части пяточной кости. В связи с этим представляется важным использование автоматических ланцетов, гарантирующих низкую травматичность и соблюдение нужной глубины прокола, в зависимости от типа выбранного ланцета. Между объемом получаемой крови и глубиной прокола существует прямая зависимость. В связи с этим тип ланцета должен подбираться в соответствии с местом прокола и объемом получаемого образца. Компания «Бектон Дикинсон» производит одноразовые ланцеты с разным типом прокалывающего устройства: игла или лезвие, а также с разной глубиной прокола. Контактно-активируемые ланцеты BD Microtainer ® c корпусом фиолетового цвета предназначены для получения одной капли крови и гарантируют отсутствие болевого синдрома у пациентов не менее, чем в 90% случаев [2], тогда как ланцеты BD Microtainer ® c корпусом голубого цвета преднзначены для получения до 0,5 мл крови и обеспечивают скорость капиллярного кровотока не менее 2 мкл/с [1]. Для взятия капиллярной крови у новорожденных предпочтение должно отдаваться контактно-активируемым BD Quikheel™ с лезвием, осуществляющим полукруговое режущее движение, что позволяет получить хороший ток крои из ранки не менее, чем в 90% случаев [7].
Учитывая возрастные особенности поведения детей во время процедуры взятия крови (подвижность, эмоциональный стресс и т. д.), следует обратить внимание на последовательность заполнения пробирок. Для корректного забора капиллярной крови начать следует с пробирок с антикоагулянтами (на гематологические исследования), а затем использовать микротейнеры или пробирки для получения сыворотки или плазмы, предназначенной для биохимических, иммунологических и других видов исследований. Так, например, использование пробирки BD Microtainer ® PST™ с корпусом янтарно-желтого цвета гарантирует стабильность образцов плазмы при анализе крови на билирубин не менее 24 часов при комнатной температуре [4]. Необходимо отметить, что исследование гематологических показателей, группы крови, глюкозы и некоторых других биохимических показателей у детей возможно из капиллярной крови, но исследование показателей системы гемостаза, гормонов необходимо проводить только из венозной крови.
Отклонения от стандартов при взятии пробы, транспортировке и хранении образца, а также факторы, связанные с пациентом, могут привести к неверным или неточным результатам анализов и, следовательно, к постановке ошибочного диагноза. Мы посмотрели влияние объема полученного образца на результаты исследований. Взятие капиллярной крови производилось одномоментно у одного пациента в микротейнеры с К2ЭДТА и К3ЭДТА разных производителей. Пробы были взяты с учетом рекомендаций производителей и с нарушением объема, как это часто бывает на практике (рис. 2, 3).
Рис. 2. Пробы с К2ЭДТА с метками для взятия 250–500 мкл крови
Рис. 3. Пробы с К3ЭДТА с метками для взятия 500 мкл крови
Избыток ЭДТА, независимо от концентрации, негативно воздействует на эритроциты, вызывая сначала их сморщивание, а затем с течением времени и набухание, что приводит к увеличению среднего объема и уменьшению среднего содержания гемоглобина в одном эритроците. Кроме того, использование К2ЭДТА в пробирках BD Microtainer ® сопровождается отсутствием формирования микросгустков [6], а пробирка BD Microtainer ® МАР с К2ЭДТА, предназначенная специально для автоматических анализаторов капиллярной крови, обеспечивает риск образования микросгустков не более 2% [6] и стабильность гематологических показателей не менее 12 часов при хранении проб при комнатной температуре [3]. При этом выявленные в ходе проведенных нами исследований нарушения наиболее выражены в пробах с КЗЭДТА. Нарушение соотношения кровь-антикоагулянт приводит к набуханию тромбоцитов и их расщеплению, что выражается в увеличении их количества, т. к. образующиеся фрагменты имеют достаточно крупные размеры и могут быть подсчитаны как нормальные кровяные пластинки. Также КЗЭДТА вызывает уменьшение общего количества лейкоцитов и их дегенеративные изменения. В связи с этим следует обращать внимание на используемый антикоагулянт, на точное соблюдение рекомендованного производителем объема образца, а также на тщательное и своевременное перемешивание пробы.
При централизации исследований взятие крови в наименьшей степени может контролироваться лабораторией. Зачастую выбор материала и места прокола осуществляется персоналом ЛПУ без учета требований лаборатории, что вынуждает отбраковывать часть образцов. В нашей лаборатории разработаны критерии отказа в проведении исследований в следующих случаях: взятый материал находится в несоответствующей пробирке (т. е. не с тем наполнителем); наличие сгустков в пробе с антикоагулянтами; несоответствие объема пробы (допускается отклонение +10%); гемолиз пробы (кроме исследований, на которые гемолиз влияния не оказывает); отсутствие штрих-кода на направлении или пробирке; отсутствие перечня исследований и т. д. Так как процедурная медицинская сестра не входит в штат лаборатории, а за конечный результат перед пациентом отвечает именно лаборатория, необходимо выработать четкие инструкции:
Немаловажным считаем обучение медицинских сестер на курсах повышения квалификации приемам и правилам забора капиллярной и венозной крови с использованием вакуумных систем и микротейнеров, с последующей выдачей сертификата.
Соблюдение правил преаналитического этапа позволит свести к минимуму ошибки лабораторных исследований.
Таблица 1. Результаты сравнительного анализа гематологических показателей при взятии разного объема капиллярной крови в пробирки с К2ЭДТА
Объем пробы, рекомендованный производителем
Пробирки с фиолетовой крышкой
Калькулятор
заказов
Новости
График работы в дни праздников
Установлен график работы Клинических отделений в дни Новогодних каникул.
ВЫЕЗД на ДОМ!
С 1 декабря возобновляется выезд на дом в Пятигорске!
ЭДТА-К3 показывает меньшую способность поддержания крови в жидком состоянии, также ЭДТА-К3 влияет на подсчет лейкоцитов, занижая их количество.
различия между ЭДТА-К2 и ЭДТА-Na2 в клиническом плане незначительны и ими можно пренебречь, но ЭДТА-Na2 хуже растворим.
Для получения качественного результата анализа необходимо:
немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта;
плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1000-1500G (2000-3000 об/мин). При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
Наиболее широко используются пробирки, содержащие 1,95 мг ЭДТА/1мл крови. Они нашли свое применение в таких областях лабораторной практики, как:
гематологические исследования – подсчет клеток крови, определение СОЭ и пр.
ПЦР-исследования (качественные и количественные методики).
Пробирки с образцами крови можно хранить до 6-10 часов при 4ºС, хранение свыше 24 часов не рекомендуется из-за снижения числа эритроцитов и лейкоцитов.
ЭДТА-К3 для капиллярной крови
Каждая пробирка содержит специальные добавки (Без капилляра: Pro-coagulation, Clot Activator /Separation Gel, EDTA K2, EDTA K3, Lithium Heparin, Sodium Heparin, NaF/EDTA K2; С капилляром: Pro-coagulation, Clot Activator /Separation Gel, EDTA K2, EDTA K3, Lithium Heparin, Sodium Heparin, NaF/EDTA K2.) позволяющие осуществлять самые разнообразные виды исследований.
Пробирки для капиллярной крови выпускаются двух типов: без капилляра и с капилляром.
Собранная для анализа кровь будет находиться в полной сохранности, ведь крышка, которая очень легко и прочно закрывается, минимизирует аэрозольный эффект. Если Вы используете пробирки с капиллярами, это станет гарантией того, что капиллярная кровь не свернется во время взятия.
Правила забора биологического материала для иммунологических исследований
ГУЗ «Кемеровская областная клиническая больница»
Правила забора биологического материала
для иммунологических исследований
Н.Б. Миловидова – к.м.н. заведующая эпидемиологическим отделом ГУЗ КОКБ;
Е.Б. Лукоянычева–заведующая иммунологической лабораторией ГУЗ КОКБ.
© ГУЗ «Кемеровская областная клиническая больница», 2008г
Данное методическое пособие предназначено для медицинских сестер Кемеровской областной клинической больницы.
Методическое пособие поможет правильно произвести забор биологического материала и оформить сопроводительные документы.
Правильно произведенный забор биологического материала и правильно оформленные направления исключат ошибку на преаналитическом этапе исследования.
Формы сопроводительных документов составлены так, чтобы сократить время медицинской сестры, затрачиваемое на оформление направлений.
Необходимо, чтобы образцы крови были правильно взяты и вовремя доставлены в лабораторию. Нарушения, допущенные на преаналитическом этапе, могут повлиять на результат исследования и его дальнейшую интерпретацию.
Раздел 1.
Общие правила забора биологического материала и оформления сопроводительных документов
Перед забором крови пациенту следует сообщить:
1. На какой вид исследования будет проводиться забор крови.
2. Требования необходимые для данного исследования.
Порядок забора венозной крови
1. Исследование проводится утром натощак, последний прием пищи за 12 часов до взятия крови.
2. Исключение приема алкоголя не менее чем за 24 часа до взятия крови.
3. Утренний прием лекарственных препаратов, лечебно-диагностических процедур (массаж, ЭКГ, физиотерапевческое лечение и др.) проводится после взятия крови.
5. Пациент перед процедурой должен находиться в покое, сидеть или лежать не менее 5 минут.
6. Продолжительность пережатия сосудов жгутом должна составлять не более 1 минуты.
7. Нельзя просить работать пациента кулаком и массировать предплечье по ходу вен.
Раздел 2
Технология забора крови из периферической вены для лабораторного исследования
подготовить на манипуляционном столе стандартный набор для забора крови из периферической вены, проверив целостность упаковок и сроки годности:
1. лоток для использованных материалов;
2. пробирки для крови;
3. упаковка с 2-мя стерильными салфетками (5х5см) или 4-5 шариками;
5. кожный спиртовой антисептик во флаконе с дозатором;
сделать необходимые надписи на пробирках;
оформить сопроводительные документы в лабораторию;
обеспечить удобное освещение;
помочь пациенту найти удобное положение;
разъяснить пациенту суть предстоящей процедуры, создавая атмосферу доверия, предоставляя возможность задать вопросы;
обработать руки спиртовым антисептиком;
вскрыть упаковки со стерильными материалами;
руку больного уложить в положении максимального разгибания, для чего под руку следует положить валик, имеющий влагостойкое покрытие.
выбрать вену для венепункции;
обработать место венепункции кожным антисептиком и дать высохнуть самостоятельно;
Не пальпируйте вену повторно!
надеть на стерильный шприц иглу;
снять с иглы защитный колпачок;
пальцами левой руки фиксировать кожу над веной;
ввести под кожу иглу срезом вверх под углом 30-40 0 ;
установить иглу параллельно вене и быстрым движением проколоть ее стенку;
иглу продвинуть немного вверх по длине вены;
набрать необходимое количество крови в шприц
— запрещается забор крови свободным кровотоком из иглы в пробирку, а также присоединение к игле нового шприца;
— для безопасного забора крови предпочтительно использовать вакуумный шприц-контейнер.
иглу извлечь из вены;
прижать место венепункции стерильной салфеткой на 2-3 минуты;
осторожно, предупреждая разбрызгивание крови, вылить содержимое шприца через иглу в одну или несколько пробирок.
набрать из емкости «Для дезинфекции инструментов» дезинфицирующий раствор через иглу в шприц;
вставить иглу в специальное отверстие контейнера «Для дезинфекции режущего и колющего инструментария» и, повернув ее, отделить от шприца и оставить в нем в растворе дезинфектанта;
Раздел 3
Правила взятия венозной крови с помощью закрытой системы (вакуумного шприца-контейнера)
полностью исключается контакт медперсонала с кровью на всех этапах взятия крови и ее транспортировки;
особо прочный пластик закрытых систем позволяет осуществить безопасную доставку крови на любые расстояния;
благодаря наличию широкого спектра пробирок с заранее добавленными реагентами для различных видов анализов (ЭДТА для гематологии, цитрат натрия для коагулогии, активатор свертывания для получения сыворотки), значительно облегчается работа медсестер и лаборатории. Международная цветовая маркировка предотвращает их не правильное применение;
уменьшается количество ошибочных анализов, связанных с неправильным взятием проб крови и неверным соотношением реагентов.
закручивающаяся крышка предотвращает «аэрозольный эффект» при открывании;
1. Надеть иглу на контейнер и закрепить легким поворотом по часовой стрелке. Провести пункцию вены.
1. Провести пункцию вены иглой. Благодаря защитной мембране кровь из иглы не вытекает.
2. Медленно оттягивая поршень, наполнить контейнер кровью. После заполнения кровью контейнер вместе с иглой вынуть из вены. Поршень зафиксировать в конечном положении до характерного щелчка. В случае взятия нескольких образцов крови, контейнер отсоединить. Иглу оставить в вене и на нее надеть следующий контейнер.
2. Создать вакуум в контейнере.
Для этого отвести поршень в конечное положение (до характерного щелчка) и отломить его
3. По окончании взятия крови, шток поршня обломить. Вы получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
3. Насадить контейнер на иглу. Взятие крови осуществляется под действием вакуума. В этом случае вы также получаете транспортный контейнер с кровью и антикоагулянтом или готовую пробирку для сепарации сыворотки.
Транспортировка образцов крови
Транспортировка образцов крови должна осуществляться при комнатной температуре (18-25 град. C). Избегайте замораживания или перегревания образцов, так как нарушение температурного режима может повлиять на результаты. После забора крови образцы должны быть доставлены в лабораторию как можно скорее. При транспортировке образцы должны находиться в вертикальном положении.
При транспортировке образца внутри лечебно-диагностического учреждения, пробирки с кровью должны находиться в контейнере, который в случае повреждения пробирки будет предотвращать разлитие крови.
Порядок доставки крови в лаборатории
наружные части контейнера двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму для вирусных гепатитов);
доставить контейнер в лабораторию;
вынимать образцы крови из контейнера только в перчатках!
после возвращения из лаборатории контейнер вновь двукратно с интервалом в 15 минут протереть дезинфицирующим средством (концентрация по режиму, предусмотренному для гемоконтактных вирусных гепатитов).
Требование к маркировке пробирок.
Маркировку пробирок и заполнение сопроводительных документов следует проводить аккуратно и четко.
Фамилию, имя, отчество пациента писать четко и разборчиво.
В направлении заполнять все графы.
Не допускается, чтобы этикетка на пробирке была размыта, порвана или плохо приклеена.
Направления заполнять в соответствии с приложениями № 1-12
Методические рекомендации. Гематологические анализаторы. Интерпретация анализа крови
УТВЕРЖДАЮ
Заместитель Министра
здравоохранения и
социального развития
Российской Федерации
Р.А.ХАЛЬФИН
21 марта 2007 г. N 2050-РХ
ГЕМАТОЛОГИЧЕСКИЕ АНАЛИЗАТОРЫ. ИНТЕРПРЕТАЦИЯ АНАЛИЗА КРОВИ
В эру использования современных технологий автоматизированного анализа крови стало реальным предоставлять значительно больше клинической информации о состоянии кроветворной системы и реагировании ее на различные внешние и внутренние факторы. Анализ результатов исследования крови составляет неотъемлемое звено в диагностическом процессе и последующем мониторинге на фоне проводимой терапии.
Высокотехнологические гематологические анализаторы способны измерять более 32 параметров крови, осуществлять полный дифференцированный подсчет лейкоцитов по 5-ти основным популяциям: нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты, что делает возможным в случае отсутствия от референсных значений этих показателей не проводить ручной подсчет лейкоцитарной формулы.
Аналитические возможности гематологических анализаторов:
высокая производительность (до 100-120 проб в час)
небольшой объем крови для анализа (12-150 мкл)
анализ большого количества (десятки тысяч) клеток
высокая точность и воспроизводимость
оценка 18-30 и более параметров одновременно
графическое представление результатов исследований в виде гистограмм, скатерограмм.
Диагностические возможности гематологических анализаторов:
оценка состояния гемопоэза
диагностика и дифференциальная диагностика анемий
диагностика воспалительных заболеваний
оценка эффективности проводимой терапии
мониторинг за мобилизацией стволовых клеток из костного мозга.
Несмотря на все достоинства, даже самые современные гематологические анализаторы обладают некоторыми ограничениями, которые касаются точной морфологической оценки патологических клеток (например, при лейкозах), и не в состоянии полностью заменить световую микроскопию.
Преаналитический этап гематологических исследований
Контроль преаналитических факторов в гематологических исследованиях является ключевым для обеспечения качественных результатов тестов. Отклонения от стандартов при взятии пробы, транспортировке и хранении образца, интерферирующие вещества, а также факторы, связанные с пациентом, могут привести к неверным или неточным результатам анализов и, следовательно, к постановке ошибочного диагноза. До 70% лабораторных ошибок связаны именно с преаналитическим этапом исследования крови. За счет снижения числа ошибок на любом этапе преаналитической подготовки можно существенно улучшить качество гематологических анализов, снизить количество повторных проб, сократить расходы рабочего времени и средств на обследование пациентов.
Снижение до минимума возможных ошибок и обеспечение высокого качества гематологических исследований возможно за счет стандартизации преаналитического и аналитического этапов работы.
На точность и правильность результатов оказывает влияние техника взятия крови, используемые при этом инструменты (иглы, скарификаторы и др.), а также пробирки, в которые берется, а в последующем хранится и транспортируется кровь.
— Кровь следует брать натощак (после примерно 12 часов голодания, воздержания от приема алкоголя и курения), между 7 и 9 часами утра, при минимальной физической активности непосредственно перед взятием (в течение 20-30 мин.), в положении пациента лежа или сидя.
— Взятие материала следует проводить в резиновых перчатках, соблюдая правила асептики.
Венозная кровь. Венозная кровь считается лучшим материалом для клинического исследования крови. При известной стандартизации процессов взятия, хранения, транспортировки венозной крови удается добиться минимальной травматизации и активации клеток, примеси тканевой жидкости, при этом всегда имеется возможность повторить и/или расширить анализ, например, добавив исследование ретикулоцитов.
Достоверность и точность гематологических исследований, проводимых из венозной крови, во многом определяется техникой взятия крови.
Подготовка пациента к взятию крови из вены включает несколько этапов. Место венепункции нужно продезинфицировать марлевой салфеткой или специальной безворсовой салфеткой, смоченной 70 град. спиртом, и подождать до полного высыхания антисептика (30-60 секунд). Применение ватных тампонов и других волокнистых материалов подобного рода может привести к засорению волокнами счетной и гемоглобиновой камер, что влечет снижение точности и воспроизводимости измерения. Не рекомендуется использовать 96 град. спирт, так как он дубит кожу, поры кожи закрываются, и стерилизация может быть неполной.
Не рекомендуется вытирать и обдувать место прокола, пальпировать вену после обработки. Рука пациента должна покоиться на твердой поверхности, быть вытянута и наклонена немного вниз так, чтобы плечо и предплечье образовывали прямую линию. Необходимо следить, чтобы в момент взятия крови кулак пациента был разжат. Жгут следует накладывать не более чем на 1-2 минуты, тем самым обеспечивается минимальный стаз, при котором клетки крови не повреждаются. Игла должна быть достаточно большого диаметра и иметь короткий срез, чтобы не травмировать противоположную стенку вены во избежание тромбоза. После взятия крови необходимо приложить сухую стерильную салфетку к месту венепункции, а затем наложить давящую повязку на руку или бактерицидный пластырь.
— Кровь для гематологических исследований должна поступать
свободным током непосредственно в пробирку, содержащую
антикоагулянт К ЭДТА. Взятие крови шприцом без антикоагулянта с последующим переливанием в пробирку нежелательно из-за
формирования микросгустков и гемолиза. При взятии капиллярной
крови необходимо использовать специальные пробирки с ЭДТА для
капиллярной крови.
У некоторых пациентов может наблюдаться небольшая спонтанная агрегация тромбоцитов или реже так называемая ЭДТА-зависимая псевдотромбоцитопения (иммунного характера), причем эти явления прогрессируют по мере увеличения времени, прошедшего после взятия крови. У таких лиц точный подсчет числа эритроцитов может быть осуществлен при взятии крови с цитратом в качестве антикоагулянта.
Следует помнить, что применение в качестве антикоагулянтов гепарина или цитрата натрия сопровождается структурными изменениями клеток и поэтому не рекомендуется для использования как при автоматизированном, так и морфологическом исследовании крови.
Капиллярная кровь. Для гематологических исследований капиллярную кровь рекомендуется брать в следующих случаях:
— при ожогах, занимающих большую площадь поверхности тела пациента;
— при выраженном ожирении пациента;
— при установленной склонности к венозному тромбозу;
Применение ватных тампонов и других волокнистых материалов не рекомендовано, поскольку это приводит к засорению волокнами счетных и гемоглобиновой камер. В результате точность и воспроизводимость измерения падает.
Первую каплю крови, полученную после прокола кожи, следует удалить тампоном, поскольку эта капля содержит примесь тканевой жидкости. Капли крови должны свободно вытекать, нельзя давить на палец и массировать зону вокруг прокола, так как при этом в кровь попадает тканевая жидкость, что существенно искажает результаты исследования. После взятия крови к раневой поверхности прикладывается новый стерильный тампон, смоченный 70 град. спиртом. Тампон следует удерживать, пока не прекратится кровотечение.
При прикосновении края пробирки к месту пункции капли крови начинают стекать в нее под действием капиллярного эффекта. После завершения сбора крови пробирку следует плотно закрыть. Необходимым условием для обеспечения качественной пробы является ее обязательное немедленное перемешивание с антикоагулянтом осторожным переворачиванием пробирки до 10 раз. В случае последовательного взятия капиллярной крови в несколько микропробирок необходимо соблюдать определенный порядок их заполнения. Последовательность взятия крови такова: в первую очередь заполняются пробирки с ЭДТА, затем с другими реактивами и в последнюю очередь заполняются пробирки для исследования сыворотки крови.
Основные рекомендации при работе с капиллярной кровью:
— При взятии крови в пробирку с антикоагулянтом не допускается стекание крови по коже пальца, стенке пробирки и любой другой поверхности, так как мгновенно происходит контактная активация прогресса свертывания.
— Кровь самотеком из прокола должна попадать прямо в антикоагулянт, перемешиваясь с ним.
— Нельзя выдавливать кровь из пальца во избежание спонтанной агрегации тромбоцитов и попадания в пробу большого количества межтканевой жидкости (тканевого тромбопластина).
Следует отметить, что при взятии капиллярной крови возможен ряд особенностей, которые бывает весьма трудно стандартизировать:
Все это приводит к значительным разбросам в получаемых результатах и, как следствие, к необходимости повторных исследований для уточнения результата.
Доставка, хранение и подготовка проб к исследованию
Для обеспечения качественного результата исследований нужно четко контролировать время и условия хранения проб до выполнения анализа.
— Непосредственно после взятия крови исключается возможность спонтанной агрегации тромбоцитов, примерно 25 мин. необходимо для адаптации тромбоцитов к антикоагулянту. При анализе, проведенном позже чем через 6-8 часов после взятия образца, уменьшается достоверность результатов. Более продолжительное хранение крови не рекомендуется, т.к. изменяются некоторые характеристики клеток (сопротивляемость клеточной мембраны), снижается объем лейкоцитов, повышается объем эритроцитов, что в конечном итоге приводит к ошибочным результатам измерения и неправильной интерпретации результатов. Только концентрация гемоглобина и количество тромбоцитов остаются стабильными в течение суток хранения крови.
— Кровь нельзя замораживать. Капиллярную кровь с ЭДТА следует хранить при комнатной температуре и анализировать в течение 4 часов после взятия.
— Непосредственно перед исследованием кровь должна быть тщательно перемешана в течение нескольких минут для разведения антикоагулянта и равномерного распределения форменных элементов в плазме. Длительное постоянное перемешивание образцов на ротомиксе до момента их исследований не рекомендуется вследствие возможного травмирования и распада патологических клеток.
— Исследование крови на приборе проводится при комнатной температуре. Кровь, хранившуюся в холодильнике, необходимо вначале согреть до комнатной температуры, так как при низкой температуре увеличивается вязкость, а форменные элементы имеют тенденцию к склеиванию, что, в свою очередь, приводит к нарушению перемешивания и неполному лизису. Исследование холодной крови может быть причиной появления «сигналов тревоги» вследствие компрессии лейкоцитарной гистограммы.
— Приготовление мазков крови рекомендуется делать не позднее 1-2 часов после взятия крови.
При выполнении гематологических исследований на значительном удалении от места взятия крови неизбежно возникают проблемы, связанные с неблагоприятными условиями транспортировки. Тряска, вибрация, постоянное перемешивание, нарушения температурного режима, возможные проливы и загрязнения проб могут оказывать существенное влияние на качество анализов. Для устранения этих причин при перевозках пробирок с кровью рекомендуется использовать герметично закрытые пластиковые пробирки (BD Vacutainer (R) производства компании «Becton Dickinson», Deltalab, Sarstedt) и специальные транспортные изотермические контейнеры (фирма «Гем»).
Влияние преаналитических факторов, зависящих от пациента
На результаты гематологических исследований могут влиять факторы, связанные с индивидуальными особенностями и физиологическим состоянием организма пациента. Изменения клеточного состава периферической крови наблюдаются не только при различных заболеваниях, они также зависят от возраста, пола, диеты, курения и употребления алкоголя, менструального цикла, беременности, физической нагрузки, эмоционального состояния и психического стресса, циркадных и сезонных ритмов; климатических и метеорологических условий; положения пациента в момент взятия крови; приема фармакологических препаратов и др. Так, например, число эритроцитов и концентрация гемоглобина у новорожденных выше, чем у взрослых. С увеличением высоты над уровнем моря значительное повышение наблюдается для гематокрита и гемоглобина (до 8% на высоте 1400 м). Физические упражнения могут приводить к существенным изменениям числа лейкоцитов, обусловленным гормональными сдвигами. У больных при переходе из положения лежа в положение стоя показатели гемоглобина и число лейкоцитов могут увеличиваться на 6-8%, а показатели гематокрита и число эритроцитов возрастать на 15-18%. Этот эффект обусловлен переходом жидкости из сосудистого русла в ткани в результате повышения гидростатического давления. Выраженная диарея и рвота могут приводить к значительной дегидратации и гемоконцентрации. После регидратации наблюдается снижение гемоглобина и гематокрита, что может быть ошибочно принято за кровопотерю.
Для устранения или сведения к минимуму влияния этих факторов кровь для повторных анализов необходимо брать в тех же условиях, что при первом исследовании.
Автоматизированное исследование клеток крови
Автоматические счетчики крови оценивают размеры, структурные, цитохимические и другие характеристики клеток. Они анализируют около 10000 клеток в одном образце и имеют несколько различных каналов подсчета клеточных популяций и концентрации гемоглобина. На основании количества определяемых параметров и степени сложности их можно условно разделить на 3 основных класса:
В основе работы анализаторов I-го класса лежит кондуктометрический метод. Анализаторы II и III-го классов используют в своей работе комбинации разных методов.
Кондуктометрические гематологические анализаторы
Если в один и тот же момент в канале находятся две клетки, они регистрируются в виде одного импульса, что приведет к ошибке подсчета клеток. Во избежание этого, проба крови разводится до такой концентрации, при которой в канале датчика всегда будет не больше одной клетки.
Апертуро-импедансный метод позволяет определять большинство эритроцитарных и тромбоцитарных показателей, связанных с объемом клеток (НСТ, MCV, МСН, МСНС, MPV), а также является основой для дифференцировки лейкоцитов по трем параметрам.
Подсчет эритроцитов и тромбоцитов, расчет величины гематокрита, эритроцитарных и тромбоцитарных индексов
Устройство, которое разделяет импульсы по величине амплитуды, называется дискриминатор. В современных анализаторах применяются многоканальные дискриминаторы, позволяющие получить детальную информацию о размерах клеток в виде гистограмм, поскольку каждый канал соответствует определенному объему клеток.
Поскольку в норме концентрация эритроцитов в крови на 3 порядка превышает концентрацию лейкоцитов, то вклад лейкоцитов в общее количество подсчитываемых клеток пренебрежимо мал по сравнению с эритроцитами, поэтому в некоторых анализаторах за количество эритроцитов принимают общее подсчитанное количество клеток. Такое допущение справедливо, за исключением случаев явных лейкоцитозов.
Подсчет и дифференцировка лейкоцитов
Определение количества лейкоцитов возможно только после лизиса эритроцитов. Эта задача оказалась легко решаемой, так как свойства мембран эритроцитов и лейкоцитов существенно различаются. Эритроциты легко лизируются под воздействием многих поверхностно-активных веществ, при этом лейкоциты, хотя и претерпевают некоторые изменения, остаются целыми. Поэтому при подсчете лейкоцитов, прежде чем пропустить разведенную суспензию крови через апертуру датчика, к ней добавляют лизирующий раствор или гемолитик, эритроциты разрушаются до очень мелких фрагментов, которые при подсчете лейкоцитов генерируют электрические импульсы очень низкой амплитуды, не влияющие на результат анализа.
Разделение неизмененных лейкоцитов кондуктометрическим методом на основные субпопуляции невозможно в виду близости их объемов, однако можно подобрать такую композицию растворителя и гемолитика, что различные формы лейкоцитов претерпевают изменения размеров в разной степени и, благодаря этому, могут разделяться данным методом. Изменение объема клетки зависит от многих факторов, включающих величину и форму ядра, объем цитоплазмы, наличие внутриклеточных включений и т.д., поэтому размер трансформированных клеток не соответствует размерам клеток при визуальном просмотре их в окрашенном мазке крови (таблица 1)
| Соотношение размеров клеток в окрашенных мазках крови и в приборах после обработки их лизирующим реагентом | ||
| Тип клеток | Размер клеток при визуальном анализе мазков крови | Размер клеток после обработки лизатом |
| Лимфоциты | малый | малый |
| Базофилы | средний | средний, малый |
| Эозинофилы | средний | средний, большой |
| Моноциты | наибольший | средний |
| Нейтрофилы | средний | большой, средний |
| Патологические формы клеток | различный | различный |
| Дальнейшая идентификация патологических форм клеток проводится визуально | ||
— Область малых объемов (35-90 фл) формируется лимфоцитами, которые под действием гемолитика значительно уменьшаются в объеме.
— Гранулоциты (нейтрофилы, базофилы и эозинофилы), напротив, подвергаются небольшому сжатию и расположены в области больших объемов (120-400 фл).
— Между двумя пиками имеется зона так называемых «средних лейкоцитов» (90-120 фл), которая лучше всего коррелирует с моноцитами (по этой причине в некоторых анализаторах клетки в этой области указываются как моноциты). Однако, учитывая тот факт, что коэффициент корреляции с моноцитами R = 0,5-0,8 сравнительно невысок, более корректным является название параметра «средние лейкоциты» или «средние клетки» (MID). Практически в область средних клеток могут частично попадать базофилы, эозинофилы, различные патологические формы.
Высокотехнологические гематологические анализаторы
Высокотехнологические гематологические анализаторы способны осуществлять дифференцированный счет лейкоцитов по 5-ти (5Diff) основным популяциям, используя различные принципы дифференцирования клеток: нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты, оценивать наличие незрелых гранулоцитов, анализировать ретикулоциты и их субпопуляции, проводить оценку стволовых гемопоэтических клеток и субпопуляций лимфоцитов. Многочисленные функции современных гематологических анализаторов стали возможны, благодаря развитию новых технологий, которые отличаются у разных фирм-производителей.
— для оценки клеточной зернистости и дифференцировки эозинофилов используется оценка светорассеивания деполяризованного луча под углом в 90 град.
Сравнивая информацию, получаемую с Perox- и Baso-каналов, компьютер осуществляет дифференцировку лейкоцитов на 5 основных популяций, а также сигнализирует в виде флагов о присутствии в крови активированных лимфоцитов, незрелых гранулоцитов, бластов, эритробластов.
3. Детекция специфического флюоресцентного сигнала (SFL), которая регистрируется также как боковое светорассеивание под углом 90 град. и позволяет судить о содержании РНК/ДНК в клетках.
Кроме того, приборы оборудованы каналом для выделения незрелых гранулоцитов и атипичных лимфоцитов.
Таким образом, использование приборов с полным дифференцированным подсчетом лейкоцитов (5Diff) позволяет повысить точность дифференциального подсчета лейкоцитов, провести скрининг нормы и патологии, динамический контроль за лейкоцитарной формулой и резко сократить ручной подсчет лейкоцитарной формулы, оставляя примерно до 15-20% образцов крови для световой микроскопии.
В классическом гемиглобинцианидном методе (метод Драбкина) +2 +3 Fe гемоглобина окисляется до Fe метгемоглобина феррицианидом, затем метгемоглобин переводится в стабильный цианметгемоглобин цианидом. Оптическая плотность CNmetHb измеряется при 540 нм, при которой имеется максимум поглощения. Гемиглобинцианидный метод рекомендован Международным комитетом по стандартизации в гематологии Всемирной Организации Здравоохранения и используется в мировой практике более 30 лет.
В гематологических анализаторах к методам определения гемоглобина предъявляется ряд специфических требований. Во-первых, время реакции должно быть в десятки раз меньше для обеспечения высокой производительности анализаторов. Во-вторых, для оптимизации конструкции анализаторов гемоглобин должен измеряться в том же гемолизате, который используется для подсчета лейкоцитов, и, следовательно, компоненты, обеспечивающие гемоглобиновую реакцию, не должны негативно влиять на подсчет лейкоцитов.
Многие гематологические анализаторы измеряют концентрацию гемоглобина модифицированным гемиглобинцианидным методом. Высокая
скорость реакции достигается путем быстрого лизиса эритроцитов, +3 денатурирования и окисления гемоглобина до Fe с помощью
поверхностно-активных веществ. Последующая реакция с цианидом формирует устойчивую форму со спектром поглощения, похожим на
спектр гемиглобинцианида в методе Драбкина, и максимумом поглощения около 545 нм. Достоинством метода является его простота, высокая скорость реакции и стабильность конечного продукта. Применение циановых методов в гематологических автоанализаторах имеет два существенных недостатка, связанных с тем, что цианид из флаконов постепенно выпаривается в виде синильной кислоты. Во-первых, это может оказывать вредное воздействие на персонал при плохой вентиляции помещения. Во-вторых, это приводит к ухудшению реакции и изменению калибровки по гемоглобину через 2-3 месяца после подсоединения к прибору флакона с гемолитиком.
Учитывая недостатки модифицированных гемиглобинцианидных методов, в последние годы в большинстве новых моделей гематологических анализаторов используются бесциановые методы. Одной из первых бесциановый SLS (натрий лаурил сульфат)-метод использовала фирма Sysmex. Этот метод оказался не совместимым с определением лейкоцитов в одном канале, для его реализации используется дополнительный реагент и канал измерения.
В других современных бесциановых методах используются компоненты гемихромной реакции, которые совместимы с подсчетом лейкоцитов и их дифференциацией на три популяции. Высокая скорость реакции достигается путем быстрого лизиса эритроцитов, +3 денатурирования и окисления гемоглобина до Fe с помощью окислителей в присутствии поверхностно-активных веществ. При этом в качестве лигандов атомов железа гема используются отличные от цианида вещества.
Качество результатов исследования крови на гематологическом анализаторе определяется следующими факторами:
— точностью дозирования цельной или разведенной крови;
— точностью дозирования изотонического раствора при проведении процедуры разведения крови;
— точностью определения объема суспензии, пропущенного через датчики подсчета клеток;
— точностью самого подсчета клеток;
— точностью определения размеров клеток;
— корректностью математических методов обработки первичных результатов измерений.
Во избежание случаев несовместимости реагентов следует использовать изотонический раствор и гемолитик от одного изготовителя. При смене реагентов одного производителя на реагенты другого производителя необходимо проверить калибровку анализатора по контрольной крови, обращая особое внимание на Hb и MCV/HCT, и при необходимости нужно делать перекалибровку этих показателей. Калибровка других показателей, как правило, не меняется.
Периодически необходима калибровка по стандартным материалам, так как электронные и механические компоненты прибора, датчиков, насосов и т.д. со временем подвергаются старению и меняют свои технические параметры. Для осуществления калибровки необходимо пользоваться только качественными контрольными материалами!
Гематологические анализаторы очень чувствительны к длительным отключениям и перебоям в работе, что связано с подсыханием шлангов, проростом микрофлоры, кристаллизацией из растворов. При длительной остановке (на период отпуска, переезда или отсутствия реагентов) обязательным является заполнение шлангов консервирующими растворами с последующей многократной отмывкой от них.
Автоматизированные гематологические анализаторы, поставляемые в КДЛ в рамках Приоритетного национального проекта «Здоровье»
Для оснащения клинико-диагностических лабораторий поликлиник предпочтение отдано автоматизированным гематологическим анализаторам, работа которых основана на кондуктометрическом методе, который позволяет получить до 18 параметров крови с определением трех популяций лейкоцитов (лимфоциты, клетки средних размеров, гранулоциты).
При использовании такого анализатора определяют:
— RBC (количество эритроцитов)
— HGB (концентрация гемоглобина)
— MCV (средний объем эритроцита)
— МСН (среднее содержание гемоглобина в эритроците)
— МСНС (средняя концентрация гемоглобина в эритроците)
— RDW (ширина распределения эритроцитов по объему)
— PLT (количество тромбоцитов)
— MPV (средний объем тромбоцита)
— PDW (ширина распределения тромбоцитов по объему)
— WBC (количество лейкоцитов)
Гистограммы (распределение клеток по объему)
Автоматизированный гематологический анализатор MEK-6400J/K
В приборе существует пять режимов разведения: нормальный, режим низкого, высокого и очень высокого разведения, режим предварительного разведения.
В нормальном режиме разведения измеряется образец объемом 30 мкл.
Для режимов измерения крови с предварительным разведением можно указать объем исследуемой крови (10 или 20 мкл). Этот режим удобен при работе с малым объемом крови, особенно у детей и пожилых людей.
При наличии лейкоцитоза образец крови может быть измерен в режиме высокого или более высокого разведения. В режиме высокого разведения образец крови объемом 10 мкл разводится втрое больше обычной пропорции разведения. В режиме более высокого разведения 5 мкл образца крови разводится в пропорции, в шесть раз большей обычной пропорции разведения.
В случаях низкого содержания в крови лейкоцитов и тромбоцитов образец измеряется в режиме низкого разведения, при котором 55 мкл крови разводится в пропорции, вдвое меньшей обычной пропорции. Пересчет с высоким/низким разведением недоступен для образцов в режиме предварительного разведения.
Прибор снабжен системой закодированных флагов, которые появляются на экране при наличии отклонений в измерении или изменении гистограмм распределения клеток. Следует внимательно изучить названия флагов, т.к. они помогают определить возможные причины их появления. Помимо количественных характеристик клеток крови в анализаторе отображается распределение клеток по объему в виде гистограмм, анализ которых имеет диагностическое значение.
Уважаемые коллеги!
Все методические рекомендации, пособия и т.д. интеллектуальная собственность авторов, Ассоциации и являются архивными материалами разных лет!!