Признаки тромбинемии что это гиперфибриногенемия
Признаки тромбинемии что это гиперфибриногенемия
Гипофибриногенемия — геморрагический синдром, возникающий благодаря уровню плазматического фибриногена ниже нормального, называющийся иногда и фибриногенопенией или фибринопенией. Он является скорее аномалийным состоянием субъекта, чем болезнью, потому что клинически не проявляется никогда спонтанно; его биологической характеристикой является постоянно пониженный уровень плазматического фибриногена, между 30 и 60 мг/100 мл.
Первые случаи были опубликованы в литературе по специальности в 1935 г. (Risak); с тех пор и до настоящего времени было сообщено о 30 случаях врожденной формы и о множестве случаев приобретенной формы.
Клиника гипофибриногенемии
Гипофибриногенемия не представляет четко очерченной клинической картины, потому что больной никогда не кровоточит спонтанно.
Когда у этих больных появляется геморрагический синдром, он детерминирован одной из следующих причин: возникновение другого расстройства гемостаза, отличного от основного дефекта больного (тромбопения, капиллярная хрупкость, недостаток одного из плазматических факторов коагуляции); открытая или закрытая рана, происшедшая по поводу очень тяжелой травмы; крупное хирургическое вмешательство, которому подвергался больной (отсечение пуповины не влечет за собой геморрагию).
В этих случаях кровоточение явное и принимает клинический аспект геморрагипарного синдрома афибриногенемии, но в более мягкой форме.
Лабораторное исследование при гипофибриногенемии
Тесты на коагуляцию, при помощи которых мы исследуем этих больных, дают результаты, которые можно сгруппировать следующим образом:
а) Тесты отбора (ТС, ТН, РТТ, РТТК, TQ) показывают более или менее удлиненное время (в зависимости от степени фибриногенемии). Что касается TCP — оно в норме,
б) Т тромбина и рептилазы увеличены, что указывает на недостаток фибриногена, в) Т.E.G. показывает низкий „ma», несмотря на то, что тромбоциты и их качество нормальные; следовательно еще один показатель недостатка фибриногена,
г) Дозирование фибриногена подтверждает диагноз: оно показывает низкие цифры, обычно составляя около 50 мг/100 мл. Эти уровни совместимы с ведением нормального образа жизни. Однако когда фибриноген падает ниже этого порога (вследствие преувеличенного расхода, благодаря известным ситуациям) и если в течение этого периода критической гипофибриногенемии происходит тяжелая травма или имеет место хирургическое вмешательство, тогда у носителей этого порока получается клиническое проявление болезни,
д) R.C. широкая и скорая (из-за низкого фибринового материала в сгустке). Это имеет своим последствием высвобождение значительной массы эритроцитов из бедного материала сгустка, что может производить ложное впечатление фибринолиза. е) Все остальные тесты, которые как мы видели, давали и при афибриногенемии нормальные результаты, показывают и в этом случае нормальные цифры.
Патофизиология гипофибриногенемии
Гипофибриногенемию можно подразделять на: врожденную (конституциональная фибриногенемия Рисака) и приобретенную.
Врожденнная гипофибриногенемия передается по наследству как менделевская автосомально рецессивная черта; она представляет гетерозиготное состояние, в то время как афибриногенемия, как мы видели, является гомозиготным состоянием. Частота ее больше чем афибриногенемии; возможная поражаемость определено больше, чем это показывают зарегистрированные случаи, так как существует высокий процент клинически немых случаев.
Приобретенння гипофибриногенемия появляется в результате действия трех возможных механизмов, а именно:
1) Недостаточный синтез Ф.1, вследствие тяжелых заболеваний, затрагивающих печень, туберкулез, аденокарцинома, хроническая гранулоцитарная лейкемия, острая лейкемия, врожденный сифилис, отравление фосфором, отравление хлороформом, острая желтая атрофия и пр.
2) Преувеличенный расход Ф.1., как это наблюдается при всех вариантах синдрома ДВС.
3) Аномалийно сильный и скорый лизис молекулы фибриногена, как это случается при фибринолитических синдромах (фибриногенолитический этап).
Из всех этих условий, лишь первое совпадает со своим конгенитальным гомологом и поэтому мы рассмотрим их вместе в нижеследующем параграфе. Остальные два условия представляют последствия особых нозологических сущностей; они появляются в специальном контексте факторов и будут рассматриваться своевременно (синдром ДВС и фибринолитический синдром).
Кровотечение при гипофибриногенемии того же типа, как и кровотечение при афибриногенемии. Оно может вызываться следующими обстоятельствами: после средних травм (никогда после малых), бывает умеренным и слегка удлиненным, но легко затихает вследствие применения обычных средств (часто оно является сигналом тревоги ведущим к диагнозу болезни); вследствие больших травм или хирургических вмешательств возникает настоящий геморрагический синдром, как при афибриногенемии, но более ограниченной амплитуды — это единственное обстоятельство, когда выражение этого расстройства принимает клинический аспект болезни.
Положительный диагноз гипофибриногенемии ставится таким же образом как и при афибриногенемии. Однако здесь следует заметить, что в случае гипофибриногенемии диагноз ставится гораздо труднее из-за отсутствия клинических проявлений. Так как, чаще всего, речь идет об эффекте тяжелой травмы или хирургического вмешательства, которые вызывают необычно сильное кровотечение, это обстоятельство привлекает внимание врача, который назначает необходимые лабораторные исследования и на основании этих результатов разъясняет положение.
Отличия устанавливаются по отношению любого геморрагического диатеза, представляющего легкие кровотечения. Лабораторные исследования, подтверждающие положительный диагноз, устанавливают также и дифференциальное разграничение, оправдываемое анамнезом больного и предшествующими данными.
Эволюция и осложнения гипофибриногенемии. Во всех случаях болезнь доброкачественная и лишенная осложнений. Те из носителей, которым известен их порок, должны, в профилактических целях, беречься от травм и предупреждать врача в случае хирургических вмешательств. Опасность грозит тем, кто не знает о своем пороке и считает себя нормальным; когда они терпят тяжелую травму или подвергаются (без тщательной проверки) хирургическому вмешательству, у них может возникнуть суровая геморрагия, с которой трудно совладеть. Это единственная критическая ситуация при этом заболевании.
Лечение гипофибриногенемии преследует ту же цель и применяет те же средства, как и при афибриногенемии, имея в виду то обстоятельство, что речь идет о том же основном недостатке, но только разной амплитуды.
Схема лечения более ограниченная, так как уровень фибриногена у больного несколько выше, а тяжесть геморрагических эпизодов меньше. Обычно для их прекращения достаточны 3—4 перфузии фибриногена, применяемые по разу в день через каждые 4 дня. Доза перфузии рассчитывается как и при афибриногенемии, но вводится целиком лишь в первой перфузии, в следующих доза сокращается на половину.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Патология системы гемостаза и ее влияние на репродуктивную функцию
Многие исследования и открытия в области гемостазиологии помогли пересмотреть причины, патогенез, концепцию лечения и профилактики важнейших осложнений беременности (синдром привычной потери плода, преждевременная отслойка нормально расположенной плаценты, гестозы, антенатальная гибель плода, тромботические осложнения у беременных и в послеродовом периоде) [5].
Физиологические и патологические изменения в системе свертывания
Беременность – особенное состояние организма, при котором происходят существенные изменения гемостаза: на фоне гормональных перестроек меняется тонус сосудистых стенок, растет потенциал свертывающей системы крови, увеличивается объем циркулирующей крови. Нарушение этого хрупкого равновесия в системе гемостаза на фоне беременности может привести к высокому риску развития тромботических осложнений, кровотечений и акушерских потерь [4].
Частота этих осложнений существенно возрастает при носительстве генетических дефектов системы гемостаза, объединенных термином «наследственная тромбофилия» (мутация в гене протромбина, Лейденовская мутация, дефицит АТ III, дефицит протеина С и S, дезагрегационная тромбоцитопатия и т. д.), и при приобретенных формах нарушениях гемостаза (гипергомоцистеинемия, АФС, СКВ, метабо- лический синдром, варикозная болезнь вен и т. д.) [4]. Сравнительно недавно стала изучаться роль тромбофилии и в патогенезе развития нарушений имплантации плодного яйца, нарушений формирования маточно-плацентарного кровотока и, соответственно, в формировании гестозов («токсикозов») у беременных. Таким образом, наличие тромбофилии представляет серьезный риск не только для исхода беременности, но и является угрозой жизни и здоровью беременной женщины и плоду [2].
Клинические проявления тромбофилий во время беременности очень многообразны. Но своевременное выявление, диагностика (комплекс включает в себя такие исследования, как генетический анализ, гомоцистеин, антифосфолипидные антитела, оценка функционального состояния тромбоцитов, коагулограмма) и правильная трактовка анамнеза и показателей позволяют диагностировать наличие тромбофилии и, соответственно, вовремя начать лечение для предотвращения осложнений (как акушерских, так и тромботических) [2].
Клинический пример 1:
«Пациентка А. 28 лет. Диагноз: наследственная предрасположенность к тромбофилии (гете- розиготы F2, F13, ITGB3, FGB), состоявшийся тромбоз в анамнезе (ТЭЛА после кесарева сечения (КС) 2012 г.). Обратилась на малом сроке беременности. Ведение беременности на низкомолекулярных гепаринах (НМГ), антиагрегантах, симптоматической терапии. Мониторинг показателей гемостаза, допплера. Коррекция терапии по показателям. Плановое КС. Профилактика тромботических осложнений в послеродовом периоде (НМГ в течение 6 нед.).»
Классификации тромбофилий
Методы диагностики тромбофилии
«Пациентка Д. 42 года. Д-з: наследственная предрасположенность к тромбофилии (гетерозиготы F5, PAI-1, ITGA2, MTHFR677), СППП, возрастной фактор, латентный железодефицит. В анамнезе: роды – 2, замершие беременности на раннем сроке – 3. Обрати- лась после ЗБ. Проведены восстановительная терапия и дообследование, прегравидарная подготовка. При наступлении беременности продолжена терапия: НМГ, фолиевая кислота, антиоксиданты, препараты железа. Срочные роды. Профилактика тромботических осложнений в послеродовом периоде (НМГ в течение 6 нед.).»
Своевременное выявление рисков тромботических осложнений, рисков патологии и угрозы вынашивания беременности позволяет правильно сформировать эффективные методы профилактики и лечения. При таком подходе терапия действует на основную причину заболевания, а не только купирует симптоматику [1].
Основные принципы терапии
Клинический пример 3:
«Пациентка В. 33 г. Д-з: наследственная предрас-положенность к тромбофилии (патологиче-ская гомозигота PAI-1, гетерозиготы интегрин а2, в3, FGB), первичное бесплодие, сочетанный фактор (ЭКО – 1 отрицательный результат, два криопереноса – отрицательный результат). УЗИ с цветовым допплеровским картированием (ЦДК): гипоплазия эндометрия, нарушение показателей гемодинамики маточного кровотока. Обратилась для планирования криопереноса. Подготовка к криопереносу (НМГ, антиагреганты, антиоксиданты). Показатели на фоне лечения с положительной динамикой. Произведен криоперенос. Получена беременность (бихориальная, биамниотическая двойня). Ведение беременности на НМГ, контроль показателей гемостаза. Коррекция назначений по показателям (На 5–6 нед. – ретрохориальная гематома (РХГ), на 20–21 нед. – нарушение гемодинамики маточно-плацентарного кровотока 1А степени). Плановое КС 35–36 нед. Профилактика тромботических осложнений в послеродовом периоде (НМГ).»
Базовыми препаратами в процессе подготовки, ведения беременности и послеродового периода, конечно, являются противотромботические препараты – низкомолекулярные гепарины, антиагреганты, а также фолиевая кислота в индивидуально подобранной дозировке и, по показаниям, вспомогательная терапия (препараты железа, антиоксиданты, препараты прогестерона, глюкокортикоиды) [3].
1. Доброхотова Ю. Э., Щеголев А. А., Комраков В. Е. и др.; Под ред. Ю. Э. Доброхотовой, А. А. Щеголева. Тромботические состояния в акушерской практике. – М.: ГЭОТАР-Медиа, 2010.
2. Макацария А. Д., Бицадзе В. О. Тромбофилические состояния в акушерской практике. – М.: РУССО, 2001. – 704 с.
3. Мхеидзе Н. Э. Клиническое значение выявления генетической и приоб- ретенной тромбофилии у беременных с преждевременной отслойкой нормально расположенной плаценты в анамнезе. – М., 2006.
4. Репина М. А., Сумская Г. Ф., Лапина Е. Н. Наследственные нарушения системы гемостаза и беременность. – СПб, 2008.
5. Физиология и патология гемостаза. Под ред. д. м. н. проф. Н. И. Стуклова. – М.: ГЭОТАР-Медиа, 2016.
Коагулограмма
В системе гемостаза принимают участие факторы свертывающей, противосвертывающей (антикоагулянтной) и фибринолитической систем крови. Изменение функционального состояния одной из систем сопровождается компенсаторными сдвигами в деятельности другой. Нарушение функциональных взаимосвязей может привести к тяжелым патологическим состояниям организма, заключающимся или в повышенной кровоточивости, или во внутрисосудистом тромбообразовании.
Условия сдачи коагулограммы
Не допускается в течение 8 часов (желательно 12) до сдачи анализа прием пищи, в том числе, сок, чай, кофе, алкоголь. Можно пить простую воду. Если врач назначил сдачу анализа на фоне приема препаратов, влияющих на свертывание крови, отметьте это при сдаче анализа.
D-димер (продукт деградации фибрина, D-dimer, Fibrin degradation fragment)
Определение уровня Д-димера является высокоспецифичным и чувствительным маркером тромбообразования. Однако его уровень повышается и при патологических состояниях, сопровождающихся усиленным фибринолизом: геморрагические осложнения, инфекции, заживлении ран, при наличии в крови ревматоидного фактора и т.п. Тем не менее, определение Д-димера имеет важное диагностическое значение в диагностике тромбозов. Нормальный его уровень позволяет с точностью 98% исключить состояния, сопровождающиеся повышенным тромбообразованием.
Антитромбин III (Antithrombin III)
АТ III определяется по ингибированию тромбина. Дефицит AT III может быть наследственным или приобретенным. Наиболее частым клиническим проявлением наследственного дефицита AT III является развитие тромбоза глубоких вен и, как следствие этого, тромбоэмболии легкого. Вероятность развития тромботических осложнений у больных с дефицитом AT III увеличивается с возрастом.
Приобретенный дефицит AT III может быть обусловлен сниженным синтезом, повышенным потреблением или потерей белка. Во всех этих случаях наблюдается параллельное снижение концентрации и активности AT III. AT III синтезируется в печени, поэтому некоторые заболевания печени приводят к снижению уровня AT III. Если параллельно со снижением AT III происходит повышение тромбогенных свойств стенки сосудов и активация свертывания, то наблюдается дальнейшее снижение AT III обусловленное его потреблением, что встречается при ДВС-синдроме, вызванном различной патологией: при массивных травмах, сепсисе, воспалениях ран, змеиных укусах, осложненной беременности, раке и т.д.
Кроме того, снижение синтеза AT III наблюдается при терапии эстрогенами и синтетическими препаратами, обладающими эстрогенным действием, нефротическом синдроме и желудочно-кишечных заболеваниях, когда потеря белка превышает скорость его синтеза. В этих случаях наблюдается параллельное снижение AT III и альбумина.
Тромбиновое время (ТВ)
Дает общую оценку конечного этапа свертывания крови. Это показатель перехода фибриногена в фибрин, состояния антикоагулянтной системы. Не зависит от внутренней и внешней системы активации, но зависит от концентрации фибриногена, наличия аномального фибриногена, активности антитромбинов, процессов полимеризации и стабилизации фибрина.
В клинике определение ТВ используется для контроля за гепаринотерапией (особенно высомолекулярным гепарином) и фибринолитической терапией; для диагностики активации фибринолиза, косвенной диагностики гипо- и дисфибриногенемий.
Этот тест — один из основных для контроля лечения гепарином. У больных, получающих гепаринотерапию, АЧТВ удлиняется в 1,5–2 раза, что свидетельствует об эффективности лечения.
Определение АЧТВ позволяет окончательно решить вопрос о толерантности к гепарину: для этого проводят определение АЧТВ за 1 ч до очередного введения гепарина. Если АЧТВ окажется удлиненным более чем в 2,5 раза по сравнению с нормой, констатируют повышенную чувствительность к гепарину, снижают его дозу или увеличивают интервал между введениями.
Протромбиновое (тромбопластиновое) время (ПВ)
Путем ПВ с вычислением международного нормализованного отношения (МНО) и протромбинового индекса (ПИ) суммарно оценивают внешний механизм. Протромбиновое время зависит от содержания собственно протромбина — фактора II, а также V, VII, X факторов и фибриногена. Используют для диагностики тромбоэмболических и геморрагических состояний, для контроля за лечением антикоагулянтами непрямого действия.
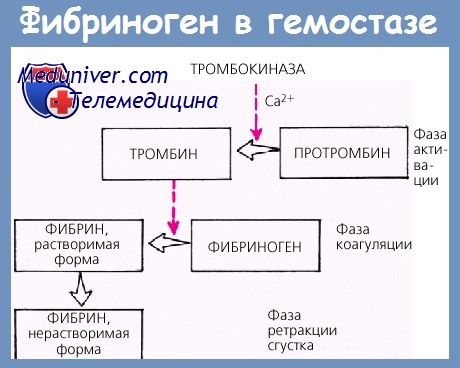
Определение содержания фибриногена
Его концентрация определяется по времени образования сгустка в разведённой бестромбоцитной плазме при добавлении избытка высокоактивного тромбина (по Клауссу). Фибриноген синтезируется в печени, откуда поступает в кровь. Изменение концентрации фибриногена наблюдается при различных заболеваниях — в первую очередь, при нарушениях системы гемостаза и острых воспалениях.
Повышение количества фибриногена даже в пределах нормальных значений рассматривается как фактор риска при сердечно-сосудистых заболеваниях.
Антифосфолипидный синдром (АФЛ)
Это группа заболеваний, вызванных наличием антител к фосфолипидам. Антифосфолипидные антитела (АФЛ) — аутоантитела класса IgG и IgM, способные связываться с антигенными детерминантами фофолипидов- (кардиолипин, фосфатидилсерин, фосфатидилинозитол, фосфатидиловая кислота, фосфатидилхолин) и фосфолипид — связывающих белков. Связывание с кардиолипином происходит при обязательном участии кофактора — рг-гликопротена I.
Причины выработки АФЛ не установлены. Предположительно, длительная персистенция вирусов, тропных к эндотелию сосудов, вызывает: морфологические и функциональные изменения клеток эндотелиальной мембраны с развитием гиперкоагуляционного синдрома, стимуляцию В-лимфоцитов, которые при определенных условиях продуцируют АФЛ.
АФЛ связываются с фосфолипидами клеточных мембран, изменяя конформационную и метаболическую структуру клетки, что приводит к нарушению функции клеток с развитием стаза и тромбоза. В связи с тем, что поражаются сосуды различного калибра и различной локализации, спектр клинических проявлений АФС разнообразен — тромбозы, инсульты, акушерская патология, тромбоцитопении. Частота встречаемости АФЛ при различных патологических состояниях представлена ниже.
Основным критерием лабораторного диагноза АФС является наличие АФЛ (или антител к кардиолипину) и волчаночного антикоагулянта в 2-х или более исследованиях с интервалом не менее 6 недель.
Устаревшие методы исследования нарушений гемостаза и варианты их замены
Гиперфибриногенемия
Гиперфибриногенемия – патологическое состояние, характеризующееся увеличением концентрации фибриногена в крови более 4 г/л. Помимо важного участия в свертывании крови, фибриноген является одним из основных белков острой фазы. Поэтому любой вид клеточного или тканевого повреждения либо воспалительный процесс сопровождается усилением выработки этого белка. Причиной гиперфибриногенемии могут быть острые инфекции, травмы, ожоги и пр. Уровень фибриногена исследуется в плазме крови в рамках стандартной коагулограммы. Коррекция осуществляется лечением основного заболевания.
Причины гиперфибриногенемии
Беременность
В период беременности многие системы организма претерпевают значительные изменения. Изменению подвергается и свертывающая система крови. Под влиянием возрастающей концентрации женских половых гормонов (эстрогенов, прогестерона) увеличивается синтез фибриногена, а также активируются другие компоненты гемостаза.
Все эти процессы имеют физиологический смысл, так как обеспечивают предотвращение возможной кровопотери во время родов, которая может быть фатальной для плода. Содержание фибриногена начинает нарастать с середины первого триместра беременности и достигает максимума к концу третьего триместра (иногда составляет до 6 г/л). После родов фибриноген постепенно возвращается к нормальным значениям, поэтому гиперфибриногенемия при беременности не требует никакого лечения.
Инфекции
При любых острых инфекционных заболеваниях, особенно генерализованных (менингококцемия, сепсис), в той или иной степени выраженности происходит выработка медиаторов воспаления и цитокинов – интерлейкинов 1 и 6, фактора некроза опухоли и т.д. Под их действием в печени синтезируются острофазовые белки, такие как С-реактивный белок, белки системы комплемента и фибриноген.
Эти белки оказывают помощь в функционировании клеток иммунной системы (Т-и В-лимфоцитов, нейтрофилов): способствуют миграции клеток к очагу воспаления, стимулируют фагоцитоз, нейтрализуют свободные радикалы. Концентрация фибриногена увеличивается в период разгара болезни и возвращается к норме в течение нескольких дней после выздоровления. Сама по себе гиперфибриногенемия не имеет никаких клинических признаков, а также не требует вмешательства.
Инфаркт миокарда
При инфаркте миокарда возникает некроз участка сердечной мышцы, а также развивается асептическое воспаление. Секретирующиеся острофазовые белки (фибриноген, СРБ) способствуют связыванию и удалению эндогенных веществ, которые образуются в результате деструкции клеток. Гиперфибриногенемия достигает максимума к 5-му дню от развития ИМ и саморазрешается к концу 3 недели.
Прием оральных контрацептивов
Так как женские половые гормоны в высоких концентрациях непосредственно влияют на свертывающую систему крови, а именно, способны вызвать гиперкоагуляцию, длительная гормональная терапия оральными контрацептивами, содержащими эстрогены, может сопровождаться гиперфибриногенемией.
Гормональные препараты имеют довольно широкий спектр применения: предотвращение нежелательной беременности, лечение ряда гинекологических и эндокринных расстройств, борьба с осложнениями тяжело протекающей менопаузы. Клиническим признаком гиперфибриногенемии на фоне приема этих гормональных средств могут быть тромбозы, наиболее часто – тромбоз глубоких вен нижних конечностей.
Злокачественные новообразования
Рост злокачественной опухоли сопровождается разрушением окружающих тканей. При интенсивном распаде клеток в системный кровоток попадают потенциально токсические вещества (калий, миоглобин). Их связывание, нейтрализация и элиминация происходит с участием фибриногена и других белков. Степень гиперфибриногенемии определяется агрессивностью роста образования.
Другие причины
Существуют некоторые заболевания и патологические состояния, которые могут сопровождаться гиперфибриногенемией, однако, механизм ее развития остается неизвестным. Гиперфибриногенемия при данных болезнях не имеет клинических признаков и не требует лечения:
Диагностика
При высоких значениях фибриногена нужно обязательно обратиться к врачу-терапевту для выяснения причины. В первую очередь уточняется, принимает ли пациент какие-либо лекарственные препараты. При подозрении на беременность врач спрашивает о дате последней менструации и о наличии симптомов, которые могут быть косвенным признаком беременности – резкое увеличение аппетита, тошнота по утрам. Назначаются дополнительные методы исследования:
Коррекция
Медикаментозная терапия
Если причиной гиперфибриногенемии послужил прием пероральных контрацептивов, во избежание развития тромбозов может потребоваться отмена данных препаратов при наличии у пациентки факторов риска (лишний вес, курение, наследственные тромбофилии). Во всех остальных случаях, за исключением беременности, для коррекции гиперфибриногенемии необходима терапия основного заболевания. Применяются следующие виды лечения:
Хирургическое лечение
Больным с ИМ проводится операция по реваскуляризации, т.е. восстановлению кровотока в коронарных артериях ‒ чрескожная транслюминальная балонная ангиопластика с последующим стентированием. Через бедренную или лучевую артерию вводится катетер и устанавливается в пораженную коронарную артерию. В месте стеноза с помощью высокого давления происходит разрушение атеросклеротической бляшки, затем на это место ставится стент, расширяющий просвет сосуда.
Больным с множественным поражением коронарных артерий на нескольких участках стентирование будет малоэффективно, поэтому им выполняется открытая операция – аортокоронарное шунтирование. Пациентам с амилоидозом часто требуется трансплантация почки.
Прогноз
Гиперфибриногененемия является признаком тяжести многих воспалительных процессов и может свидетельствовать о неблагоприятном прогнозе. Также она выступает фактором риска венозных или артериальных тромбозов. Поэтому данное лабораторное отклонение требует дальнейшего обследования для своевременной диагностики и лечения заболеваний.