Признаки лабильности в атланто аксиальном сочленении что это
Что такое нестабильность шейного отдела позвоночника? Причины возникновения, диагностику и методы лечения разберем в статье доктора Никитина С. С., невролога со стажем в 12 лет.
Определение болезни. Причины заболевания
В скелетно-мышечном аппарате есть суставы, которые от природы являются неподвижными, то есть стабильными. Это свойство может быть утеряно, тогда суставы и сочленения становятся «нестабильными». Например, лонное сочленение или крестцово-подвздошные суставы могут утратить свою неподвижность после родов или ввиду травм данной анатомической области. Сегменты позвоночника также относятся к образованиям, которые могут утратить свою неподвижность, что и называется в медицинской практике термином «нестабильность». [1] Стоит отметить, что у детей до 10-ти лет нестабильность считается нормой, так как структуры, отвечающие за стабильность позвоночника, в их возрасте находятся в фазе активного роста.
Позвоночник взрослого человека состоит из 33-х или 34-х позвонков (встречается вариант нормы с шестью поясничными позвонками), что составляет 25 или 26 двигательных сегментов. [1]
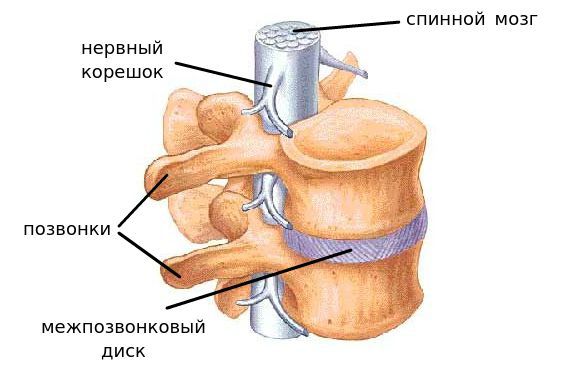
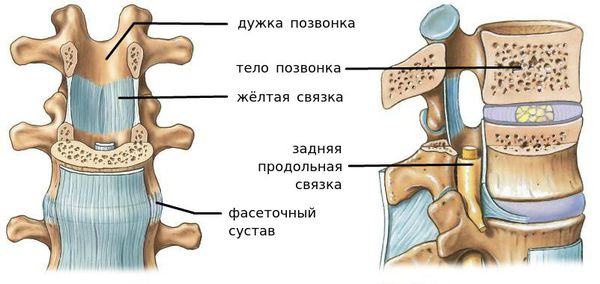
Сегмент позвоночника — это анатомическая и функциональная единица позвоночника. Анатомически сегмент состоит из межпозвонкового диска, нижней половины вышележащего позвонка, верхней половины нижележащего позвонка, передней и задней продольной связки, жёлтой связки, межпозвонковых суставов, а также всех мягких и нервных тканей, находящихся на этом уровне. [1]
За стабильность сегмента отвечают следующие структуры (перечислены в порядке убывания): межпозвонковый диск, связки и фасеточные суставы, тела позвонков.
Соответственно, и причины развития нестабильности воздействуют именно на перечисленные структуры.
Причинами являются:
Симптомы нестабильности шейного отдела позвоночника
Смещение диска как проявление нестабильности сегмента не всегда может порождать какие-то симптомы и жалобы. Вызывающую определенную симптоматику нестабильность называют «клинически значимой».
1. Боль. Сюда же относится и головная боль. Является самым частым симптомом, возникает периодически. Часто появляется после физической нагрузки, нередко уже во время нагрузки. Также возникает после сна в неудобном положении, длительном сидении при наклонённой вперёд и вниз голове, также при сгибании и разгибании головы. При повороте головы в стороны и наличии нестабильности может появиться онемение конечностей и головокружение. Также часто появляется при выполнении неверно подобранных упражнений, не подходящих для пациента, или при неправильном их выполнении. [2]
2. Мышечная симптоматика. Постоянное ощущение напряжения мышц шеи, усталости. Повседневная нагрузка вызывает напряжение, боль и требует отдыха. [2]
3. Очаговая неврологическая симптоматика. По своим проявлениям напоминает корешковую симптоматику — простреливающие боли, онемение и слабость верхних конечностей. При пальпации паравертебральных точек определяется боль.
4. Гипертензионный синдром. Проявляется повышением внутричерепного давления, что, в свою очередь, усиливает головную боль, головокружение. Также проявляется повышением артериального давления. Многие авторы считают, что оба эти проявления чреваты развитием панических атак. [1] [3]
5. Вестибуло-кохлеарные и окуло-кохлеарные нарушения. К ним относятся шум в ушах и головокружение, нарушение зрения. Пациенты часто обращаются к врачам-офтальмологам или врачам-отоларингологам, но при обследовании органов зрения и слуха не обнаруживается сколь значимых нарушений. Симптомы вызываются сдавлением позвоночной артерии, что возможно при изменении высоты межпозвонковых дисков и спондилоартроза, или артроза межпозвонковых суставов. [5]
6. Деформация позвоночника. Боль уменьшается при фиксированной шее, часто при наклоне на бок. Длительное пребывание в таком положении изменяет форму шеи, вызывает формирование или усиление кифоза (искривление позвоночника в форме горба). Кстати, тот самый нарост, который многие именуют «скоплением жира», может быть симптомом нестабильности. [5]
7. Нарушение сна. Развивается при хронизации боли. Постоянное ощущение дискомфорта, невозможность найти удобную позу для сна, вынужденная поза при выполнении повседневной нагрузки — всё это способствует невротизации, и, как следствие, развивается нарушение сна. [2] [3] [4]
Патогенез нестабильности шейного отдела позвоночника
Вопросом изучения патогенеза нестабильности сегментов шейного отдела позвоночника занимался Krismer и его ученики. [1] Опытным путём они доказали, что волокна фиброзного кольца межпозвонкового диска ограничивают ротацию позвонков даже сильнее, чем межпозвонковые и фасеточные суставы. Они также перечислили различные определения нестабильности, описали её, как состоящую из следующих механических аномалий:
Вопросы развития других видов нестабильности в настоящий момент являются дискутабельными. Хотя, рассматривая патогенез послеоперационной нестабильности, многие авторы сходятся во мнении, что сама операция является фактором, усиливающим нестабильность. Ведь сложно представить ситуацию, когда потребовалось удалить здоровый диск.
Классификация и стадии развития нестабильности шейного отдела позвоночника
Различают три стадии нестабильности: [1]
Осложнения нестабильности шейного отдела позвоночника
Самыми частыми осложнениями являются сдавление позвоночной артерии (или синдром позвоночной артерии) и интенсивный болевой синдром.
Синдром позвоночной артерии развивается в двух ситуациях:
Сдавление артерии чревато развитием общемозговой и вестибулярной симптоматики в виде головной боли, головокружения и шумовых эффектов. При остром сдавлении, как правило, развивается острый приступ в виде выраженного головокружения с тошнотой и рвотой, нарушение вестибулярной функции. При длительном сдавлении развивается хроническое нарушение мозгового и спинального кровообращения. [4]
Интенсивный болевой синдром встречается достаточно часто (либо в ситуации отсутствия лечения, либо невыполнения рекомендаций доктора по ограничению физических нагрузок). Нарастание мышечного тонуса, постоянный недостаток питательных веществе в силу нарушения кровообращения способствуют также хронизации боли. [1] [2] [5]
Расстройство двигательной функции и чувствительности развивается при сдавлении мышц и нервов, залегающих в межмышечных пространствах. Характеризуется ограничением функции мышц и онемением в зоне иннервации нервов. [1] [3] [4] [5]
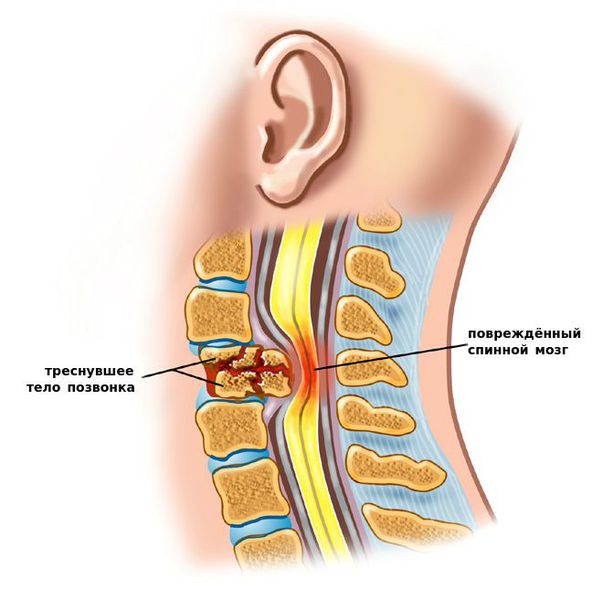
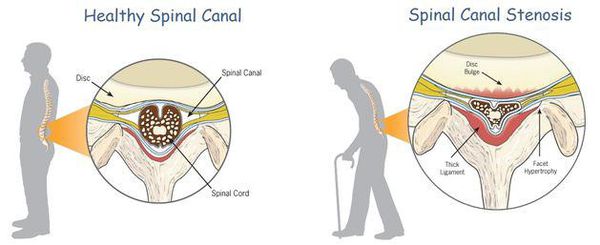
К самым серьезным осложнениям нестабильности относят стеноз позвоночного канала и компрессию спинного мозга. [1] [4] [5]
Оба расстройства опасны нарушением кровообращения, признаком которого является поражение проводящих нервных волокон, что клинически проявляется парезом (параличом) верхних и нижних конечностей, нарушением функции органов малого таза и кожной чувствительности.
Справедливости ради стоит отметить, что подобные осложнения при современном уровне диагностики и лечения возникают крайне редко.
Диагностика нестабильности шейного отдела позвоночника
Сбор жалоб и анамнеза заболевания является неотъемлемым этапом обследования пациента. При этом врач обращает внимание на характеристики и описания болевого синдрома, его локализацию, сопутствующие симптомы, такие как головная боль, головокружение, шаткость при ходьбе и др.
Неврологический осмотр. При осмотре врач-невролог определяет болезненность паравертебральных точек в шейном отделе позвоночника, напряжение и болезненность мышц, зоны отражённой и иррадиирующей боли, нарушения чувствительности, объём движений мышц и суставов, объём движений в шейном отделе позвоночника.
Рентгенографическое исследование. В стандартных проекциях признаки нестабильности обнаруживаются редко. Обязательным является выполнение функциональных рентгенологических исследований. Это самая важная методика, которой в последнее время, к сожалению, пренебрегают. При выполнении определяется переднезаднее смещение тела одного позвонка относительно другого позвонка. Общепринятой толщиной этого размера является 4 мм. Одной из возможных причин, по которой методику всё чаще игнорируют, является тот факт, что не обнаруживается корреляции между выраженностью симптомов и размерами смещения.
Компьютерная томография применяется для исследования всего шейного отдела или одного позвонка. На КТ шейного отдела можно определить ширину позвоночного канала, степень спондилоартроза.
Магнитно-резонансная томография применяется для исследования всего шейного отдела, особенно тщательно позволяет рассмотреть межпозвонковые диски.
Лечение нестабильности шейного отдела позвоночника
При наличии нестабильности лечение должно быть комплексным. Огромную роль играет профилактика.
Лечение строится из нескольких этапов.
Медикаментозное лечение:
Физиотерапевтическое лечение. [1] [2] [5]
Является эффективным средством лечения боли, купирования воспаления, восстановления нервной и мышечной ткани. Также физиотерапевтическое лечение позволяет доставить в очаг лекарственное вещество посредством электрического тока. При физиотерапевтическом лечении применяют:
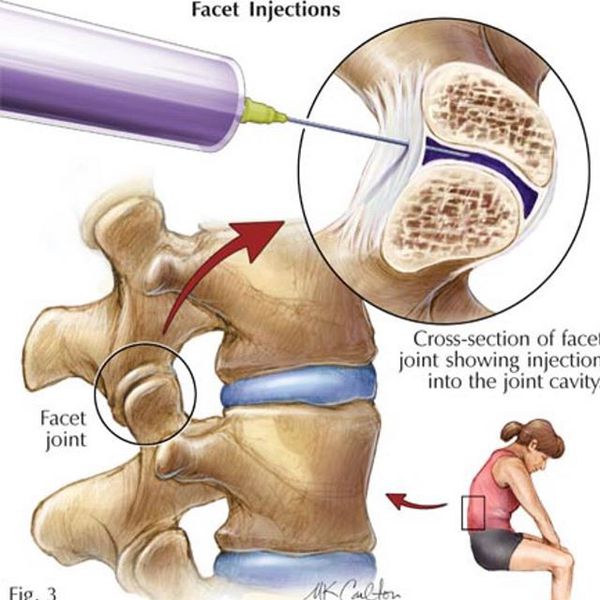
Новокаиновая блокада [1] [2]
Является способом купирования острой боли за счёт доставки лекарственного вещества непосредственно к её очагу. Проводится врачом-неврологом в медицинском учреждении (не на дому!) после специального курса обучения. Лекарственным веществом может выступать раствор Новокаина 0,5% или раствора Лидокаина 2%. Также можно добавить растворы витаминов или гормонов. Состав вводимого вещества подбирает доктор в соответствии с клиническими показаниями в отсутствии противопоказаний к вводимым препаратам. Следует учесть, что врач-невролог не должен вводить вещество в межпозвонковые суставы, эту процедуру могут проводить только врачи-нейрохирурги.
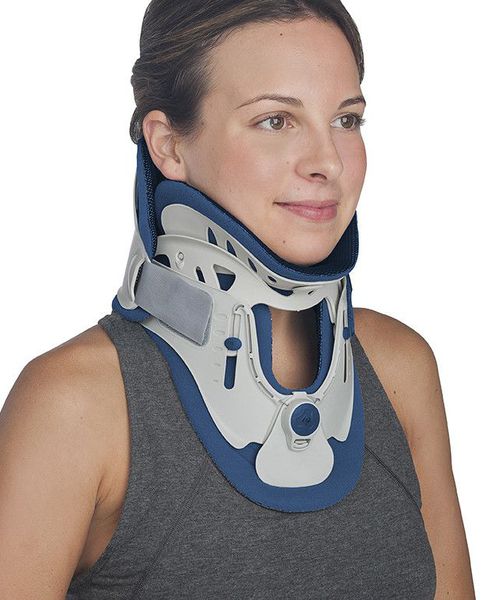
Иммобилизация позвоночника. [2] [3] [5]
Является одним из первых средств помощи при обострении. Осуществляется специальным воротником, ограничивающим подвижность. Назначается только врачом, подбирается строго индивидуально по размерам шеи. Рекомендовано подбор проводить в специализированных ортопедических салонах. Режим ношения воротника также рекомендуется в зависимости от причины, вызвавшей обострение.
Мануальная терапия. [3] [5]
Является средством мобилизации позвонков. Запрещено выполнять в острый период травмы. Выполняется мануальным терапевтом по рекомендации невролога после осмотра.
Лечебная гимнастика. [3]
Является одним из самых эффективных средств профилактики и лечения. Курс разрабатывается для пациента в зависимости от причины, вызвавшей нестабильность, а также состояния позвоночника. Цель гимнастики — это укрепления мышечной ткани (связок и мышц). Если гимнастика проводится после травмы или оперативного вмешательства, то проводится только под контролем врача-невролога или инструктора-методиста в кабинете ЛФК. После обучения курс проводится дома самостоятельно.
Рефлексотерапия, в частности акупунктура.
Является средством купирования боли, восстановления мышечной и нервной ткани, лечения сопутствующих симптомов: улучшение кровообращения, улучшение сна. Выполняется только врачом-рефлексотерапевтом при помощи специальных игл.
Хирургическое лечение. [1] [5]
Является редкой практикой. Выполняется в детском возрасте в случае доказанных аномалий строения. Во взрослой практике чаще выполняется операция «спондилодез». Она заключается в имплантации конструкции из металлических пластин и фиксирующих элементов. Её задача — препятствовать избыточной подвижности позвоночника. Операция применяется после травм, дискотомий и ламинэктомий. Последние две проводятся при грыжах позвоночника.
Атланто-аксиальная нестабильность
Общее описание.
Важно понимать, что суставное соединение между первым и вторым шейными позвонками представляет собой наиболее подвижную часть позвоночника и имеет небольшую врожденную устойчивость, по сравнению с другими отделами позвоночника. Существует несколько патологий, которые могут возникать между первым и вторым шейными позвонками. Они вызывают определенную нестабильность шейного отдела позвоночника. Следствием этого является временное сужение позвоночного канала и вторичное сдавление нервных элементов. Зубовидный отросток, который отходит вверх от 2 шейного позвонка, и соединяющие оба позвонка связки, являются единственными факторами, ограничивающими движение.
Причины.
Дегенеративные процессы в нижних отделах позвоночника ограничивают его подвижность и приводят к увеличению нагрузки и объема движений в шейном отделе. Это может служить причиной того, что атланто-аксиальная нестабильность становится более выраженной с возрастом.
У детей возможно неправильное развитие зубовидного отростка. Встречаются сочетанные аномалии развития задней черепной ямки, вследствие чего отмечается выпадение и вклинивание мозжечка в позвоночный канал. К атланто-аксиальной нестабильности может приводить травматическое или ревматическое разрушение связок, которые удерживают зубовидный отросток на месте.
Симптомы.
Для людей с атланто-акисиальной недостаточностью наиболее характерна переменчивая картина неврологических симптомов. Возможна общая слабость и эпизоды падений. Если вовлечен мозжечок, то отмечается нарушение координации движений. Иногда задействованы позвоночные артерии, которые проходят с каждой стороны позвоночного столба. Наиболее часто это происходит в старшем возрасте в силу процессов старения позвоночника и кровеносных сосудов. При недостаточности позвоночных артерий отмечаются такие симптомы, как головокружение, судорожные припадки, замедленная умственная реакция, обмороки.
Диагностика в нашей клинике:
Запись в Пресненский центр: +7 (495) 266-30-55
Признаки лабильности в атланто аксиальном сочленении что это
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Долгопрудненская ЦГБ», ул. Павлова, 2, Долгопрудный, Московская область, Россия, 141704
Атлантоаксиальные дислокации ревматоидного генеза: хирургическая тактика
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018;82(1): 41-47
Лисицкий И. Ю., Киселев А. М., Киселев С. Е. Атлантоаксиальные дислокации ревматоидного генеза: хирургическая тактика. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2018;82(1):41-47.
Lisitskiy I Yu, Kiselev A M, Kiselev S E. Rheumatoid atlanto-axial dislocation: a surgical approach. Zhurnal Voprosy Neirokhirurgii Imeni N.N. Burdenko. 2018;82(1):41-47.
https://doi.org/10.17116/neiro201882141-47
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», ул. Щепкина, 61/2, Москва, Россия, 129110
ГБУЗ МО «Долгопрудненская ЦГБ», ул. Павлова, 2, Долгопрудный, Московская область, Россия, 141704
Атлантоаксиальная дислокация (ААД) не является самостоятельной нозологической единицей и представляет собой патоморфологический субстрат ряда травм и заболеваний краниовертебральной области (КВО). Наряду с травматическим, воспалительным, опухолевым генезом, причиной ААД нередко является ревматоидный артрит [1—3].
Ревматоидный артрит — хроническое системное заболевание соединительной ткани, имеющее аутоиммунный характер, затрагивающее преимущественно мелкие суставы. Распространенность заболевания в популяции составляет от 0,8 до 2% [4]. Женщины болеют в 3 раза чаще мужчин [1, 4]. Заболевание манифестирует на 4—6-й декаде жизни [5, 6]. По данным разных авторов [5—7], от 40 до 80% больных с ревматоидным артритом имеют клинические симптомы поражения шейного отдела позвоночника. У большинства из них находят рентгенологические признаки заболевания. При этом у 65% пациентов с подвывихами и деформациями шейного отдела позвоночника ревматоидный артрит разрушает атлантоаксиальное сочленение и приводит к ААД.
КВО представляет собой уникальный анатомический комплекс, осуществляющий, наряду с защитой жизненно важных структур мозга и его магистральных сосудов, разнообразные двигательные функции. Сложная биомеханика КВО обеспечивается атлантозатылочным и атлантоаксиальным суставами и их связочным аппаратом. В то время как парный атлантозатылочный сустав является достаточно стабильным, атланто-аксиальное сочленение, представленное парным латеральным атлантоаксиальным и срединным атлантоаксиальным суставом (сустав Крювелье), представляет собой более мобильный комплекс, который обеспечивает 60% движений головой [8]. Мобильность комплекса делает его более уязвимим, что обусловливает дислокационные осложнения при травмах и патологических процессах КВО, в том числе ревматоидного генеза. Патогенез ААД при ревматоидном артрите связан с деструкцией капсульно-связочного аппарата и костных структур атлантоаксиального сочленения, приводящей к нестабильности. Неврологические осложнения обусловлены компрессией ствола мозга дислоцированным зубовидным отростком или ревматоидной гранулемой (паннусом) [9].
Дислокации при ревматоидном поражении КВО делятся на передние (49%), боковые (20%), задние (7%) и ротационные (крайне редкие). Они могут быть нефиксированными или ригидными. Ригидность дислокации обусловлена стадией артрита. В поздней стадии заболевания формируется фиброзно-костный анкилоз и деформация становится ригидной. В 38% случаев ААД сочетаются с базилярной инвагинацией, что связано с деструкцией латеральных атлантоаксиальных суставов [10].
Не всегда ревматоидное поражение шейного отдела позвоночника проявляет себя клинически. Так, по данным ряда авторов [11, 12], у 40—88% пациентов с рентгенологически подтвержденным ревматоидным поражением шейного отдела позвоночника клиника представлена только болевым синдромом, и лишь у 7—34% из них имеются неврологические нарушения. Клиническая картина при ААД проявляется целой гаммой неврологических расстройств, связанных с компрессией ствола мозга, верхних отделов спинного мозга и с нарушением кровотока в вертебробазилярном бассейне.
Материал и методы
В 2015—2016 гг. нами оперированы 5 пациентов с ААД ревматоидного генеза — 4 женщины и 1 мужчина в возрасте от 54 до 73 лет. У всех больных был диагностирован ревматоидный артрит. Длительность заболевания составляла более 20 лет. Все дислокации были передними. У 3 пациентов была дислокация паннуса. В 2 случаях нефиксированной, с наличием ААД была ригидной и сочеталась с инвагинацией зубовидного отростка в большое затылочное отверстие (БЗО). Величина ААД определялась передним атлантодентальным интервалом и варьировала от 6 до 10 мм.
Всем пациентам с ревматоидным поражением КВО, помимо стандартных методов предоперационного обследования, проводилась функциональная спондилография для оценки степени ригидности деформации, что имело ключевое значение для выбора тактики хирургического лечения.
Клиническая картина, кроме болевого синдрома, спастического тетрапареза и проводниковых расстройств чувствительности, в отдельных случаях была представлена атаксией, нейрогенной дисфункцией тазовых органов, бульбарными расстройствами, преходящими ишемическими нарушениями кровообращения в вертебробазилярном бассейне. Мотивом обращения больных в стационар был, как правило, не болевой синдром, а прогрессирующий неврологический дефицит.
Выраженность неврологических расстройств находилась в прямой зависимости от величины ААД. Показанием для оперативного лечения являлось увеличение переднего атлантодентального интервала до 6 мм и более.
Алгоритм принятия клинических решений о выборе метода хирургического лечения определялся стабильностью деформации. Мобильные ААД являлись показанием для непрямой декомпрессии путем проведения инструментальной коррекции дислокации и атлантоаксиальной фиксации из заднего доступа. При фиксированных ААД задняя фиксация дополнялась передней декомпрессией из транс-орального доступа.
Для анализа результатов хирургического лечения использованы шкалы C. Ranawat (табл. 1 и 2), 

Инструментальная коррекция деформации и атлантоаксиальная фиксация винтовыми металлоконструкциями выполнена 3 больным с нефиксированными дислокациями. Винты вводились в боковые массы С1 позвонка и транспедикулярно в тело С2 позвонка по методу J. Harms, после чего проводились инструментальное устранение дислокации и монтаж металлоконструкции. В одном случае, когда коррекция ААД была недостаточной, с целью увеличения подвижности осуществлен артролиз боковых атлантоаксиальных суставов, для доступа к которым проводилась мобилизация С2 корешка с двух сторон.
При ригидных ААД, сочетавшихся с базилярной инвагинацией, проведены комбинированные одномоментные оперативные вмешательства. Первым этапом в одном случае выполнен окципитоспондилодез С0—С2—С3, в другом — задняя фиксация С1—С2 позвонков по методу Harms. Вторым этапом произведена трансоральная декомпрессия мозга (резекция передней дужки атланта и зубовидного отростка С2 позвонка).
Наблюдение № 1
Больная А., 54 лет. Клинический диагноз: ревматоидное поражение КВО. Нефиксированная ААД. Спастический тетрапарез. Нейрогенная дисфункция тазовых органов. Транзиторные ишемические нарушения в вертебробазилярной системе.
В течение 20 лет страдает ревматоидным артритом с поражением суставов кистей и стоп, коленных суставов с их вторичной деформацией. Клиническая картина представлена болевым синдромом, грубым спастическим тетрапарезом со снижением силы в руках и ногах до 3 баллов, мозжечковой и сенситивной атаксией, нейрогенной дисфункцией тазовых органов по центральному типу, преходящими нарушениями мозгового кровообращения по типу «дроп-атак» при резкой смене положения головы (Ranawat III B, боль 2 балла). Наблюдался симптом Лермитта. Неврологическая симптоматика манифестировала за 2 года до госпитализации и постепенно прогрессировала.
При функциональной спондилографии выявлен нефиксированный характер деформации (рис. 1, а, 
Операция: в положении больной на животе с фиксированной в скобе Mayfield головой осуществлена установка винтов в боковые массы С1 позвонка и транспедикулярно в тело С2 позвонка, произведены инструментальная редукция дислокации и монтаж металлоконструкции.
Течение послеоперационного периода гладкое. В неврологическом статусе отмечены увеличение силы в руках и ногах до 4—5 баллов, купирование болевого синдрома, регресс чувствительных расстройств и нормализация мышечного тонуса в конечностях, отсутствие симптомов нарушения кровообращения в вертебробазилярном бассейне (Ranawat I, боль 0 баллов).
Контрольные РКТ и спондилография подтвердили воссоздание правильных анатомических взаимоотношений в КВО, в том числе при функциональных пробах, отсутствие компрессии ствола мозга (рис. 2, а‒г). 
Наблюдение № 2
Больная А., 68 лет. Клинический диагноз: ревматоидное поражение КВО. Ригидная ААД. Спастический тетрапарез.
Страдает ревматоидным артритом более 20 лет, с вторичной деформацией суставов кистей и стоп. Неврологический статус представлен грубым спастическим тетрапарезом со снижением силы в руках и ногах до 3 баллов, бульбарными нарушениями (Ranawat III B, боль 0 баллов). Неврологические расстройства появились за несколько месяцев до госпитализации.
При РКТ и функциональной спондилографии выявлена фиксированная ААД со смещением зубовидного отростка в БЗО и грубой компрессией ствола мозга (рис. 3, а—г). 
Операция: первым этапом в положении больной на животе произведена резекция края БЗО и задней полудужки атланта, артролиз боковых атлантоаксиальных суставов, окципитоспондилодез винтовой металлоконструкцией с коррекцией деформации. После поворота на спину выполнена трансоральная резекция нижних отделов ската, передней полудужки атланта, зубовидного отростка до твердой мозговой оболочки.
Послеоперационный период протекал без осложнений. В неврологическом статусе отмечены положительная динамика в виде увеличения силы в руках до 4 баллов и в ногах до 3 баллов, регресс чувствительных расстройств и нормализация мышечного тонуса в конечностях (Ranawat III А, боль 0 баллов).
Контрольная РКТ подтвердила отсутствие сдавления ствола мозга как за счет проведенной декомпрессии, так и за счет инструментальной коррекции деформации КВО (рис. 4). 
Результаты
Обсуждение
Раннее формирование ААД характерно для ревматоидного поражения КВО. Тяжелые неврологические осложнения, а также риск их развития, определяют показания к оперативному лечению. Учитывая неблагоприятный прогноз, оперативное лечение в этих случаях должно проводиться как можно раньше.
Цель хирургического лечения ААД ревматоидного генеза — устранение сдавления ствола мозга и надежная фиксация пораженной области. Использование декомпрессивной ляминэктомии, протяженных задних фиксаций в настоящее время необходимо признать избыточными при лечении ревматоидного поражения КВО. Возможность проведения инструментальной коррекции ААД и надежной «короткой» фиксации из заднего доступа позволяет выполнить декомпрессию ствола мозга, восстановив правильные анатомические взаимоотношения в КВО, минимизировать операционную травму и значительно улучшить функциональные исходы лечения. Эта возможность определяется не только современными техническими средствами, но и особенностями ААД. К таким особенностям относится, в частности, стабильность деформации, которая определяет тактику хирургического лечения ААД.
Ригидность ААД зависит от длительности течения ревматоидного артрита. При манифестации ревматоидного поражения дислокационные осложнения имеют нефиксированный характер. Неврологические осложнения обусловлены дислоцированным зубовидным отростком и ревматоидной гранулемой. В этих случаях устранение деформации возможно с помощью задней фиксации по методу Harms. Эта техника позволяет избежать протяженной фиксации и обеспечивает оптимальные функциональные исходы лечения. Более того, фиксация С1—С2 позвонков приводит к купированию воспалительного процесса и самопроизвольному рассасыванию паннуса.
На поздней стадии заболевания вследствие фиброзно-костного анкилоза ААД становятся фиксированными. Показания к операции в этих случаях определяются наличием неврологических расстройств.
Кажущаяся очевидной необходимость транс-оральной декомпрессии будет неоправданной в случае сохранения даже минимальной мобильности ААД. В данной ситуации проведение артролиза атлантоаксиальных суставов, задней фиксации С1—С2 позвонков по методу Harms и инструментальной коррекции ААД позволяет выполнить непрямую декомпрессию ствола мозга, избежав трансорального вмешательства.
Трансоральная декомпрессия при ревматоидном поражении КВО показана только в случаях ригидных ААД после проведения окципитоспондилодеза или задней фиксации С1—С2 позвонков по методу Harms.
Выводы
Все пациенты с ревматоидным артритом должны быть целенаправленно обследованы для ранней диагностики поражения КВО. Учитывая риск развития неврологического дефицита, наличие дислокационных осложнений является абсолютным показанием к проведению хирургического лечения.
Диагностика стабильности деформации является ключевым фактором, определяющим тактику хирургического лечения.
При нефиксированных ААД, даже при наличии неврологического дефицита, показана инструментальная коррекция деформации и атлантоаксиального спондилодеза из заднего доступа.
Ригидные ААД являются показанием к хирургическому лечению при наличии неврологических расстройств. В этих случаях требуется выполнение окципитоспондилодеза или задней фиксации С1—С2 позвонков и трансоральной декомпрессии.
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Вработеописано 5 клиническихслучаевхирургическоголечениянестабильностиватлантоаксиальном сочленении на фоне ревматоидного артрита. Авторы используют общепринятую тактику лечения пациентов в зависимости от характера нестабильности (передняя, задняя) и давности процесса. Применяются все варианты хирургических доступов (в том числе трансоральный), а также различные варианты ограниченной и распространенной стабилизации.
Статья представляет интерес в связи с редкостью описываемой патологии.