Приведите примеры реакций подтверждающие что оксиды и гидроксиды щелочных и щелочноземельных
Приведите примеры реакций, подтверждающие, что оксиды и гидроксиды щелочных и.
В 7:41 поступил вопрос в раздел Химия, который вызвал затруднения у обучающегося.
Вопрос вызвавший трудности
Ответ подготовленный экспертами Учись.Ru
Для того чтобы дать полноценный ответ, был привлечен специалист, который хорошо разбирается требуемой тематике «Химия». Ваш вопрос звучал следующим образом:
После проведенного совещания с другими специалистами нашего сервиса, мы склонны полагать, что правильный ответ на заданный вами вопрос будет звучать следующим образом:
Основные свойства:
Na2O+2HCl=2NaCl+H2O
CaO+SO2=CaSO3
KOH+HNO3=KNO3+H2O
Ba(OH)2+H2SO4=BaSO4+2H2O
Амфотерные свойства:
Be(OH)2+2HCl=BeCl2+2H2O
Be(OH)2+KOH=K2[Be(OH)4]
НЕСКОЛЬКО СЛОВ ОБ АВТОРЕ ЭТОГО ОТВЕТА:
Работы, которые я готовлю для студентов, преподаватели всегда оценивают на отлично. Я занимаюсь написанием студенческих работ уже более 4-х лет. За это время, мне еще ни разу не возвращали выполненную работу на доработку! Если вы желаете заказать у меня помощь оставьте заявку на этом сайте. Ознакомиться с отзывами моих клиентов можно на этой странице.
ПОМОГАЕМ УЧИТЬСЯ НА ОТЛИЧНО!
Выполняем ученические работы любой сложности на заказ. Гарантируем низкие цены и высокое качество.
Деятельность компании в цифрах:
Зачтено оказывает услуги помощи студентам с 1999 года. За все время деятельности мы выполнили более 400 тысяч работ. Написанные нами работы все были успешно защищены и сданы. К настоящему моменту наши офисы работают в 40 городах.
Площадка Учись.Ru разработана специально для студентов и школьников. Здесь можно найти ответы на вопросы по гуманитарным, техническим, естественным, общественным, прикладным и прочим наукам. Если же ответ не удается найти, то можно задать свой вопрос экспертам. С нами сотрудничают преподаватели школ, колледжей, университетов, которые с радостью помогут вам. Помощь студентам и школьникам оказывается круглосуточно. С Учись.Ru обучение станет в несколько раз проще, так как здесь можно не только получить ответ на свой вопрос, но расширить свои знания изучая ответы экспертов по различным направлениям науки.
Приведите примеры реакций, подтверждающие, что оксиды и гидроксиды щелочных и щелочноземельных металлов имеют оснОвный характер а оксид и гидроксид бериллия амфотерный?
Приведите примеры реакций, подтверждающие, что оксиды и гидроксиды щелочных и щелочноземельных металлов имеют оснОвный характер а оксид и гидроксид бериллия амфотерный.
Na2O + 2HCl = 2NaCl + H2O
KOH + HNO3 = KNO3 + H2O
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Be(OH)2 + KOH = K2[Be(OH)4].
Какую валентность проявляют щелочные металлы в оксидах и гидроксидах?
Какую валентность проявляют щелочные металлы в оксидах и гидроксидах?
Напишите уравнения образования оксида и гидроксида щелочного металла лития.
Привидите доказательства амфотерного характера оксида и гидроксида бериллия?
Привидите доказательства амфотерного характера оксида и гидроксида бериллия.
Написать формулы оксидов, соответствующих указанным гидроксидам?
Написать формулы оксидов, соответствующих указанным гидроксидам.
Написать уравнения реакций, доказывающих основной, кислотный или амфотерный характер оксидов и их гидроксидов.
Оксид и гидроксид титана?
Оксид и гидроксид титана?
Напишите характер(кислотный, амфотерный, основный?
Напишите формулы высших оксидов и их гидроксидов для элементов с порядковыми номерами 4 ; 37 ; 75?
Напишите формулы высших оксидов и их гидроксидов для элементов с порядковыми номерами 4 ; 37 ; 75.
Напишите уравнение реакций, доказывающих амфотерный характер гидроксида бериллия.
Помогите написать амфотерные свойства : оксида Бериллия, гидроксида Бериллия ; оксида Аллюминия и гидроксида Аллюминия?
Помогите написать амфотерные свойства : оксида Бериллия, гидроксида Бериллия ; оксида Аллюминия и гидроксида Аллюминия.
Это сложноевещество может вступать в реакции с металлами, основнымии амфотерными оксидами, основаниями и амфотернымигидроксидами, солями?
вещество может вступать в реакции с металлами, основными
и амфотерными оксидами, основаниями и амфотерными
В чем проявляется основной характер оксидов и гидроксидов щелочных щелочноземельных элементов и магния?
В чем проявляется основной характер оксидов и гидроксидов щелочных щелочноземельных элементов и магния.
Какими химическими свойствами обладают оксиды щелочных и щелочноземельных металлов?
Какими химическими свойствами обладают оксиды щелочных и щелочноземельных металлов?
1. Молярная масса вещества 1, 52 * 29 = 44г / моль 2. Количество вещества углеводорода 4, 4г / 44г / моль = 0, 1 моль 3. Количество вещества оксида углерода 13, 2г / 44г, моль = 0, 3 моль 4. Количество вещества атомов углерода п (СО2) = п (С) = 0.
. 2. Находим количество углеводорода 3. Находим количество атомов углерода 4. Находим массу углеводорода 5. Находим массу водорода 6. Находим количество атомов водорода 7. Находим соотношение атомов в углеводороде 8. Формула углеводорода.
1) Al2(SO4)3 + H2 2) Pb + H2O(Это не точно) 3)MgCI2 + H2 4)Mn + H2O(Это не точно).
Потому что если бы было всё золото тогда например алмаз был бы тоже золото, вот поэтому его называют аурум.
Золото — пожалуй, первый металл, с которым познакомилось человечество. Поскольку золото было известно, вероятно, ещё до появления письменности, проследить историю его названия, скорее всего, невозможно. Известно, однако, что в славянских языках сло..
(10 * 20) / 100% = 2 0, 4kg * 100% / 2 = 20.
1. Это сложное вещество, так как в его состав входят атомы разных видов 2. В состав метана входят химические элементы углерод и водород 3. Молекула метана образована одним атомом углерода и четырьмя атомами водорода 4. Mr(CH4) = Ar(C) + 4Ar(H) = 1..
NH3 + HNO3 = NH4NO3 (реакция соединения) ( реакция является обратимой).
Приведите примеры реакций, подтверждающие, что оксиды и гидроксиды щелочных и.
В 7:41 поступил вопрос в раздел Химия, который вызвал затруднения у обучающегося.
Вопрос вызвавший трудности
Ответ подготовленный экспертами Учись.Ru
Для того чтобы дать полноценный ответ, был привлечен специалист, который хорошо разбирается требуемой тематике «Химия». Ваш вопрос звучал следующим образом:
После проведенного совещания с другими специалистами нашего сервиса, мы склонны полагать, что правильный ответ на заданный вами вопрос будет звучать следующим образом:
Основные свойства:
Na2O+2HCl=2NaCl+H2O
CaO+SO2=CaSO3
KOH+HNO3=KNO3+H2O
Ba(OH)2+H2SO4=BaSO4+2H2O
Амфотерные свойства:
Be(OH)2+2HCl=BeCl2+2H2O
Be(OH)2+KOH=K2[Be(OH)4]
НЕСКОЛЬКО СЛОВ ОБ АВТОРЕ ЭТОГО ОТВЕТА:
Работы, которые я готовлю для студентов, преподаватели всегда оценивают на отлично. Я занимаюсь написанием студенческих работ уже более 4-х лет. За это время, мне еще ни разу не возвращали выполненную работу на доработку! Если вы желаете заказать у меня помощь оставьте заявку на этом сайте. Ознакомиться с отзывами моих клиентов можно на этой странице.
ПОМОГАЕМ УЧИТЬСЯ НА ОТЛИЧНО!
Выполняем ученические работы любой сложности на заказ. Гарантируем низкие цены и высокое качество.
Деятельность компании в цифрах:
Зачтено оказывает услуги помощи студентам с 1999 года. За все время деятельности мы выполнили более 400 тысяч работ. Написанные нами работы все были успешно защищены и сданы. К настоящему моменту наши офисы работают в 40 городах.
Площадка Учись.Ru разработана специально для студентов и школьников. Здесь можно найти ответы на вопросы по гуманитарным, техническим, естественным, общественным, прикладным и прочим наукам. Если же ответ не удается найти, то можно задать свой вопрос экспертам. С нами сотрудничают преподаватели школ, колледжей, университетов, которые с радостью помогут вам. Помощь студентам и школьникам оказывается круглосуточно. С Учись.Ru обучение станет в несколько раз проще, так как здесь можно не только получить ответ на свой вопрос, но расширить свои знания изучая ответы экспертов по различным направлениям науки.
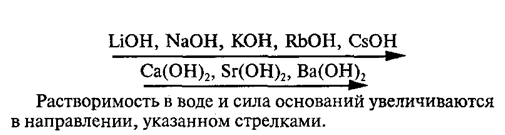
Оксиды и гидроксиды щелочных и щелочноземельных металлов



Оксиды щелочных и щелочноземельных металлов являются типичными основными оксидами, они обладают всеми свойствами основных оксидов. Оксидам соответствуют сильные основания, растворимые в воде (щелочи), они обладают всеми свойствами оснований.
Характеристика оксидов и гидроксидов щелочных и щелочноземельных металлов
В природной воде содержатся соли кальция и магния. Если они содержатся в заметных концентрациях, то в такой воде не мылится мыло из-за образования нерастворимых стеаратов. При её кипячении образуется накипь.
Временная жесткость обусловлена присутствием гидрокарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2. Такую жесткость воды можно устранить кипячением.
Щелочноземельные металлы и их соединения
Элементы II группы главной подгруппы
Элементы II группы главной подгруппы
Положение в периодической системе химических элементов
Щелочноземельные металлы расположены во второй группе главной подгруппе периодической системы химических элементов Д.И. Менделеева (или просто во 2 группе в длиннопериодной форме ПСХЭ). На практике к щелочноземельным металлам относят только кальций Ca, стронций Sr, барий Ba и радий Ra. Бериллий Be по свойствам больше похож на алюминий, магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них. Однако, согласно номенклатуре ИЮПАК, щелочноземельными принято считать все металлы II группы главной подгруппы.
Электронное строение и закономерности изменения свойств
Рассмотрим некоторые закономерности изменения свойств щелочноземельных металлов.
Физические свойства
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Кристаллическая решетка щелочноземельных металлов в твёрдом состоянии — металлическая. Следовательно, они обладают высокой тепло- и электропроводимостью. Кипят и плавятся при высоких температурах.
Нахождение в природе
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочноземельные металлы:
Доломит — CaCO3 · MgCO3 — карбонат кальция-магния.
Магнезит MgCO3 – карбонат магния.
Кальцит CaCO3 – карбонат кальция.
Гипс CaSO4 · 2H2O – дигидрат сульфата кальция.
Барит BaSO4 — сульфат бария.
Витерит BaCO3 – карбонат бария.
Способы получения
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
или восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают восстановлением оксида бария алюминием в вакууме при 1200 °C:
4BaO+ 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
Цвет пламени:
Ca — кирпично-красный
Sr — карминово-красный (алый)
Ba — яблочно-зеленый
Качественная реакция на ионы магния : взаим одействие с щелочами. Ионы магния осаждаются щелочами с образованием белого осадка гидроксида магния:
Mg 2+ + 2OH — → Mg(OH)2↓
Качественная реакция на ионы кальция, стронция, бария : взаим одействие с карбонатами. При взаимодействии солей кальция, стронция и бария с карбонатами выпадает белый осадок карбоната кальция, стронция или бария :
Ca 2+ + CO3 2- → CaCO3↓
Ba 2+ + CO3 2- → BaCO3↓
Качественная реакция на ионы стронция и бария : взаим одействие с карбонатами. При взаимодействии солей стронция и бария с сульфатами выпадает белый осадок сульфата бария и сульфата стронция :
Ba 2+ + SO4 2- → BaSO4↓
Sr 2+ + SO4 2- → SrSO4↓
Также осадки белого цвета образуются при взаимодействии солей кальция, стронция и бария с сульфитами и фосфатами.
Химические свойства
1.1. Щелочноземельные металлы реагируют с галогенами с образованием галогенидов при нагревании.
1.2. Щелочноземельные металлы реагируют при нагревании с серой и фосфором с образованием сульфидов и фосфоридов.
Ca + S → CaS
Кальций взаимодействует с фосфором с образованием фосфидов:
1.4. С азотом магний взаимодействует при комнатной температуре с образованием нитрида:
Остальные щелочноземельные металлы реагируют с азотом при нагревании.
1.5. Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов.
Ca + 2C → CaC2
Бериллий реагирует с углеродом при нагревании с образованием карбида — метанида:
2Be + C → Be2C
1.6. Бериллий сгорает на воздухе при температуре около 900°С:
2Be + O2 → 2BeO
Магний горит на воздухе при 650°С с выделением большого количества света. При этом образуются оксиды и нитриды:
2Mg + O2 → 2MgO
Щелочноземельные металлы горят на воздухе при температуре около 500°С, в результате также образуются оксиды и нитриды.
Видеоопыт : горение кальция на воздухе можно посмотреть здесь.
2. Щелочноземельные металлы взаимодействуют со сложными веществами:
2 Ca 0 + 2 H2 + O = 2 Ca + ( OH)2 + H2 0
2.2. Щелочноземельные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной, разбавленной серной кислотой и др.). При этом образуются соль и водород.
2Mg + 2HCl → MgCl2 + H2↑
2.3. При взаимодействии щелочноземельных металлов с концентрированной серной кислотой образуется сера.
При взаимодействии щелочноземельных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочноземельные металлы могут восстанавливать некоторые неметаллы (кремний, бор, углерод) из оксидов.
2Ca + SiO2 → 2CaO + Si
2Mg + CO2 → 2MgO + C
Ca + CuCl2 → CaCl2 + Cu
Оксиды щелочноземельных металлов
Способы получения
1. О ксиды щелочноземельных металлов можно получить из простых веществ — окислением металлов кислородом :
2Ca + O2 → 2CaO
3. Оксиды магния и бериллия можно получить термическим разложением гидроксидов :
Химические свойства
1. Оксиды кальция, стронция, бария и магния взаимодействуют с кислотными и амфотерными оксидами :
2. Оксиды щелочноземельных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
CaO + 2HCl → CaCl2 + H2O
3. Оксиды кальция, стронция и бария активно взаимодействуют с водой с образованием щелочей.
CaO + H2O → 2Ca(OH)2
Оксид магния реагирует с водой при нагревании:
MgO + H2O → Mg(OH)2
Оксид бериллия не взаимодействует с водой.
4. Оксид бериллия взаимодействует с щелочами и основными оксидами.
При взаимодействии оксида бериллия с щелочами в расплаве или с основными оксидами образуются соли-бериллаты.
При взаимодействии оксида бериллия с щелочами в растворе образуются комплексные соли.
Гидроксиды щелочноземельных металлов
Способы получения
Оксид магния взаимодействует с водой только при нагревании:
2. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих металлов с водой.
Магний взаимодействует с водой только при кипячении:
Химические свойства
1. Гидроксиды кальция, стронция и бария реагируют с всеми кислотами (и сильными, и слабыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Гидроксид магния взаимодействует только с сильными кислотами.
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. Гидроксиды кальция, стронция и бария взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид кальция реагирует с гидрокарбонатом кальция с образованием карбоната кальция:
5. Гидроксиды кальция, стронция и бария взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода). Взаимодействие щелочей с неметаллами подробно рассмотрено в статье про щелочные металлы.
В растворе образуются комплексная соль и водород:
7. Гидроксиды кальция, стронция и бария вступают в обменные реакции с растворимыми солями. Как правило, с этими гидроксидами реагируют растворимые соли тяжелых металлов (в ряду активности расположены правее алюминия), а также растворимые карбонаты, сульфиты, силикаты, и, для гидроксидов стронция и бария — растворимые сульфаты.
Также с гидроксидами кальция, стронция и бария взаимодействуют соли аммония.
8. Гидроксид кальция разлагается при нагревании до 580 о С, гидроксиды магния и бериллия разлагаются при нагревании:
Ba(OH)2 ↔ Ba 2+ + 2OH —
Гидроксид магния — нерастворимое основание. Гидроксид бериллия проявляет амфотерные свойства.
При взаимодействии гидроксида бериллия с избытком раствора щелочи образуется комплексная соль:
Соли щелочноземельных металлов
Нитраты щелочноземельных металлов
Нитраты кальция, стронция и бария при нагревании разлагаются на нитриты и кислород. Исключение — нитрат магния. Он разлагается на оксид магния, оксид азота (IV) и кислород.
Карбонаты щелочноземельных металлов
1. Карбонаты щелочноземельных металлов при нагревании разлагаются на оксид и углекислый газ.
2. Карбонаты щелочноземельных металлов под действием воды и углекислого газа превращаются в растворимые в воде гидрокарбонаты.
3. Карбонаты щелочноземельных металлов взаимодействуют с более сильными кислотами с образованием новой соли, углекислого газа и воды.
Более сильные кислоты вытесняют менее сильные из солей.
4. Менее летучие оксиды вытесняют углекислый газ из карбонатов при сплавлении. К менее летучим, чем углекислый газ, оксидам относятся твердые оксиды — оксид кремния (IV), оксиды амфотерных металлов.
Менее летучие оксиды вытесняют более летучие оксиды из солей при сплавлении.
Жесткость воды
Постоянная и временная жесткость
Жесткость воды — это характеристика воды, обусловленная содержанием в ней растворенных солей щелочноземельных металлов, в основном кальция и магния (солей жесткости).
Временная (карбонатная) жесткость обусловлена присутствием гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2 в воде.
Постоянная (некарбонатная) жесткость обусловлена присутствием солей, не выделяющихся при кипячении из раствора: хлоридов (CaCl2) и сульфатов (MgSO4) кальция и магния.
Способы устранения жесткости
Существуют химические и физические способы устранения жесткости. Химические способы устранения временной жесткости:
1. Кипячение. При кипячении гидрокарбонаты кальция и магния распадаются на нерастворимые карбонаты, углекислый газ и воду:
2. Добавление извести (гидроксида кальция). При добавлении щелочи растворимые гидрокарбонаты переходят в нерастворимые карбонаты:
Химические способы устранения постоянной жесткости — реакции ионного обмена, которые позволяют осадить ионы кальция и магния из раствора:
1. Добавление соды (карбоната натрия). Карбонат натрия связывает ионы кальция и магния в нерастворимые карбонаты:
CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl
2. Добавление фосфатов. Фосфаты также связывают ионы кальция и магния: